Ⅲ期肺腺癌病人合并COVID-19后出现EML4-ALK融合基因1例报告并文献复习
宋海涛 万昭君 孟令新
不可切除的Ⅲ期非小细胞肺癌(non-small cell lung cancer,NSCLC)常以除手术外的放疗、化疗、免疫及靶向治疗等为主。PACIFIC研究结果显示,同步放化疗后免疫治疗巩固可显著改善不可切除的Ⅲ期NSCLC病人的生存,确定了不可手术局部晚期肺癌的标准治疗模式[1]。我们收治了1例初始仅有TP53驱动基因的Ⅲ期肺腺癌病人,在诱导化疗及序贯同步放化疗后,病情显著缓解,然而在发生新型冠状病毒感染(COVID-19)后,短时间内病情出现了全面进展,再次完善基因检测,检测到了棘皮动物微管相关蛋白样4-间变性淋巴瘤激酶(EML4-ALK)融合基因。现结合文献报道如下,探索COVID-19以及EML4-ALK融合基因在肺癌进展中可能发挥的作用。
1 病例资料
病人,男,63岁,2022年2月无明显诱因出现咳嗽,偶有白痰,无胸闷。查体:左肺呼吸音明显减低。既往体健。辅助检查:2022年6月16日行支气管镜示:各支气管黏膜光滑,管腔通畅,左肺上叶尖后段及舌段超声探及高密度病灶,行经支气管镜肺活检术,送检病理示:(左肺上叶)浸润性腺癌(图1)。免疫组化结果:CD68(吞噬细胞+),CK7(+),CK5/6(-),P63(-),NapsinA(+),TTF-1(+)。2022年8月1日行正电子发射计算机断层显像(PET-CT)示:(1)左肺上叶内,叶间胸膜前上方大片状影,代谢异常增高;(2)纵隔多发大小不等淋巴结,代谢异常增高。考虑左肺上叶炎性肺癌并多发淋巴结转移可能性大(图2)。2022年7月25日行肺癌相关基因检测:TP53基因(c.782+2 T>G)突变。根据国际抗癌联盟(Unionfor International Cancer Control,UICC)第8版肺癌分期,临床诊断为:T4N3M0 ⅢC期肺腺癌。病人因肿瘤巨大且双侧纵隔淋巴结转移,无法行手术切除及初始同步放化疗,于2022年7月20日起行4周期紫杉醇脂质体+顺铂方案诱导化疗,肿瘤明显退缩后,考虑病人耐受性,2022年10月27日起行单药顺铂同步放化疗,总处方剂量为60 Gy/30次,单次剂量为2 Gy/次,左肺V20= 31%,双肺平均肺部剂量(MLD)=1283c Gy。2022年12月10日同步放化疗结束,期间复查肿瘤退缩显著(图3)。2022年12月25日出现咳嗽、头晕、全身乏力等症状,COVID-19核酸检测阳性。2022年12月30日血常规示:淋巴细胞数为0.57×109/L。2023年1月14日全面复查,胸腹部增强CT示:(1)左肺上叶肺癌治疗后改变,较前大致相仿;左肺门及纵隔多发肿大淋巴结,较前相仿。(2)右侧锁骨上窝及气管旁肿大淋巴结较前增大。(3)左侧肾上腺增粗并其内低密度灶,较前新发,考虑转移。2023年1月16日颅脑MRI示:脑内多发异常信号,考虑转移瘤。2023年1月18日骨扫描示:T10、T12、L1、L3、L4椎体,骶骨放射性浓集,结合椎体MRI,符合转移表现。骨质破坏不明显,未诉骨痛,2023年1月18日起规律行地舒单抗修复骨质。颅内肿瘤散在多发,2023年1月30日行全脑放疗,30 Gy/10次。2023年2月10日行血液淋巴细胞亚群分析,未见明显异常。2023年2月17日送检血液,再次基因检测回示:检测到EML4-ALK融合(V1亚型)。2023年2月17日起口服阿来替尼靶向治疗至今。治疗时间线见图4。
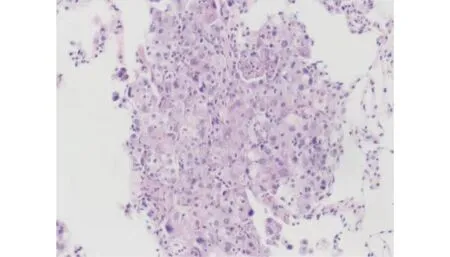
图1 肺腺癌病人的病理表现(HE染色,×100)
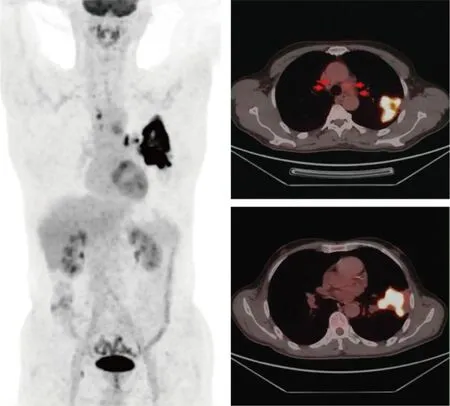
图2 全身PET-CT所示肿瘤负荷
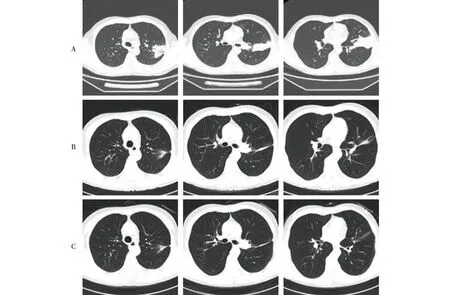
注:A:2022年8月1日;B:2022年9月3日;C:2022年10月18日。
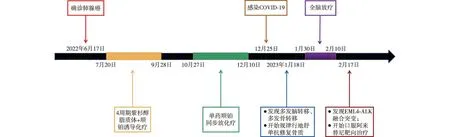
图4 治疗时间线
2 讨论
Ⅲ期不可手术的NSCLC是一类异质性很强的肿瘤。随着PACIFIC研究的出现,改变了不可切除局部晚期NSCLC病人的治疗结局[2]。 但是,PACIFIC研究也有不完美之处,例如PACIFIC研究只包含了初始治疗即为同步放化疗的病人。GEMSTONE-301研究是对PACIFIC研究很好的补充,其在设计上覆盖范围更广。对于不可切除Ⅲ期NSCLC病人,有相当数量的病人无法耐受或不可行同步放化疗,故接受序贯放化疗更为常见[3]。本例病人肿瘤巨大(130 mm×69 mm×52 mm),若初始放疗,照射范围过大将难以耐受放疗所带来的不良反应,故采用诱导化疗充分缩小肿瘤后,行同步放化疗。而在同步化疗方案的选择上,国内外尚无固定的标准化疗方案,该病人借鉴了美国国立综合癌症网络(NCCN)指南同步方案中顺铂的使用策略。采用诱导化疗后的同步单药铂类放化疗,一方面保证了放疗照射区域内危及器官的保护,使放疗得以进行;另一方面充分考量了病人的耐受性,作为老年男性经历了4周期紫杉醇+顺铂方案化疗,在已经出现骨髓抑制的情况下,采用单药铂类的同步放化疗方式有效地减轻了治疗过程的不良反应,最大限度地提升了治疗效果。
参照PACIFIC治疗模式,在病人同步放化疗后1~42 d,拟加用免疫药物维持,放疗结束1个月后全面评估病情,然而发现病情全面进展。诱导化疗及同步放化疗后短短35 d左右的时间内,病人出现了脑、骨的多发转移以及肾上腺及淋巴结的多处转移。我们尝试去探究这段时间内病人机体究竟发生了怎样的重大变化,同时观察到了2个极为有意思的现象:(1)病人在COVID-19后病情出现进展;(2)病情进展后新发现了EML4-ALK融合基因。
癌症与COVID-19之间的关系是双向的,一方面,癌症病人由于化疗、放疗等各种治疗以及手术后恢复期带来的免疫抑制,更容易感染严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2),且更容易发生更为严重的感染后果。有证据表明,癌症病人死于COVID-19的风险是无合并症病人的5倍左右,且在感染前14 d内接受化疗的病人出现严重后果的风险比其他癌症病人高得多[4-6]。另一方面,SARS-CoV-2引起的炎症免疫反应和免疫系统的损伤,可能导致病人肿瘤进展的风险增加[7]。越来越多的研究发现,COVID-19病人普遍表现为淋巴细胞减少和细胞因子水平显著升高[8-10]。一些高水平的炎症因子本身就具有促肿瘤活性,加之淋巴细胞数量的骤减,极大地削弱了免疫系统对肿瘤的抑制作用,致使肿瘤更容易发生局部复发和远处转移。
由于SARS-CoV-2的感染会导致包括IL-6在内的细胞因子水平升高,而IL-6不仅参与大多数炎症反应,而且在炎症相关癌症中也起着重要作用[11]。虽然尚缺少关于COVID-19促癌相关的研究,但是一些研究报道了SARS-CoV-1与癌症之间的关系,而COVID-19这种与SARS-CoV-2有很多相似之处的病毒也可能会干扰与细胞致癌转化相关的多种信号通路[7]。COVID-19病人另一个显著的血液学特征就是淋巴细胞的减少,尤其是包括CD4+和CD8+在内的T细胞的减少[12],其损伤机制可能与病毒的直接杀伤、细胞因子的免疫介导、淋巴细胞分化障碍、诱导淋巴细胞凋亡有关。SARS-CoV-2进入人体后大量破坏淋巴细胞,特别是T淋巴细胞,造成淋巴细胞减少,机体细胞免疫功能急剧下降。不仅使病毒在短时间内迅速繁殖,还有可能致使外周血中肿瘤细胞不能被有效杀伤,从而导致远处转移的发生。有研究显示,外周血免疫细胞亚群的比例和某些癌症的治疗结局是相关的[13]。
2022年12月25日左右病人感染COVID-19,出现了明显的感染症状,且持续时间较长,在感染期间完善过一次血常规检查,提示淋巴细胞数为0.57×109/L,远低于正常水平。遗憾的是,因诸多因素我们未能在感染期间完善淋巴细胞亚群分析,直至2023年2月10日才完善相关检查。此时淋巴细胞绝对数已恢复至正常,淋巴细胞亚群并未见明显异常。在高强度的全身治疗之后,如此短的时间内,发生了肿瘤的全身多处转移,所以我们仍然有足够的理由相信COVID-19对疾病的进展发挥了举足轻重的作用。
另一个现象是,病情进展后检测到了EML4-ALK融合基因。EML4-ALK融合基因是迄今为止发现的NSCLC最重要的致病驱动基因之一。EML4和ALK分别位于人类2号染色体的p21和p23上,臂内互换导致了易位融合。EML4-ALK融合基因可编码EML4-ALK融合蛋白,这是一种具有致瘤活性的融合蛋白[14],该融合蛋白可直接形成ALK二聚体,从而激活ALK及其下游的ERK/STAT3/RAS/mTOR等信号通路,最后通过促进细胞增殖和侵袭,抑制细胞凋亡,导致NSCLC的发生[15-18]。之前的研究发现,不同长度的EML4片段被插入到ALK的外显子20中形成了不同的融合基因类型[19],其中V1亚型是最常见的融合类型,它是由EML4的13外显子与ALK的20外显子融合产生的[20]。TP53突变是ALK阳性的NSCLC中最常见的基因组协同改变,也导致了对间变性淋巴瘤激酶-酪氨酸激酶抑制剂(ALK-TKI)的异质性反应[21]。该病人初始仅有TP53基因突变,短时间内病情发生了全面进展,肿瘤由局部扩散到全身,推测可能有新的驱动基因的存在,致使肿瘤活性增加以及生物学行为的改变,最终导致了病情的进展,所以再次完善基因检测,新发现了EML4-ALK融合基因。至于COVID-19带来的细胞因子风暴以及淋巴细胞的减少是否改变了肿瘤的微环境,促进了EML4-ALK融合基因的出现,目前缺乏相关的研究。
本文报道1例经诱导化疗及同步放化疗的Ⅲ期肺癌病人,在经历了COVID-19后出现病情进展,并且检测到EML4-ALK融合基因。目前这种现象少有报道,对了解COVID-19、EML4-ALK融合基因对肿瘤进展的影响具有重要的意义。但是,我们只是观察到了这种现象,三者之间是否存在明确的因果关系还有待探究,其具体的分子机制也尚不明确。另外,没有在感染期间及时完善淋巴细胞亚群分析,且2次基因检测是否存在假阴性或假阳性的问题,都是值得考虑的地方。

