基于Fe7S8纳米酶的H2O2手机可视化比色检测
顾婧婧,李钟杰,李宇浩,公海龙,马勤勤,刘婷婷,2*,王学东*
(1.苏州科技大学 环境科学与工程学院,江苏 苏州 215009;2.江苏省环境科学与工程重点实验室,江苏 苏州 215009)
过氧化氢(H2O2)因具有强抗氧化性、易分解等特点被广泛用作漂白剂、消毒剂、保鲜剂、液体燃料等。然而,过量使用的H2O2和工业非法添加的H2O2排放到环境中,会对环境造成严重污染。此外,人体中过量的H2O2则可诱发各种生物损害,导致衰老、神经变性、DNA损伤和癌症等[1]。因此,开发一种快速、灵敏、高效、成本低的H2O2检测方法在环境监测、食品安全、临床诊断等领域具有重要意义。
目前,常用的H2O2检测方法有电化学法[2]、荧光法[3]、表面增强拉曼散射法[4]、紫外分光光度法[5]、比色法[6]等。其中比色法具有检测速度快、操作简便、分析成本低、无需依靠复杂操作和昂贵的仪器即可实现H2O2定性和半定量测量的优点,引起了研究者们的关注[7]。比色法检测中,利用酶催化H2O2氧化显色底物较为常见,但在传统的酶催化底物显色的过程中,存在天然酶易失活、稳定性差、使用成本高等问题,因此探索人工模拟酶来替代显色体系中的天然酶,成为进一步拓展比色法应用范围的重要手段[8]。在众多人工模拟酶中,纳米酶具有催化活性优异、稳定性高、易于制备、成本低廉等优点,被认为是能够替代天然酶的最佳选择[9]。迄今为止,许多纳米材料已被发现具有类天然酶催化活性,包括贵金属[10]、金属氧化物[11]、金属硫化物[12]、金属有机框架材料(MOF)[13]等。其中,金属硫化物基纳米酶因具有可调控的类酶活性、独特的光学性能和易功能化的结构组成受到广泛关注[14]。Gao等[15]合成的 5,10,15,20-四(4-羧基苯基)卟啉-Co9S8纳米复合材料(H2TCPP-Co9S8)比纯Co9S8纳米片具有更强的过氧化物酶活性,可以实现隐形眼镜护理液中H2O2的灵敏检测,检出限低至8.19 μmol/L。Zhang 等[16]基于一步水热法制备的MoS2纳米片构建了牛奶样品中H2O2的比色检测方法,建立的比色体系检测H2O2的线性范围为10~50 μmol/L。Zhang 等[17]将碳纳米管(CNTs)引入MoS2纳米片(MoS2NSs)中,利用MoS2NSs和CNTs的协同作用,构建了灵敏的H2O2比色检测平台,其线性范围比MoS2NSs拓宽了近10 倍。在众多金属硫化物纳米酶中,铁硫化合物(FexSy)因具有Fe2+/Fe3+氧化还原电对以及Fe与S 间丰富的价态转换,表现出优异的类酶活性[18]。Song 等[19]利用FeS2的类过氧化物酶活性构建了高效的生物传感器,所得米氏常数(Km)是辣根过氧化物酶的13倍。He等[20]通过在FeS2表面包覆共价有机骨架材料(COFs)进一步提高了FeS2纳米酶的稳定性和可重复使用性。Liu 等[21]制备了含有不同硫空位的Fe3S4纳米酶,硫空位的引入进一步提高了Fe3S4纳米片的催化活性。与FeS2和Fe3S4相比,Fe7S8具有更长的Fe-S 键,可为表面的Fe2+和Fe3+与H2O2之间提供更多的通道,为利用Fe7S8催化底物显色用于高效检测H2O2含量提供了基础。目前Fe7S8纳米材料的应用主要集中在储能领域,在利用其类酶活性进行比色法传感检测领域还有较大空白。
本研究采用溶剂热法,以四水合氯化亚铁、硫代乙酰胺为原料制备了Fe7S8纳米花(Fe7S8NFs),Fe7S8纳米花优异的类过氧化物酶活性可催化H2O2氧化显色底物3,3',5,5'-四甲基联苯胺(TMB)生成oxTMB,使溶液颜色由无色变为蓝色。基于此,构建了H2O2的比色传感检测方法。为进一步克服肉眼观察显色结果引起的误差,采用智能手机作为颜色结果获取装置,结合“Thing Identify”软件的色值分析功能,建立了样品颜色灰度值与H2O2浓度的线性关系。该方法已成功用于水样中H2O2的含量检测,为比色传感法的应用提供了新思路。
1 实验部分
1.1 试剂与仪器
四水合氯化亚铁(FeCl2·4H2O,分析纯,99%)、乙二醇(C2H6O2,分析纯,99%)、乙酸(CH3COOH,分析纯,99%)、乙酸钠(CH3COONa,分析纯,99%)、无水乙醇(CH3CH2OH,分析纯,99%)、5,5'-二甲基-1-吡咯啉N-氧化物(DMPO,分析纯,99.5%)购自上海阿拉丁有限公司。硫代乙酰胺(C2H5NS,TAA,分析纯,99%)、3,3',5,5'-四甲基联苯胺(TMB,分析纯,98%)、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,分析纯,98%)、邻苯二胺(OPD,分析纯,99%)、乙二胺四乙酸(EDTA,分析纯,99%)、对苯醌(PBQ,分析纯,99%)、异丙醇(IPA,分析纯,69%~71%)购自阿达玛斯试剂公司。过氧化氢(H2O2,分析纯,30%)购自上海联试化工试剂有限公司。实验用水(>18.2 MΩ)由Milli-Q净水系统(美国)提供。实际水样为我校自来水。
DHG-9070A 电热鼓风干燥箱(上海夕闻生物科技有限公司)、Quanta FEG 250 扫描电子显微镜(SEM,美国赛默飞世尔科技(中国)有限公司)、X-act 能谱仪(EDS,英国牛津仪器公司)、FEI Tecnai F20 透射电子显微镜(TEM,美国赛默飞世尔科技(中国)有限公司)、Bruker D8 advance X 射线衍射仪(XRD,德国布鲁克公司)、UV-5500PC 紫外可见分光光度计(UV-Vis,上海元析仪器有限公司)、TriStar Ⅱ Plus 3030 全自动比表面积与孔隙度分析仪(BET-BJH,美国麦克仪器公司)、LakeShore7404磁滞回线测试仪(VSM,美国湖岸公司)、Thermo Scientific ESCALAB 250Xi X 射线光电子能谱仪(XPS,美国赛默飞世尔科技(中国)有限公司)、Bruker EMXplus-6/1顺磁共振波谱仪(EPR,德国布鲁克公司)。
1.2 Fe7S8 NFs的制备
将2.7 mmol/L FeCl2·4H2O 和3.6 mmol/L TAA 加入到70 mL 乙二醇中,剧烈搅拌形成均匀溶液。将溶液转移至100 mL的不锈钢高压反应釜中,200 ℃条件下反应12 h。离心收集黑色沉淀物,经超纯水、乙醇各洗涤3次,60 ℃真空干燥得到黑色产物,合成流程如图1所示。
图1 Fe7S8 NFs的合成流程示意图Fig.1 Schematic for the synthesis of Fe7S8 NFs
1.3 显色条件优化
选择ABTS、OPD 和TMB 为底物考察显色效果。以TMB 为显色底物,考察反应条件对Fe7S8NFs 催化性能的影响,对缓冲液pH 值(3.2、3.6、4.0、4.6、5.0、6.0)、温度(20、25、30、35、40、45 ℃)、孵育时间(0、5、10、15、20、25、30、35、40 min)、Fe7S8NFs质量浓度(0.01、0.03、0.05、0.07、0.09、0.11、0.13 mg·mL-1)进行优化。除Fe7S8NFs质量浓度考察实验外,其它实验过程为:将60 μL Fe7S8悬浊液(0.05 mg·mL-1)、100 μL TMB(6 mmol/L)、40 μL H2O2(50 mmol/L)加入到1 700 μL NaAc-HAc 缓冲液中,孵育后过滤,使用UV-Vis 紫外可见分光光度计记录波长在652 nm 处的吸光度值。Fe7S8NFs质量浓度考察实验中,固定其它条件不变,仅改变Fe7S8NFs的质量浓度。
1.4 Fe7S8 NFs的类过氧化物酶活性探究
设置了5 组(Fe7S8+H2O2、Fe7S8+TMB、Fe7S8+TMB+H2O2、纯H2O2、纯TMB)对照试验考察Fe7S8NFs的类过氧化物酶活性。所有反应均在2 mL 含有NaAc-HAc 缓冲液(pH 4.0,0.2 mol/L)的反应体系中进行,Fe7S8、TMB、H2O2的最终浓度分别为0.05 mg·mL-1、6 mmol/L、50 mmol/L。混合溶液在40 ℃条件下孵育20 min后,使用UV-Vis紫外可见分光光度计记录其在450~750 nm处的光谱。
1.5 Fe7S8 NFs的稳态动力学分析
在最佳反应条件下,以TMB为显色底物,通过一系列显色反应研究了Fe7S8NFs催化显色反应的稳态动力学参数。以恒定的H2O2水平(3 mmol/L)和变化TMB 浓度(0.2、0.4、0.6、0.8、1、2、4、6 mmol/L)研究了反应的催化动力学;以恒定的TMB 水平(3 mmol/L)和变化H2O2浓度(0.2、0.4、0.6、0.8、1、2、4、6 mmol/L)分析了反应的稳态动力学。最后,根据Michaelis-Menten 方程计算出米氏常数Km和最大反应速率Vmax。
其中:V0为初始的反应速度,Vmax为最大反应速度,Km为米氏常数(酶促反应达到最大反应速率一半时的底物浓度),[S]为底物浓度。
1.6 Fe7S8 NFs催化活性机制探究
为了确定参与催化反应的活性氧类型,分别使用异丙醇(IPA)、EDTA 和对苯醌(PBQ)作为自由基清除剂进行自由基清除实验。将60 μL Fe7S8(0.05 mg·mL-1)、100 μL TMB、40 μL H2O2、100 μL自由基清除剂(1 mmol/L)与1 700 μL NaAc-HAc 缓冲液(0.2 mol/L,pH 4.0)混合,40 ℃下孵育20 min。随后,通过UV-Vis紫外可见分光光度计测量其在652 nm处的吸光度以判断自由基的存在。同时,使用DMPO作为自由基捕获剂,通过EPR波谱探究羟基自由基(·OH)、超氧自由基(·O2-)和光生空穴(h+)的产生。
1.7 H2O2的比色传感检测
将60 μL Fe7S8NFs 悬浊液(0.05 mg·mL-1)、100 μL TMB(6 mmol/L)与不同浓度的H2O2溶液(0、0.001、0.003、0.005、0.007、0.009、0.3、0.5、0.7、1、1.5、2、3、4、5、9、20、30、40、50、60、70 mmol/L)加入到NaAc-HAc 缓冲液(pH 4.0)中,40 ℃孵育20 min,用UV-Vis 紫外可见分光光度计测量其在652 nm处的吸光度值。
加入500 mmol/L的 Na+、K+、Ca2+、Mg2+、Zn2+、Al3+、Cu2+、Cl-、葡萄糖(Glu)、尿酸(UA)作为干扰物质,考察了Fe7S8NFs+TMB体系对H2O2(50 mmol/L)检测的抗干扰性。
1.8 智能可视化比色传感法检测实际水样中的H2O2
为考察Fe7S8NFs在实际水体中的应用,采用加标法对自来水中的H2O2进行检测。取自来水离心并经0.22 μm 混合纤维素滤膜过滤后进行加标实验,加标浓度为1.5、3、5 mmol/L。使用UV-Vis紫外可见分光光度计测定吸光度变化,考察吸光度与浓度间的线性关系,并测定水样中的H2O2含量,计算加标回收率。
采用智能手机对显色结果进行拍照,结合“Thing Identify”软件的灰度值分析功能,利用“Fe7S8+TMB+H2O2”显色体系的颜色灰度值与H2O2浓度间的线性关系,实现高效、准确、便捷的H2O2含量检测,并与UV-Vis紫外可见分光光度法的测试结果进行比较。
2 结果与讨论
2.1 Fe7S8 NFs的形貌结构表征
通过SEM、TEM 和EDS 对Fe7S8NFs的形貌与组成进行表征。SEM 结果表明,Fe7S8NFs具有由片层组成的类似银耳的花状结构,且表面较为光滑(图2A)。TEM测试结果进一步证明构成Fe7S8NFs的片层较薄,测得的晶格间距为0.29 nm,对应于Fe7S8NFs 的(200)晶面(图2B、C)。通过EDS 测试发现该纳米材料存在Fe、S元素且均匀分布在Fe7S8NFs表面(图2D、E、F)。
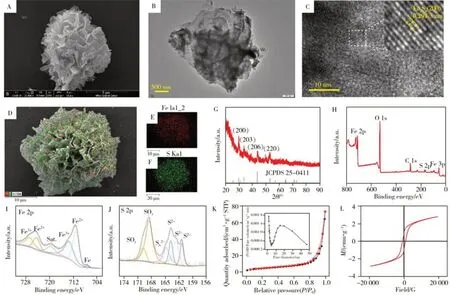
图2 Fe7S8 NFs的形貌结构表征Fig.2 Morphology and structural characterizations of Fe7S8 NFs
通过XRD 对Fe7S8NFs 的晶体结构进行表征,如图2G 所示,在29.950 °、33.757 °、43.648 °、53.077 °处的特征峰,分别对应于Fe7S8晶体的(200)、(203)、(206)、(220)晶面,与标准卡片(JCPDS 25-0411)一致,表明样品具有较好的结晶度和纯度。通过XPS 对Fe7S8表面的元素组成和价态进行分析,XPS 全谱图(图2H)显示,Fe7S8NFs 表面存在Fe、S、C、O 元素,其中,C、O 峰可能是由于材料表面吸附空气中的H2O、CO2和O2等引起。对Fe 2p 轨道进行分峰,如图2I 所示,其711.0、724.3 eV处的特征峰对应于Fe2+,713.4、726.7 eV 处的特征峰对应于Fe3+,位于719.5 eV 处的峰对应于Fe3+的卫星峰。以上结果表明Fe7S8NFs 的表面包含Fe2+、Fe3+两种价态,与文献报道一致[22]。混合价态的存在,有利于在催化过程中芬顿体系的形成,进而产生更多的活性氧催化显色底物显色。如图2J 所示,对S 2p 轨道进行分峰,产生的6 个峰分别对应于Sn2-(164.7 eV)、S2-(161.3、162.6、163.8 eV)和SOx(168.5 eV 和169.8 eV)。SOx可能来自于Fe7S8NFs 的表面氧化。上述XPS 结果说明Fe7S8NFs 成功合成[23]。图2K为Fe7S8NFs的氮气等温吸脱附曲线(BET),该吸脱附等温线符合Ⅱ型吸附等温线特征。经计算Fe7S8的比表面积为17.6475 cm2/g。内嵌图为Fe7S8NFs 的孔径分布图,该纳米花的平均孔径为22.46 nm,孔径较大,且为介孔结构。较大的比表面积和介孔结构有利于显色底物分子、H2O2分子与Fe7S8NFs 表面的活性位点接触,增加反应发生的概率。通常铁基氧化物和硫化物具有一定的磁性,便于通过磁分离来终止反应。为探究该纳米花的磁性强弱,对其进行了磁滞回线分析(图2L)。Fe7S8NFs的饱和磁化强度仅为2.17 emu/g,具有一定磁性,但不足以实现使用磁铁进行外部分离。因此本工作中,通过对反应后的溶液进行过滤终止反应并进行测试。
2.2 Fe7S8 NFs的类酶活性探究及显色条件优化
为了探究Fe7S8NFs 的类酶活性,考察了3 种不同显色底物(ABTS、TMB、OPD)的显色效果。如图3A~C 所示,“ABTS+ Fe7S8+H2O2”体系在425 nm 处出现吸收峰,吸光度值为1.89,溶液呈绿色;“TMB+ Fe7S8+H2O2”体系在652 nm 处出现较强吸收峰,吸光度值约1.34;而“OPD+ Fe7S8+H2O2”体系未出现明显颜色变化。以上结果说明可选择ABTS或TMB作为显色底物,但相较而言,TMB毒性更小,成本更低,因此选择“TMB+Fe7S8+H2O2”体系进行后续实验。如图3D 所示,纯TMB 溶液为无色;“TMB+H2O2”体系呈极浅的蓝色,说明H2O2可以氧化TMB变色,但是氧化能力极弱。“Fe7S8NFs+H2O2”体系中溶液无色,且无UV-Vis 吸收,说明Fe7S8NFs 和H2O2对显色体系不存在试剂底色干扰。“Fe7S8+TMB”体系中,溶液仍呈无色,表明Fe7S8NFs本身不能催化TMB 底物显色,且不能催化溶液中的溶解氧使TMB 变蓝,进一步说明其不具备类氧化酶活性。“Fe7S8+TMB+H2O2”体系中,溶液变为蓝色,且在652 nm处有明显吸收峰,说明Fe7S8NFs可以催化H2O2氧化TMB,具有典型的类过氧化物酶活性。

图3 Fe7S8 NFs的类过氧化物酶催化条件探究Fig.3 Catalytic conditions for the peroxidase-like enzymes of Fe7S8 NFs
分别考察了缓冲液pH 值、孵育温度、孵育时间、Fe7S8NFs 质量浓度4 个因素对“Fe7S8NFs+TMB+H2O2”体系催化效果的影响。如图4A 所示,随着pH 值从3.2 增大到6.0,溶液颜色由浅变深又变浅,吸光度值呈现先增后减的趋势,pH 4.0时,吸光度值达到最高,此时Fe7S8NFs的活性最强,溶液颜色最深。如图4B 所示,温度从20 ℃上升至40 ℃时,吸光度值随着温度的升高而上升,并在40 ℃时达到最高,当温度升至45 ℃时吸光度略有降低。这是因为,随着孵育温度的升高,反应物分子的运动愈发剧烈,使得H2O2、TMB 与Fe7S8NFs的接触概率变大,反应有效碰撞增加,有利于催化反应的进行;但当温度过高时,容易导致氧化产物oxTMB 不稳定,因此选择40 ℃作为孵育温度进行实验。如图4C 所示,在0~40 min 范围内,吸光度值随时间的增加而增大。0~20 min,吸光度值急剧增加,在20~40 min,吸光度值缓慢上升。说明反应进行20 min时,反应速率减慢,显色效果达到较佳水平。基于快速检测的考虑,选择20 min作为最佳孵育时间。如图4D所示,吸光度值随Fe7S8NFs质量浓度的增加而增加,与孵育时间的变化趋势类似,在Fe7S8NFs质量浓度增加的过程中,反应速率由快变慢,当Fe7S8NFs为0.05 mg·mL-1时,反应速率较快,显色现象明显,因此选择该质量浓度进行实验。因此,选择pH 4.0、孵育温度40 ℃、孵育时间20 min、Fe7S8NFs质量浓度0.05 mg·mL-1为最佳显色条件用于后续实验。
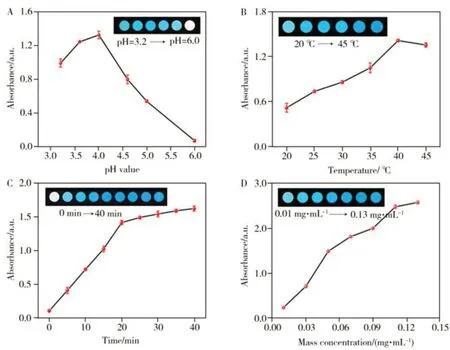
图4 不同实验条件对Fe7S8 NFs催化活性的影响Fig.4 Effect of different conditions on the catalytic activity of Fe7S8 NFs
2.3 Fe7S8 NFs的类酶活性稳态动力学研究
为考察Fe7S8NFs与底物之间的结合能力和催化效率,对比了最佳条件下TMB、H2O2为底物时的米氏常数(Km)和最大反应速率(Vmax)。Km值的大小与酶、底物的亲和力有关,Km值越小,与底物的亲和力越强;Km值越大,与底物的亲和力越弱[24]。如图5 和表1 所示,Fe7S8NFs 对H2O2和TMB 的Km值分别为0.241、0.569 mmol·L-1,对TMB 的亲和性低于CoMoO4NBs[27]和CWNSs[28],但优于其它材料;而对H2O2的亲和性优于其它材料。这主要是因为Fe7S8NFs具有片花结构、比表面积较大、表面带有丰富的电荷,可以结合更多的底物分子。本研究中的Fe7S8NFs 对底物的最大反应速率(Vmax)不及Fe3O4@heparin[25]、FeMn DSA/N-CNTs[26]、CoMoO4NBs[27],CWNSs[28],但其制备简单,成本低,且显色结果能够满足比色检测的需要,同样具有较大的应用潜力。

表1 Fe7S8 NFs与其它纳米材料反应动力学参数的比较Table 1 Comparison of kinetic parameters of Fe7S8 NFs with other nanomaterials

图5 TMB(A)和H2O2(B)分别作为底物的Michaelis-Menten曲线和Lineweaver-Burk图(插图)Fig.5 Michaelis-Menten curves and Lineweaver-Burk diagrams(insert) of TMB(A) and H2O2(B) as substrate
2.4 Fe7S8 NFs类过氧化物酶催化机理探究
基于文献报道[24]和上述实验结果,推测Fe7S8NFs 可以催化H2O2生成羟基自由基(·OH),进而将无色的TMB溶液氧化成蓝色的oxTMB溶液。为了验证上述猜想,通过加入自由基清除剂分析Fe7S8NFs的催化显色机理。据报道,EDTA、IPA、PBQ 可分别作为光生空穴(h+)、羟基自由基(·OH)、超氧自由基(·O2-)的自由基清除剂[30]。如图6A 所示,在最佳实验条件下分别加入EDTA 和IPA 后,“Fe7S8+TMB+H2O2”体系的溶液基本无色,吸收峰基本消失;然而在加入PBQ后,溶液颜色变浅,吸收峰强度下降,说明h+和·OH在催化显色过程中起主要作用。通过EPR进一步检测了该体系中的活性自由基,结果观察到明显的h+、·OH 信号,但·O2-的信号很弱(图6B~D),再次验证了h+和·OH 在反应体系中起主要作用,·O2-在催化反应中存在但作用较弱。上述实验结果表明,Fe7S8NFs 优异的催化性能可能来源于其表面含有的丰富的Fe2+、Fe3+。双价态铁离子间的相互转换可以促进催化反应中的电子转移,由已有文献[31]可知,酸性条件下Fe3+是催化H2O2分解产生·OH 的主要活性位点。因此,在酸性条件下,Fe7S8NFs表面的Fe3+催化H2O2产生·OH,具有强氧化能力的·OH夺取TMB的电子使之生成oxTMB,导致溶液由无色变为蓝色,并在652 nm波长处检测到明显的吸收峰(图6E),反应过程中产生的h+同样对催化反应具有促进作用。
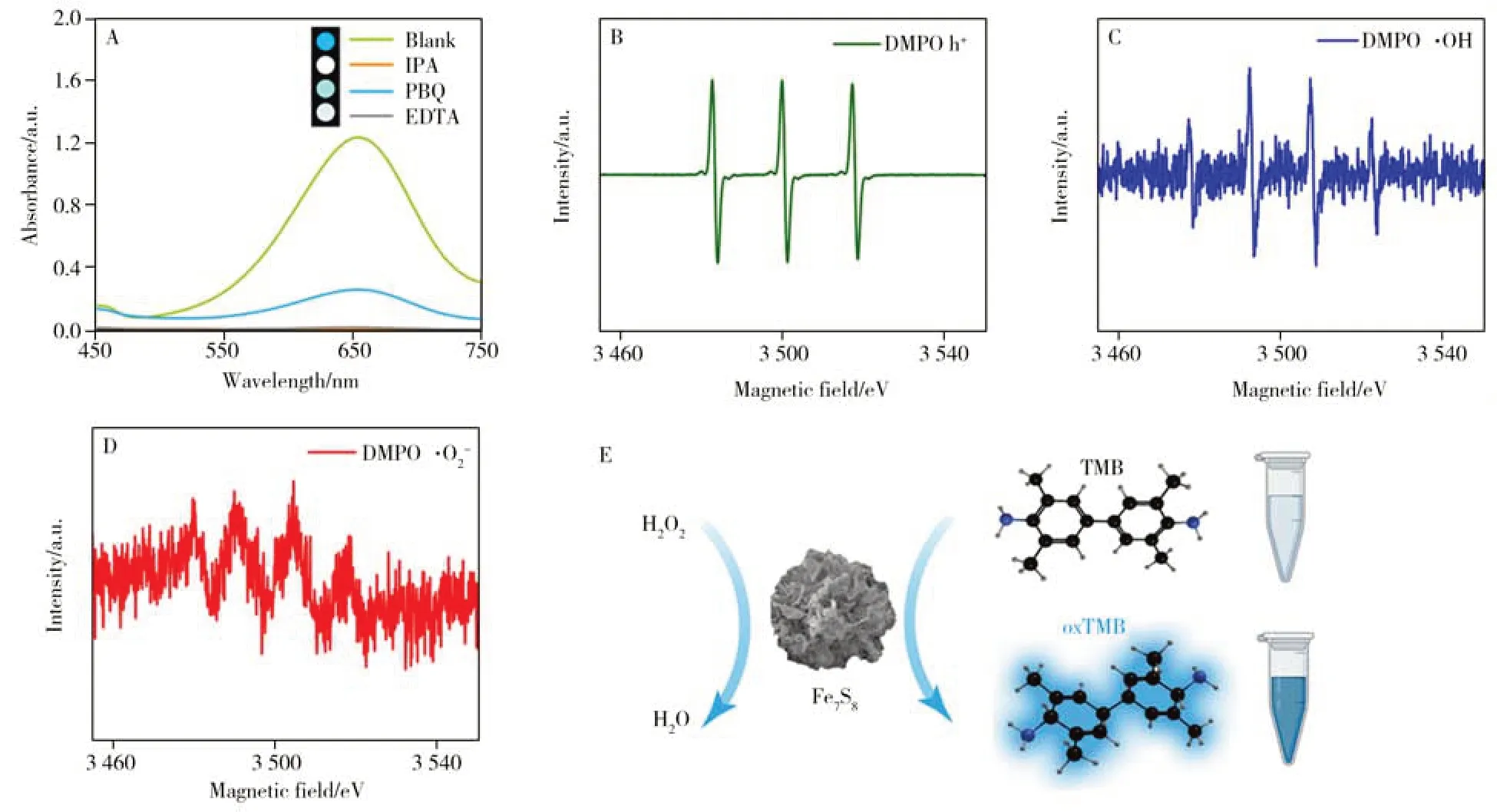
图6 Fe7S8 NFs的类过氧化物酶催化机理探究Fig.6 Catalytic mechanism studies of Fe7S8 NFs
2.5 可视化比色检测H2O2方法的建立及性能考察
基于Fe7S8NFs优异的类过氧化物酶活性,在最佳实验条件下构建比色传感方法对水体中H2O2的含量进行检测。反应体系的吸光度值随着H2O2浓度的增加而升高,溶液颜色也随之变深(图7A)。在0.001~9 mmol/L和9~70 mmol/L范围内,H2O2浓度(x,mmol/L)与652 nm处的吸光度值(y)呈良好的线性关系,如图7B~C 所示。对应的线性方程分别为y=0.123 18x+0.045 91 和y=0.005 37x+1.053 74,相关系数分别为r2=0.978 8 和r2=0.963 4,检出限(LOD,S/N=3)分别为0.33 μmol/L 和3 mmol/L。与已报道的其它基于纳米材料比色检测H2O2的方法相比,所构建的“Fe7S8NFs +TMB”显色体系的线性范围更宽,检出限较低(表2)。

表2 不同H2O2检测方法的对比Table 2 Comparison of different methods for the detection of H2O2
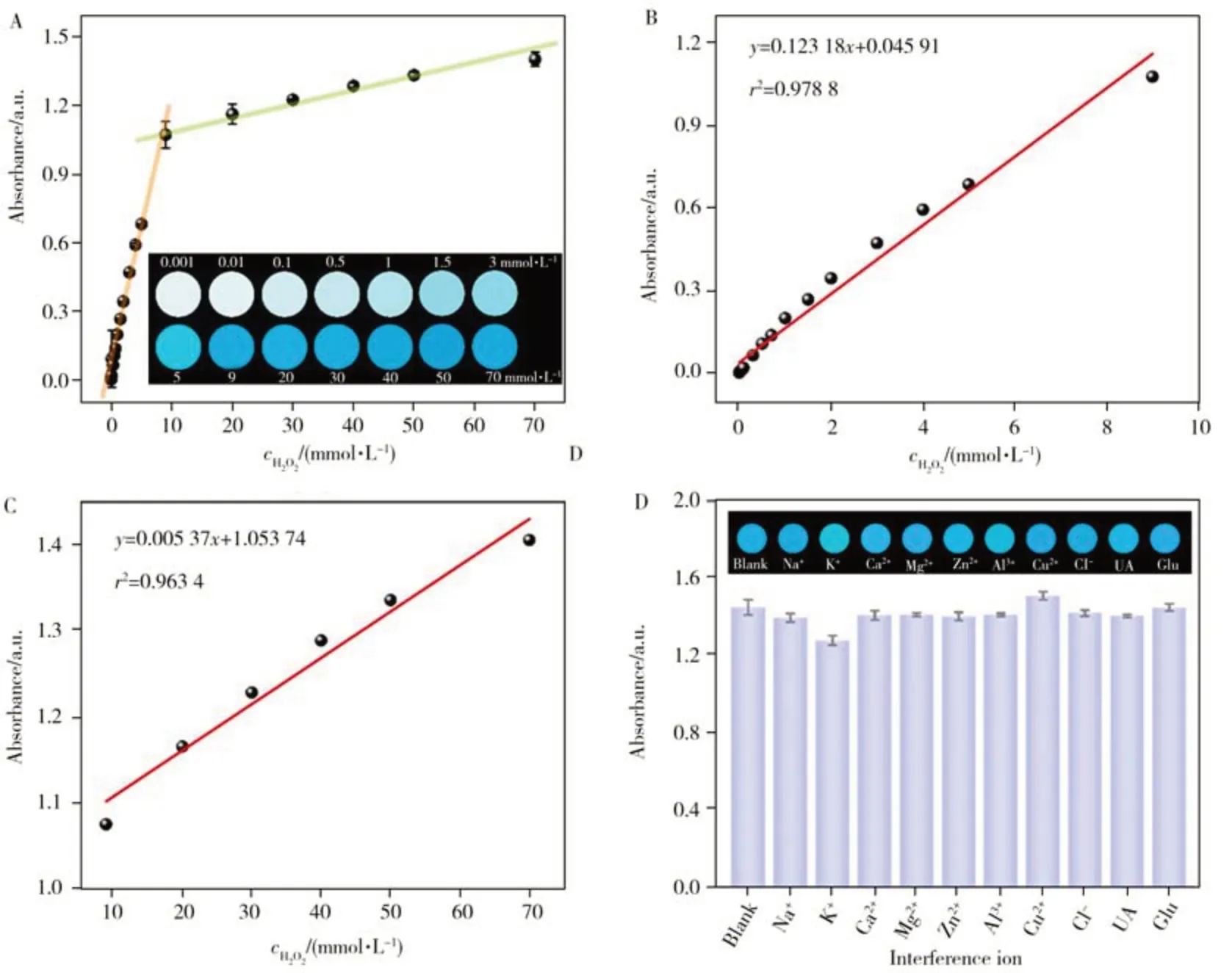
图7 652 nm处吸光度随H2O2浓度的变化曲线(A)及对应的线性工作曲线(B~C),方法的抗干扰能力(D)Fig.7 The absorbance curve at 652 nm with diffirent concentrations of H2O2(A),corresponding linear calibration curves(B-C),and anti-interference ability of the method(D)inset A shows plots of the corresponding solutions for H2O2 concentration of 0.001-70 mmol/L
考察了500 mmol/L 的Na+、K+、Ca2+、Mg2+、Zn2+、Al3+、Cu2+、Cl-、UA、Glu 为干扰物时对Fe7S8NFs+TMB 体系检测50 mmol/L H2O2的影响。结果显示,与未加入干扰物的体系相比,各干扰物存在时,体系在652 nm 处的吸光度变化均低于12%。表明上述干扰物对该体系检测H2O2的结果几乎无影响,说明所建立的方法用于H2O2检测时具有良好的抗干扰能力(图7D)。
2.6 智能手机可视化比色检测H2O2方法的构建
为实现上述比色方法使用的便捷性,本研究制作了适用于手机拍照的小型便捷式暗箱装置,通过将“Fe7S8+TMB+H2O2”反应体系与团队开发的“Thing Identify”分析软件集成,实现了实际水体中H2O2的智能手机可视化检测。该暗箱装置内部密封,可以提供稳定的内部光源,增强蓝色图像的颜色,最大程度地降低外部干扰,实现图片结果色值的准确分析。具体检测流程为:将显色后的溶液过滤后加入到黑色96 孔板中,置于自制的拍照暗箱装置,以智能手机的摄像头作为检测器获得显色结果照片。将该结果照片导入到“Thing Identify”分析软件转换为灰度值,构建灰度值(y)与H2O2浓度(x,mmol/L)的线性关系,在0.1~7 mmol/L H2O2浓度范围内,得到线性方程y=-0.167x+37.207(r2=0.942)。具体软件操作流程如图8 所示。在软件中保存该线性曲线,将实际样品的显色结果导入,软件即可依据现存线性方程自动计算出实际样品的浓度。智能手机可视化比色法更加便捷,相较于肉眼观察,准确度更高;相较于仪器检测,成本更低,便携性更强。
图8 智能手机可视化检测H2O2软件部分的操作流程Fig.8 The software part operation flow of the smart phone visualization detection of H2O2
2.7 实际水样中H2O2的检测
采用所建立的智能手机可视化比色检测方法对实际自来水样品进行检测。通过标准加入法在实际自来水样品中添加1.5、3、5 mmol/L 3个浓度的标准溶液,计算加标回收率,结果如表3所示。方法的加标回收率为92.6%~109%,相对标准偏差(RSD)为2.4%~4.0%,与紫外可见分光光度计(UV-Vis)测试所得的加标回收率(94.7%~118%)和RSD(1.1%~4.2%)结果接近。表明该手机智能可视化比色法可实现实际水样中H2O2的检测。

表3 实际水样中H2O2的检测及回收率(n=3)Table 3 Detection of H2O2 in actual water samples and recovery(n=3)
3 结 论
本文采用一步水热法制备了Fe7S8纳米花,通过SEM、HRTEM、XRD、XPS、BET、VSM 对其形态、结构和理化特性进行了系统表征。基于Fe7S8NFs的高类过氧化物酶活性,结合智能手机的暗箱拍照装置及“Thing Identify”色值分析软件,开发了一种高灵敏性的H2O2可视化比色检测方法,其检测效果与UV-Vis光度计结果相当,表明智能手机比色法具有较好的可靠性和灵敏性,准确度和精密度较高。将智能手机、色值分析软件与比色反应检测相结合,具有操作简单、灵敏度高、特异性好、可实现原位定量分析等优点,为H2O2的原位快速检测提供了一种可靠的方法,同时也为便捷可视化手机传感器的研发提供了新的思路。

