CXCR2在食管癌组织中的表达及其对食管癌细胞生物学行为的影响
黄丛改,刘 清,郑树涛,刘 涛,谭依依,彭天元,陈 娇,卢晓梅
(新疆医科大学第一附属医院,省部共建中亚高发病成因与防治国家重点实验室,新疆 乌鲁木齐 830011)
食管癌是全球发病率排位第8 和死亡率排位第6的恶性肿瘤,其中我国的发病率和死亡率最高[1]。在我国,食管鳞癌(esophageal squamous cell carcinoma,ESCC)占总食管癌病例的90%以上。尽管ESCC多模式治疗取得了重大进展,但晚期ESCC患者的5年生存率仍低于20%[2]。目前,食管癌的治疗仍与肿瘤分期、分型及是否存在远处转移密切相关[3]。CXC 受体2(CXC receptor 2,CXCR2)编码基因位于染色体2q33-q36,属于7 次跨膜的G 蛋白(G protein-coupled receptors,GPCR)偶联受体家族。CXCR2 在肿瘤微环境中的作用越来越得到重视,研究发现CXCR2参与肿瘤的发生发展及治疗过程[4]。目前,CXCR2 拮抗剂SCH527123 在食管癌治疗方面的作用鲜有报道。本实验采用免疫组织化学技术检测ESCC 组织及癌旁正常食管组织中CXCR2 的表达水平,分析CXCR2 表达与食管癌临床病理特征的关系,并检测CXCR2 拮抗剂SCH527123 对食管癌细胞生物学行为的影响,旨在为探索CXCR2 作为ESCC 的分子预测和靶向治疗分子标志物提供实验数据。
1 材料与方法
1.1 组织样本与细胞系
选取经组织病理学确诊手术切除的ESCC 组织74例作为研究组,患者术前均未行放疗或化疗;选取配对距离ESCC组织边缘5 cm以上的正常食管组织74例作为对照组。ESCC 患者中男性66 例,女性8 例;年龄43~90岁,中位年龄63岁;肿瘤部位上、中、下段分别为2、23 和49 例;肿瘤大体分型缩窄型3 例、蕈伞型7 例、髓质型13 例、溃疡型51 例;肿瘤直径≤5 cm 者68 例,>5 cm 者6 例;病理分级高分化者25 例、中-低分化者49 例;浸润深度达黏膜下层者8 例、肌层15 例、外膜51 例;发生脉管瘤栓者24 例;神经侵犯者12例;淋巴结转移者51例。
本研究经新疆医科大学第一附属医院医学伦理委员会批准(KY2022274),患者或其家属知情同意。人食管癌细胞系KYSE30 购自武汉大学细胞库,且经短串联重复序列(short tandem repeats,STR)测序,证实为食管鳞状细胞癌细胞株。
1.2 主要试剂
免疫组织化学一抗CXCR2 单克隆抗体购自美国R&D 公司,将一抗CXCR2(MAB331-100)按1∶100 标准化稀释。通用二抗试剂及DAB显色试剂盒购自福州迈新生物技术有限公司。PRMI-1640细胞培养液和胎牛血清(FBS)购自美国Gibco 公司,CXCR2 拮抗剂SCH527123购自美国Selleck公司,CCK-8细胞增殖检测试剂盒购自美国ApexBio公司。
1.3 实验方法
1.3.1 免疫组织化学检测CXCR2 在食管癌组织中的表达石蜡切片常规脱蜡至水,采用EnVision 法检测74 例ESCC 及相应癌旁正常食管组织中CXCR2 的表达。用柠檬酸缓冲液(pH=6.0)高压修复抗原。使用PBS代替一抗作为阴性对照,预实验的阳性组织切片作为阳性对照。根据细胞染色强度和阳性细胞百分率进行免疫组织化学综合评分,结果由2 位经验丰富的病理专家完成独立评价。细胞染色强度评分为:无着色计0分,黄色计1分,棕黄色计2分,黄褐色计3分;阳性细胞百分率评分为:肿瘤细胞无阳性显色为0 分,阳性显色≤10%为1 分,阳性显色>10%~50%为2 分,阳性显色>50%~80%为3 分,阳性显色>80%为4 分。将细胞染色强度和阳性细胞百分率得分相乘,总分<4分判读为CXCR2低表达,反之为高表达。
1.3.2 CCK-8 法及平板集落形成实验检测食管癌细胞的增殖本实验分为两组,常规PRMI-1640培养基培养的食管癌细胞为对照组,细胞培养基中添加了CXCR2 拮抗剂SCH527123(10 mmol/mL)的食管癌细胞为观察组。将食管癌细胞KYSE30 每孔1 500 个细胞(100 μL)接种于96孔板中,培养于37 ℃,CO2体积分数为5%培养箱中,待细胞贴壁后更换培养基,其中,观察组添加含有10 mmol/mL 的CXCR2 拮抗剂0.2 μL(根据前期预实验结果浓度),分别于SCH527123作用细胞24、48、72、96 h后,吸弃培养基,每孔新加入90 μL PRMI-1640 培养基+10 μL CCK-8 溶液,避光、混匀,继续在培养箱中静置2 h 后,使用酶标仪在450 nm波长处测定吸光度值。
平板集落形成实验中,正常培养的食管癌细胞为对照组,培养基中添加了CXCR2拮抗剂SCH527123的食管癌细胞为观察组,6孔板中每孔1 000个细胞,每组3个复孔,每孔2 mL培养基,培养过夜后,观察组添加拮抗剂SCH527123 每孔2 μL,放入培养箱静置培养,当培养皿底部有可见的细胞集落时,终止培养,用4%多聚甲醛固定,0.1%结晶紫染色。将6孔板置于白纸上拍照,使用ImageJ软件对克隆细胞进行计数及定量分析。
1.3.3 Transwell 迁移和侵袭实验将Transwell 小室放入24孔培养板中进行细胞迁移实验。上室为无血清培养基200 μL,接种1×105个KYSE30细胞;下室为含血清培养液600 μL,添加10 mmol/mL 的SCH527123 0.6 μL。作用36 h后染色、拍照及统计。同时设常规培养的食管癌细胞为对照组。侵袭实验在Transwell小室上室铺Matrigel基质胶,其余操作同迁移实验。
1.4 统计学分析
应用SPSS 16.0 统计软件。各组计数资料以百分率(%)表示;组间比较采用χ2检验或Fisher's 精确检验进行分析。使用ImageJ 软件、GraphPad Prism 8 软件对细胞实验数据进行统计分析。P<0.05为差异有统计学意义。
2 结 果
2.1 CXCR2在ESCC组织中的表达
CXCR2 在研究组ESCC 组织及对照组癌旁正常食管组织的表达情况见图1。CXCR2 棕黄色颗粒主要表达在细胞浆,部分在细胞膜。经统计分析结果显示,对照组的CXCR2 高表达细胞占13.5%(10/74),而研究组CXCR2 高表达细胞占73.0%(54/74),较对照组显著升高,差异具有统计学意义(χ2=53.298,P=0.000),见表1。
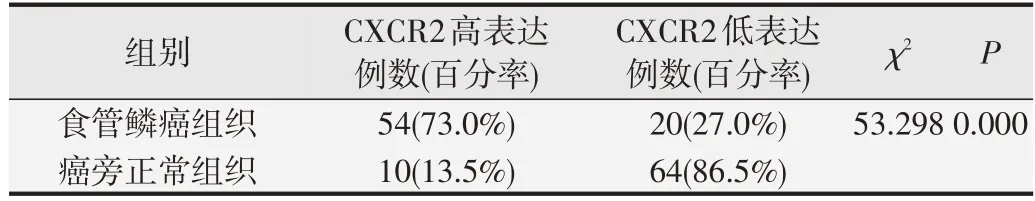
表1 CXCR2在食管鳞癌组织中的表达情况
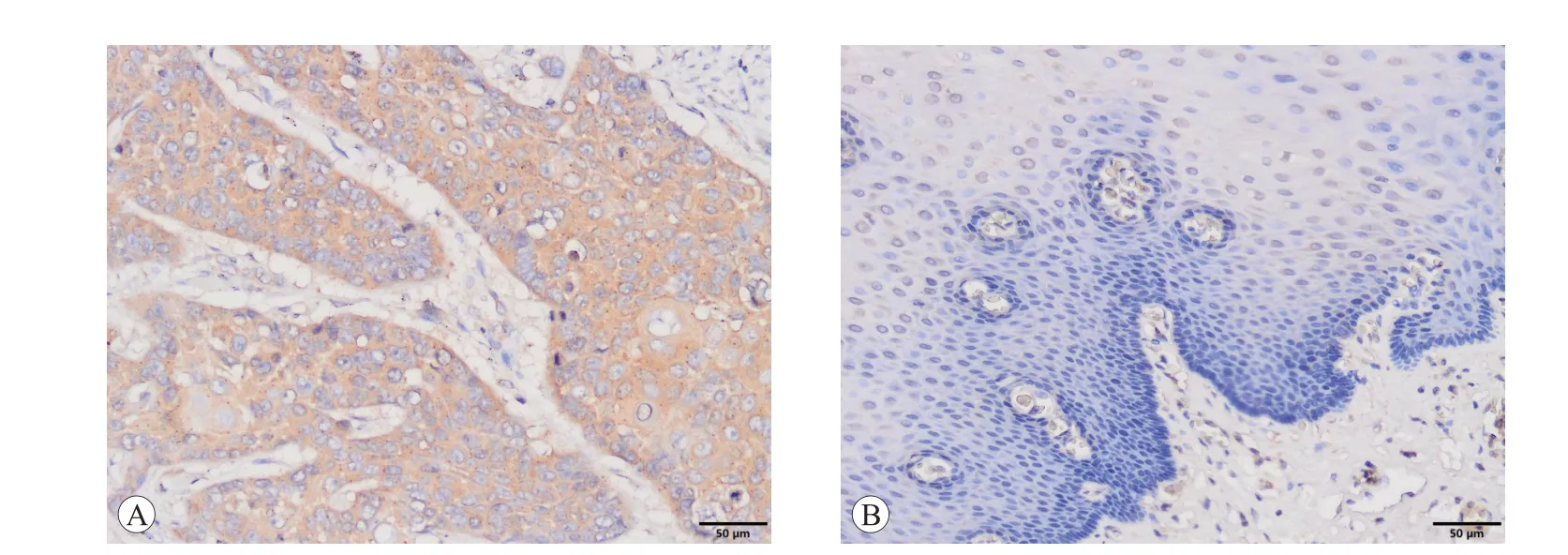
图1 免疫组织化学检测食管鳞癌组织CXCR2的表达
2.2 CXCR2表达与食管鳞癌临床病理特征的关系
食管鳞癌组织中CXCR2 的表达水平与患者性别、年龄、肿瘤部位、肿瘤大体分型、肿瘤直径、浸润深度、脉管瘤栓及神经侵犯均无显著相关关系(P>0.05),但与ESCC的病理分级(χ2=5.515,P=0.019)和淋巴结转移(χ2=7.320,P=0.007)间的差异均具有统计学意义,见表2。
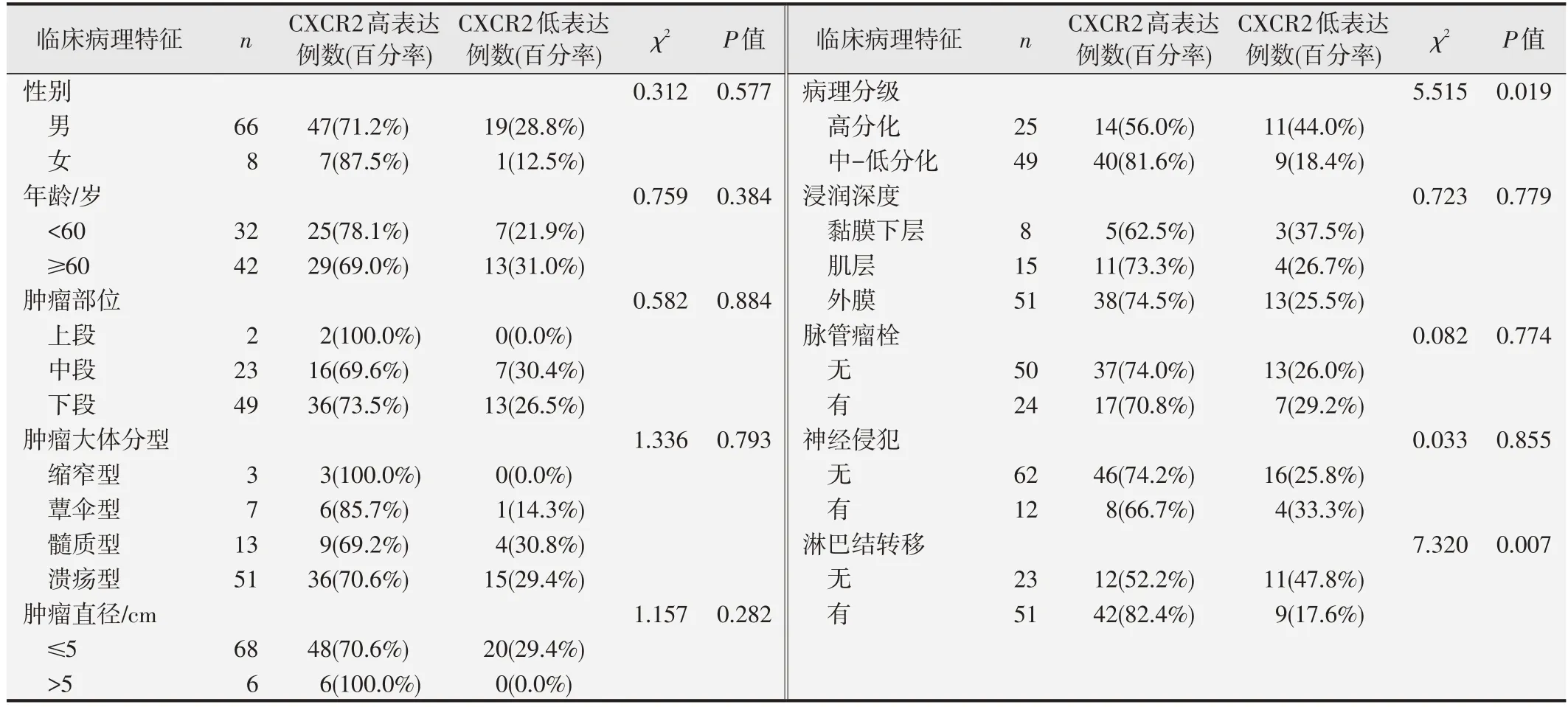
表2 食管鳞癌组织中CXCR2表达与临床病理特征的关系
2.3 抑制CXCR2表达对食管癌细胞增殖能力的影响
相较于对照组,CCK-8细胞增殖实验和平板集落形成实验结果均显示,添加CXCR2拮抗剂SCH527123后显著抑制了KYSE30食管癌细胞的增殖(图2)。

图2 CXCR2拮抗剂SCH527123对食管癌细胞增殖能力的影响
2.4 抑制CXCR2 表达对食管癌细胞迁移和侵袭能力的影响
与对照组比较,添加CXCR2 拮抗剂SCH527123后,KYSE30 细胞迁移数量较对照组明显减少。统计分析结果显示,抑制CXCR2的表达可明显抑制食管癌细胞KYSE30 的迁移能力(P<0.01,图3)。将Transwell小室上室铺Matrigel 基质胶,进一步检测了CXCR2 拮抗剂SCH527123对食管癌细胞侵袭能力的影响,结果发现添加了拮抗剂的观察组食管癌细胞KYSE30 侵袭能力明显低于对照组(P<0.01,图4)。

图3 CXCR2拮抗剂SCH527123对食管癌细胞迁移能力的影响

图4 CXCR2拮抗剂SCH527123对食管癌细胞侵袭能力的影响
3 讨 论
CXCR2 是G 蛋白偶联受体,能够促进血管生成[5]。研究发现肿瘤细胞可通过自分泌方式分泌趋化因子与CXCR2 结合,或以旁分泌方式结合CXCR2,促进肿瘤细胞的生长;CXCR2还可激活基质细胞,促进肿瘤血管生成、转移扩散和免疫逃逸[6],提示肿瘤细胞在CXCR2的作用下实现了自身的增殖和转移。而Wu等[7]研究发现沉默CXCR2显著降低了食管癌细胞在体内的生长,并通过ERK1/2 途径诱导细胞凋亡来预防食管癌[7]。
本研究结果显示,食管鳞癌组织中CXCR2的阳性表达明显高于癌旁正常食管组织,表明CXCR2在食管鳞癌组织中表达上调,推测其可能具有癌基因的功能;且CXCR2的高表达与食管鳞癌分化程度差和淋巴结转移密切相关,即食管癌患者肿瘤分化越差、淋巴结出现转移时CXCR2表达越高,预示食管鳞癌不良预后。既往研究[8]表明CXCR2 表达与淋巴结转移显著相关,是ESCC 切除后的不良预后因素;CXCR2 表达阳性的食管癌患者5 年生存率和预期生存时间显著低于阴性者[9];ESCC 组织中CXCR2 呈高水平表达且与TNM 分期、淋巴结转移和远处转移关系密切[10];术后出现并发症的CXCR2呈阳性表达的食管癌患者预后较差[11]。本实验结果与先前研究报道一致。综合本实验结果和文献报道,表明CXCR2 在食管癌组织中高表达,CXCR2阳性表达促进食管癌的迁移和侵袭,预后不良。
SCH527123 是一种有效的、变构的口服活性CXCR2 拮抗剂[12]。关于SCH527123 在肿瘤中的作用已有相关报道。研究[13]显示,口服SCH527123 选择性靶向CXCR2 是抑制黑色素瘤生长和血管生成的一种有前景的治疗方法;SCH527123 还可抑制卵巢肿瘤细胞迁移和侵袭,下调STAT3 和AKT 磷酸化以及survivin表达[14]。CXCR2 拮抗剂SCH527123 通过抑制IL-8/CXCR1/2 信号通路可降低人胰腺癌细胞的恶性特征[15],并能抑制结直肠癌的增殖以及能增强体内外结直肠癌细胞对奥沙利铂敏感性[16]。
但目前,关于SCH527123在食管癌中的作用尚未见报道。于是,本文进一步用CXCR2 拮抗剂SCH527123作用于食管癌细胞KYSE30,观察CXCR2 的表达被拮抗后食管癌细胞生物学行为变化。结果显示,相较于对照组,SCH527123 可显著抑制KYSE30 食管癌细胞的增殖、迁移和侵袭能力。
已知CXCR2 配体有7 个趋化因子:CXCL1/2/3、CXCL5/6/7/8。有报道提示CXCLs/CXCR2 轴可能通过维持和促进癌症干细胞(cancer stem cells,CSCs)的迁移在肿瘤的进展和转移中发挥重要作用,这些CSCs周围的内皮细胞不仅可以分泌CXCLs,还可上调CSCs中CXCR2的表达,从而增强CSCs的迁移和生长[17]。查阅国内外相关文献,目前关于CXCLs/CXCR2 在食管癌中的研究报道不多。Yang等[18]的研究表明直接干扰肿瘤细胞源性CXCL1 或抑制CXCL1/CXCR2 通路可有效恢复食管癌患者体内放射耐药异种移植物的放射敏感性,CXCL1 通过CXCR2-STAT3 通路进一步激活癌症相关成纤维细胞来驱动食管癌放射耐药。CXCL8/CXCR2或IL-8/CXCR2表达升高与ESCC患者的肿瘤进展、转移以及不良预后相关[19-20]。目前,CXCR2 参与食管癌患者预后的确切机制尚不完全清楚,需要深入探究,另外用动物模型验证CXCR2拮抗剂的作用也将是我们下一步的工作计划。
总之,本研究结果显示食管鳞癌组织中CXCR2表达水平上调,且与患者的不良预后相关。CXCR2的拮抗剂SCH527123 可显著抑制食管癌细胞KYSE30 的增殖、迁移和侵袭,推测CXCR2可能为食管鳞癌潜在的预测和靶向治疗的分子标志物。

