细菌回复突变试验菌株鉴定方法的比较
高 梅,汤连升,郑智勇,马 会,秦春雪,曹 冲
(山东省药学科学院,山东 济南 250101)
细菌回复突变试验(Ames 试验)作为一项体外遗传毒性试验,是食品、医疗器械、化妆品、化学品、农药和药物等研发常规开展的毒理学试验项目,目的是检测受试物能否引起细菌碱基置换或移码突变,从而评价其是否具有致突变性。
在Ames 试验相关的国家和行业标准、技术规范和指导原则中[1-8],均规定了应采用营养缺陷型菌株组合作为试验菌株,组合方式一是鼠伤寒沙门氏菌菌株间进行组合,二是鼠伤寒沙门氏菌和大肠杆菌进行组合。实验室在进行Ames试验时,多采用第一种组合,如TA97a、TA98、TA100、TA102、TA1535 组 合[9-11],TA97、TA98、TA100、TA102、TA1535 组合[12-14],TA97、TA98、TA100、TA102 组 合[15-16],TA97a、TA98、TA100、TA102 组 合[17-18],TA97、TA98、TA100、TA102、TA1535、TA1537 组合[19]等。无论采用哪种组合,都需要对菌株特性进行鉴定,鉴定合格后才能用于正式试验。GB 15193.4-2014、GBZ/T 240.8-2011、YY/T 0127.10-2009、YY/T 0870.1-2013、GB/T 15670.14-2017 和化妆品安全技术规范等标准和规范中,都规定需对菌株进行组氨酸缺陷型鉴定、脂多糖屏障缺陷(rfa 突变)鉴定、氨苄青霉素抗性(R因子)鉴定、四环素抗性(pAQ1质粒)鉴定和uvrB修复缺陷型(紫外线敏感性)鉴定,但鉴定方法不尽相同,本文就这几种菌株基因型鉴定的试验方法进行比较分析,并对TA97a、TA98、TA100、TA102、TA1535 等5 株试验菌株进行了鉴定,以期为Ames试验菌株鉴定方法提供参考。
1 材料与方法
1.1 菌株
组氨酸营养缺陷型鼠伤寒沙门氏菌TA97a、TA98、TA100、TA102、TA1535,由Molecular Toxicology公司提供。
1.2 主要试剂与仪器
牛肉膏、胰蛋白胨、琼脂粉、结晶紫,均购于国药集团化学试剂有限公司;D-生物素、L-组氨酸、氨苄青霉素、四环素,均购于北京索莱宝科技有限公司。
HFsafe-1500TE 型生物安全柜,购自上海力申科学仪器有限公司;SPX-250B-Z 型生化培养箱,购自上海博迅实业有限公司医疗设备厂;ZHWY-100B 型恒温培养振荡器,购自上海智城分析仪器制造有限公司;15 W 紫外线杀菌灯,购自广东雪莱特光电科技股份有限公司。
1.3 菌株组合
Ames试验相关的标准、规范和指导原则中,对试验菌株组合要求不尽相同,见表1。食品国家标准GB 15193.4-2014、化学品国家标准GB/T 21786-2008、《药物遗传毒性研究技术指导原则》中要求使用TA98、TA100、TA1535、TA97a 或TA97 或TA1537、TA102 或大肠杆菌WP2 uvrA 或大肠杆菌WP2 uvrA(pKM101)5 株菌株组合;口腔医疗器械行业标准YY/T 0127.10-2009、《化妆品安全技术规范》中要求使用TA97、TA98、TA100和TA102 4株菌株组合;化学品国家职业卫生标准GBZ/T 240.8-2011、医疗器械行业标准YY/T 0870.1-2013 和农药国家标准GB/T 15670.14-2017则推荐使用4株菌株组合,需要时可增加菌株。
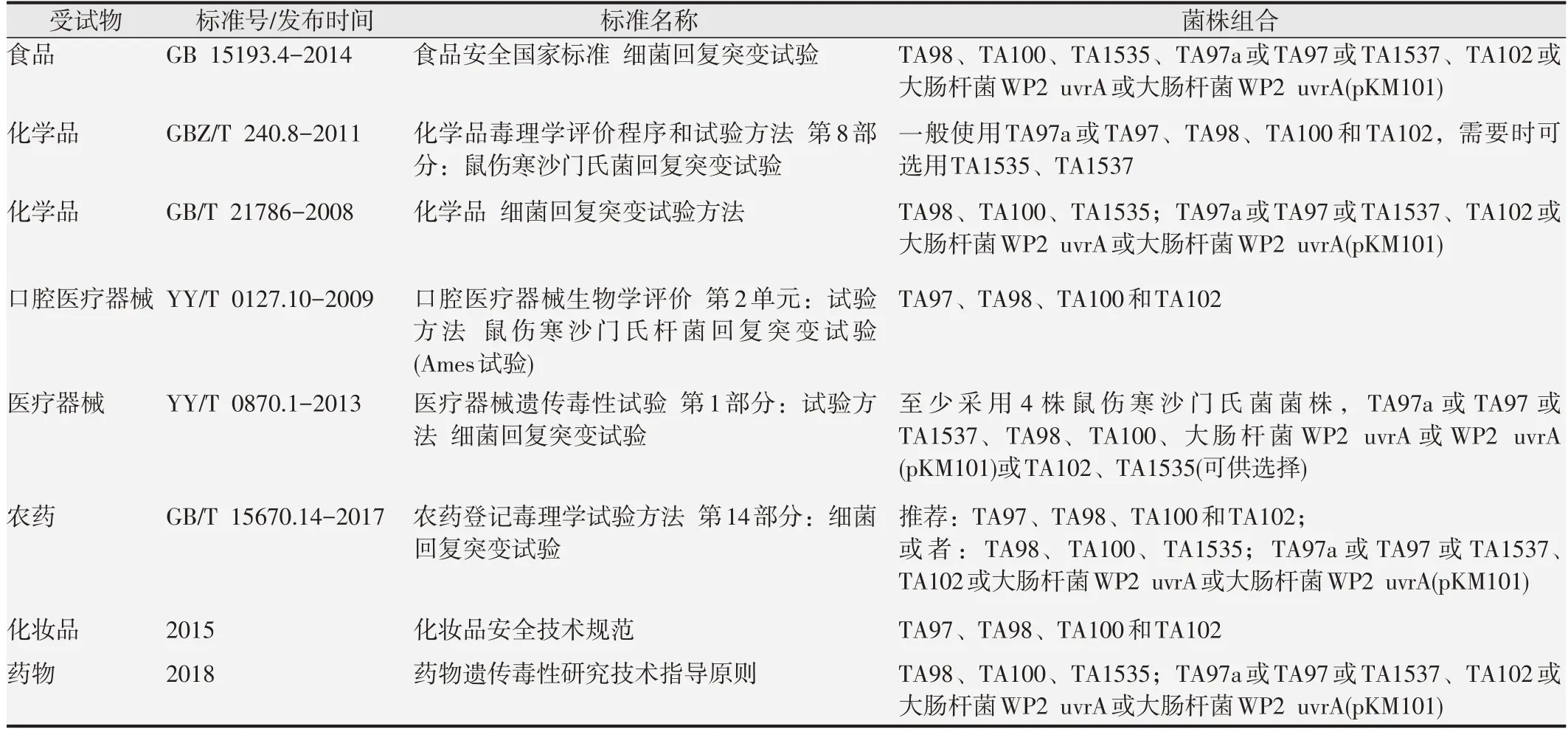
表1 Ames试验相关的国家和行业标准、技术规范、指导原则
1.4 组氨酸缺陷型鉴定
1.4.1 试验原理组氨酸营养缺陷型鼠伤寒沙门氏菌生长需要组氨酸,其本身没有合成组氨酸的能力,若培养基不含组氨酸,则菌株不能正常生长,只能在补充组氨酸的培养基上生长。
1.4.2 鉴定方法鉴定方法见表2。基本方法是制作两种平板,一种同时含有L-组氨酸和D-生物素,另一种只含D-生物素。将菌株分别接种在两种平板上,培养24 或48 h 观察菌株是否生长,但平板制作方法和培养时间有所不同。

表2 组氨酸缺陷型鉴定试验方法
在平板制作方面,食品、医药器械、化妆品、农药平板制作方法基本相同,在底层培养基中加入组氨酸和/或生物素溶液混合后倒平板,口腔医疗器械是将组氨酸和/或生物素溶液平铺在底层培养基平板表面;在培养时间上,食品、医疗器械、农药要求在菌株接种后培养48 h观察,口腔医疗器械、化妆品、化学品则要求培养24 h观察。
参考食品试验方法对TA97a、TA98、TA100、TA102、TA1535 菌株进行鉴定。用移液器分别吸取0.1 mL菌液,使用涂布棒在含组氨酸和不含组氨酸的培养基平板上涂成一条带,37 ℃培养48 h 观察结果。同时,参考其他文件,也对菌株接种后培养24 h的生长情况进行了观察。
1.5 脂多糖屏障缺陷鉴定
1.5.1 试验原理具有脂多糖屏障缺陷(rfa 突变)的试验菌株,表面一层脂多糖屏障缺损,细胞壁屏障功能丧失,通透性增加,结晶紫等一些大分子物质与其接触后,能穿透菌膜进入菌体,菌株的生长被抑制。
1.5.2 鉴定方法鉴定方法见表3。基本方法是将菌液与0.1%的结晶紫溶液接触24 h,观察结晶紫是否能抑制菌株生长,但平板制作方法和结晶紫溶液与菌液接触方法有所不同。

表3 脂多糖屏障缺陷鉴定试验方法
食品、医疗器械和农药试验方法相同,将0.1 mL菌液与营养肉汤琼脂培养基混合后制备平板,再放上滤纸片滴加结晶紫溶液;口腔医疗器械和化学品试验方法基本相同,将菌液加到顶层培养基试管混合后平铺到营养肉汤琼脂培养基平板表面,再放上浸过结晶紫溶液的滤纸片或者放上滤纸片后再滴加结晶紫溶液;化妆品则是将菌液于营养肉汤琼脂培养基平板表面划线,将浸过结晶紫溶液的滤纸条与划线处交叉放置。
参考食品试验方法进行鉴定。用移液器吸取0.1 mL菌液,使用涂布棒在营养肉汤琼脂培养基表面涂成一条带,待其干后,将无菌滤纸片放入条带中,并轻压滤纸片,用移液器在滤纸片上滴加0.1%结晶紫溶液10 μL,37 ℃培养24 h后观察结果。
1.6 氨苄青霉素抗性(R因子)鉴定
1.6.1 试验原理试验菌株若含R因子则具有氨苄青霉素抗性,与氨苄青霉素接触后能照常生长,不含R因子则无氨苄青霉素抗性,生长会被抑制。
1.6.2 鉴定方法鉴定方法见表4。基本方法是将菌液与氨苄霉素接触,37 ℃培养24 h,观察氨苄青霉素是否能够抑制菌株生长,但在平板制备、菌液使用量和菌液与氨苄青霉素接触的方法有所不同。食品、医疗器械、农药和化学品试验方法相同,先将氨苄青霉素溶液在营养肉汤琼脂培养基平板上划线,再交叉划线菌液;化妆品是在氨苄青霉素平板上划线接种0.1 mL菌液;口腔医疗器械则包括两种平板方法,在使用营养肉汤琼脂培养基平板时,是将沾有氨苄青霉素溶液的滤纸条与菌液划线处交叉放置。鉴定方法中只规定了氨苄青霉素的使用量,除化妆品技术规范外,都未规定划线接种时菌液使用量。

表4 氨苄青霉素抗性鉴定试验方法
参考食品试验方法进行鉴定。用移液器吸取10 μL 0.8%的氨苄青霉素,用涂布棒在营养肉汤琼脂培养基表面平板涂成一条带,待其干后,将待测菌株0.1 mL 与条带交叉处用涂布棒涂成一条带,37 ℃培养24 h观察结果。
1.7 四环素抗性(pAQ1质粒)鉴定
1.7.1 试验原理试验菌株若含pAQ1 质粒则对四环素有抗性,与四环素接触后能照常生长,不含pAQ1质粒则无四环素抗性,生长会被抑制。
1.7.2 鉴定方法鉴定方法见表5。基本方法是将菌液与四环素接触,37 ℃培养24 h,观察四环素是否能够抑制菌株生长,但平板制备、菌液使用量和菌液与四环素接触方法有所不同。食品、医疗器械、农药试验方法相同,先将四环素溶液和氨苄青霉素溶液在营养肉汤琼脂培养基平板上划线,再交叉划线接种菌液;化学品也是使用营养肉汤琼脂培养基平板,仅四环素与菌株接触无需使用氨苄青霉素;化妆品是在氨苄青霉素/四环素平板上划线接种0.1 mL 菌液;口腔医疗器械则包括两种平板方法,在使用营养肉汤琼脂培养基平板时,也不使用氨苄青霉素与菌株接触。鉴定方法中只规定了氨苄青霉素、四环素的使用量,除化妆品技术规范外,均未规定划线接种时的菌液使用量。
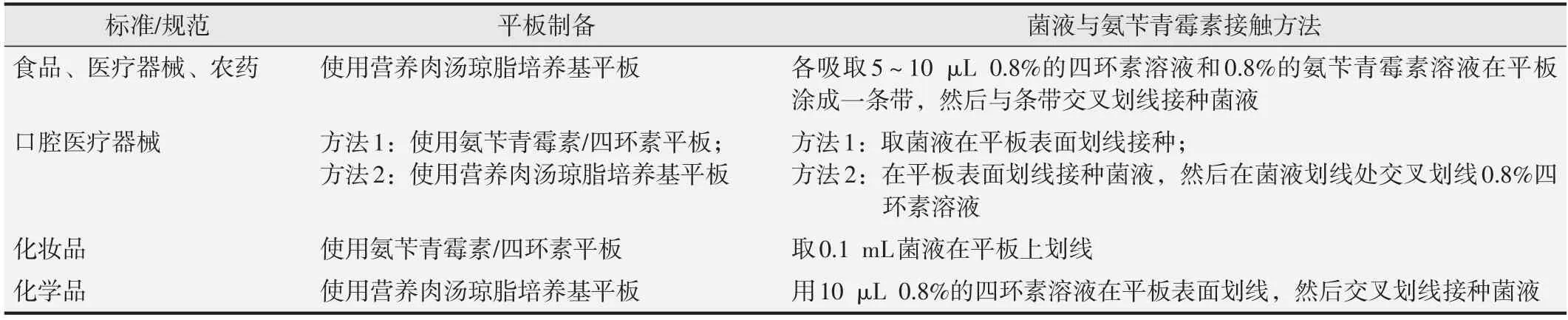
表5 四环素抗性鉴定试验方法
参考化学品和食品试验方法进行鉴定。用移液器吸取10 μL 0.8%的四环素溶液,用涂布棒在营养肉汤琼脂培养基平板表面涂成一条带,待干后,将待测菌株0.1 mL 与条带交叉处用涂布棒涂成一条带,37 ℃培养24 h观察结果。
1.8 uvrB修复缺陷型(紫外线敏感性)鉴定
1.8.1 试验原理试验菌株若具有uvrB突变,切除修复功能有缺陷,被紫外线照射后不能生长,具有野生型切除修复酶的菌株,具有损伤修复功能,被紫外线照射后照常生长。
1.8.2 鉴定方法食品、医疗器械、口腔医疗器械、化妆品、化学品、农药试验方法一致,基本方法是在营养肉汤琼脂培养基平板表面划线接种菌液,然后用黑纸遮盖住划线的一半,紫外线照射后37 ℃培养24 h,观察菌株能否生长。鉴定方法中规定了紫外线照射的强度、距离和时间,除化妆品技术规范外,均未定划线接种时菌液使用量。
用移液器吸取0.1 mL菌液,用涂布棒在营养肉汤琼脂培养基表面涂成一条带,待其干后,用黑纸遮盖涂布带的一半,在距离平板33 cm 处用15 W 紫外线灭菌灯照射8 s,37 ℃培养24 h观察结果。
2 结 果
2.1 组氨酸缺陷型鉴定
鉴定结果见图1 和图2。结果显示,接种后培养48 h,TA97a、TA98、TA100、TA102、TA1535 菌株在无组氨酸培养基平板上仅有自发回变菌落生长,而在有组氨酸培养基平板上生长出一条菌膜,表明5 株菌株生长均需要组氨酸。
图1 组氨酸缺陷型鉴定结果(不含组氨酸平板)
图2 组氨酸缺陷型鉴定结果(含组氨酸平板)
此外,在组氨酸缺陷型鉴定中,不同文件中培养时间要求不同,对TA97a、TA98、TA100、TA102 和TA1535 菌株接种后培养24 h,结果显示菌株在未添加组氨酸的平板上未见自发回变菌落生长,而在添加了组氨酸的平板上均生长出菌膜。
2.2 脂多糖屏障缺陷(rfa突变)鉴定
鉴定结果见图3。结果显示,TA97a、TA98、TA100、TA102、TA1535 在滤纸片周围均出现抑制环,说明5株菌株均对结晶紫敏感,为rfa突变型菌株。

图3 脂多糖屏障缺陷鉴定结果
2.3 氨苄青霉素抗性(R因子)鉴定
鉴定结果见图4。结果显示,TA97a、TA98、TA100、TA102 与氨苄青霉素接触后生长正常,说明这4 株菌株均含有R 因子,生长不被氨苄青霉素抑制;TA1535在氨苄青霉素带附近生长被抑制,表明该菌株不含R因子。

图4 氨苄青霉素抗性鉴定结果
2.4 四环素抗性(pAQ1质粒)鉴定
鉴定结果见图5。结果显示,TA102 菌株与四环素接触后生长正常,说明该菌株含有pAQ1 质粒,生长不被四环素抑制;TA97a、TA98、TA100、TA1535在四环素条带附近生长均被抑制,表明这4 株菌株不含pAQ1质粒。

图5 四环素抗性鉴定结果
2.5 uvrB修复缺陷型(紫外线敏感性)鉴定
鉴定结果见图6。结果显示,TA97a、TA98、TA100、TA1535菌株经紫外线辐射后不生长,仅在未照射过的一半生长,说明这4 株菌株对紫外线敏感,有uvrB突变;TA102经紫外线辐射后仍生长,说明该菌株对紫外线不敏感,具有完整的切除修复系统。

图6 uvrB修复缺陷型鉴定结果
3 讨 论
Ames试验是采用原核细胞测试受试物能否致细菌基因突变的体外试验,预测其致突变性和潜在的致癌作用。试验菌株生长需要组氨酸或色氨酸,若培养基不含组氨酸或色氨酸,则菌株不能正常生长,菌株与有致突变作用的受试物作用后,回复突变为野生型而具有合成组氨酸或色氨酸的能力,从而回变菌落数增多,因此可以通过菌落数量来评价受试物是否有遗传毒性。在使用5株菌株组合进行Ames试验时,国内实验室较多的是组氨酸营养缺陷型鼠伤寒沙门氏菌TA1535、TA97/TA97a、TA98、TA100 和TA102 组合[9-14],较少使用色氨酸营养缺陷型大肠杆菌WP2 uvrA[20],国外实验室使用此菌株频率较高[21-23]。
Ames试验中用到的菌株为突变型菌株,其某些特性易丢失或变异,以下情况应鉴定菌株的基因型:新购入菌株后;制备冷冻保存菌株时;重新挑选菌株时;当自发回变数不在正常范围时;对标准诱变剂丧失敏感性时;使用主平板传代时;用长期保存的菌株进行试验时[1,3-6]。GB 15193.4-2014、GBZ/T 240.8-2011、YY/T 0127.10-2009、YY/T 0870.1-2013、GB/T 15670.14-2017 和化妆品安全技术规范等文件中[1-6],均规定需对菌株进行组氨酸缺陷型鉴定、脂多糖屏障缺陷(rfa突变)鉴定、氨苄青霉素抗性(R因子)鉴定、四环素抗性(pAQ1 质粒)鉴定和uvrB 修复缺陷型(紫外线敏感性)鉴定等基因型鉴定,并详细地说明了各种试剂的配制及鉴定的具体操作方法。药物指导原则中[8]要求菌株特性鉴定需符合要求,未介绍具体的试验方法,ICH S2(R1)[24]和OECD TG471[25]中亦未规定相关鉴定方法。此外,氨苄青霉素抗性、四环素抗性鉴定和紫外线敏感性鉴定试验中,对接种时菌液的使用量规定也不尽相同,建议控制划线接种的菌液量,均匀划线或涂布,避免菌液分布不均匀导致鉴定结果不准确。较其他文件,食品安全标准GB 15193.4-2014 还要求进行生物素缺陷型的鉴定。Maron 和Ames[26]建议紫外线敏感性鉴定中,不含R因子的菌株用紫外线照射6 s,而且用到的紫外线灭菌灯应定期监测紫外线辐射照度;另外,他们认为不需要进行生物素需求试验。虽然不同文件中鉴定方法不同,但是判定标准和鉴定结果相同[27], TA97/TA97a、 TA98、 TA100、TA102 和TA1535 菌株生长均需组氨酸,均具有rfa 突变,除TA1535 外均具有氨苄青霉素抗性,除TA102外均对紫外线敏感和均无四环素抗性(见表6)。
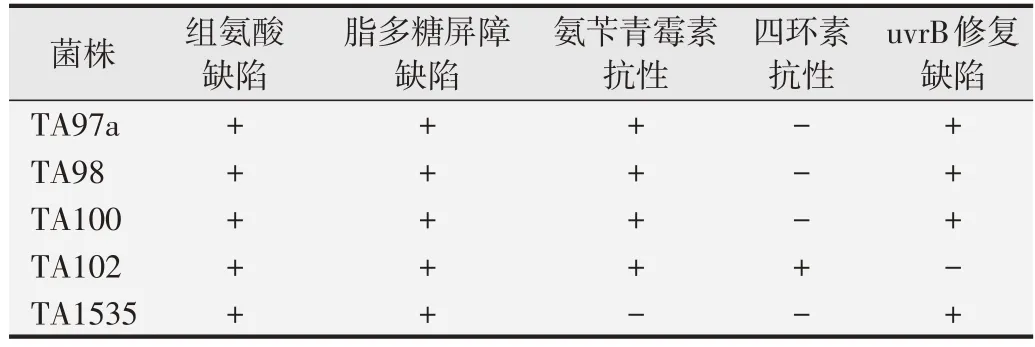
表6 试验菌株生物需特性鉴定结论
此外,除基因型鉴定外,还应进行自发回变、对诱变剂敏感性的生物特性鉴定[1-4],各实验室在参考文献的基础上,应建立自己实验室的菌株自发回变菌落数和对阳性诱变剂的回变菌落数的历史背景数据库。其中,张慧君等[28]研究显示多次传代后会影响菌株的自发回变数,建议实验室控制菌株传代次数,必要时对传代后用于试验的菌株进行鉴定。总之,各个实验室应规定好试验菌株鉴定的试验方法和鉴定频率,只有菌株合格,才能为Ames 试验结果的真实、可靠提供根本保障。

