丁香油对红鳍东方鲀幼鱼血液生化指标的影响
王舒慧,赵睿虎,曹新宇,李欣阳,姜志强
(大连海洋大学 农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
红鳍东方鲀(Takifugurubripes)是暖水性海洋底栖鱼类,主要分布于北太平洋西部,在中国常见于东海和黄渤海区域[1]。其肉质细腻嫩滑、蕴含丰富的营养成分,目前在国内海水鱼类养殖方面较为成功[2]。红鳍东方鲀具有抗炎、降压、护胃、调节免疫系统等多方面的积极作用。在其内脏及血液等部位存在河鲀毒素,这一剧毒物质可应用于神经系统疾病的治疗。红鳍东方鲀对刺激反应较强烈,在生产研究和试验操作过程中易挣扎,导致可操作性差,易使鱼体受损,在长途运输过程中,很容易由于缺氧和应激等因素导致死亡。
麻醉剂被广泛用于鱼类形态学测量、捕捞、运输和标记放流等研究工作中,科学合理使用麻醉剂能够有效地降低鱼类的应激变化,减轻对鱼体的损伤,使其存活率得以升高。丁香油化学式为C11H14O2,学名2-甲氧-4-烯丙基苯油,是一种植物香料,凭借其安全、高效等优势在美国农用杀虫剂以及食品添加剂中被广泛使用。此外,丁香油以其高效、成本小、低毒等优点,近年来在鱼类麻醉剂中被较高关注,已在活体采卵、活鱼运输以及手术过程中得到广泛应用[3]。在鱼类麻醉中,丁香油关键有效成分为丁香酚,方法采取药液浸泡。澳大利亚、智利、芬兰、新西兰等国家普遍认为丁香油是水产麻醉的理想选择,因为它被认为没有残留期[4]。
血液生化指标可充分反映鱼体生理状况、健康状况以及营养水平等方面。因此,本研究检测了麻醉过程中及复苏后红鳍东方鲀幼鱼的各项血液生化指标,并对麻醉剂造成的试验鱼应激以及器官功能(肝、肾)影响进行了重点研究,旨在为探讨丁香油麻醉红鳍东方鲀幼鱼的安全性以及揭示其麻醉机理提供研究基础。
1 材料与方法
1.1 试验用鱼
红鳍东方鲀幼鱼购自大连富谷水产有限公司,体重为40~55 g,状态健康无任何疾病。在进行试验之前,对这些鱼进行了24 h的禁食处理。
1.2 试验用水
试验所使用的海水来自于大连黑石礁海区,经过过滤处理。海水的温度为18~20 ℃,盐度为31‰~33‰,同时,总氨氮浓度低于0.05 mg·L-1,溶解氧浓度高于7 mg·L-1,亚硝酸盐浓度小于0.01 mg·L-1。
1.3 试验器材
采用溶菌酶(LZM)试剂盒(比浊法)进行试验,供应商为南京建成生物科技公司。麻醉试验设备包括:移液枪(5 mL和1 mL)、200 L塑料圆桶、电子秤、冰盘、1 mL无菌注射器、水浴锅、计时器、1.5 mL离心管、722型紫外分光光度计、比色皿(0.5和1.0 cm)。
1.4 试验方法
1.4.1 丁香油溶液的配制
丁香油溶液的配置:由于丁香油不易溶于水,首先将其用无水乙醇配制成0.1 g·mL-1的丁香油待用液[5],配好的待用液4 ℃冷藏保存,可多次使用。试验时可用移液枪取所用量的待用液加入120 L蓝色塑料箱,箱内应提前倒入相应体积水。充分搅拌使其溶解,以分别配成8、16、24 mg·L-1的丁香油溶液,放置5 min后待用。
1.4.2 选定试验浓度并进行分组
对照组不对幼鱼进行麻醉,用K来表示。丁香油麻醉试验组用D表示,其后数字表示麻醉剂的浓度,分别为1、2、3,对应的浓度分别为8、16、24 mg·L-1。在不同的时间点,包括麻醉1/4、4、8、24 h及复苏后24 h时,取样并测量各组幼鱼的生化指标和血清中的溶菌酶含量。值得注意的是,由于16 mg·L-1浓度时麻醉时间超过4 h会导致幼鱼死亡,因此在该浓度下,只测1/4、4、8和复苏后24 h,24 mg·L-1组只测麻醉1/4 h和复苏后24 h。每个麻醉试验组中包括30尾幼鱼,在每个时间段,随机选择5尾进行采血并进行后续的测量。
1.4.3 采血与后续测定
选择特定的麻醉时间段的试验鱼,将它们置于冰盘中,冰盘内需提前铺好纱布。使用湿纱布盖住试验鱼的头部,再使用一次性无菌注射器在试验鱼的尾部进行采血。采集的血液分装到4~5个离心管中,随后在4 ℃的冷冻离心机中以12 000 r·min-1的速度离心10 min,以获得大于300 μL的上清液样品。取3份送至大连市体检中心测量相关血清生化指标,包括:血糖、总蛋白、谷丙转氨酶、谷草转氨酶、总胆红素以及尿素氮。剩余的血清用于后续测定溶菌酶(LZM)活性。溶菌酶用南京建成有限公司的试剂盒进行测定,测定方法为比浊法中的自身对照法,操作按照试剂盒说明书进行,溶菌酶1 g=80 U。
1.5 数据处理
使用SPSS statistics17.0对试验结果进行单因素方差分析,并选择Duncan(邓肯)多重比较分析方法对数据进行进一步处理。试验结果表示形式为平均值±标准差,当P<0.05时,差异被视为显著。
2 结果与分析
2.1 麻醉剂影响下红鳍东方鲀幼鱼血糖(GLU)变化
根据表1数据可知,部分麻醉组与对照组在GLU水平上存在显著差异。对照组的GLU水平在24 h内保持相对稳定,但在麻醉复苏24 h后,所有组的GLU水平与麻醉开始后的1/4 h相比均下降。在麻醉过程中,各麻醉组在1/4 h时都显示为GLU升高。其中,D1、D2组在4、8 h时的GLU水平显著高于对照组,而D2组在麻醉后4 h时GLU水平急剧上升。值得注意的是,复苏24 h后,D1、D2、D3组的GLU水平与对照组之间的差异不显著。
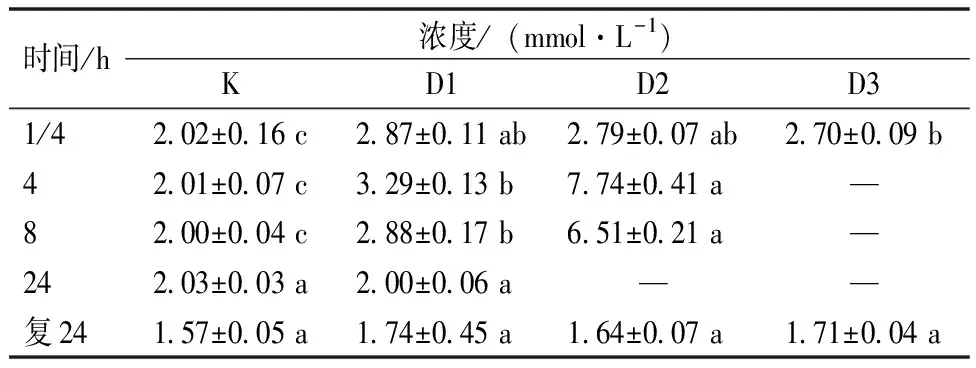
表1 红鳍东方鲀幼鱼血糖(GLU)受不同浓度麻醉剂的影响Table 1 Effect of different concentrations of anesthetics on GLU of juvenile T. rubripes
2.2 麻醉剂影响下红鳍东方鲀幼鱼血清总蛋白(TP)变化
根据表2数据可知,在麻醉开始后1/4 h时,各个麻醉组的血清TP水平与对照组相比没有显著差异。然而,当麻醉进行到4 h和8 h时,D2组的血清TP水平显著低于对照组,而其他麻醉组在麻醉时间内与对照组之间的血清TP水平差异不显著。在复苏24 h后,只有D2组的血清TP水平显著低于对照组,而其他麻醉组与对照组之间的血清TP水平差异并不显著。

表2 红鳍东方鲀幼鱼血清总蛋白(TP)受不同浓度麻醉剂的影响Table 2 Effect of different concentrations of anesthetics on TP of juvenile T. rubripes
2.3 麻醉剂影响下红鳍东方鲀幼鱼血清谷丙转氨酶(ALT)变化
根据表3数据可知,在麻醉开始后1/4 h时,麻醉组的试验鱼与对照组相比,其血清中的ALT活性没有显著差异。但是,D1组在麻醉24 h时,血清中的ALT水平较对照组差异显著,尽管复苏24 h后差异不显著。而D2组从麻醉后的4 h开始,血清中ALT水平较对照组显著升高,且该组还出现了鱼死亡的情况。值得关注的是,即使在复苏24 h后,D2组的血清ALT水平仍远高于对照组。
2.4 麻醉剂影响下红鳍东方鲀幼鱼血清谷草转氨酶(AST)变化
根据表4数据可知,在麻醉开始后1/4 h时,麻醉组的试验鱼与对照组相比,其血清AST活性没有显著差异。但是D2组在麻醉后的4 h和 8 h时,该组的血清AST活性明显高于对照组,而在复苏24 h后,只有D2组的血清AST水平仍远超对照组。

表4 红鳍东方鲀幼鱼血清谷草转氨酶(AST)受不同浓度麻醉剂的影响Table 4 Effect of different concentrations of anesthetics on AST of juvenile T. rubripes
2.5 麻醉剂影响下红鳍东方鲀幼鱼血清总胆红素(T-BIL)变化
根据表5数据可知,在麻醉过程中,各个麻醉组的T-BIL水平都显著高于对照组。然而,在复苏24 h后,D1和D2组的T-BIL水平仍然显著高于对照组,而D3组与对照组之间的T-BIL水平差异不显著。
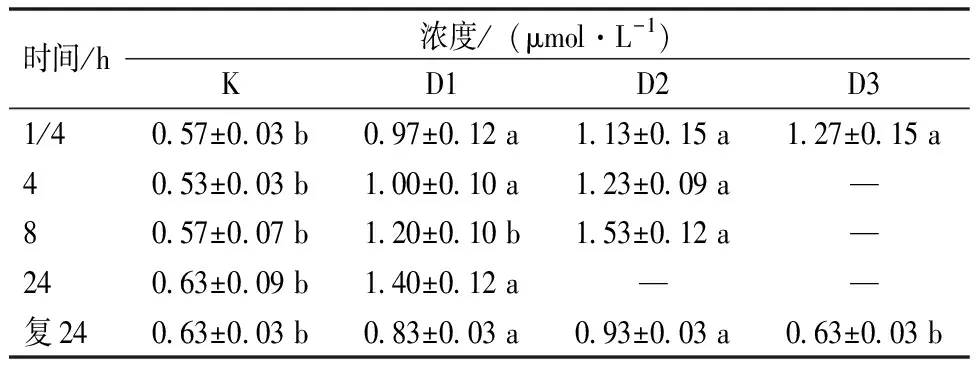
表5 红鳍东方鲀幼鱼血清总胆红素(T-BIL)受不同浓度麻醉剂的影响Table 5 Effect of different concentrations of anesthetics on T-BIL of juvenile T. rubripes
2.6 麻醉剂影响下红鳍东方鲀幼鱼血清尿素氮(BUN)变化
根据表6数据可知,在麻醉开始后1/4 h时,D3组的试验鱼血清中的BUN水平显著高于对照组;而在麻醉4、8 h时,D2组的试验鱼血清BUN水平明显高于对照组,而D1组的差异不显著。然而,在复苏24 h后,D2组的试验鱼血清BUN水平明显低于对照组。

表6 红鳍东方鲀幼鱼血清尿素氮(BUN)受不同浓度麻醉剂的影响Table 6 Effect of different concentrations of anesthetics on BUN of juvenile T. rubripes
2.7 麻醉剂影响下红鳍东方鲀幼鱼血清溶菌酶(LZM)变化
根据表7数据可知,在整个麻醉过程中,D1组试验鱼血清中的LZM活性始终与对照组无显著差异,与D1组不同,D2、D3组血清中LZM活性与对照组相比显著降低。而在复苏24 h后,除D2组外,D1和D3组的LZM活性均显著高于对照组。

表7 红鳍东方鲀幼鱼血清溶菌酶(LZM)受不同浓度麻醉剂的影响Table 7 Effect of different concentrations of anesthetics on LZM of juvenile T. rubripes
3 讨论
3.1 麻醉剂影响下红鳍东方鲀幼鱼相关血液生化指标
血糖水平是应激指标之一,会受到环境和摄食情况等多种因素的影响。为了减少这些影响,在试验开始之前,对所有的试验鱼进行停止投喂24 h处理,以使鱼体在开始试验时能够达到消化吸收后状态[6]。根据表1数据,可以看到在24 h内,对照组试验鱼血糖水平一直保持相对稳定,而在复苏后24 h血糖水平有所下降。这表明,未受到外部因素如麻醉等的干扰时,试验鱼的血糖在24 h内保持相对稳定,而在复苏24 h后时略有下降。而麻醉组在麻醉1/4 h时各组血糖水平较对照组均显著升高,这种情况的产生可能是由于外界环境突然发生较大变化导致鱼体发生应激,试验鱼需要消耗能量以使机体保持稳定,从而加快肝糖原与肌糖原的降解。此外,由于被麻醉,试验鱼活动受到限制,耗能降低。D1、D2组在4、8 h时的血糖水平较对照组相比显著升高,原因可能为鱼体发生应激糖原降解加快,远超代谢所消耗。该组结果与梁政远等[7]对罗非鱼麻醉效果不同,原因可能与浓度的选择和试验鱼对麻醉剂敏感度的差异有关。
在机体代谢中,肝脏起着尤为关键的作用,血清蛋白主要在其中合成,肝脏健康与否可通过血清总蛋白水平间接反映。在4~24 h期间,D2组血清总蛋白水平较对照组显著降低,说明丁香油麻醉剂在浓度为16 mg·L-1时对试验鱼肝脏具有显著影响。
丁香油对ALT水平影响结果显示,在24 h时,D1组ALT明显高于对照组,而在复苏24 h后,这种差异不再显著,这说明浓度为8 mg·L-1的丁香油在麻醉24 h后会对试验鱼产生影响,但该影响在复苏24 h后是可恢复的。D2组从4 h开始,ALT水平较对照组显著升高且伴有鱼死亡情况发生,这说明浓度为16 mg·L-1的丁香油在麻醉时不可麻醉超过4 h。D3组丁香油浓度24 mg·L-1时麻醉不超过15 min试验鱼复苏24 h后可以恢复。丁香油浓度16 mg·L-1麻醉8 h时,麻醉过程中细胞受损,复苏24 h后试验鱼仍不能恢复,说明复苏24 h后试验鱼仍不能恢复到正常状态,但是ALT较麻醉时期明显降低,说明此过程是可逆的,与徐启明等[8]研究结果一致。血清AST在试验过程中的变化与ALT相同,这表明,较高浓度的麻醉剂麻醉时间较长(长于4 h)会导致试验鱼心脏及肝脏中某些组织受到损伤,此结果与齐红莉等[9]研究结果相同。
血清中胆红素的来源主要是红细胞在老化后被瓦解产生的血红蛋白所生成,丁香油对幼鱼血液总胆红素影响结果显示,麻醉剂使试验鱼血液内总胆红素明显上升,说明麻醉剂会破坏血液中的衰老红细胞。
在蛋白质代谢过程中,尿素氮是主要的终极产物,是能反映肾功能情况的一种指标[10]。鱼体血清中的尿素氮在正常生理水平下处于动态的平衡。本试验结果显示,D2组在4和8 h时尿素氮含量显著高于对照组,说明丁香油溶液在16 mg·L-1时4 h内可以抑制试验鱼的肾功能,在这段时间内,此浓度下丁香油溶液使试验鱼对尿素氮的滤过率降低,导致尿素氮在体内蓄积。D3组在麻醉1/4 h时血清中尿素氮含量显著增加,说明24 mg·L-1丁香油溶液1/4 h即可显著抑制试验鱼肾功能。复苏24 h后D2组血清中尿素氮仍显著低于对照组,说明该组试验鱼机体蛋白质分解仍受抑制。
3.2 麻醉剂影响下红鳍东方鲀幼鱼血清中溶菌酶变化
溶菌酶是一种碱性酶,对细菌细胞壁能起到水解作用,从而使细菌发生溶解。溶菌酶还可与病毒蛋白结合,使病毒失去活性,从而在机体内起到防御作用[11]。根据试验结果,在麻醉时间内,D1组鱼体血清中的溶菌酶活性较对照组始终无明显差异,说明麻醉剂在较低浓度下对血清中溶菌酶活性没有明显影响。与低浓度处理组结果不同,在D2和D3组中,血清中溶菌酶活性显著降低,此结果说明丁香油浓度为16 mg·L-1时已超过试验鱼鱼体的生理调节范围。在复苏24 h后,除D2组以外,其他各组的溶菌酶活性较对照组相比均显著提高,说明丁香油麻醉后试验鱼鱼体抗菌和抗病毒能力得到显著提高。

