新型N-取代靛红杂合喹唑啉类化合物的合成及其抗肿瘤活性
王 伟,冯志娟,吕梦娇,张娅玲,侯佳威,李宝林
(陕西师范大学 化学化工学院,陕西 西安 710119)
近年来,随着对肿瘤细胞信号传导途径研究的不断深入,以酪氨酸激酶为靶点的治疗成为癌症治疗效果较好的方法之一[1]。喹唑啉类化合物,如已上市的抗肿瘤药物拉帕替尼(Lapatinib,图1a)[2-3]、吉非替尼(Gefitinib,图1b)[4-5]和埃罗替尼(Erlotinib,图1c)[6]等,是活性较高、选择性较好的一类小分子酪氨酸激酶抑制剂。其中,拉帕替尼是首个可口服的双靶点小分子酪氨酸激酶抑制剂,它可以同时作用于表皮生长因子受体EGFR和HER-2,抑制其活性,阻止表皮生长因子受体过度表达,抑制癌细胞增殖[7]。然而,上述抗肿瘤药物在使用一段时间后会产生耐药性,同时也具有一定的毒副作用,易引发腹泻、恶心、呕吐、皮疹及肝损伤等症状。
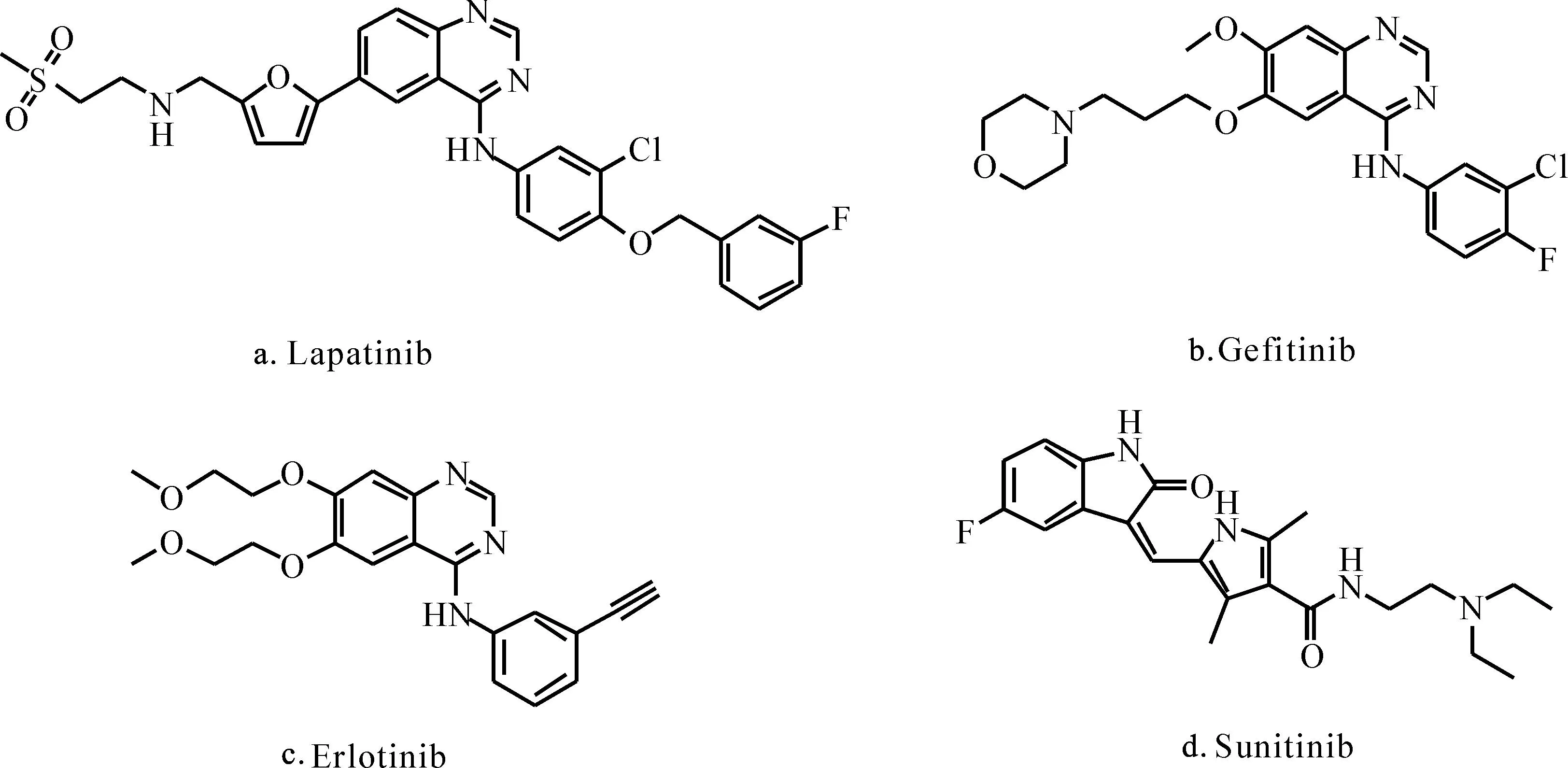
图1 部分抗肿瘤化合物的结构式
靛红,又名1-氢-吲哚-2,3-二酮,是人体组织中一种内源性杂环分子[8],也是海洋生物维持生存所必需的一种天然活性物质,具有多种药理活性[9-10]。目前,对靛红的研究包括1-位N原子上的取代、2-位和3-位羰基碳修饰以及苯环修饰,其中修饰3-位羰基碳所得化合物的抗肿瘤活性最高,如3-芳基亚甲基靛红衍生物[11]、靛红-3-腙衍生物[12]、靛红-3-亚胺金属配合物[13]和C3-靛红螺环衍生物[14-15]等。研究表明,靛红类化合物可作用于血管内皮细胞生长因子受体VEGFR-2、成纤维细胞生长因子受体FGFR-1等,通过抑制其过度表达而诱导肿瘤细胞凋亡[16]。已上市的含靛红结构单元的抗肿瘤药物如舒尼替尼(Sunitinib,图1d)[17-18]、托西尼布磷酸盐(Toceranib phosphate)[18]可用于治疗肾癌、胃肠道肿瘤等疾病,说明靛红衍生物在抗肿瘤方面具有药用价值。
部分靶向药物服用一段时间后会产生耐药性,而将2个或2个以上具有不同药效或互补药效的生物片段进行杂合,其协同作用能够增强癌症治疗效果[19]。鉴于上述喹唑啉类化合物和靛红衍生物在抗肿瘤方面的良好效果,本研究拟采用药效基团杂合的方式[20],在课题组前期工作的基础上[21],以拉帕替尼的药效基团喹唑啉环为母核,4-位分别连接不同的芳氨基结构单元,6-位连接呋喃甲醛基结构单元,并进一步在醛基上连接靛红腙结构单元。基于以上设计思路,进行结构新颖的N-取代靛红杂合喹唑啉类化合物的合成,并对所合成化合物进行初步的抗肿瘤活性研究。
1 材料与方法
1.1 仪器与试剂
核磁共振仪,Bruker Avance 600 MHz,四甲基硅烷作为内标;红外光谱仪,Bruker Fensor 27;高分辨质谱仪,Bruker Esquire 3000plus;显微熔点测定仪,X-6,北京泰克仪器有限公司。
所用试剂均为市售分析纯。所用受试细胞株人结肠癌细胞SW480、人皮肤鳞状细胞癌细胞A431、人非小细胞肺癌细胞NCI-H1975和A549均购自中国科学院细胞库。
1.2 实验方法
本研究共合成9个结构新颖的N-取代靛红杂合喹唑啉类化合物(8a~8i),其合成路线如图2所示。
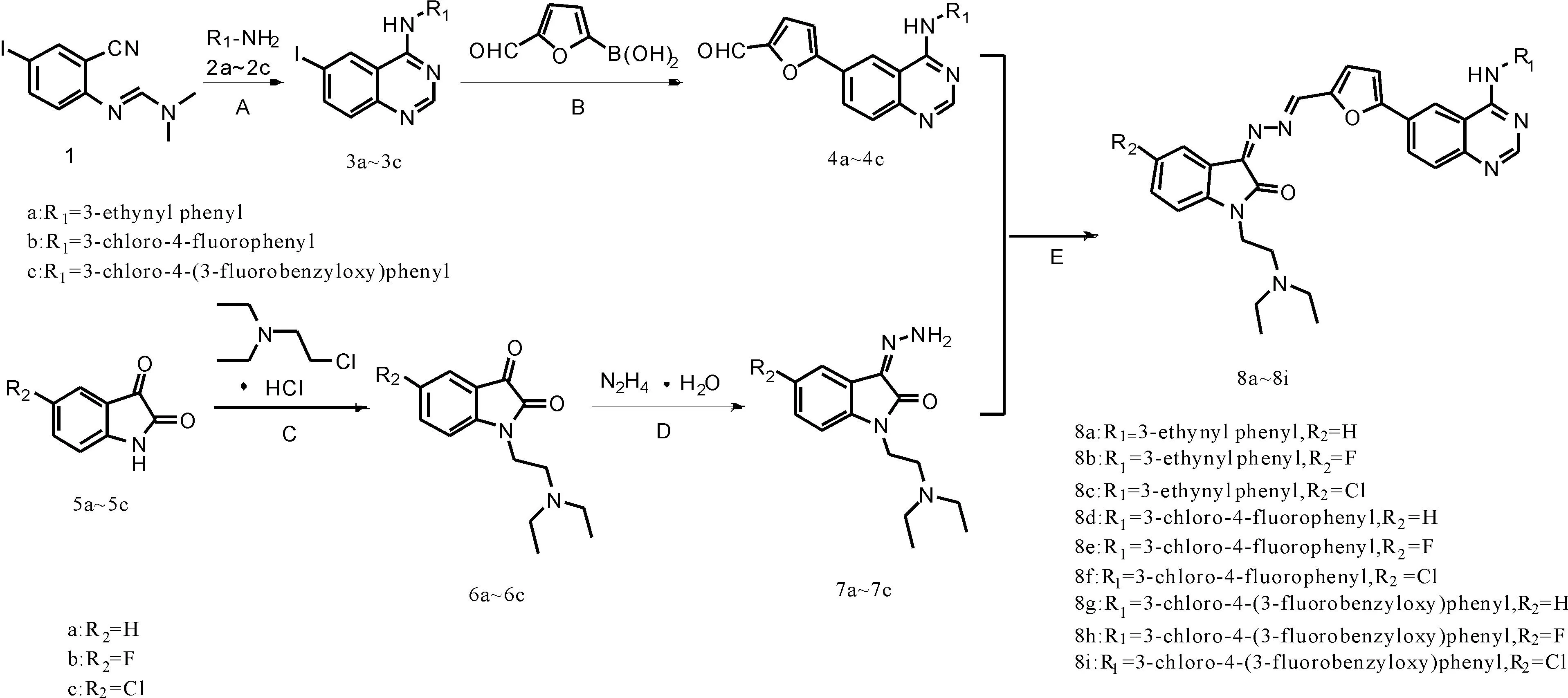
A:CH3COOH,130 ℃,20 min;B:5% Pd/C,乙二醇二甲醚,MeOH,Et3N,50 ℃,3 h;C:CHCl3,H2O,K2CO3,40 ℃,4 h;D:CH3OH,65 ℃,30 min;E:C2H5OH,N,N-二甲基甲酰胺,CH3COOH,79 ℃,6 h。
1.2.1 化合物3a~3c的合成
称取N′-(2-氰基-4-碘苯基)-N,N-二甲基甲脒(2.99 g,10.0 mmol)和芳胺化合物2a~2c(11 mmol)于圆底烧瓶中,加入5 mL冰乙酸溶解,130 ℃反应20 min,冷却至室温。减压旋蒸除去冰乙酸,向体系中加入20 mL蒸馏水,并用浓氨水调节pH值为9~10,室温下搅拌30 min。抽滤,水洗滤饼,所得滤饼经硅胶柱色谱分离(洗脱剂中V乙酸乙酯∶V石油醚=1∶6),得到白色固体即为化合物3a~3c。
4-(3-乙炔基苯氨基)-6-碘喹唑啉(3a)[7],白色固体3.05 g,收率为83%。
4-(3-氯-4-氟苯氨基)-6-碘喹唑啉(3b)[7],白色固体3.48 g,收率为88%。
4-[3-氯-4-(3-氟苄氧基)苯氨基]-6-碘喹唑啉(3c)[7],白色固体4.55 g,收率为91%。
1.2.2 化合物4a~4c的合成
称取化合物3a~3c(6 mmol)、5-甲酰基呋喃-2-硼酸(1.12 g,8.0 mmol)、5% Pd/C (0.56 g)于圆底烧瓶中,加入40 mL乙二醇二甲醚和20 mL甲醇,并加入三乙胺(2.42 g,24 mmol),50 ℃反应3 h。趁热抽滤,滤饼用四氢呋喃洗涤,将滤液减压旋蒸除去溶剂,所得浓缩物经硅胶柱色谱分离(洗脱剂中V乙酸乙酯∶V氯仿=1∶15),得到橘黄色固体即为化合物4a~4c。
4-(3-乙炔基苯氨基)-6-(5-甲酰基呋喃-2-基)喹唑啉(4a)[7],橘黄色固体1.44 g,收率为71%。
4-(3-氯-4-氟苯氨基)-6-(5-甲酰基呋喃-2-基)喹唑啉(4b)[7],橘黄色固体1.85 g,收率为85%。
4-[3-氯-4-(3-氟苄氧基)苯氨基]-6-(5-甲酰基呋喃-2-基)喹唑啉(4c)[22],橘黄色固体2.44 g,收率为86%。
1.2.3 化合物6a~6c的合成
称取化合物5a~5c(10 mmol)、碳酸钾(5.53 g,40 mmol)于圆底烧瓶中,加入10 mL氯仿;称取N,N-二乙氨基氯乙烷盐酸盐(3.44 g,20 mmol)于另一个圆底烧瓶中,加入9 mL水。将N,N-二乙氨基氯乙烷盐酸盐水溶液加入装有化合物5a~5c的圆底烧瓶中,室温剧烈搅拌10 h。反应完全后,用氯仿(30 mL)萃取2次,有机相合并,并用无水硫酸镁干燥,减压旋蒸除去溶剂,所得浓缩物经硅胶柱色谱分离(洗脱剂中V甲醇∶V乙酸乙酯=1∶80),得到红色油状液体即为化合物6a~6c。
1-(2-二乙氨基乙基)-1-氢-吲哚-2,3-二酮(6a),红色油状液体1.55 g,收率为63%。
1-(2-二乙氨基乙基)-5-氟-1-氢-吲哚-2,3-二酮(6b),红色油状液体1.79 g,收率为68%。
1-(2-二乙氨基乙基)-5-氯-1-氢-吲哚-2,3-二酮(6c),红色油状液体2.34 g,收率为83%。
1.2.4 化合物7a~7c的合成
称取化合物6a~6c (5 mmol)于圆底烧瓶中,加入15 mL甲醇和6.5 mL水合肼(80%),65 ℃回流30 min。待反应液冷却后,减压旋蒸除去溶剂,所得浓缩物经硅胶柱色谱分离(洗脱剂中V甲醇∶V乙酸乙酯=1∶80),得到亮黄色油状液体即为化合物7a~7c。
(Z)-1-(2-二乙氨基乙基)-3-腙吲哚啉-2-酮(7a),亮黄色油状液体1.06 g,收率为82%。
(Z)-1-(2-二乙氨基乙基)-5-氟-3-腙吲哚啉-2-酮(7b),亮黄色油状液体1.12 g,收率为80%。
(Z)-1-(2-二乙氨基乙基)-5-氯-3-腙吲哚啉-2-酮(7c),亮黄色油状液体1.11 g,收率为76%。
1.2.5 化合物8a~8i的合成
称取化合物4a~4c(0.3 mmol)、化合物7a~7c(0.3 mmol)于圆底烧瓶中,加入7 mL无水乙醇和0.1 mLN,N-二甲基甲酰胺(DMF)溶解后,再加入0.3 mL冰乙酸,79 ℃回流6 h。冷却至室温,减压旋蒸除去溶剂,所得浓缩物在甲醇-四氢呋喃(THF)混合物中重结晶,得到红色固体即为化合物8a~8i。
(Z)-1-(2-(二乙氨基乙基))-3-(((E)-(5-(4-(3-乙炔苯氨基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)吲哚啉-2-酮(8a),红色固体0.136 g,收率为78%。熔点:242.0~244.4 ℃; HRMS:C35H32N7O2,[M+H]+:582.261 4(计算值582.261 7);1H NMR (600 MHz,DMSO-d6) δ:10.16 (s,1H),9.05 (s,1H),8.74 (s,1H),8.69 (s,1H),8.48 (d,J=6.4 Hz,1H),8.36 (d,J=8.2 Hz,1H),8.09 (s,1H),8.03 (d,J=7.7 Hz,1H),7.93 (d,J=8.9 Hz,1H),7.66~7.65 (m,1H),7.54~7.49 (m,2H),7.47 (t,J=7.7 Hz,1H),7.29 (d,J=7.3 Hz,1H),7.25 (d,J=7.3 Hz,1H),7.22~7.17 (m,1H),4.26 (s,1H),4.12 (brs,2H),3.49 (brs,2H),3.24 (brs,4H),1.19 (brs,6H);13C NMR (151 MHz,DMSO-d6)δ:164.1,157.7,157.0,155.0,152.3,151.0,150.0,149.2,146.0,144.4,139.4,133.5,129.6,129.3,129.0,126.9,126.7,124.9,123.3,123.1,122.6,121.9,119.2,116.7,115.5,110.6,109.5,83.4,80.7,48.6,46.4,34.8,8.7; IRνmax(KBr) cm-1:3 448,2 929,1 714,1 608,1 533,1 384,1 161,842,746,590。
(Z)-1-(2-(二乙氨基乙基))-3-(((E)-(5-(4-(3-乙炔苯氨基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氟吲哚啉-2-酮(8b),红色固体0.134 g,收率为75%。熔点:253.5~256.2 ℃; HRMS:C35H31FN7O2,[M+H]+:600.252 1 (计算值600.252 3);1H NMR(600 MHz,DMSO-d6) δ:10.11(s,1H),9.08(s,1H),8.77(s,1H),8.67(s,1H),8.32(d,J=8.6 Hz,1H),8.24(dd,J=8.0、2.0 Hz,1H),8.08 (s,1H),7.96(d,J=8.0 Hz,1H),7.90(d,J=8.6 Hz,1H),7.68(d,J=3.5 Hz,1H),7.50 (d,J=3.5 Hz,1H),7.45 (t,J=7.9 Hz,1H),7.41 (td,J=8.7、2.7 Hz,1H),7.29~7.28 (m,2H),4.21 (s,1H),4.14 (brs,2H),3.41 (brs,2H),3.29~3.22 (m,4H),1.22 (t,J=6.7 Hz,6H);13C NMR (151 MHz,DMSO-d6) δ:164.0,159.0,157.8,157.4,157.3,154.1 (d,1JC-F=270 Hz),150.8,149.9,149.1,140.6,139.2,129.1,128.9,128.7,127.1,126.7,125.2,123.7,123.0,121.8,119.6(d,2JC-F=23.4 Hz),119.4,117.3 (d,3JC-F=8.9 Hz),116.4 (d,2JC-F=26.1 Hz),115.5,110.8,110.7 (d,3JC-F=8.2 Hz),83.4,80.6,47.8,46.4,34.7,8.3; IRνmax(KBr) cm-1:3 490,2 974,1 716,1 573,1 533,1 384,1 164,1 028,847,574。
(Z)-1-(2-(二乙氨基乙基))-3-(((E)-(5-(4-(3-乙炔苯氨基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氯吲哚啉-2-酮(8c),红色固体0.141 g,收率为76%。熔点:278.7~281.0 ℃;HRMS:C35H31ClN7O2,[M+H]+:616.221 8(计算值:616.222 8);1H NMR (600 MHz,DMSO-d6)δ:10.13 (s,1H),9.09 (s,1H),8.80 (s,1H),8.67 (s,1H),8.55 (brs,1H),8.37 (d,J=8.6 Hz,1H),8.03 (s,1H),7.91 (d,J=8.2 Hz,2H),7.65 (d,J=3.1 Hz,1H),7.61 (d,J=7.9 Hz,1H),7.50 (d,J=3.1 Hz,1H),7.45 (t,J=8.0 Hz,1H),7.31~7.27 (m,2H),4.23 (s,1H),4.14 (brs,2H),3.40 (brs,2H),3.26 (brs,4H),1.21~1.20 (m,6H);13C NMR (151 MHz,DMSO-d6)δ:163.7,157.8,157.2,155.0,153.2,150.8,148.9,142.9,139.1,132.6,129.0,128.9,128.6,127.1,126.6,125.4,124.3,123.1,121.8,119.6,118.0,115.4,111.2,111.1,110.7,83.3,80.7,47.8,46.4,34.6,8.4; IRνmax(KBr) cm-1:3 490,2 974,1 716,1 573,1 533,1 384,1 164,1 028,847,574。
(Z)-1-(2-(二乙氨基乙基))-3-(((E)-(5-(4-(3-氯-4-氟苯氨基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)吲哚啉-2-酮(8d),红色固体0.153 g,收率为83%。熔点:231.5~234.1 ℃; HRMS:C33H30ClFN7O2,[M+H]+:610.213 0(计算值:610.213 4);1H NMR (600 MHz,DMSO-d6) δ:10.21 (s,1H),9.01 (s,1H),8.74 (s,1H),8.68 (s,1H),8.47 (d,J=7.4 Hz,1H),8.36 (d,J=8.4 Hz,1H),8.20 (d,J=4.8 Hz,1H),7.93 (d,J=7.8 Hz,2H),7.65 (d,J=3.2 Hz,1H),7.55~7.47 (m,3H),7.27 (d,J=7.8 Hz,1H),7.19 (t,J=7.5 Hz,1H),4.15 (brs,2H),3.42 (brs,2H),3.29 (brs,4H),1.22 (t,J=6.8 Hz,6H);13C NMR (151 MHz,DMSO-d6)δ:164.1,157.7,156.9,154.9,154.3,152.7,152.2,150.0 (d,1JC-F=263 Hz),149.8,144.3,136.3 (d,4JC-F=1.8 Hz),133.5,129.6,129.4,128.9,126.8 (d,3JC-F=8.8 Hz),123.7,123.3,123.0,122.5 (d,3JC-F=6.8 Hz),119.1,118.9 (d,2JC-F=18.4 Hz ),116.7,116.6(d,2JC-F=21.4 Hz),115.4,110.7,109.6,47.9,46.4,34.5,8.3; IRνmax(KBr) cm-1:3 456,2 925,1 716,1 608,1 496,1 191,1 031,810,752,549。
(Z)-1-(2-(二乙氨基乙基))-3-(((E)-(5-(4-(3-氯-4-氟苯氨基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氟吲哚啉-2-酮(8e),红色固体0.152 g,收率为81%。熔点:249.6~252.1 ℃; HRMS:C33H29ClFN7O2,[M+H]+:628.203 6 (计算值:628.203 9);1H NMR (600 MHz,DMSO-d6)δ:10.12 (s,1H),8.98 (s,1H),8.74 (s,1H),8.64 (s,1H),8.27 (d,J=7.5 Hz,1H),8.23 (dd,J=8.2、2.4 Hz,1H),8.19 (d,J=4.8 Hz,1H),7.90 (d,J=7.8 Hz,1H),7.85 (d,J=8.6 Hz,1H),7.65 (d,J=3.6 Hz,1H),7.47~7.44 (m,2H),7.40 (td,J=9.0、2.7 Hz,1H),7.28 (dd,J=8.5、4.0 Hz,1H),4.13 (t,J=5.3 Hz,2H),3.47 (brs,2H),3.30 (brs,4H),1.23 (t,J=7.1 Hz,6H);13C NMR (151 MHz,DMSO-d6)δ:164.0,158.3 (d,1JC-F=215.4 Hz),157.4,157.2,154.8,153.5 (d,1JC-F=242.2 Hz),153.3,150.9 (d,4JC-F=2.2 Hz),149.8,149.0,140.5,136.2 (d,4JC-F=2.0 Hz),129.0,128.7,126.7,123.8 (d,3JC-F=7.3 Hz),123.7,122.5 (d,3JC-F=6.8 Hz),119.6 (d,2JC-F=23.4 Hz),119.2,118.8 (d,2JC-F=18.1 Hz),117.3 (d,3JC-F=9.2 Hz),116.5 (d,2JC-F=21.5 Hz),116.4,115.3,110.8,110.6 (d,3JC-F=7.4 Hz),48.6,46.4,34.6,8.4; IRνmax(KBr) cm-1:3 431,2 979,1 720,1 614,1 498,1 166,1 029,891,810,547。
(Z)-1-(2-(二乙氨基乙基))-3-(((E)-(5-(4-(3-氯-4-氟苯氨基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氯吲哚啉-2-酮(8f),红色固体0.152 g,收率为79%。熔点:251.6~252.7 ℃; HRMS:C33H29Cl2FN7O2,[M+H]+:644.173 1 (计算值:644.174 4);1H NMR (600 MHz,DMSO-d6)δ:10.05 (s,1H),8.95 (s,1H),8.73 (s,1H),8.61 (s,1H),8.47 (m,1H),8.27 (d,J=8.7 Hz,1H),8.13 (d,J=4.5 Hz,1H),7.84~7.80 (m,2H),7.59 (d,J=3.6 Hz,1H),7.57 (dd,J=8.5、1.8 Hz,1H),7.46 (t,J=9.0 Hz,1H),7.42 (d,J=3.6 Hz,1H),7.27 (d,J=8.4 Hz,1H),4.10 (brs,2H),3.49 (brs,2H),3.27 (brs,4H),1.21 (t,J=6.9 Hz,6H);13C NMR (151 MHz,DMSO-d6)δ:163.8,157.6,157.1,154.9,154.3,153.3,152.7,149.8 (d,1JC-F=278.3 Hz),148.9,142.8,136.1,132.5,129.0,128.9,128.6,127.1,126.6,124.2,124.0,122.8 (d,3JC-F=6.7 Hz),119.4,118.8(d,2JC-F=18.1 Hz),117.9,116.5(d,2JC-F=21.6 Hz),115.3,111.1,110.6,47.8,46.4,34.7,8.8; IRνmax(KBr) cm-1:3 525,2 935,1 722,1 608,1 496,1 365,1 031,804,630,547。
(Z)-1-(2-(二乙氨基乙基))-3-(((E)-(5-(4-(3-氯-4-(3-氟苄氧基)苯氨基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)吲哚啉-2-酮(8g),红色固体0.139 g,收率为65%。熔点:174.5~176.9 ℃; HRMS:C40H36ClFN7O3,[M+H]+:716.255 6 (计算值:716.255 2);1H NMR (600 MHz,DMSO-d6)δ:10.23 (s,1H),9.26 (s,1H),9.06 (s,1H),8.74 (s,1H),8.65 (s,1H),8.47 (d,J=7.2 Hz,1H),8.36 (d,J=8.6 Hz,1H),8.04 (s,1H),7.93 (d,J=8.7 Hz,1H),7.83 (d,J=8.8 Hz,1H),7.65 (d,J=2.8 Hz,1H),7.54~7.45 (m,3H),7.35~7.31(m,3H),7.28 (d,J=7.8 Hz,1H),7.19 (t,J=7.0 Hz,2H),5.29 (s,2H),4.16 (brs,2H),3.41 (d,J=4.3 Hz,2H),3.27~3.26(m,4H),1.22 (t,J=6.8 Hz,6H);13C NMR (151 MHz,DMSO-d6)δ:163.8,162.2 (d,1JC-F=243.1 Hz),157.6,157.0,155.0,152.0,151.0,149.9,149.7,149.1,144.7,139.6 (d,3JC-F=7.6 Hz),133.4,133.1,130.5 (d,3JC-F=9.1 Hz),129.6,129.0,128.7,126.6,124.4,123.9,123.3 (d,4JC-F=1.5 Hz),123.1,122.7,122.1,121.1,119.1,116.5,115.4,114.6 (d,2JC-F=21.1 Hz),114.3,114.0 (d,2JC-F=22.6 Hz),110.5,109.8,109.5,69.4,48.4,46.5,35.9,9.9; IRνmax(KBr) cm-1:3 654,2 968,1 714,1 604,1 382,1 267,1 024,794,750,513。
(Z)-1-(2-(二乙氨基乙基))-3-(((E)-(5-(4-(3-氯-4-(3-氟苄氧基)苯氨基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氟吲哚啉-2-酮(8h),红色固体0.141 g,收率为64%。熔点:196.7~197.3 ℃; HRMS:C40H35ClF2N7O3,[M+H]+:734.246 4 (计算值:734.245 8);1H NMR (600 MHz,DMSO-d6)δ:10.00 (s,1H),8.98 (s,1H),8.72 (s,1H),8.60 (s,1H),8.25 (d,J=8.8 Hz,1H),8.18 (d,J=6.4 Hz,1H),8.03 (s,1H),7.83 (d,J=8.6 Hz,1H),7.79 (d,J=8.7 Hz,1H),7.63 (d,J=2.0 Hz,1H),7.52~7.46 (m,1H),7.44 (d,J=2.6 Hz,1H),7.37~7.32 (m,3H),7.28 (d,J=9.0 Hz,1H),7.22~7.17 (m,2H),5.27 (s,2H),3.95 (brs,2H),2.99 (brs,4H),1.06 (brs,6H);13C NMR (151 MHz,DMSO-d6)δ:163.7,162.2 (d,1JC-F=244.6 Hz),158.8 (d,1JC-F=238.6 Hz),157.6,157.2 (d,3JC-F=6.0 Hz),155.1,153.0,150.9 (d,4JC-F=3.0 Hz),149.9,149.8,149.0,145.8,141.0,139.6 (d,3JC-F=7.5 Hz),132.9,130.5 (d,3JC-F=7.5 Hz),128.8,128.7,126.5,124.4,124.1,123.5,123.3 (d,4JC-F=3.0 Hz),122.6,122.3,121.0,119.5 (d,2JC-F=24.2 Hz),119.2,116.4 (d,2JC-F=25.7 Hz),115.3,114.7 (d,2JC-F=21.1 Hz),114.2,114.0 (d,2JC-F=21.1 Hz),110.6 (d,3JC-F=9.1 Hz),69.4,48.4,46.5,36.0,10.0; IRνmax(KBr) cm-1:3 332,2 636,1 710,1 617,1 498,1 417,1 269,1 028,810,518。
(Z)-1-(2-(二乙氨基乙基))-3-(((E)-(5-(4-(3-氯-4-(3-氟苄氧基)苯氨基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氯吲哚啉-2-酮(8i),红色固体0.138 g,收率为61%。熔点:199.3~200.9 ℃; HRMS:C40H35Cl2FN7O3,[M+H]+:750.216 6 (计算值:750.216 2);1H NMR (600 MHz,DMSO-d6)δ:10.16 (s,1H),9.03 (s,1H),8.77 (d,J=4.6 Hz,1H),8.62 (s,1H),8.52 (d,J=5.4 Hz,1H),8.33 (t,J=7.7 Hz,1H),7.97 (s,1H),7.85 (t,J=8.3 Hz,1H),7.73 (d,J=8.3 Hz,1H),7.68~7.56 (m,2H),7.52~7.42 (m,2H),7.33 (dd,J=27.2、8.6 Hz,4H),7.20 (t,J=8.3 Hz,1H),5.28 (s,2H),4.13 (brs,2H),3.40 (brs,2H),3.28 (brs,4H),1.22 (t,J=7.0 Hz,6H);13C NMR (151 MHz,DMSO-d6)δ:163.8,162.2 (d,1JC-F=244.6 Hz),157.9,157.1,154.8,153.2,150.7,150.1,148.9,142.9,139.6 (d,3JC-F=7.5 Hz),132.6,130.5 (d,3JC-F=7.5 Hz),129.0,127.9,127.1,126.7,125.9,124.6,124.3,123.3 (d,4JC-F=3 Hz),122.8,122.6,121.1,119.5,118.0,115.2,114.7 (d,2JC-F=21.1 Hz),114.3,114.0 (d,2JC-F=21.1 Hz),111.5,111.2,110.7,69.4,47.8,46.4,34.6,8.3; IRνmax(KBr) cm-1:3 422,2 640,1 714,1 598,1 382,1 261,1 026,981,798,513。
1.2.6 抗肿瘤活性实验
利用MTT法测定化合物8a~8i对肿瘤细胞的生长抑制活性。取对数期生长状态良好的人肿瘤细胞SW480、A431、NCI-H1975和A549,用0.25%的胰酶消化液消化细胞,离心收集,重悬计数后,制备成细胞悬液,并调整细胞悬液浓度为2×104~5×104个/mL。随后将细胞悬液接种于96孔细胞培养板(100 μL/孔),并将其置于37 ℃、5% CO2、饱和湿度的培养箱中培养24 h。用培养基将受试化合物稀释至相应浓度,并将其加入上述已接种人肿瘤细胞的96孔细胞培养板中(100 μL/孔),调整二甲基亚砜(DMSO)的最终体积分数为0.5%,随后将培养板置于培养箱中继续培养。72 h后,在培养板中加入噻唑蓝溴化四唑(MTT,20 μL/孔),混匀后,继续在培养箱中反应。4 h后取出培养板,弃去孔内上清液,加入DMSO(150 μL/孔),将培养板置于摇床上震荡10 min。待充分溶解甲臜后,用多功能酶标仪测定570 nm处的吸光度,同时以630 nm处的吸光度作为参比,计算肿瘤细胞生长抑制率。
肿瘤细胞生长抑制率= 1—[(DS-DNC)/
(DPC-DNC)]× 100%。
(1)
其中:DS为样品孔的吸光度(细胞+待测化合物+MTT);DNC为调零孔的吸光度(培养基DMSO+MTT);DPC为对照孔的吸光度(细胞+DMSO+MTT)。
受试化合物对肿瘤细胞生长的抑制曲线采用Graphpad Prism 5软件拟合,得到IC50值,每组实验均重复3次。
2 结果与讨论
本研究所述的9个N-取代靛红杂合喹唑啉类化合物8a~8i的合成路线如图2所示。先是由化合物N′-(2-氰基-4-碘苯基)-N,N-二甲基甲脒分别与3种不同的芳胺类化合物2a~2c进行Dimroth重排反应生成3种喹唑啉类化合物3a~3c;所得3a~3c在钯碳的催化下分别与5-甲酰基呋喃-2-硼酸进行Suzuki偶联生成化合物4a~4c。同时,分别通过3种靛红衍生物5a~5c与N,N-二乙氨基氯乙烷盐酸盐之间的亲核取代反应得到靛红1-位接入亲水基团的衍生物6a~6c;而化合物6a~6c与水合肼之间加成消去得到化合物7a~7c。最后,4a~4c分子中的醛基分别与7a~7c分子中的氨基通过先加成再消去反应生成目标产物8a~8i。
2.1 化合物6a~6c的合成
化合物6a~6c的制备参考文献[23-24]的方法,以5-取代靛红和N,N-二乙氨基氯乙烷盐酸盐为原料通过亲核取代反应合成。分别对碱的种类、反应溶剂、反应温度、反应时间进行优化,结果列于表1。结果表明:1)由实验1、2可知,当其他条件一定,V氯仿∶V水=1∶1.8时,改变反应温度与反应时间对产率的影响较小。2)由实验3、4可知,当其他条件一定,V氯仿∶V水=1∶0.9时,室温反应10 h,产率明显提高。3)由实验4、5可知,以NaH作碱、DMF作反应溶剂,后处理中会有大部分产物溶在DMF中,产率较低;而以K2CO3作碱、氯仿-水作溶剂,后处理用氯仿萃取,产率较高。
2.2 目标化合物8a~8i的合成及结构确定
目标化合物8a~8i参考文献[25]的方法,以4-芳氨基-6-(5-甲酰基呋喃-2-基)喹唑啉和(Z)-1-(二乙氨基乙基)-3-腙-5-取代吲哚啉-2-酮为原料,通过先亲核加成再消去反应得到。选择冰乙酸作为催化剂而不用盐酸等强酸,是由于酸给出的氢离子不仅能够和羰基结合,增加羰基的亲电性,也能与氨基结合,使氨基丧失亲核能力。冰乙酸为弱酸,其在使羰基亲电性增加的同时,能够避免胺类化合物过度质子化。选择无水乙醇和DMF作为反应溶剂,后处理只需要旋蒸除去溶剂,用甲醇-四氢呋喃重结晶即可得到目标化合物。该方法操作简单,处理方便。

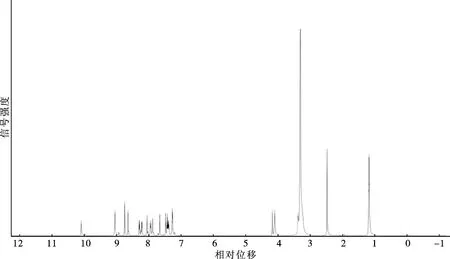
图3 化合物8b的1H NMR谱
2.3 抗肿瘤活性
以上市的抗肿瘤药物拉帕替尼(Lapatinib)和吉非替尼(Gefitinib)为阳性对照,以SW480、A431、NCI-H1975和A549为受试细胞,用MTT法对合成的目标化合物8a~8i进行抗肿瘤活性测试,结果如表2所示。化合物8a、8b、8e、8g、8h对A431增殖具有明显抑制作用,化合物8a、8b、8c、8d、8e、8g对A549和NCI-H1975增殖具有明显抑制作用,化合物8a、8b、8c、8d、8e、8f、8g对SW480增殖具有明显抑制作用。综上所述,化合物8a、8b、8e、8g对4种受试细胞均表现出良好的增殖抑制作用,优于阳性对照拉帕替尼和吉非替尼。此外,当喹唑啉4-位引入3-乙炔基苯氨基时,抑制肿瘤细胞增殖的活性较好;引入3-氯-4-氟苯氨基和3-氯-4-(3-氟苄氧基)苯氨基时,抑制肿瘤细胞增殖的活性次之。靛红5-位无取代基或被F取代时,抑制肿瘤细胞增殖的活性较好;被Cl取代时,抑制肿瘤细胞增殖的活性较差。

表2 目标化合物对4种受试肿瘤细胞的体外抑制活性(IC50)
根据合成化合物的结构及其抗肿瘤活性测试结果,分析出可能存在的构效关系:在喹唑啉4-位引入芳氨基能够增强化合物对表皮生长因子受体HER-2的亲和力,抑制表皮生长因子受体过度表达;且由于与酪氨酸激酶结合的ATP疏水性口袋空间比较大,即使在喹唑啉4-位引入如芳氨基这样较大的基团,也能够通过旋转的方式深入亲脂性口袋与激酶结合。此外,4-芳氨基C3、C4位的取代基与激酶表面非常相近,在4-芳氨基C3、C4位上引入—F、—Cl、—C≡CH这样的小基团可能更有利于化合物与激酶结合[26]。在靛红1-位引入亲水基团N,N-二乙氨基乙基可以调节化合物的水溶性,且通过与前期实验室抗肿瘤活性数据[21]的比较,证明引入亲水基团可以提高化合物对肿瘤细胞增殖的抑制活性。综上所述,喹唑啉母核上引入的芳氨基、靛红结构单元和亲水基团协同作用,能够更大程度地发挥喹唑啉类化合物的抗肿瘤作用。
3 结论
本研究在保留上市药物拉帕替尼、吉非替尼和埃罗替尼结构单元的基础上,与具有抗肿瘤活性的靛红结构单元杂合,同时引入亲水基团,经5步反应合成了9个结构新颖的N-取代靛红杂合喹唑啉类化合物。利用NMR、IR和HRMS对反应中间体及目标化合物的结构进行确定,同时以4种人肿瘤细胞为受试细胞,采用MTT法对合成的9个新化合物进行了体外抗肿瘤活性测试。结果表明,9个化合物均具有一定的肿瘤细胞增殖抑制活性。其中,化合物8a、8b、8e、8g对4种受试细胞均表现出较好的增殖抑制作用,优于阳性对照拉帕替尼和吉非替尼;其合成原料易得,步骤较为简单,路线较为成熟,是具有开发潜力的抗肿瘤化合物。

