基于纳米材料拉曼增强特性的细胞氧化损伤检测
宋芷仪,王周平,马小媛
(1 江南大学 食品科学与资源挖掘全国重点实验室,江苏 无锡 214122;2 江南大学 食品学院,江苏 无锡 214122)
表面增强拉曼(surface-enhanced Raman spectroscopy,SERS)是通过增强基底的表面等离子共振,引起电磁增强,进而将拉曼信号放大的一种技术[1-2]。它具有灵敏度高、破坏性小、预处理简单等优点。对大多数水溶液样品来说,表面增强拉曼技术可以大幅度减弱水拉曼散射对样品造成的干扰,弥补红外吸收光谱在这方面的不足。其中,具有特殊形貌的金属纳米粒子可极大地增强附着在金属纳米粒子表面的分子拉曼信号,使表面增强拉曼技术能够被广泛应用于化学、生物、医药、环境等领域[3-5]。
铜是大多数真核生物细胞生理过程的必需元素,但当其浓度过高时可引起细胞氧化应激,并通过形成自由基而对蛋白质、脂质和DNA造成直接损伤,进而对肝脏或大脑造成特定损伤[6-7]。研究表明,大脑或肝脏内的铜元素稳态失衡会导致细胞形态发生变化,活性氧和丙二醇含量升高,谷胱甘肽含量下降,并对DNA造成氧化损伤[8-9]。因此,保护肝脏免受由铜离子浓度升高引起的氧化损伤十分必要。
当前,细胞氧化损伤的传统检测方法主要包括细胞内物质成分的变化检测(如脂质、蛋白质、碳水化合物、DNA等的氧化损伤检测)、氧化受损细胞内自由基的直接检测(包括电子自旋共振法和化学发光法)、细胞内总活性氧自由基(reactive oxygen species,ROS)测定、抗氧化酶测定等[10]。此外,高剂量ROS会诱导细胞坏死,低剂量ROS会引起细胞凋亡,因此还可以通过检测氧化应激引起的细胞凋亡反应间接判断细胞的受损状态[11]。然而,由于细胞受ROS损伤的机制较为复杂,目前还没有形成标准的细胞氧化损伤检测方法。关于细胞生物学方向的氧自由基检测还有待发展出灵敏度更高、选择性更好的新方法。
基于此,本研究将以铜离子诱导的细胞氧化损伤为模型、表面增强拉曼技术为手段,旨在建立一种检测细胞损伤的拉曼光谱表征法[12]。研究首先通过种子生长法制备金纳米花作为拉曼检测基底,并筛选能增强拉曼信号的基底;再利用CCK-8法进行细胞毒性检测及Cu2+对细胞造成的氧化损伤检测,建立氧化损伤模型;最后,通过SERS对细胞氧化损伤模型进行检测,进而建立一种新的细胞氧化损伤检测手段。
1 材料与方法
1.1 材料与试剂
4-羟乙基哌嗪乙磺酸(HEPES,C8H18N2O4S)、氯金酸(HAuCl4)、抗坏血酸(AA,C6H8O6)、二水合柠檬酸三钠(C6H5Na3·2H2O)、无水乙醇(C2H6O)、氢氧化钠(NaOH)、二水合氯化铜(CuCl2·2H2O)均为分析纯。
人体肝癌细胞HepG2,购自中科院上海生物化学与细胞生物学研究所;CCK-8试剂,购自上海生工生物工程有限公司;超纯水,美国Millipore净水系统;DMEM高糖培养基、胎牛血清、胰蛋白酶、青霉素、链霉素,购自上海拜力生物科技有限公司。
1.2 设备与仪器
HH-4数显恒温水浴锅,常州市荣冠实验分析仪器厂;全自动雪花制冰机,常熟市雪科电器有限公司;高速离心机,安徽中科中佳科学仪器有限公司;注射泵,保定兰格恒流泵有限公司;Shimadzu MV-1800型紫外可见光分光光度计,岛津(上海)实验器材有限公司;JEM-2100(200 kV)透射电子显微镜,日本电子公司;LabRAM HR 800 共聚焦显微拉曼光谱仪,法国HORIBA公司;超纯水仪,美国Millipore公司;恒温油浴锅、电热式磁力搅拌器,巩义市予华仪器有限责任公司;超声波清洗仪,无锡市科洁超声电子设备有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;电子天平,奥豪斯仪器(上海)有限公司;SpectraMax M5/M5e酶标仪,美国Molecular Device公司;微量移液器,德国Eppendorf股份公司;超净工作台,苏州尚田洁净技术有限公司。
1.3 实验方法
1.3.1 金种子的合成[13]
所用玻璃器皿及搅拌棒用王水(V浓硝酸∶V盐酸=1∶3)浸泡12 h以上,超纯水冲洗后烘箱烘干。配置质量分数为1%的柠檬酸三钠水溶液和1%的HAuCl4水溶液,备用。三颈烧瓶中加入0.5 mL上述HAuCl4水溶液和49.5 mL去离子水,安装冷凝回流装置后,置于120 ℃油浴锅中加热并搅拌。待溶液沸腾后继续加热10 min,迅速加入2.5 mL上述柠檬酸三钠水溶液,加热搅拌至溶液变为酒红色。撤去热源,继续搅拌冷却至室温,得到球状金种子(AuNPs)。改变柠檬酸三钠水溶液的添加量,以制备不同尺寸的AuNPs,并用紫外分光光度计和透射电镜表征。金种子置于棕色瓶中,于4 ℃冰箱中避光保存。
1.3.2 金纳米花的合成[13]
配置质量分数为1%的抗坏血酸水溶液和物质的量浓度为20 mmol/L的HEPES水溶液(pH为7.4),备用。在50 mL烧杯中依次加入3 mL粒径为15 nm的金种子、8 mL HEPES水溶液和400 μL抗坏血酸水溶液,冰浴搅拌均匀。另取680 μL质量分数1%的HAuCl4水溶液,用去离子水稀释至10 mL,使用注射泵逐滴加入烧杯中,流速控制在30 滴/min,并保持冰浴搅拌。继续冰浴搅拌2 h以上,得到蓝紫色的金纳米花胶体溶液。增加HEPES水溶液的添加量至12 mL,得到支角更多、更尖锐的金纳米花(AuNFs)。取10 mL金纳米花胶体溶液在3 000 r/min条件下离心15 min,去上清液并用1 mL去离子水重悬,使用紫外分光光度计和透射电镜表征。
1.3.3 人体肝癌细胞HepG2的培养
人体肝癌细胞HepG2使用含10%胎牛血清、100 U/mL青霉素、100 g/L链霉素的DMEM高糖培养基在37 ℃、5% CO2的细胞培养箱中培养。待细胞贴壁生长至80%左右时,进行传代培养:将培养皿中原有的细胞液吸去,加入2 mL磷酸盐缓冲液(PBS)进行洗涤,重复2次后加入2 mL胰酶消化液(含0.25%胰蛋白酶、1 mmol/L EDTA和25 mmol/L HEPES的PBS),轻轻晃动培养皿使消化液均匀铺在细胞上层,消化2~3 min,用显微镜观察到细胞质回缩、细胞间隙增大时吸去消化液,加入2 mL完全培养基终止消化。吸取1~2 mL培养液将培养皿底部贴壁生长的细胞全部吹打下后,以1∶2的比例传代接种细胞于新培养皿中。
1.3.4 SERS探针和Cu2+的细胞毒性实验
取1 mL金纳米花重悬液,加入10 μL多肽,摇床中孵育8 h以上,使金纳米花被肽链修饰。在3 000 r/min条件下离心15 min,去上清液并用1 mL去离子水重悬,备用。将生长至指数期的细胞用胰酶消化,在培养皿中加入2 mL培养基,用移液枪轻轻吹打混匀,得到细胞悬液。将细胞悬液以每孔100 μL接种至96孔板中,置于37 ℃、5% CO2细胞培养箱中培养12 h,备用。
将孔板中的培养基吸出,每孔加入100 μL不同质量浓度的被多肽修饰的金纳米花(0、80、160、240和360 μg/mL),混合均匀。培养8 h后,每孔再加入10 μL CCK-8试剂,轻轻敲击培养板以帮助混匀,继续培养4 h。最后,将孔板置于450 nm波长下进行检测。用同样方法检测不同物质的量浓度的Cu2+(0、50、100、150、200 μmol/L)对细胞的氧化损伤。细胞存活率计算公式为:细胞存活率=(实验组吸光值-CCK-8本底吸光值)/(对照组吸光值-CCK-8本底吸光值)×100%。
1.3.5 Cu2+诱导细胞氧化损伤的SERS检测
贴壁生长的HepG2细胞在加入金纳米花的培养基中培养12 h后,将CuCl2溶液加入培养基,使其Cu2+物质的量浓度分别为0、50、100、150和200 μmol/L,在37 ℃、5% CO2细胞培养箱中培养8 h后,用共聚焦显微拉曼光谱仪进行表征。拉曼光谱仪的参数设置如下:激发波长为633 nm,扫描范围为400~1 800 cm-1,物镜放大倍数为50,扫描时间为10 s,循环次数为1次,每个样品上随机选取10个测试点。实验重复3次,获取平均SERS光谱。
2 结果与讨论
2.1 金种子(AuNPs)的表征
图1是AuNPs的表征结果。图1a显示,AuNPs的紫外吸收峰分别在521 nm (15 nm)和523 nm (25 nm)左右,随着AuNPs粒径的增大,能级间隔减小,对应的吸收峰位将靠近较长波段,即表面等离子体共振(LSPR)吸收峰会出现一定程度的红移,符合AuNPs直径与其LSPR吸收峰之间的变化规律[14]。图1b、1c表明,AuNPs呈尺寸均匀的圆形,且分散性良好。使用Nano Measure对AuNPs进行粒径统计,结果如图1d、1e所示。15 nm AuNPs平均粒径为15.1±1.1 nm,25 nm AuNPs平均粒径为25.1±1.5 nm。对AuNPs进行Zeta电位表征,电位值为-25.3 mV,这是因为柠檬酸根离子在合成AuNPs的过程中起到还原剂和稳定剂的作用,并使纳米颗粒表面带负电荷,防止它们在溶液中发生聚集。
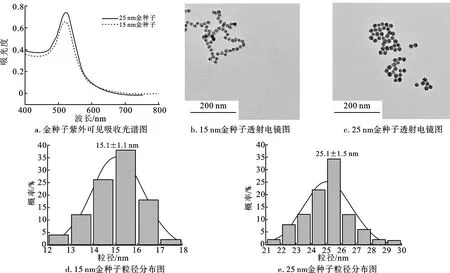
图1 金种子表征结果
2.2 金纳米花(AuNFs)的表征
AuNFs的透射电镜表征结果如图2a~2c所示。在支角生长阶段,Au以AuNPs为基础在表面异向生长,当AuNPs粒径较大时,随之合成的AuNFs尺寸较大。HEPES作为形貌诱导剂,能够控制AuNPs表面支角的生长,当HEPES浓度较高时,AuNFs表面支角数量增多,长度增大。

图2 金纳米花表征结果
使用Nano Measure对AuNFs进行粒径统计,结果如图2d~2f所示。25 nm AuNPs在高浓度HEPES中介导合成的AuNFs平均粒径为94.1±1.7 nm,15 nm AuNPs在低浓度HEPES中介导合成的AuNFs平均粒径为55.3±1.5 nm,15 nm AuNPs在高浓度HEPES中介导合成的AuNFs平均粒径为74.3±1.9 nm。对AuNFs进行Zeta电位表征,电位值为-29.4 mV。
图3为不同实验条件下制备的AuNFs紫外可见吸收光谱图。通过比较AuNFs最大吸收峰的位置可知,当HEPES的添加量增加后,未离心组的LSPR吸收峰由579 nm红移至585 nm,离心组的LSPR吸收峰由570 nm红移至583 nm,符合AuNFs形貌与LSPR吸收峰位置之间的关系。对于不规则的金纳米花颗粒,其形貌越复杂,表面支角越多、越尖锐,LSPR吸收峰红移越明显。离心后的AuNFs出现微小的蓝移,同时吸光度有所下降,这可能是因为离心后除去了粒径较小的AuNFs以及反应后多余的试剂。此外,在未离心组的光谱图中可以看到,530 nm左右有1个小峰,这可能是由溶液中残余的AuNPs造成,也有可能是AuNFs核心等离子体共振与支角等离子体共振模式杂交,从而出现2个LSPR吸收峰。
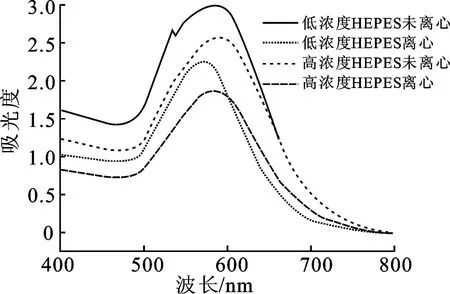
图3 金纳米花的紫外可见吸收光谱图(15 nm金种子)
由于制备的纳米颗粒最终需要进入细胞,材料粒径过大不利于细胞胞吞且容易发生聚集,故选用15 nm AuNPs在低浓度HEPES中介导的AuNFs作为后续实验材料。
2.3 金纳米花SERS探针和Cu2+的细胞毒性实验
利用种子生长法制备的金纳米花经离心浓缩后质量浓度为1 600 μg/mL,将其加入完全DMEM高糖培养基中混匀,分别配制成质量浓度为0(空白对照)、80、160、240、320 μg/mL的细胞培养液,与指数生长期的细胞混合培养8 h,用CCK-8法进行细胞毒性检测,计算细胞存活率。由图4a可知,当金纳米花质量浓度较低时,细胞存活率较高,金纳米花质量浓度增加,细胞存活率逐渐降低,说明材料本身也对细胞具有一定程度的生长抑制作用。由于金纳米花是拉曼增强基底,为了获得较高的拉曼信号并尽量降低对细胞的损伤,故选择质量浓度为160 μg/mL的金纳米花作为后续实验材料。

图4 CCK-8细胞毒性检测结果
以Cu2+作为细胞的氧化损伤诱导剂,分别配置Cu2+物质的量浓度为0、50、100、150、200 μmol/L的完全DMEM高糖培养基,与细胞共培养8 h后进行CCK-8细胞毒性检测,计算细胞存活率。由图4b可知,Cu2+的存在对细胞生长会产生显著损伤,随着Cu2+物质的量浓度的升高,细胞存活率大大降低,这可能是由于Cu2+破坏了细胞内的氧化还原平衡,诱导细胞产生氧化应激反应,进而造成不可逆损伤。因此,可以利用Cu2+诱导的细胞作为氧化损伤模型,用于进一步的拉曼检测。
2.4 Cu2+诱导细胞氧化损伤的SERS检测分析
由图5可知,HepG2细胞使用不含金纳米花的DMEM培养基培养6 h后,基本无明显拉曼信号峰,金纳米花本身也无明显拉曼信号峰。将一定浓度的金纳米花加入到培养基中,与HepG2细胞共同培养6 h后进行拉曼信号检测,得到数个较为明显的信号峰。这表明细胞对金纳米花进行胞吞,使金纳米花成功进入到细胞内部。同时,信号峰反映出细胞内的部分物质,HepG2细胞的各拉曼光谱峰所对应的物质归属如表1所示。

表1 拉曼光谱峰对应的物质归属[15]

图5 HepG2细胞的拉曼光谱图
2.5 Cu2+诱导细胞氧化损伤的SERS表征
分别用Cu2+物质的量浓度为0、50、100、150、200 μmol/L的DMEM完全培养基处理细胞6 h和12 h,并进行拉曼光谱表征,结果如图6所示。可以看出,不同Cu2+处理时间的HepG2细胞的平均拉曼光谱图存在较大差异,相比于6 h的处理时间,处理12 h细胞的SERS峰强度整体偏弱,说明随着处理时间的延长,细胞的受损程度随之变大。
对相同物质的量浓度Cu2+处理不同时间的HepG2细胞进行拉曼光谱检测,所得拉曼光谱作归一化处理,进行差谱分析,结果如图7所示。可以看出,经不同物质的量浓度Cu2+处理后,HepG2细胞均出现了不同程度的损伤。
糖类的变化:细胞中糖原(490 cm-1)和碳水化合物(1 153 cm-1)的含量均发生变化,随着细胞氧化损伤程度的加深,糖类物质含量不断减少。
核酸的变化:相比于6 h处理时间,经12 h处理的HepG2细胞在1 083 cm-1、788 cm-1处的光谱强度均有所减弱。1 083 cm-1处的峰代表DNA骨架磷酸二酯基团的对称伸缩振动,788 cm-1处的峰代表DNA骨架磷酸根的对称伸缩振动。可见,随着细胞氧化损伤程度的加深,DNA骨架断裂,双螺旋结构发生改变,核酸含量减少。
脂类的变化:1 450 cm-1处的峰代表脂质CH2和CH3的振动峰,从拉曼光谱图中可以看出,细胞中脂质含量相对较少且变化不大。这可能是因为HepG2细胞本身生长迅速、耗能快,脂质提供细胞生长所需能量,难以在癌细胞内积累。
蛋白质的变化:蛋白质分子的苯丙氨酸和酪氨酸残基中的C—O伸缩振动峰出现在1 174 cm-1附近,蛋白酰胺Ⅰ的α螺旋结构出现在1 655 cm-1处,肽链骨架C—C键振动峰位于937 cm-1处,这些峰均出现了相应的变化,说明细胞氧化损伤对蛋白质产生了氢键破坏、二硫键断裂和脱酰胺作用等,蛋白质发生空间结构改变,造成了生物活性功能的改变。
糖类、核酸、脂类和蛋白质的变化均可能改变细胞的形态、结构和功能,使之无法维持正常生理活动,从而引发各种疾病。
3 结论
本研究建立了一种基于无标记纳米材料增强拉曼光谱对细胞氧化损伤进行检测的方法。制备出有多肽修饰的金纳米花作为拉曼增强基底,成功观察到金纳米花进入细胞,且达到信号增强的效果。利用CCK-8法进行细胞毒性检测,确定金纳米花作为拉曼增强基底可以在尽量不损伤细胞的情况下达到良好的拉曼增强效果,其适宜的质量浓度为160 μg/mL。进一步检测Cu2+对HepG2细胞造成的氧化损伤,发现经Cu2+诱导后,细胞出现明显损伤和死亡,且随着Cu2+物质的量浓度的提高,细胞受损程度增大。最后,建立了Cu2+诱导的细胞氧化损伤模型,并获得不同Cu2+处理条件下细胞的拉曼光谱,发现经氧化处理后的细胞均受到不同程度的损伤,细胞内的糖类、核酸、脂质和蛋白质等物质均出现了一定程度的改变,对机体造成了损伤。

