神经生长因子改善糖尿病大鼠随意皮瓣缺血坏死的机制
王晓武,朱仙懂,王永强,吴志炫,温知楷,吴大洲,陈吉彩
温州医科大学附属第一医院,浙江 温州 325015,1.肝胆胰外科;2.甲状腺外科;3.乳腺外科;4.疝与腹壁外科
皮瓣移植是修复外伤、肿瘤切除、下肢血管性溃疡或糖尿病引起的皮肤缺损的重要外科技 术[1-3],但是移植后的皮瓣坏死仍是问题[4-5];而目前国内外的主流观点是认为皮瓣的坏死是由血流再灌注不足、回流阻塞以及缺血再灌注损伤所引起的,而后者会引发皮瓣组织循环障碍、活性氧物质大量生成等系列问题[5]。这将会影响皮瓣组织和细胞的形态和功能,以及细胞“微环境”-细胞因子的变化。机体内细胞因子是一个复杂的网络关系,每种因子的作用不可忽视,因此探讨每种因子的作用将有助于多层次的了解缺血随意皮瓣存活与生长因子的关系。有研究发现神经生长因子(nerve growth factor, NGF)能促进不同类型皮瓣的存活,并能促进移植皮瓣感觉恢复[6],但是具体分子机制仍不详。本研究以大鼠糖尿病缺血随意皮瓣为代表模型,通过动物和细胞实验探讨NGF改善糖尿病大鼠随意皮瓣缺血坏死的分子机制,为NGF应用于糖尿病缺血随意皮瓣存活和防治提供理论支持。
1 材料和方法
1.1 材料
1.1.1 动物造模与分组 实验所需动物来自温州医科大学实验动物中心,动物许可证号:SYXK(浙)2021-0017。6~8周的240~320 g健康雄性Wistar大鼠40 只。饲养环境:5 只/笼,SPF环境(温度20~24 ℃,湿度50%~60%)下,用蒸馏水和优质实验饲料喂养。使动物适应环境1周后展开后续的动物实验。动物实验方案已通过温州医科大学实验动物伦理委员会审批(WYYY-AEC-2023-036)。建立I型糖尿病大鼠模型,40只大鼠注射1%链脲佐菌素(streptozotocin, STZ,65 mg/kg)[7]。在STZ注射前1天及注射后第3、5、7天,通过监测尾静脉血液中的血糖浓度是否超过16.67 mmol/L证实模型成功与否。I型糖尿病模型稳定后,随机分为DM组(20 只)、DM+NGF组(20只)。在I型糖尿病模型上,对2组大鼠建立改良McFarlane皮瓣模型[8]。建模流程:将所有大鼠利用异氟烷诱导和维持麻醉,将每只大鼠俯卧置于塑料板上,固定肢体,用剃刀进行背部备皮,范围为3 cm×9 cm,用亚甲蓝标记矩形随机皮瓣范围(宽3 cm、长9 cm)进行皮瓣模型建立,而皮瓣手术均由熟悉皮瓣移植的同一人完成。具体手术步骤:将皮肤和浅筋膜与深筋膜完全剥离,保留真皮下毛细血管网,保留蒂部并结扎蒂部双侧髂动脉;采用4-0医用缝合线将皮瓣修复至原位。术后DM+NGF组在皮瓣固定点处注射10 nmol/(mL·kg)NGF[9],DM组注射等量0.9%氯化钠溶液7 d,完成相应实验并收集组织标本后用1%~3%剂量的异氟烷和氧气混合气体麻醉大鼠,使大鼠安乐死。
1.1.2 细胞实验与分组 人脐静脉内皮细胞 (human umbilical vein endothelial cells,HUVEC)由上海iCell公司提供。使用ECM完全培养基,配置体系为500 mL ECM基础培养基+5 mL内皮生长添加物+5 mL青霉素/链霉素溶液,按比例配置完全培养基。培养环境为:37 ℃,5% CO2细胞培养箱。待HUVEC融合度达到85%~90%,细胞呈鹅卵石 状,状态良好,培养基无污染,用胰酶-EDTA(含0.25%胰酶)消化细胞,进行细胞计数,再进行后续细胞建模和实验。为确认HUVEC高糖模型的糖浓度,向ECM完全培养基中添加不同浓度的10%葡萄糖溶液使 培养基最终糖浓度为5.5、15、25、37.5 mmol/L, 通过CCK-8实验检测HUVEC的活性,最终确认细胞高糖模型的葡萄糖浓度为25 mmol/L,并与ECM完全培养基配制成高糖ECM完全培养基,作为后续细胞培养的培养基。基于该模型,将细胞实验分为细胞模型组(DM组)和细胞实验组(DM+NGF)组。为确定NGF对高糖环境下HUVEC活力影响的最适合浓度,在高糖ECM完全培养基中加入不同浓度NGF溶液,使得NGF最终浓度为0、12.5、25、50、100、200 ng/mL,将其置于37 ℃,5% CO2细胞培养箱中处理24 h,通过CCK-8实验检测细胞活力和增殖情况。
1.1.3 主要耗材与试剂 NGF购自武汉海特生物制药股份有限公司;STZ和Triton X-100购自由美国Sigma公司;基质胶和transwell小室购自美国Corning公司;TRIzol试剂、SYBR Green和反转录试剂盒(K1622)购自美国Thermo Fisher公司;总RNA提取试剂盒购自北京天根生化科技公司;抗荧光淬灭封片液、DAPI染色液、4%细胞固定液、0.1%结晶紫染色液购自上海碧云天生物技术有限公司。CCK-8试剂盒由美国Biolite公司提供;4%多聚甲醛、DAB显色试盒和HE染色试剂盒购自北京索莱宝科技有限公司;过氧化氢(H2O2)购自北京中杉金桥生物技术有限公司;CD31一抗(兔源)购自英国Abcam公司;血管内皮生长因子(vascular endothelial growth factor, VEGF)、糖基化终未产物受体(receptor for advanced glycation products,RAGE)和微小染色体维持蛋白2(minichromosome maintenance protein 2, MCM2)一抗(兔源)购自美国Affinity公司;HRP标记山羊抗兔IgG和HRP标记山羊抗鼠IgG购自中国Bioworld公司;Cora®Lite 488荧光二抗购自武汉三鹰生物技术有限公司;其余试剂和生物化学试剂均为进口分装或国产分析纯。所用引物由上海捷瑞生物工程有限公司设计和生产。
1.2 方法
1.2.1 皮瓣坏死存活的测量 术后第7天(POD7),使用高级摄影照相机对所有皮瓣进行评估。肉眼观察皮瓣颜色;是否结痂、出血、分泌物渗出;毛发发育和颜色。用拓印纸拓印皮瓣坏死和存活面积,然后将数据导入ImageJ软件测量并评估存活皮瓣的面积。计算公式:皮瓣存活百分比(%)=存活区范围/整个皮瓣。
1.2.2 HE染色 用手术器械采集大鼠背部皮瓣的皮瓣组织,在4%多聚甲醛中固定24 h。第2天取出组织样本,修整至0.5 cm×0.5 cm大小,然后冲洗、脱水并用组织包埋机将其包埋在石蜡中,再用组织切片机将皮瓣蜡块切成4~5 μm厚的组织石蜡切片。根据HE染色试剂盒的说明书对组织切片进行染色。在光学显微镜下观察随机多视野下拍照。

表1 引物序列
1.2.3 免疫组化染色 将组织石蜡切片进行烘干、脱蜡、水化处理,按照先前工作流程以及前期预实验探索地染色条件进行组织切片的染色、脱水、透明和封片[10]。不同的是本实验的一抗为CD31(1:200)和VEGF(1:400)。最后,在光学显微镜下观察并在随机多视野下拍照。
1.2.4 CCK-8实验 根据不同浓度的NGF(0、12.5、25、50、100和200 ng/mL)设置组别,每组至少3个孔。往96孔板中添加细胞(5 000个细胞/孔),用25 mmol/L糖浓度ECM完全培养基进行培养24 h,待其贴壁,24 h后,移去旧培养基,加入不同浓度的NGF,培养24 h。再向每孔加入10 μL的10% CCK-8溶液,在细胞培养箱中黑暗孵育1~4 h,然后用酶标仪(美国Thermo公司)在450 nm测定OD值,并对数据进行统计学分析。
1.2.5 细胞增殖计数实验 消化、重悬和计数良好长势的细胞,向96孔板中的每个孔中加入3 500个细胞。在高糖ECM完全培养基上,设定组别为NGF(0、50、100和200 ng/mL),每组至少3个孔。之后流程按照先前工作进行[10],用不同浓度的NGF培养1、3、5 d,在固定时间点消化各组细胞,计数。最后对数据进行统计分析。
1.2.6 MCM2+细胞免疫荧光 设置细胞DM组和DM+NGF组。首先,往含有圆形爬片的12孔板中加入细胞(10 000~20 000个细胞/孔),摇匀细胞、待细胞贴壁。之后DM+NGF组加入含NGF的高糖ECM完全培养基,两组均培养24 h。然后,根据先前工作流程进行后续操作[10],以MCM2抗体为一抗。最后用免疫荧光显微镜在随机多视野下对MCM2+细胞进行拍摄。
1.2.7 划痕实验 在6孔板接种相同浓度的细胞量并晃匀。待细胞融合度达到100%时,用200 μL的黄色枪头进行划痕,用PBS洗去脱落细胞,DM组中加入2 mL的(内含2%血清+25 mmol/L葡萄糖,不含内皮生长添加物)ECM培养基,而在DM+NGF组中加入上述ECM培养基并添加100 ng/mL NGF,置于细胞培养箱中培养24 h。在0、24 h时间点在光学显微镜下观察和拍摄图片。结果采用ImageJ软件进行统计和分析。
1.2.8 Transwell实验 将30 000个细胞加入上室中。向DM+NGF组中加入100 ng/mL NGF,向对照组中加入PBS。将800 μL(内含20%血清+25 mmol/L葡萄糖,不含内皮生长添加物)ECM培养基加入到下室中,将其在细胞培养箱中培养24 h。之后流程按照先前工作进行[10],最后在倒置显微镜下随机视野拍照并进行统计分析。
1.2.9 血管形成实验 将基质凝胶从-20 ℃的冰箱中取出,将其包埋在干冰中,使其成为液体状态。将50 μL/孔的基质凝胶加入到96孔板中,摇动凝胶使其均匀分布。将其放置在细胞培养箱3~4 h让胶固化。将同一瓶中的细胞消化并在离心机中离心以获得两管沉淀的细胞团,然后将它们加入到含有或不含有NGF的高糖ECM完全培养基中,再重新悬浮细胞并计数。将35 000个细胞/100 μL细胞悬液加入到96孔板中,并将该板转移到细胞培养箱中进行培养。在0和6 h时用倒置显微镜拍摄血管生成的照片。使用ImageJ软件对获得的图像进行统计分析。
1.2.10 NGF与常见血管生成相关因子的关系 将NGF和常见的血管生成相关基因[VEGF、表皮细胞生长因子(epidermal growth factor, EGF)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)血小板衍生生长因子A(platelet derived growth factor A, PDGFA)、基质细胞衍生因子1α(stromal cell derived factor 1α, SDF1α)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、精氨酸酶-1(arginase-1, Arg-1)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)]输入STRING 11.0数据库建立PPI,并分析这些基因的GO和KEGG功能富集情况。
1.2.11 RT-qPCR 实验过程参考以前的工作[10]。HUVEC的总RNA提取按照总RNA提取试剂盒说明书进行。7500 Fast系统(American Applied Biology Systems, USA)用于RT-qPCR分析。采用上海捷瑞生物工程有限公司研发的mRNA特异性引物检测VEGF、PDGFA、SDF1α、HIF-1α、EGF、Arg-1、bFGF的表达。采用2-ΔΔCt法分析结果。
1.2.12 RNA-seq 测序数据集包含6个HUVEC样本,分为两组:DM组(25 mmol/L高糖正常组,3个样本)和DM+NGF组(25 mmol/L高糖+24 h NGF处理组,3 个样本)。收获细胞团低温保存并运送至上海前程生物科技有限公司进行RNA-seq操作和分析。使用RNAmini试剂盒(Qiagen, Germany)从细胞中提取总RNA。mRNA的富集、片段化、反转录、文库构建、Illumina Novaseq 6000和数据分析由Tenk Genomics进行。利用R软件的DESeq2软件包分析后,根据|log2FC|≥1和P<0.05选择差异表达mRNAs。然后在Reactome数据库中分析差异表达的mRNAs的功能富集情况。
1.2.13 Western blot实验 实验方法参考本课题组前期研究成果[10]。根据细胞分组对细胞进行培养和预处理后收集细胞提取细胞蛋白质进行Western blot实验;根据动物实验的分组分别获取相应的动物皮瓣蛋白并进行Western blot实验。使用的抗体如下:CD31、p-ERK1/2(1:1 000);VEGF、RAGE(1:1 000);丝氨酸/苏氨酸激酶(AKT)、p-AKT、磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K,1:1 000)。
1.3 统计学处理方法
采用Graphpad Prism 8软件对数据进行统计学分析。正态分布计量资料用±s表示,两组比较采用t检验,多组比较采用单因素方差分析,两两比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 NGF对糖尿病大鼠随意皮瓣存活面积率的影响
在皮瓣移植模型后的第7天,DM组所有大鼠在所有皮瓣的I区(远端区)的大部分皮瓣中形成痂,没有毛发生长。在皮瓣II区(中间部分)和III区(蒂部区)的伤口边缘有散在的痂和变黑。DM+NGF组I区少数大鼠皮瓣呈棕褐色和暗红色,其余皮瓣区无黑色痂,有少量毛发生长,而I、II、III区其余大鼠皮瓣无黑色硬痂,有少量毛发生长。与DM组比,DM+NGF组皮瓣存活率更高。术后第7天发现DM+NGF组皮瓣存活率高达85%~90%,而DM组为70%~75%,两组间差异有统计学意义(P<0.01),见图1。

图1 术后第7天NGF对I型糖尿病大鼠缺血随意皮瓣存活的影响
2.2 NGF促进糖尿病缺血随机皮瓣的血管生成
与DM组比,DM+NGF组皮瓣中有更多的新生微血管,且DM+NGF组中CD31+微血管的密度比DM组高,差异有统计学意义(P<0.01),见图2A。免疫组化和Western blot结果显示,皮瓣组织DM+NGF组CD31和VEGF表达水平高于DM组,差异有统计学意义(P<0.05),见图2B、图2C。

图2 皮瓣组织HE染色、CD31/VEGF指标免疫组化染色及CD31/VEGF相应蛋白表达量的结果
2.3 移植皮瓣的存活和血管生成与AGE-RAGE/MAPKERK1/2信号通路的关系
与DM组比,10 μg/mL NGF的DM+NGF组RAGE蛋白表达下降,差异有统计学意义(P<0.05);而MAPKERK1/2信号通路中p-ERK1/2的蛋白表达增加,差异有统计学意义(P<0.05),见图3。

图3 移植皮瓣存活和血管生成与AGE-RAGE/MAPK-ERK1/2信号通路的关系
2.4 NGF促进高糖环境中HUVEC的活力和增殖
HUVEC的活性随着葡萄糖浓度增加而降低;与5.5 mmol/L浓度比,在25.0 mmol/L和37.5 mmol/L浓度下HUVEC的活性降低,差异有统计学意义(P<0.05),但25.0 mmol/L和37.5 mmol/L间差异无统计学意义(P>0.05),可能达到HUVEC细胞可以耐受的最高葡萄糖浓度,见图4A。因此,用25 mmol/L葡萄糖建立细胞高糖模型。不同浓度的NGF对25 mmol/L 葡萄糖中HUVEC活性的影响,在0~100 ng/mL浓度范围内,HUVEC活性随NGF浓度的增加而增加,NGF在100 ng/mL时增殖最明显,差异有统计学意义(P< 0.01),见图4B。100 ng/mL的NGF作用6 d也是增殖效果最显著的,差异有统计学意义(P<0.05),见图4C。与DM组比,DM+NGF组的MCM2+阳性细胞数较多,差异有统计学意义(P<0.01),见图4D。

图4 NGF对在高糖环境下HUVEC增殖的影响
2.5 NGF促进高糖环境中HUVEC的迁移和血管生成
在25 mmol/L葡萄糖浓度下,DM+NGF组在24 h内的愈合面积比DM组大,差异有统计学意义(P<0.05),见图5A。DM+NGF组较DM组迁移细胞数多,差异有统计学意义(P<0.01),见图5B。25 mmol/L葡萄糖浓度下,100 ng/mL NGF组6 h内血管形成的总长度、总分支长度和总分段长度均大于DM组,差异有统计学意义(P<0.01),见图5C。
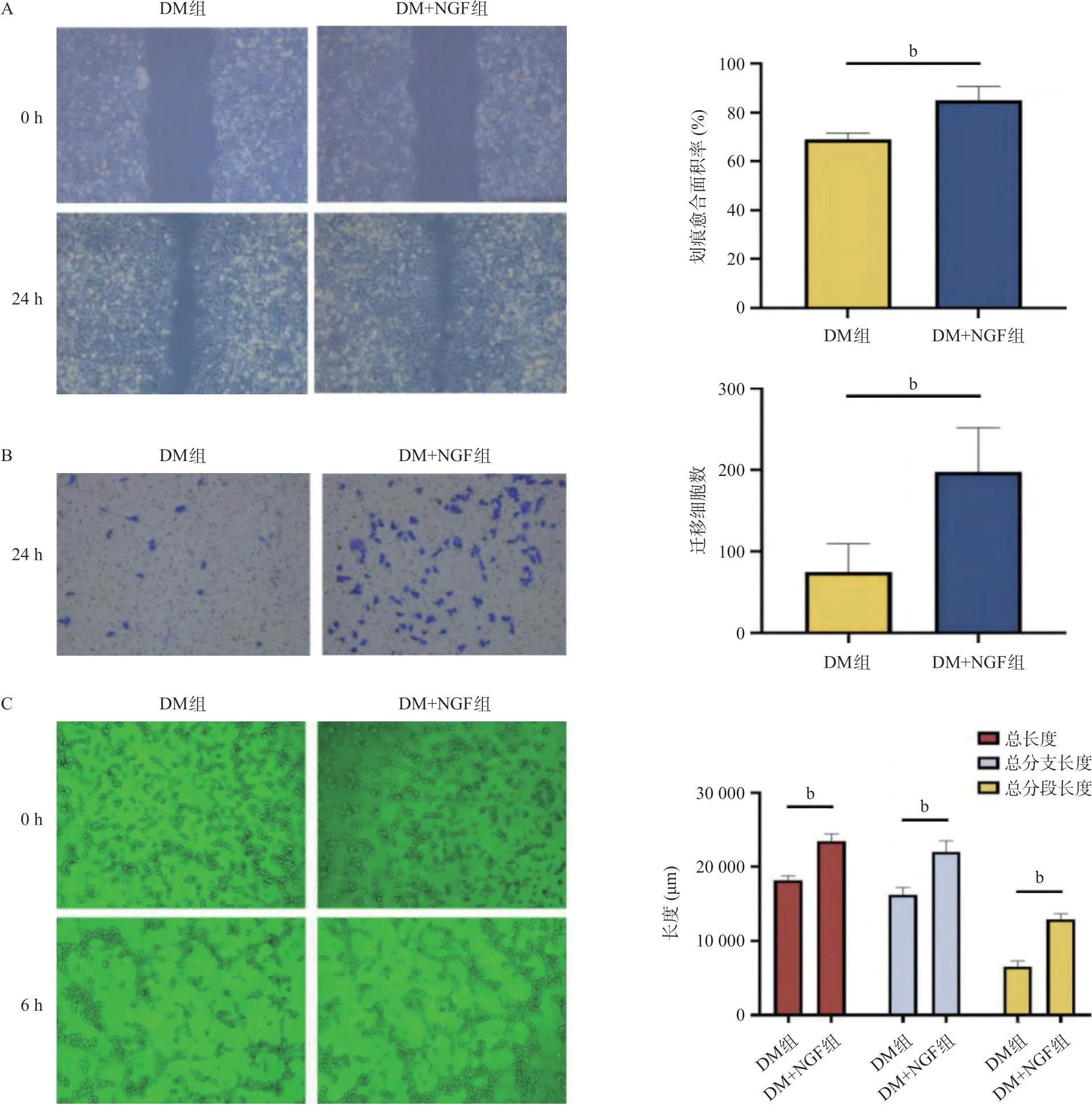
图5 在25 mmol/L葡萄糖环境中100 ng/mL NGF对HUVEC迁移和血管生成的影响
2.6 NGF上调血管生成相关因子的表达
NGF与常见血管生成因子的关系及功能富极化分析结果:NGF与VEGF、PDGFA、EGF、HIF-1α、SDF1α、Arg-1、bFGF、TGF-β相互作用;这些基因的GO分析结果主要富集到了内皮细胞增殖和迁移、表皮生长因子信号通路、伤口愈合、生长因子受体激活和调控、血管生成和PI3K分子调控相关的功能(P<0.05),见图6A-D。KEGG分析的结果主要涉及MAPK信号通路和AGE-RAGE信号通路。与DM组比,DM+NGF组的VEGF、PDGFA、HIF-1α、Arg-1和bFGF的mRNA相对表达量均升高,差异均有统计学意义(P<0.05),见图6E-K。与血管生成相关的主要因子VEGF在DM+NGF组中比DM组蛋白相对表达量高,差异有统计学意义(P<0.05),见图6L。

图6 NGF与常见血管生成相关因子的互作、功能富极化分析和表达调节的结果
2.7 HUVEC的RNA-seq的结果
DM+NGF组中MMP-2、ZNF33B、TPP1等基因表达量高于DM组,ZNF330、LIME1等基因表达量低于DM组,见图7A、图7B。在Reactome数据库中,这些差异基因 主要富含与MAPK信号通路相关的代谢通路,见图7C。

图7 HUVEC的RNA-seq的结果
2.8 HUVEC表型与AGE-RAGE/MAPK-ERK1/2信号通路的关系
在25 mmol/L葡萄糖浓度下,100 ng/mL NGF促进了HUVEC细胞的增殖、迁移和血管生成。与DM组比,DM+NGF组中RAGE的蛋白表达降低,MAPK信号通路中的p-ERK1/2的蛋白表达增多,差异均有统计学意义(均P<0.05),见图8。

图8 HUVEC表型与AGE-RAGE/MAPK-ERK1/2信号通路间关系
3 讨论
近年来,随着糖尿病相关的慢性难愈合性创面(chronic refractory wounds, CRWs)或其他CRWs[11]的发病率不断增加,随意皮瓣移植的应用也将显著增加,但随意皮瓣存活和坏死问题仍未解决。而影响皮瓣存活与坏死的关键因素之一是血管状态,它也是皮瓣存活与坏死之间的桥梁[12]。本研究创新性地关注NGF与糖尿病随意缺血皮瓣成活及血管生成的关系,首次通过细胞和动物实验证实,NGF通过影响AGE-RAGE/MAPK-ERK1/2信号通路促进糖尿病缺血随意皮瓣血管生成,而益于皮瓣成活。以往的研究表明,大鼠缺血皮瓣的存活与细胞因子途径有关[13]。然而,据报道细胞因子在糖尿病皮肤中经常被混淆和缺乏表达,常见的因子包括 bFGF、VEGF和NGF等[14]。NGF是一种最常见的神经营养因子,其主要结构是由三个α 2βγ 2亚基组成的复合体,β亚基是NGF发挥生物学功能的主要结构[15]。有报道称,NGF除了本身有营养神经的功能之外,还有很强抗炎作用[15]、促进血管生成[16],修复创 面[14]、减少氧化应激损伤[17]等作用,NGF还能促进不同类型皮瓣的存活,但机制不详。本研究为了探讨NGF对糖尿病缺血随意皮瓣成活的影响,通过动物实验发现,DM+NGF组皮瓣成活面积比DM组多10%~20%。DM+NGF组中CD31+标记的微血管数量和CD31相对蛋白表达水平均高于DM组;但DM+NGF组和DM组中VEGF的整体表达水平非常低,这可能是VEGF抗体结合不良的原因,但并不影响实验结论。与DM组比,DM+NGF组中皮瓣组织蛋白中VEGF的高表达也证实了这一点。上述结果表明NGF能促进糖尿病皮瓣血管生成,有利于皮瓣成活。
血管生成是一个复杂的过程,其中内皮细胞受血管生成相关的促进和抑制因子的调节,并涉及多种信号通路的参与[18]。这一过程中常见的调节因子有VEGF、HIF-1α、bFGF、PDGFA、EGF等。其中,VEGF是促进血管生成的主要因子;而与血管生成相关的常见信号通路包括p38 MAPK-ERK1/2信号通路和PI3K-AKT信号通路[19-20]。本研究结果表明,在 25 mmol/L葡萄糖环境中,100 ng/mL NGF可刺激HUVEC分泌VEGF、PDGFA、HIF-1α、Arg-1和bFGF等与血管生成相关的因子,促进血管生成。许多研究报告称,在糖尿病皮肤中发现许多因子缺乏,包括NGF[14]。结合糖尿病皮肤结构中微血管的减少和周围神经的损伤,推测NGF可能是导致糖尿病因子紊乱和缺乏的关键因素。关于NGF的促进血管生成作用,有研究[21]发现NGF促进血管生成与直接和间接影响VEGF表达有关;但HAN等[22]发现,NGF促血管生成作用不受VEGF抑制剂的抑制,或许这与NGF促进内皮细胞分泌bFGF等其他血管生成相关的促进因子有关。NGF向细胞因子网络提供信号并促进血管生成。内皮细胞首先影响皮瓣的微环境和微环境中的细胞状态。在NGF的刺激下,内皮细胞分泌血管生成因子,如VEGFA。VEGFA通过激活多种酶,如VEGFR2、VEGFA相关的丝裂原活化激酶和激活MAPKERK1/2通路,可产生内皮细胞存活、增殖、迁移和血管生成的生物学效应[7]。此外,NGF还可刺激bFGF在内的其他因子通过其下游靶分子信号促进血管生成。总之,NGF影响内皮细胞分泌血管生成相关的生长因子,这些因子在促进内皮细胞的增殖、迁移和血管生成中发挥协同作用,导致缺血皮瓣血管生成增加,改善皮瓣的缺血,促进其存活。
在探讨何种机制时,本研究发现了NGF与AGERAGE/MAPK-ERK1/2信号通路有关。至于与糖尿病并发症相关的AGE-RAGE信号通路,其主要与两个主要分子AGEs和RAGE有关。AGEs是糖基化末端物质,主要是原糖与蛋白质糖基化产生的不可逆的稳定产物,它们通常在糖尿病患者中高度表达[23]。至于RAGE,属于免疫球蛋白超家族,主要表达在内皮细胞和单核细胞的膜上。在血管损伤领域,AGEs与RAGE结合后会内化到内皮细胞的细胞外基质中,导致血管基底膜的形态和功能发生剧烈变化,从而导致血管的功能和结构发生改变。两者结合可以通过NF-κB[24]信号通路刺激多种下游靶基因的表达,进一步导致炎症因子和氧自由基产物的产量增多,引起了包括内皮细胞在内的细胞微环境的变化和细胞损伤甚至死亡。这种变化在宏观上体现之一为皮瓣血管状态的改变,类似于皮瓣缺血再灌注损伤过程中活性氧的产生、内皮细胞的损伤和炎症因子的瀑布式爆发导致的血管改变。更糟糕的是氧自由基产物增加了糖酵解途径中的中间产物数量,相应地增加了AGEs的数量,从而引发炎症的恶性循环[25]。本研究发现,NGF降低了高糖环境下内皮细胞RAGE的表达,从而抑制了这种恶性循环。据文献报道,高表达的p-ERK1/2 还能促进内皮细胞的增殖、迁移和血管生成,这与本研究细胞实验结果一致,即 100 ng/mL的NGF能促进含25 mmol/L葡萄糖的高糖环境中HUVEC细胞的增殖、迁移和血管生成,这些表型与MAPK-ERK1/2通路有关[26]。这一点也与细胞RNA测序结果发现与MAPK信号通路有关相符合。
综上所述,本研究首次通过细胞和动物实验证实了NGF通过影响AGE-RAGE/MAPK-ERK1/2信号通路促进糖尿病缺血随意皮瓣血管生成而益于皮瓣成活,为糖尿病缺血皮瓣的研究做好铺垫,也为皮瓣存活和防治坏死提供了理论支持。

