染色体微阵列分析在中枢神经系统畸形胎儿诊断中的应用
徐晨阳,项延包,周丽丽,李焕铮,林小玲,唐少华
温州市中心医院 中心实验室 温州市出生缺陷重点实验室,浙江 温州 325000
中枢神经系统(central nervous system, CNS)畸形是最常见的先天性畸形之一,发病率约为活产婴儿的1.5/1 000[1]。常见的CNS畸形包括全前脑畸形、脑积水、脊柱裂、露脑畸形和Dandy-Walker综合征等,且常合并其他系统缺陷,如心脏畸形、骨骼畸形和颅面发育异常[1-2]。CNS畸形的发生严重降低胎儿的存活率及出生后的生存质量,为家庭和社会带来较大的负担。由于胎儿CNS畸形在孕期超声检查中存在明显的进展性及显著的形态和功能不相符[2],使其产前诊断较其他系统更为困难。虽然CNS畸形病因尚未完全明确,但遗传学分析可以为产前诊断提供理论基础,也有助于CNS畸形发病机制的深入探讨[3-4]。
传统核型分析是检测非整倍体或染色体重排的经典方法,但该技术存在分辨率低、检测周期长等局限性,而染色体微阵列分析(chromosomal microarray analysis, CMA)能够检出低至1 kb的拷贝数变异(copy number variations, CNVs),在染色体不平衡的微缺失、微重复检测方面具有一定的优势。近年来,CMA已被广泛推荐应用于结构异常胎儿的产前诊断,各类CNS畸形的基因组CNVs相关研究也陆续被报道[5-7]。然而,CMA应用于产前CNS畸形胎儿的综合性评估仍然有限。本研究回顾了232例CNS畸形胎儿的临床和分子检测结果,探讨了各类表型相关CNVs的临床意义,旨在为CNS畸形胎儿的产前诊断和相关遗传咨询提供有用的信息。
1 对象和方法
1.1 研究对象
回顾性分析2014年至2022年期间在温州市中心医院进行产前诊断的232例影像学提示为CNS畸形的胎儿,胎儿神经系统畸形诊断标准参照相关指南[8],包括无脑畸形、露脑畸形、脑膜膨出、脊柱裂、脑积水、胼胝体发育不全、Dandy-Walker综合征、全前脑畸形、脉络丛囊肿等。根据超声表现将232例CNS畸形病例分为孤立性CNS畸形(不伴有其他系统结构异常或超声软标记异常)和非孤立性CNS畸形(CNS畸形合并其他系统结构异常或超声软标记异常)。除案例38和39为同一孕妇的两次妊娠,其余胎儿和家系之间均无亲缘性。所有孕妇均接受详细的遗传学咨询并签署知情同意。孕妇年龄20~45岁,孕周12~32周。样本类型包括胎儿皮肤组织23例、绒毛3例、羊水149例和脐血57例。
1.2 方法
1.2.1 核型分析 对209例胎儿样本(排除23例胎儿皮肤组织)使用320~450条带分辨率的G-显带进行分析。每个样本至少有20个中期细胞用于检测染色体结构异常和数量异常。
1.2.2 CMA 使用Illumina Human CytoSNP-12 (Illumina, USA)芯片或Affymetrix CytoScan 750k(Affymetrix, USA)芯片对232例样本进行检测。使用相应配套软件读取数据并进行分析,基因组版本注释为GRCh37(hg19)。参考数据库包括内部CNVs数据库及国际公共数据库:DECIPHER(http:// decipher.sanger.ac.uk/)、DGV(http://dgv.tcag.ca/dgv/app/home)、OMIM(http://www.omim.org)、ClinGen(https://www.ncbi.nlm.nih.gov/projects/dbvar/clingen)、PubMed(http://www.ncbi.nlm.nih.gov/pubmed/)等。根据美国医学遗传学与基因组学学会(American College of Medical Genetics, ACMG)发布指南[9],将检测到的CNVs分为良性、可能良性、临床意义未明、可能致病和致病。必要时通过实时荧光PCR技术检测进行验证和溯源。
1.3 统计学处理方法
采用SPSS23.0对数据进行分析。χ2检验比较孤立性CNS畸形组与非孤立性CNS畸形组之间致病性变异的检出率。P<0.05为差异有统计学意义。
2 结果
2.1 染色体核型分析结果
19例(19/209,9.1%)胎儿存在染色体异常,其中1例三倍体69,XXX,13例非整倍体,5例染色体结构异常。非整倍体包括9例18-三体、3例21-三体及1例13-三体。染色体结构异常包括46,XN,add(6)(p25)、46,XN,del(7)(q34)、46,XN,der(13)t(4;13)(q35;q31)、46,XN,der(2)t(2;3)(p21;p25.1),der(3)dup(3)(p25.1p26.3)t(2;3)及46,XN,del(14)(q12q21)。
2.2 CMA检测结果
CMA检出多倍体1例(1/232,0.4%),非整倍体19例(19/232,8.2%),见表1。检出其他致病或可能致病的CNVs 33例(33/232,14.2%),其中1例(案例21)涉及1号染色体长臂末端重复和3号染色体长臂重复,18例(案例22-39,其中38及39为同一孕妇的两次妊娠)涉及微缺失/微重复综合征,8例(案例40-47)涉及单倍剂量不足致病基因DLL1、FOXC1、SHH、ZIC2、CHAMP1,1例(案例53)涉及14号父源单亲同二体导致的Kagami-Ogata综合征,其余5例(案例48-52)涉及1p35.2p35.1、14q12q21.1、16q22.1q23.1 区域的缺失及3p26.3p25.1、7p22.3p21.3区域的重复,见表2和图1。此外,9例(9/232,3.9%)仅检出临床意义未明的CNVs,见表3。其余170例(170/232,73.3%)未检测到CNVs或仅检出良性/可能良性的CNVs。

图1 6例致病性拷贝数变异的染色体微阵列分析检出图

表1 CNS畸形胎儿的多倍体及非整倍体检出结果

表2 CNS畸形胎儿的P/LP CNVs检出结果

表3 CNS畸形胎儿的意义未明CNVs检出结果
2.3 CNS畸形类型及异常检出率
本研究中传统核型染色体异常检出率为9.1%(19/209),CMA染色体异常和p/lp CNVs检出率为22.8%(53/232,),检出率提高13.7%。不同类型CNS畸形的异常检出率各有差异,其中全前脑畸形(71.4%)、脉络丛囊肿(42.3%)和胼胝体发育不良(40.0%)检出率最高。此外,非孤立性CNS畸形组与孤立性CNS畸形组的异常检出率差异有统计学意义(27/57vs.26/175,P<0.01)。详见表4。
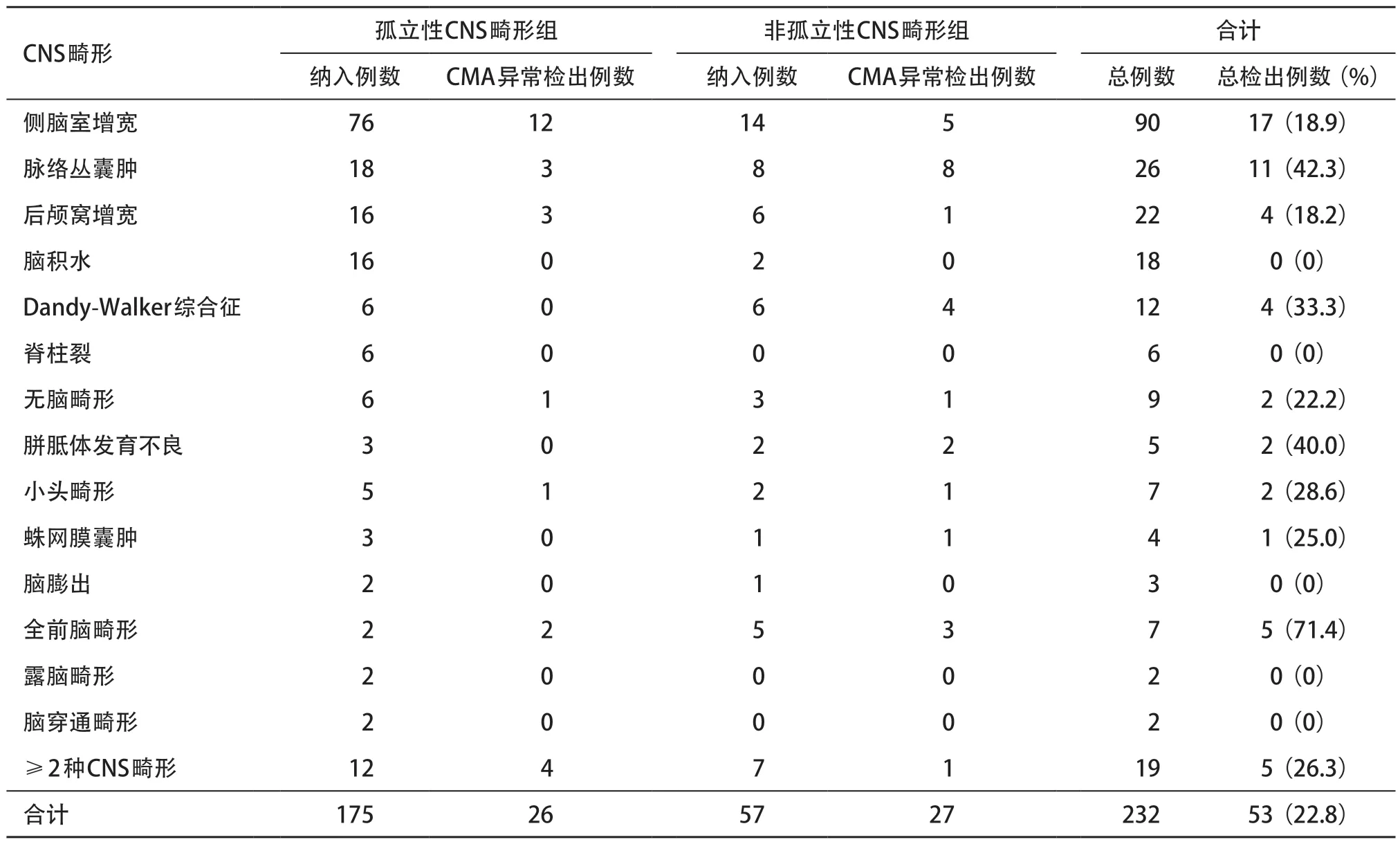
表4 CNS畸形类型及异常检出率
3 讨论
目前,CMA技术在不同类型CNS畸形中的应用已有一定的报道[8,10-11],但产前CNS畸形与CNVs的综合性研究仍然有限。本研究对232例CNS畸形胎儿进行CMA检测,整体异常检出率为22.8%(53/232),与YANG等[12]报道的21.6%及ZHI等[13]报道的25.1%比较接近。相对传统染色体核型分析,CMA在染色体微缺失、微重复检出方面有突出优势,但CMA无法检测低比例嵌合以及基因组平衡的染色体倒位和易位,本研究中案例44和47的亲本CMA结果未见异常,通过核型分析分别发现母源平衡易位和父源平衡易位,因此,CMA技术结合传统核型分析可以有效提高检出率和追溯致病机制,有助于高危家系的再生育指导。此外,亲本的隐匿性平衡易位尤其需要警惕。案例45的孕妇曾孕有同样表现为全前脑畸形的胎儿,而同一家系的案例38和39具有相似的表型和基因型,这两个家系的胎儿均同时携带染色体末端 10 Mb以内缺失和重复且大小相近的CNVs,对于这类隐匿性平衡易位高风险的家系,即使亲本核型分析及CMA未见异常,仍有必要采用光学基因组图 谱[14]等新技术进行变异溯源。
本次检出的CNVs涉及多个神经发育异常易感位点,包括1q21.1 distal duplication、16p11.2 distal deletion、16p11.2 proximal duplication、 16p11.2 proximal deletion、16p12.2 proximal deletion和16p13.11 deletion,这些易感位点通常与自闭症、发育迟缓、学习障碍、智力低下等神经发育异常相关,是一类临床异质性较强且不完全外显的CNVs,即使携带相同变异的同一家系成员,其临床表型也各有差异[15]。本研究中案例23、32和34携带的易感位点即遗传自无表型的亲本。目前,环境、单基因变异、表观遗传引发的二次打击理论被认为可能是导致这类疾病外显不全和可变表达的原因[16]。神经发育异常易感位点导致的表型通常无法预测及量化,给产前诊断和遗传咨询带来极大困难。本研究表明这类CNVs在一定程度上可导致宫内CNS畸形,但也强调即使携带同种变异的胎儿,其影像学表现仍存在相当大的差异,如案例22和23、案例32和33,以及案例34和35,并且鉴于临床异质性,这类胎儿出生后更需要进行长期的随访跟踪。
除神经发育异常易感位点以外,Miller Dieker syndrome(MDS)以及7q11.23 duplication syndrome 在检出的微缺失/微重复综合征中也有较高的占比。MDS是一种以无脑回和特殊面容为特征的遗传综合征,发病率约为1.2/10万,此类患儿通常表现有严重的发育迟缓、癫痫和喂养问题[17]。MDS涉及染色体17p13.3区域连续基因缺失,其中关键基因LIS1编码的PAFAH1B1蛋白是神经元迁移所必需的[18],虽然有报道表明侧脑室增宽是最常见的宫内表型[17], 但本研究3 例MDS患胎均发现胼胝体发育异常。7q11.23 duplication syndrome是7号染色体长臂部分重复引起的罕见综合征,其表型高度可变,主要为智力低下、语言发育障碍和特征性面容,目前已报道的脑部影像学异常有脑室扩张、白质发育异常和小脑蚓部发育不全等[19]。研究表明GTF2I编码的蛋白是兴奋剂诱导钙进入细胞质的调节因子,该基因重复与分离焦虑症相关,缺失与智力低下和自闭症的程度相关[20-21],指向该基因在神经发育中起到了重要作用。
研究中多个案例的CNVs包含剂量敏感致病基因,其中SHH基因检出率最高,其次是ZIC2和CHAMP1。SHH和ZIC2的单倍剂量不足已与前脑无裂畸形建立了明确的疾病关联,CHAMP1基因内也发现了多个功能丧失型变异与智力障碍等神经发育异常表型相关[22]。案例40检出的DLL1基因和案例41检出的FOXC1基因同样有充分的单倍型证据可以分别导致伴有非特异性脑异常的神经发育障碍[23]和Axenfeld-Rieger综合征3型。Axenfeld-Rieger综合征是一种眼睛前段发育异常的常染色体显性疾病,CNS方面主要表现为小脑蚓发育不良[24]。在其他未能明确致病基因的案例中,本研究筛选了一批与神经系统发育相关的候选基因,但这些基因的剂量敏感仍需要更多的案例和功能实验的支持。此外,在缺失型CNVs的病因探索中,隐性遗传病相关基因内呈反式排列的另一致病变异也应纳入考虑。
本研究发现了一系列致病或可能致病的CNVs,并试图说明这些CNVs与CNS畸形之间的相关性,也在一定程度上丰富了CNVs综合征的宫内表型谱,同时,筛选了一批与神经系统发育异常相关的剂量敏感基因和候选基因,有助于CNS表型与基因型相关性的深入研究。

