紫草素调节Nrf2/HO-1 信号通路对实验性大鼠肉芽肿性小叶性乳腺炎的治疗作用研究
李凡凡, 徐阳, 王晓旭
1.天津中医药大学第一附属医院(国家中医针灸临床医学研究中心)乳腺外科,天津300193; 2.天津中医药大学第一附属医院(国家中医针灸临床医学研究中心)疮疡血管外科,天津 300193
肉芽肿性小叶性乳腺炎(GLM)是一种罕见的乳腺特发性慢性炎症性病变,在临床和乳房X 光检查中通常伪装成乳腺癌[1]。GLM 的病因和发病机制目前尚不清楚,其诊断治疗是一个挑战。 紫草素(Shikonin, SHI)是从紫草根中分离出来的一种天然萘醌类化合物,具有抗氧化、抗炎和抗肿瘤等多种活性[2]。研究表明紫草素能通过抑制NF-κB 信号通路在LPS 诱导的乳腺炎中发挥抗炎作用[3]。Nrf2/HO-1信号通路是氧化应激反应中不可或缺的信号通路,参与抗炎、抗氧化、细胞凋亡等过程[4]。Nrf2 是一种关键的转录因子,调节细胞的氧化应激,也是维持细胞内氧化还原稳态的重要调节因子[5]。热休克蛋白家族成员HO-1 是一种重要的抗炎、抗氧化和细胞保护酶,受主要转录因子Nrf2 激活的调节,HO-1 表达上调对氧化应激和炎症条件下的细胞起保护作用。研究表明犬尿烯酸能通过抑制NF-κB 和激活Nrf2/Ho-1,减少炎症反应和增强血乳屏障完整性来减轻LPS 诱导的乳腺炎[6]。紫草素能否通过调节Nrf2/HO-1 信号通路改善大鼠肉芽肿性小叶性乳腺炎尚不清楚,本文建立肉芽肿性小叶性乳腺炎大鼠模型,基于Nrf2/HO-1 信号通路,探讨紫草素对肉芽肿性小叶性乳腺炎的治疗作用及可能的机制。
1 材料与方法
1.1 材料
SPF 级大鼠,180~220 g,购自广东南模生物科技有 限 公 司(SCXK(粤)2022-0062);紫 草 素(HYN0822)和ML385(HY-100523)均购自MCE 公司;IL-1β(SP12225)、TNF-α(SP12250)、IL-8(SP12278)、SOD(SP12914)和GSH(SP12673)ELISA 试剂盒均购自武汉赛培生物科技有限公司;T-AOC(CB11081-Ra)和MPO(CB10780-Ra)ELISA 试剂盒均购自上海科艾博生物技术有限公司;NAGase(ER1177)ELISA 试剂盒购自武汉菲恩生物科技有限公司;ROS(JN482)ELISA 试剂盒购自上海纪宁生物科技有限公司;SYBR Premix EX Taq 试剂盒(RR390Q)购自Takara Bio 公司;抗体HO-1(ab305290)、GAPDH(ab8245)和二抗山羊抗兔IgG(ab6721)均购自Abcam 公司;抗体Nrf2(AF7623)和NLRP3(AF2155)购自上海碧云天生物技术有限公司。
1.2 肉芽肿性小叶性乳腺炎大鼠模型建立
根据参考文献[7]建立肉芽肿性小叶性乳腺炎(GLM)大鼠模型。将人新鲜GLM 病变组织制成病变乳腺组织匀浆液,取0.04 mL 病变乳腺组织匀浆液在大鼠第3、4 对乳房进行注射包埋。正常大鼠注射等量的生理盐水。1 周后进行大鼠乳腺组织局部观察,随后处死2 只大鼠,取第3、4 对乳腺组织进行病例切片观察,镜下出现特征性脂质空泡周围伴多种炎症细胞浸润,形成肉芽肿性炎症或微脓肿时即可确认造模成功。将GLM 大鼠分为模型组(GLM 组)、紫草素低剂量组(SHI-L 组)、紫草素中剂量组(SHI-M组)、紫草素高剂量组(SHI-H 组)和紫草素高剂量+Nrf2 抑制剂ML385 组(SHI-H+ML385 组),每组15只。另取15 只正常大鼠作为对照组(Control 组)。根据参考文献[3]及药物剂量调整,SHI-L 组、SHI-M 组和SHI-H 组大鼠分别灌胃17.5、35、70 mg·kg-1·d-1的紫草素。SHI-H+ML385 组灌胃70 mg·kg-1·d-1的紫草素+腹 腔 注 射14 mg·kg-1·d-1的ML385[8]。Control 组 和GLM 组给予等量的生理盐水。连续干预14 d。
1.2.1 HE 染色观察乳腺组织病理学变化 各组随机取5 只大鼠,取出乳腺组织,浸泡于4%多聚甲醛中固定,然后进行石蜡包埋,切片,HE 染色,光学显微镜下观察组织病理变化。
1.2.2 炎症因子水平和氧化指标检测 各组随机取5只大鼠,取出乳腺组织进行匀浆,离心收集上清液,按照ELISA 试剂盒说明操作检测乳腺组织中炎症因子IL-1β、TNF-α 和IL-8 水 平 及 过 氧 化 指 标T-AOC、SOD、GSH 和ROS 水平。
1.2.3 MPO 和NAGase 水平检测 使用1.2.2 中乳腺组织匀浆,离心获得上清液,严格按照ELISA 检测试剂盒说明书操作,检测MPO 和NAGase 水平。
1.2.4 NLRP3 炎性小体表达检测 使用1.2.1 中的各组大鼠乳腺组织石蜡切片,脱水并水合,3%过氧化氢酶处理切片阻断内源性过氧化物酶活性,与抗体NLRP3 在4 ℃下孵育过夜,后与荧光二抗室温孵育1h,DAPI 复染,共聚焦显微镜下拍照观察,并计算NLRP3 阳性率,NLRP3 阳性率(%)=NLRP3 阳性细胞数/DAPI×100%。
1.2.5 Nrf2、HO-1 蛋白水平检测 将各组剩余5 只大鼠处死,取出乳腺组织。RIPA 缓冲液裂解各组大鼠乳腺组织,提取蛋白,BCA 蛋白测定试剂盒测定蛋白浓度,样品经SDS-PAGE 分离,转移到PVDF 膜上,后使用5%的脱脂奶粉封闭1 h,与一抗Nrf2、HO-1 和GAPDH 在4 ℃下过夜孵育。后与二抗山羊抗兔IgG室温孵育2h,ECL 显影,Image J 软件计算蛋白灰度值。
1.3 数据分析
所有实验数据采用SPSS 20.0 进行统计分析,实验数据符合正态分布以(均值±标准差)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 紫草素对GLM 大鼠乳腺组织病理变化的影响
与Control 组相比,GLM 组大鼠乳腺小叶被破坏、大片结节样慢性肉芽肿炎性病灶生成,乳腺小叶组织边界不清,腺叶内出现空泡,伴有大量淋巴细胞及中性粒细胞浸润;与GLM 组相比,SHI-L 组、SHI-M 组和SHI-H 组乳腺组织病变逐渐减轻;与SHI-H 组相比,SHI-H+ML385 组乳腺组织病变加重(图1)。
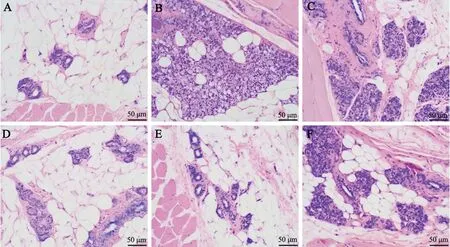
图1 紫草素对GLM 大鼠乳腺组织病理变化的影响A: Control 组B: GLM 组C: SHI-L 组D: SHI-M 组E: SHI-H 组F: SHI-H+ML385 组Fig. 1 Effect of shikonin on pathological changes of mammary gland tissue in GLM rats. A: Control group; B:GLM group; C: SHI-L group; D: SHI-M group; E: SHI-H group; F: SHI-H+ML385 group.
2.2 紫草素对GLM 大鼠乳腺组织炎症因子水平和氧化指标的影响
与Control 组相比,GLM 组大鼠乳腺组织IL-8、IL-1β、TNF-α 和ROS 水 平 显 著 增 加(P<0.05),TAOC、SOD 和GSH 水平显著降低(P<0.05);与GLM组相比,SHI-L 组、SHI-M 组和SHI-H 组大鼠乳腺组织IL-8、IL-1β、TNF-α 和ROS 水平依次降低(P<0.05),TAOC、SOD 和GSH 水平依次增加(P<0.05);与SHI-H组相比,SHI-H+ML385 组大鼠乳腺组织IL-8、IL-1β、TNF-α 和ROS 水平显著增加(P<0.05),T-AOC、SOD和GSH 水平显著降低(P<0.05),见表1 和表2。
表1 紫草素对GLM 大鼠乳腺组织炎症因子水平的影响(±s, n=5)Tab.1 Effect of shikonin on the levels of inflammatory factors in breast tissue of GLM rats (Mean±SD, n=5)
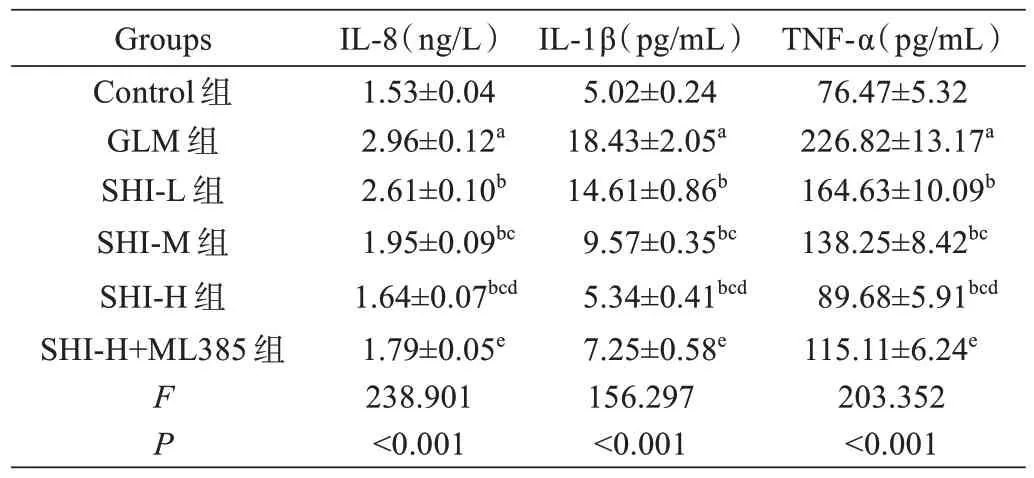
表1 紫草素对GLM 大鼠乳腺组织炎症因子水平的影响(±s, n=5)Tab.1 Effect of shikonin on the levels of inflammatory factors in breast tissue of GLM rats (Mean±SD, n=5)
注:aP<0.05 vs Control 组; bP<0.05 vs GLM 组; cP<0.05 vs SHI-L 组;dP<0.05 vs SHI-M 组; eP<0.05 vs SHI-H 组。Note: aP<0.05 vs Control group, bP<0.05 vs GLM group, cP<0.05 vs SHI-L group, dP<0.05 vs SHI-M group, eP<0.05 vs SHI-H group.
TNF-α(pg/mL)76.47±5.32 226.82±13.17a 164.63±10.09b 138.25±8.42bc 89.68±5.91bcd 115.11±6.24e 203.352<0.001 Groups Control 组GLM 组SHI-L 组SHI-M 组SHI-H 组SHI-H+ML385 组FP IL-8(ng/L)1.53±0.04 2.96±0.12a 2.61±0.10b 1.95±0.09bc 1.64±0.07bcd 1.79±0.05e 238.901<0.001 IL-1β(pg/mL)5.02±0.24 18.43±2.05a 14.61±0.86b 9.57±0.35bc 5.34±0.41bcd 7.25±0.58e 156.297<0.001
表2 紫草素对GLM 大鼠乳腺组织氧化指标的影响(±s ,U/mg, n=5)Tab.2 Effect of shikonin on oxidative indicators of mammary tissue in GLM rats (Mean±SD,U/mg, n=5)

表2 紫草素对GLM 大鼠乳腺组织氧化指标的影响(±s ,U/mg, n=5)Tab.2 Effect of shikonin on oxidative indicators of mammary tissue in GLM rats (Mean±SD,U/mg, n=5)
注:aP<0.05 vs Control 组;bP<0.05 vs GLM 组;cP<0.05 vs SHI-L 组;dP<0.05 vs SHI-M 组;eP<0.05 vs SHI-H 组。Note: aP<0.05 vs Control group, bP<0.05 vs GLM group, cP<0.05 vs SHI-L group, dP<0.05 vs SHI-M group, eP<0.05 vs SHI-H group.
ROS Groups T-AOC SOD GSH 1.14±0.07 5.82±0.47a 4.75±0.36b 3.28±0.21bc 1.86±0.09bcd 2.39±0.18e 217.750<0.001 Control 组GLM 组SHI-L 组SHI-M 组SHI-H 组SHI-H+ML385 组FP 64.79±4.10 21.68±1.06a 33.04±1.15b 45.47±1.41bc 58.03±2.79bcd 51.25±2.36e 222.767<0.001 174.32±10.56 76.82±4.32a 94.63±5.85b 128.25±6.91bc 159.68±9.03bcd 132.11±7.76e 116.951<0.001 264.06±18.26 104.58±8.79a 145.61±12.43b 193.85±11.37bc 251.69±15.48bcd 206.92±13.01e 101.905<0.001
2.3 紫草素对GLM 大鼠乳腺组织MPO 和NAGase 水平的影响
与Control 组相比,GLM 组大鼠乳腺组织MPO 和NAGase 水平显著增加(P<0.05);与GLM 组相比,SHI-L 组、SHI-M 组和SHI-H 组大鼠乳腺组织MPO 和NAGase 水平依次降低(P<0.05);与SHI-H 组相比,SHI-H+ML385 组大鼠乳腺组织MPO 和NAGase 水平显著增加(P<0.05),见表3。
表3 紫草素对GLM 大鼠乳腺组织MPO 和NAGase 水平的影响(±s, ng/mL, n=5)Tab. 3 Effect of shikonin on MPO and NAGas levels in mammary gland tissue of GLM rats(Mean±SD, ng/mL, n=5)

表3 紫草素对GLM 大鼠乳腺组织MPO 和NAGase 水平的影响(±s, ng/mL, n=5)Tab. 3 Effect of shikonin on MPO and NAGas levels in mammary gland tissue of GLM rats(Mean±SD, ng/mL, n=5)
注:aP<0.05 vs Control 组;bP<0.05 vs GLM 组;cP<0.05 vs SHI-L 组;dP<0.05 vs SHI-M 组;eP<0.05 vs SHI-H 组。Note: aP<0.05 vs Control group, bP<0.05 vs GLM group, cP<0.05 vs SHI-L group, dP<0.05 vs SHI-M group, eP<0.05 vs SHI-H group.
NAGase MPO 27.83±1.64 64.12±4.07a 56.37±3.29b 43.06±2.81bc 32.84±2.25bcd 38.10±2.43e 120.028<0.001 Control 组GLM 组SHI-L 组SHI-M 组SHI-H 组SHI-H+ML385 组FP 34.53±2.84 92.96±7.73a 78.61±5.42b 65.95±4.17bc 43.64±2.36bcd 51.95±3.21e 110.016<0.001
2.4 紫草素对GLM 大鼠乳腺组织NLRP3 阳性表达的影响
与Control 组相比,GLM 组大鼠乳腺组织NLRP3阳性表达率显著增加(P<0.05);与GLM 组相比,SHIL 组、SHI-M 组和SHI-H 组大鼠乳腺组织NLRP3 阳性表达率依次降低(P<0.05);与SHI-H 组相比,SHI-H+ML385 组大鼠乳腺组织NLRP3 阳性表达率显著增加(P<0.05),见图2 和表4。
表4 紫草素对GLM 大鼠乳腺组织NLRP3 阳性表达的影响(±s ,%, n=5)Tab.4 Effect of shikonin on NLRP3 positive expression in breast tissue of GLM rats (Mean±SD, %, n=5)
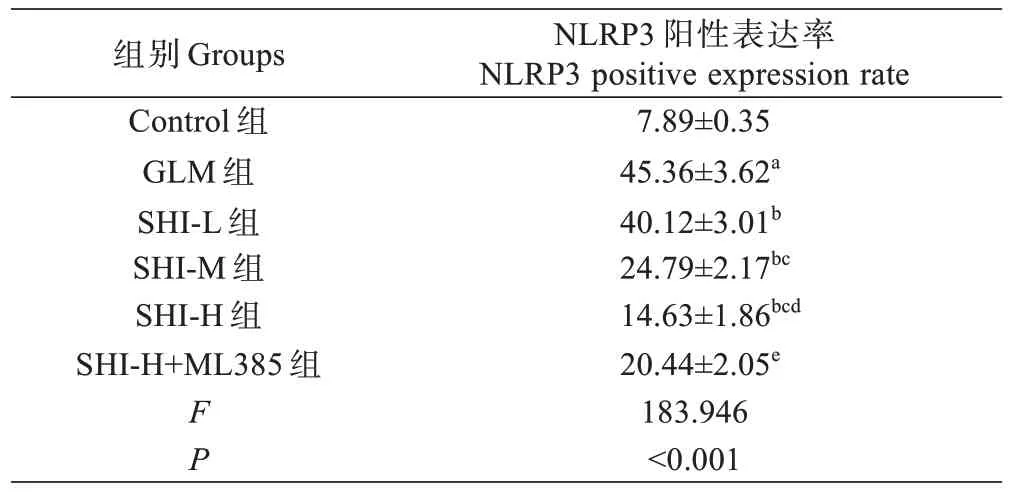
表4 紫草素对GLM 大鼠乳腺组织NLRP3 阳性表达的影响(±s ,%, n=5)Tab.4 Effect of shikonin on NLRP3 positive expression in breast tissue of GLM rats (Mean±SD, %, n=5)
注:aP<0.05 vs Control 组;bP<0.05 vs GLM 组;cP<0.05 vs SHI-L 组;dP<0.05 vs SHI-M 组;eP<0.05 vs SHI-H 组。Note: aP<0.05 vs Control group, bP<0.05 vs GLM group, cP<0.05 vs SHI-L group, dP<0.05 vs SHI-M group, eP<0.05 vs SHI-H group.
NLRP3 阳性表达率NLRP3 positive expression rate 7.89±0.35 45.36±3.62a 40.12±3.01b 24.79±2.17bc 14.63±1.86bcd 20.44±2.05e 183.946<0.001组别Groups Control 组GLM 组SHI-L 组SHI-M 组SHI-H 组SHI-H+ML385 组FP
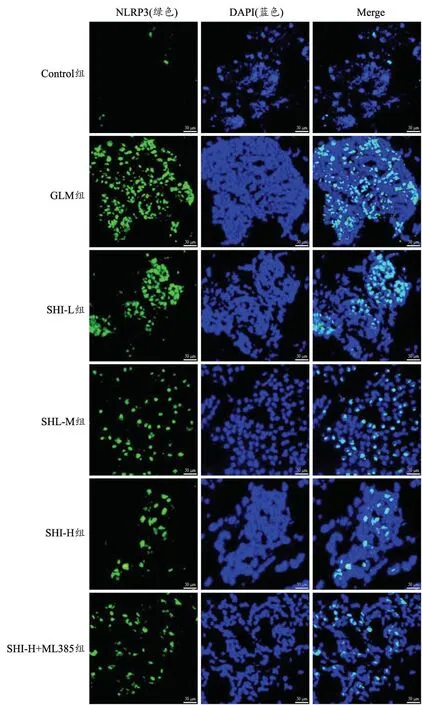
图2 紫草素对GLM 大鼠乳腺组织NLRP3 阳性表达的影响(标尺50 μm)Fig.2 Effect of shikonin on NLRP3 positive expression in breast tissue of GLM rats.(bar=50 μm)
2.5 紫草素对GLM 大鼠乳腺组织Nrf2 和HO-1 蛋白表达的影响
与Control 组相比,GLM 组大鼠乳腺组织Nrf2 和HO-1 蛋白表达显著降低(P<0.05);与GLM 组相比,SHI-L 组、SHI-M 组 和SHI-H 组 大 鼠 乳 腺 组 织Nrf2 和HO-1 蛋白表达依次增加(P<0.05);与SHI-H 组相比,SHI-H+ML385 组大鼠乳腺组织Nrf2 和HO-1 蛋白表达显著降低(P<0.05),见图3 和表5。
表5 紫草素对GLM 大鼠乳腺组织Nrf2 和HO-1 蛋白表达的影响(±s , n=5)Tab.5 Effect of shikonin on Nrf2 and HO-1 protein expression in mammary gland tissue of GLM rats(Mean±SD, n=5)

表5 紫草素对GLM 大鼠乳腺组织Nrf2 和HO-1 蛋白表达的影响(±s , n=5)Tab.5 Effect of shikonin on Nrf2 and HO-1 protein expression in mammary gland tissue of GLM rats(Mean±SD, n=5)
注:aP<0.05 vs Control 组;bP<0.05 vs GLM 组;cP<0.05 vs SHI-L 组;dP<0.05 vs SHI-M 组;eP<0.05 vs SHI-H 组。Note: aP<0.05 vs Control group, bP<0.05 vs GLM group, cP<0.05 vs SHI-L group, dP<0.05 vs SHI-M group, eP<0.05 vs SHI-H group.
HO-1 0.74±0.04 0.13±0.01a 0.30±0.02b 0.48±0.03bc 0.69±0.05bcd 0.53±0.06e 177.418<0.001 Groups Control 组GLM 组SHI-L 组SHI-M 组SHI-H 组SHI-H+ML385 组FP Nrf2 0.94±0.07 0.32±0.02a 0.51±0.03b 0.76±0.06bc 0.91±0.04bcd 0.80±0.05e 127.568<0.001
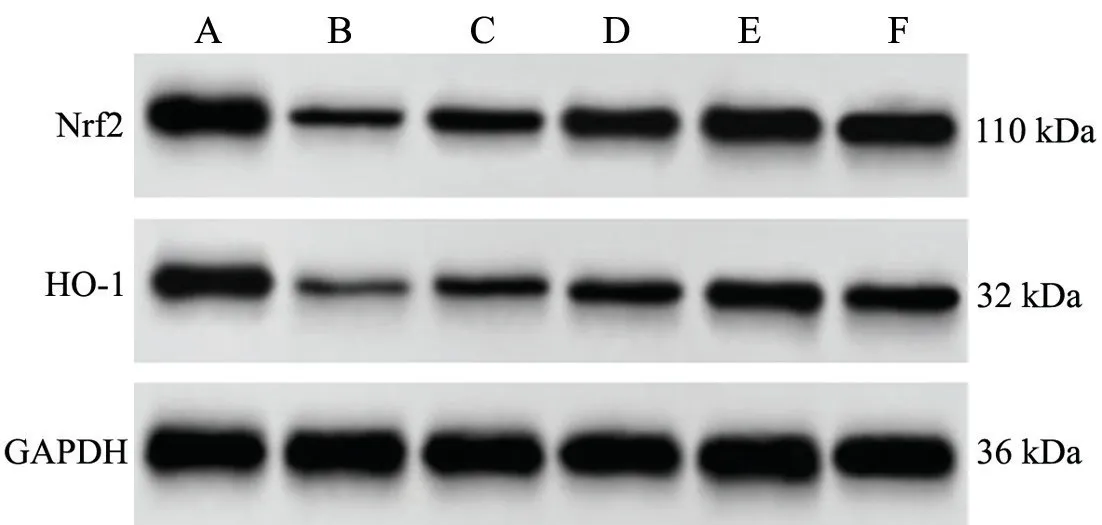
图3 紫草素对GLM 大鼠乳腺组织Nrf2 和HO-1 蛋白表达的影响A: Control 组 B: GLM 组 C: SHI-L 组 D: SHI-M 组 E: SHI-H 组F: SHI-H+ML385 组Fig.3 Effect of shikonin on the expression of Nrf2 and HO-1 proteins in breast tissue of GLM rats. A: Control group;B:GLM group; C: SHI-L group; D: SHI-M group; E: SHI-H group;F: SHI-H+ML385 group.
3 讨论
GLM 是一种罕见的慢性乳腺良性炎症性疾病,通常表现为非干酪样肉芽肿性病变。在过去二十年里,随着发病率的迅速增加,GLM 往往发生在育龄妇女身上,病程长且反复发作[9]。研究表明紫草素主要通过调节多种信号通路、NLRP3 炎性体、活性氧应激、Bax/Bcl-2 等发挥抗炎、抗癌、心血管保护等作用[10]。紫草素是一种很有前途的药物,有必要对紫草素进行广泛和深入的探索,以加快紫草素类药物在临床中的应用。Lebda[11]等研究表明纳米姜黄素显著降低MDA、氧化型谷胱甘肽、促炎细胞因子的释放以及TLR4、NF-κB p65 和HMGB1 的基因表达,提高还原型谷胱甘肽水平和Nrf2 活性,减轻LPS 诱导的乳腺炎的炎症和氧化应激。本研究中紫草素治疗后大鼠乳腺组织病变减轻,乳腺组织IL-8、IL-1β 和TNF-α 水平降低,T-AOC、SOD 和GSH 水平增加。表明紫草素能抑制炎症因子及氧化应激水平,发挥抗炎和抗氧化作用,改善大鼠肉芽肿性小叶性乳腺炎。
在炎症部位中性粒细胞迅速集结,识别、吞噬和灭活外来微生物[12]。MPO 是中性粒细胞的主要成分,MPO 的激活可被视为中性粒细胞浸润的直接生物标志物,外部刺激可导致中性粒细胞聚集,MPO 产生增加[13]。研究表明鸡骨草总黄酮可以降低乳腺炎小鼠乳腺组织中的MPO 活性,减少中性粒细胞的聚集,缓解LPS 诱导的小鼠乳腺炎症[14]。NAGase 主要来源于乳腺上皮细胞,乳腺组织中NAGase 的水平与乳腺炎的严重程度成正比,当乳腺上皮细胞被破坏时释放NAGase,该因素是乳腺上皮细胞损伤程度的标志[15]。研究显示抑制MPO 和NAGase 活性,减少炎症细胞浸润,能保护大鼠乳腺组织免受过度炎症反应的损伤[16]。NLRP3 炎性小体在乳腺炎等炎症性疾病的发病机制中起重要作用,通常被ATP 和活性氧(ROS)等各种“危险信号”激活[17]。NLRP3 炎症小体通过调节炎症因子水平影响炎症的后续发展[18]。持续和不受控制的炎症与氧化应激密切相关,严重的炎症反应导致更多的ROS 产生,过量的ROS 会引起更严重的炎症,加剧组织破坏[19]。本研究中紫草素治疗后大鼠乳腺组织MPO、NAGase、ROS 水平及NLRP3 表达降低。表明紫草素能通过降低MPO、NAGase、ROS 水平减少炎症细胞浸润,抑制氧化应激反应,缓解炎症。Nrf2/HO-1 信号通路被认为是最关键的内源性抗氧化应激途径之一,是炎症相关疾病的重要靶标[20]。转录因子Nrf2 是抗氧化系统的主要调节因子,HO-1 被认为是一种细胞保护、抗炎和抗氧化酶,Nrf2 和HO-1 是抗氧化信号传导的重要调节剂[21]。研究表明转录因子Nrf2 通过诱导HO-1 来减轻炎症,对氧化应激起到保护作用[22]。Nrf2 储存在细胞质中,在正常状态下与Keap 1 结合。当受到氧化刺激时,Nrf2 从细胞质转移到细胞核,然后诱导HO‐1 转录并发挥抗氧化作用[23]。Zhao[24]等研究表明衣康酸二甲酯上调Nrf2、HO-1、p38 和ERK 的 磷 酸 化,下 调TLR4 和p65-NF-κB 的 磷酸化,降低乳腺的病理损伤及炎症因子水平,改善LPS 诱导的乳腺炎。本研究中紫草素治疗后大鼠乳腺组织Nrf2 和HO-1 蛋白下调,炎症因子水平降低及氧化应激反应受到抑制,抑制剂ML385 逆转了紫草素对肉芽肿性小叶性乳腺炎大鼠的抗炎及抗氧化作用。表明紫草素可能通过激活Nrf2,上调HO-1 表达,进而抑制大鼠炎症反应及氧化应激,缓解大鼠肉芽肿性小叶性乳腺炎。
综上所述,紫草素可能通过增强Nrf2 和HO-1 的表达,抑制炎症因子水平,增强抗氧化能力,发挥抗炎和抗氧化作用,改善大鼠肉芽肿性小叶性乳腺炎。紫草素对肉芽肿性小叶性乳腺炎大鼠的治疗作用可能是通过激活Nrf2/HO-1 信号通路实现的。