人参皂苷Rg1 通过抑制NLRP3 炎症小体途径减轻氧糖剥夺/复供后小胶质细胞炎症反应
王兴航, 丁佳媛, 李放, 包翠芬*, 阎丽菁*
锦州医科大学 1.组织胚胎学教研室,2.人体解剖学教研室,3.分析化学教研室,4.基础医学实验教学中心,辽宁 锦州 121001
缺血性脑卒中(Ischemic stroke,IS)是临床上最常见的一种卒中类型,占所有卒中患者的80%以上,具有高发病率、高死亡率、高致残率、高复发率四个特点,且常急性起病,严重威胁人类健康和生命[1]。目前,临床上常采用溶栓治疗IS,但若血栓自溶或溶栓药物使用超过时间窗,血流再通后可引起脑缺血再灌注 损 伤(cerebral ischemia-reperfusion injury,CIRI)[2]。CIRI 是一个动态变化的病理生理过程,包括能量代谢障碍、氧化损伤、炎性细胞浸润、血脑屏障破坏、细胞内钙超载、细胞自噬、凋亡等,其中炎性反应是其主要病理过程之一[3]。小胶质细胞是脑内常驻免疫细胞,在受到内源性或外源性刺激后迅速激活,释放抗炎因子,促进组织修复与重塑。但是在发挥抗炎作用的同时也释放大量的促炎因子及神经毒性介质,加重缺血部位组织损伤[4]。因此,减轻炎症,积极控制小胶质细胞过度激活是减轻脑缺血再灌注损伤的重要环节之一。研究发现核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide-binding oligomerization domainlike receptor protein3,NLRP3)炎症小体与炎症的发展密切相关,大量实验已经证实炎症反应通常伴随NLRP3 炎症小体表达增多,因此,抑制NLRP3 炎症小体表达对控制炎症发展具有重要意义[5]。人参皂苷Rg1 是人参的主要生物活性成分,具有广泛的药理活性,例如抗炎症反应、抗纤维化、抗自由基损伤、抗疲劳及显著的神经保护和肝保护的作用,还可促进干细胞的增殖和分化。前期实验已证实Rg1 可减轻脑缺血再灌注损伤大鼠的炎症反应[6],本文旨在探讨体外情况下Rg1 能否通过抑制NLRP3 炎症小体在BV-2 小胶质细胞中的表达减轻脑缺血再灌注损伤。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器 BV-2 小胶质细胞购自上海传秋生物公司;人参皂苷Rg1(纯度>95%)购自吉林大学有机化学教研室;DMEM/F12 细胞培养基、胰蛋白酶、青链霉素双抗购自美国Gibco 公司;BCA 蛋白定量试剂盒、RIPA 裂解液、蛋白Marker 购自TransGen Biotech 公 司;CCK-8 试 剂 购 自 美 国APExBIO 公 司;ASC、Caspase-1 抗体购自Abclonal 公司;NLRP3 抗体购自Abcam 公司;IL-1β、IL-18 ELISA 检测试剂盒购自R&D 公司。缺氧仓购自STEMCELL 公司;高速冷冻离心机购自Thermo 公司;细胞培养箱购自Thermo公司;电泳槽、电转仪购自Bio-Rad 公司;凝胶成像系统购自伯乐公司。
1.1.2 细胞培养 BV-2 小胶质细胞用含10% 胎牛血清、106 IU /L 链霉素、105 IU /L 青霉素的DMEM/F12培养基进行培养,接种于培养瓶中,调整细胞至合适密度,加入2~3 mL 培养液,将培养瓶置于37 ℃、含有95%空气和5%CO2的孵箱中培养,每2~3天传代1次。
1.2 实验方法
1.2.1 氧葡萄糖剥夺/复供(OGD/R)模型构建方法OGD 模型:取对数生长期贴壁后的细胞,加入无糖培养基,放入缺氧仓中,为营造缺氧环境,向缺氧仓中通氮气10 min 以排空仓内的氧气,排空后密闭,放入培养箱中培养2 h,在体外模拟脑缺血损伤。OGD/R 模型:OGD 处理2 h 后取出细胞恢复氧气供应,将无糖培养基置换为完全培养基,加入等量细胞培养液继续培养48 h,置于含有95% 空气和5% 的CO2孵箱中,在体外模拟脑缺血/再灌注损伤[7]。对照组细胞始终用完全培养基,并置于37 ℃、含有95% 空气和5%CO2的孵箱中培养。
1.2.2 实验分组 将生长状态良好的BV-2 小胶质细胞随机分为6 组:无处理组(Con)、氧糖剥夺/复供组(OGD/R)、人 参 皂 苷Rg1 低 剂 量 组(0.1 mmol/L,Rg1L)、人参皂苷Rg1 中剂量组(0.2 mmol/L,Rg1M)、人参皂苷Rg1 高剂量组(0.4 mmol/L,Rg1H)、MCC950对照组(0.05 mmol/L,MCC950)[8,9]。除Con 组不作任何处理外,其它各组制备OGD/R 模型后,分别加入细胞培养液、不同浓度的人参皂苷Rg1 和MCC950,置于培养箱中培养48 h。
1.2.3 CCK8 检测细胞增殖 取对数生长期的BV-2小胶质细胞,以每孔1×104个/孔接种于96 孔板中,每孔100 μL,细胞贴壁后进行OGD/R 处理。接下来依次加入不同浓度人参皂苷Rg1 和MCC950。每组设置5 个复孔,每孔加入10 μL CCK8 试剂,放入培养箱孵育1~4 h。于450 nm 处测定OD 值。根据说明书计算细胞活力。
1.2.4 免疫荧光法检测Iba-1、NLRP3、ASC、Caspase-1蛋白表达水平 将聚赖氨酸防脱载玻片置入12 孔板中,六组细胞分别接种于孔板的载玻片上,调整细胞密度至2×104/ml,每孔加入1 mL 细胞悬液,培养至细胞完全贴壁后,除Con 组不作任何处理外,其它各组制备OGD/R 模型后,分别加入细胞培养液、不同浓度的人参皂苷Rg1 和MCC950,置于培养箱中培养48 h。48 h 后取出孔板,弃上清,磷酸盐缓冲液(PBS)漂洗3次;4%多聚甲醛固定细胞30 min,固定后以PBS 漂洗3 次,每次3 min;加入0.1%Triton X-100 的PBS 溶液通透细胞膜30 min 后,漂洗3 次,每次3 min;加入5%胎牛 血 清 室 温 封 闭60 min。 每 孔 加 入200 μL 的NLRP3、ASC、Caspase-1(稀释比例均为1∶100)、Iba-1(稀释比例均为1∶1000)一抗工作液后置入4 ℃冰箱过夜。次日取出孔板,加入FITC 标记的二抗工作液(稀释比例为1∶200)室温孵育60 min,全程避光;最后避光加入DAPI 染色剂常温复染细胞核。在荧光显微镜下观察并拍照。
1.2.5 Western blotting 检 测Iba-1、NLRP3、ASC、Caspase-1 蛋白表达水平 RIPA 裂解法抽提细胞总蛋白后,根据二喹啉甲酸( bicinchoninic acid,BCA) 法测定的蛋白浓度结果,将各样品的蛋白浓度调节一致; 经过SDS-PAGE 蛋白转印后,用含有3%BSA 封闭液将转印好的PVDF 膜,室温孵育,封闭1 h; 加入NLRP3、ASC(稀释比例均为1∶1000)Caspase-1(稀释比例为1∶2000)GAPDH(稀释比例为1∶1500)一抗工作液,4 ℃孵育过夜;次日加入相应二抗(稀释比例为1:2000),室温下振摇1.5 h,以ECL发光显色,得到条带。
1.2.6 ELISA 法检测IL-18、IL-1β 炎症因子表达水平收集所有组别细胞上清液,将测试样品按照说明书精准加液后,将孔板37 ℃水浴温育60 min。取出孔板,吸弃所有孔内液体,洗涤并尽量拍干,重复5 次。每孔加入显色剂反应10 min,加入终止液终止反应。10 min 内以450 nm 波长测量各孔光密度值并计算样品浓度。
1.3 统计学分析
本实验使用SPSS 19.0 软件对实验数据进行统计分析,多组样本之间的比较采用单因素方差分析,方差齐性采用LSD,方差不齐采用Tamhane 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 人参皂苷Rg1 对OGD/R 损伤后BV-2 小胶质细胞形态的影响。
如图1 所示, BV-2 小胶质细胞正常状态下呈椭圆形和纺锤形,纺锤形细胞两端有两根细小突起[10];经OGD/R 处理后,小胶质细胞迅速激活,表现为胞体呈正圆形,胞质出现空泡,折光度增强,此为M1(经典型),可启动吞噬功能、分泌促炎因子[11]。经人参皂苷Rg1 和MCC950 处理48h 后,胞体缩小,细胞呈分支状,突起粗且长,此为M2(替代型),主要分泌抗炎因子和神经保护介质[12]。与ODG/R 组对比,人参皂苷Rg1 和MCC950 均可促进损伤激活的BV-2 小胶质细胞由M1 向M2 转化,起到了抑制炎症发展的作用。

图1 人参皂苷Rg1 和MCC950 对BV-2 小胶质细胞形态变化的影响Fig.1 Effect of ginsenoside Rg1 and MCC950 on morphological changes of BV-2 microglia cells.
2.2 Iba-1 免疫荧光法检测BV-2 小胶质细胞的活化情况
如图2 所示,Iba-1 通常作为活化的小胶质细胞标记物[13]。免疫荧光染色结果显示,Con 仅有少量细胞呈现Iba-1 绿色荧光,而OGD/R 组可见大量细胞呈现Iba-1 绿色荧光表达。提示经过缺氧缺糖/复供后大量小胶质细胞被激活。

图2 BV-2 小胶质细胞Iba-1 染色Fig.2 Iba-1 staining of BV-2 microglia cells.
2.3 CCK8 法检测BV-2 小胶质细胞增殖情况
如图3 所示,与Con 组比较,OGD/R 处理后,BV-2小胶质细胞增殖率显著增高;而经过人参皂苷Rg1 和MCC950 作用于OGD/R 处理后的BV-2 小胶质细胞48 h 后,BV-2 细胞的增殖率则呈现显著的下降趋势,且Rg1 3 个剂量之间有显著差异,但Rg1H 与MCC950之间无显著差异。

图3 各组BV-2 小胶质细胞增殖率改变与Con 组 比 较,**P<0.01;与OGD/R 组 比 较,##P<0.01;与Rg1L 组比较,ΔΔP<0.01;与Rg1M 组比较,▲▲P<0.01Fig. 3 Changes in the proliferation rate of BV-2 microglia in each group. Compared with Con group, **P<0.01; Compared with OGD/R group, ##P<0.01;Compared with Rg1L group, ΔΔP<0.01; Compared with Rg1M group, ▲▲P<0.01.
2.4 人参皂苷Rg1 对NLRP3、ASC、Caspase-1 蛋白表达的影响
如图4、6、8 所示,免疫荧光结果显示,Con 组仅见微弱的绿色荧光;经OGD/R 处理后呈现明显的绿色荧光表达;低、中、高浓度人参皂苷Rg1 和MCC950 作用于OGD/R 处理后的BV-2 小胶质细胞48 h,绿色荧光表达强度明显减弱;如图5、7、9 所示,免疫印迹法检测结果分析,与其它各组比较,OGD/R 组呈现最为明显的ASC、Caspase-1、NLRP3 表达条带。低、中、高剂量人参皂苷Rg1 和MCC950 作用于OGD/R 处理后的BV-2 小胶质细胞48h 后,细胞内NLRP3、ASC 蛋白表达明显下调,且Rg1 3 个剂量之间有显著差异,但Rg1H 与MCC950 之间无显著差异;Caspase-1 的表达与上述有些许不同,与Rg1L 组比较,Rg1M 和Rg1H的表达水平显著降低,但二者之间无显著差异,且与MCC950 组无显著差异。
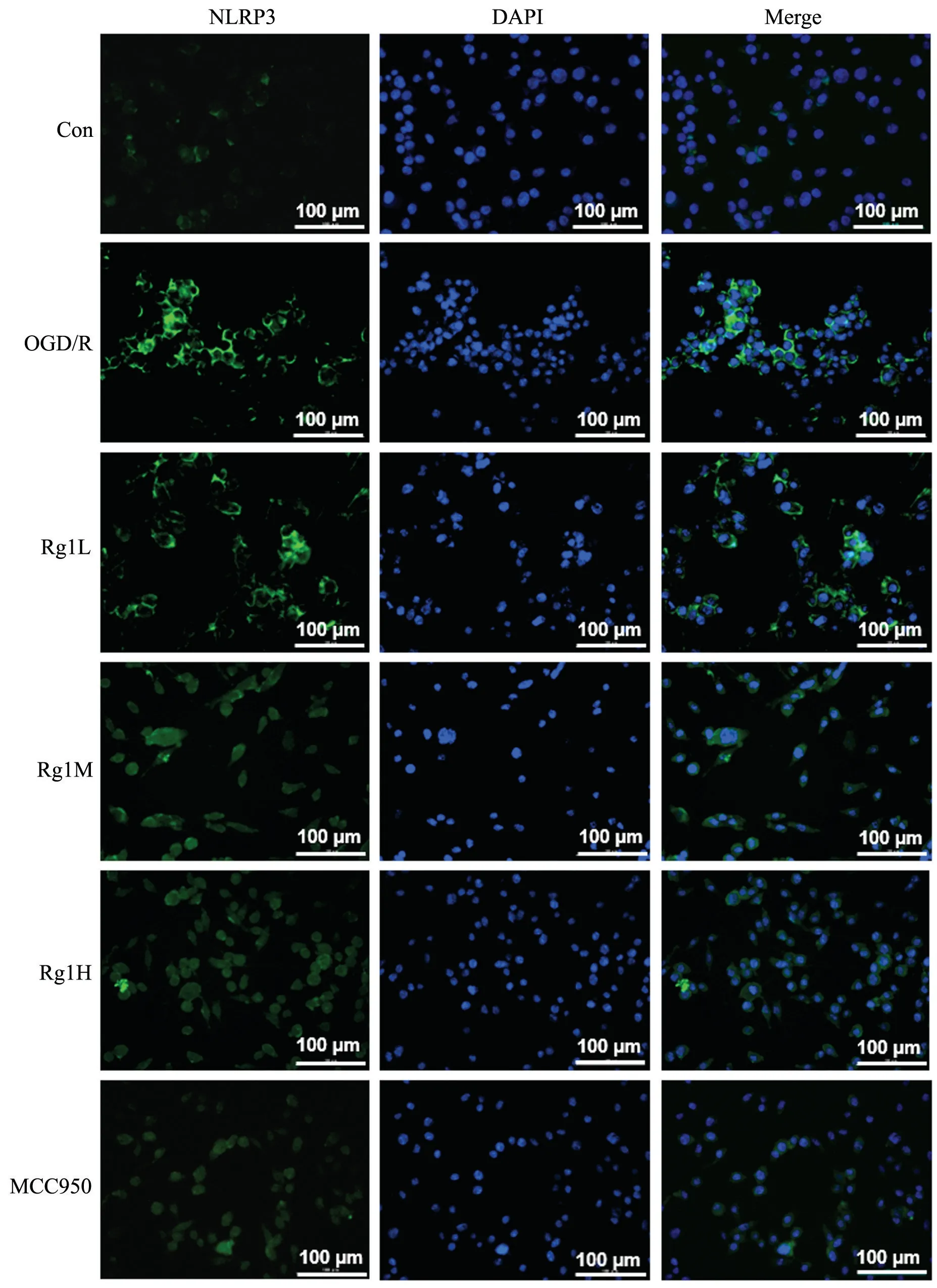
图4 免疫荧光法观察各组BV-2 小胶质细胞NLRP3 表达情况Fig.4 The expression of NLRP3 in BV-2 microglia detected by immunofluorescence.
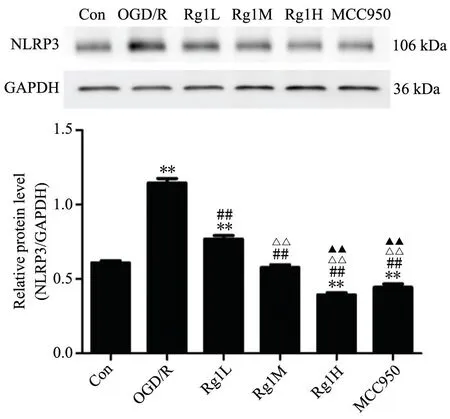
图5 免疫印迹法检测各组BV-2 小胶质细胞NLRP3 蛋白表达水平及柱状图与Con 组比较,**P<0.01;与OGD/R 组比较,##P<0.01;与Rg1L 组比较,ΔΔP<0.01;与Rg1M 组比较,▲▲P<0.01Fig.5 The protein expression level of NLRP3 in BV-2 microglia in each group detected by WB and the bar graph. Compared with Con group, **P<0.01; Compared with OGD/R group, ##P<0.01;Compared with Rg1L group, ΔΔP<0.01;Compared with Rg1M group, ▲▲P<0.01.

图6 免疫荧光法观察各组BV-2 小胶质细胞ASC 表达情况Fig. 6 The expression of ASC in BV-2 microglia detected by immunofluo rescence.

图7 免疫印迹法检测各组BV-2 小胶质细胞ASC 蛋白表达水平及柱状图与Con 组比较,**P<0.01;与OGD/R 组比较,##P<0.01;与Rg1L 组比较,ΔΔP<0.01;与Rg1M 组比较,▲▲P<0.01Fig. 7 The protein expression level of ASC in BV-2 microglia in each group detected by WB and the bar graph. Compared with Con group, **P<0.01; Compared with OGD/R group,##P<0.01; Compared with Rg1L group, ΔΔP<0.01;Compared with Rg1M group, ▲▲P<0.01.

图8 免疫荧光法观察各组BV-2 小胶质细胞Caspase-1 表达情况Fig.8 The expression of Caspase-1 in BV-2 microglia detected by immunofluorescence.
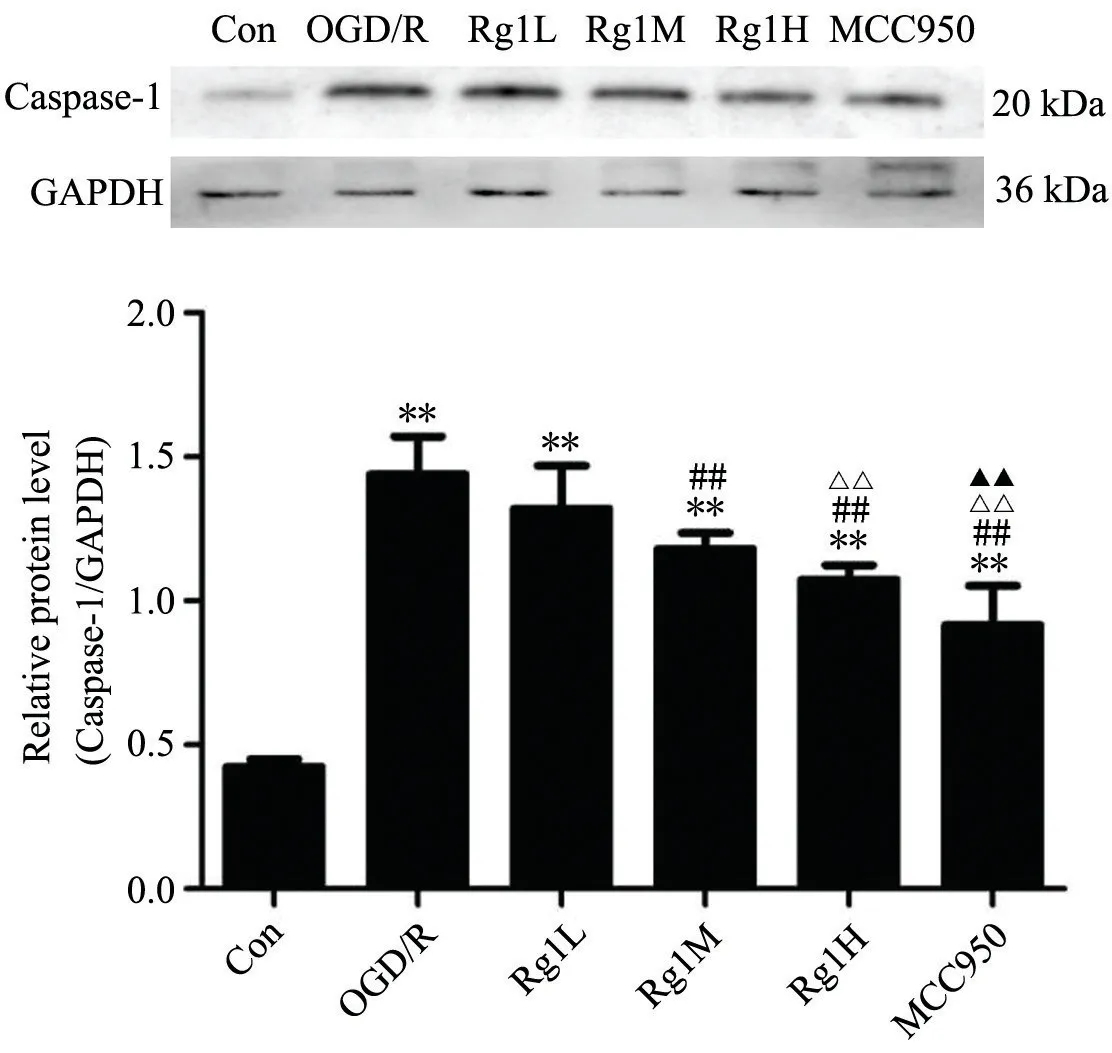
图9 免疫印迹法检测各组BV-2 小胶质细胞Caspase-1 蛋白表达水平及柱状图与Con 组比较,**P<0.01;与OGD/R 组比较,##P<0.01;与Rg1L 组比较,ΔΔP<0.01;与Rg1M 组比较,▲▲P<0.01Fig. 9 The protein expression level of Caspase-1 in BV-2 microglia in each group detected by WB and bar graph. Compared with Con group, **P<0.01; Compared with OGD/R group, ##P<0.01;Compared with Rg1L group,ΔΔP<0.01; Compared with Rg1M group, ▲▲P<0.01.
2.5 人参皂苷Rg1 对细胞因子IL-1β 和IL-18 表达的影响
ELISA 法检测结果如图10 所示,低、中、高剂量人参皂苷Rg1 和MCC950 作用于OGD/R 处理后的BV-2小胶质细胞48 h 后,细胞培养液中的IL-1β、IL-18 的表达明显下调。且Rg1 3 个剂量之间有显著差异,但均高于MCC950 组。
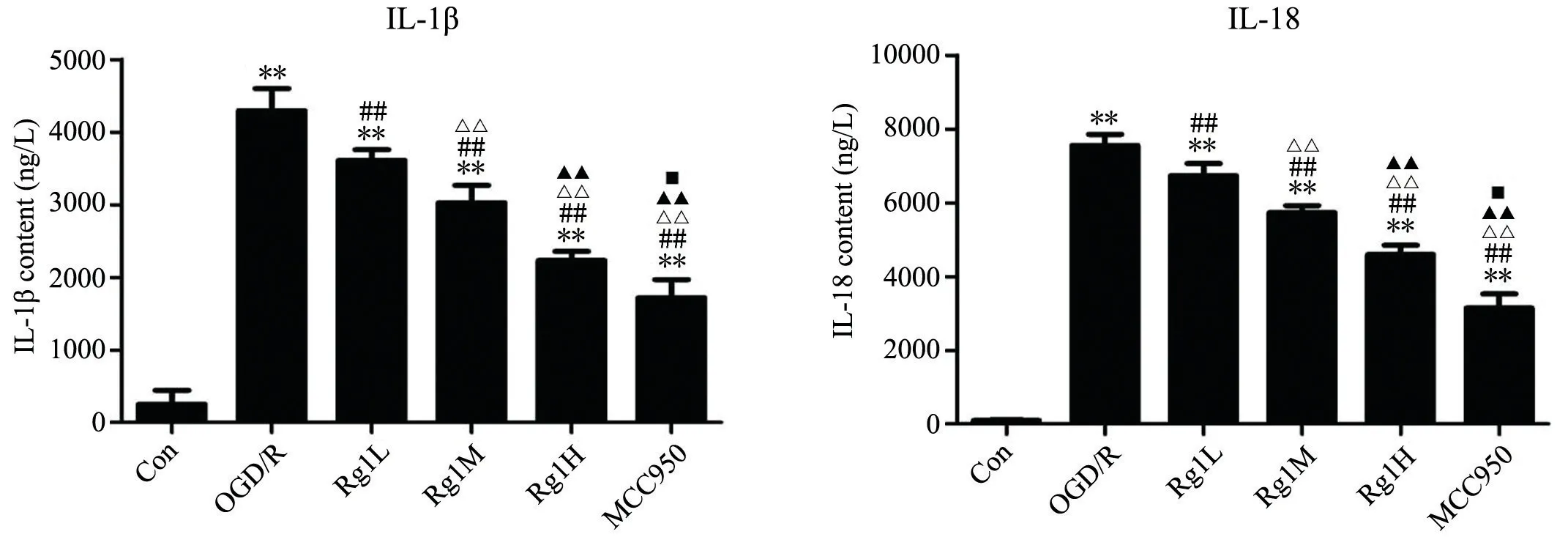
图10 各组BV-2 小胶质细胞培养液中IL-1β、IL-18 蛋白表达影响与Con 组比较,**P<0.01;与OGD/R 组比较,##P<0.01;与Rg1L 组比较,ΔΔP<0.01;与Rg1M 组比较,▲▲P<0.01;与Rg1H 组比较,■P<0.05Fig.10 Effect of IL-1β and IL-18 protein expression in the culture medium of BV-2 microglia cells in each group. Compared with Con group, **P<0.01; Compared with OGD/R group, ##P<0.01; Compared with Rg1L group, ΔΔP<0.01;Compared with Rg1M group, ▲▲P<0.01; Compared with Rg1H group, ■P<0.05.
3 讨论
脑缺血再灌注损伤是一种可严重影响缺血性脑卒中预后的病理生理过程,病变周围组织会出现细胞凋亡、线粒体自噬、严重的氧化应激反应和激烈的级联炎症反应[14]。大量实验已证实,脑缺血损伤后,缺血组织会产生严重的炎症反应,血流再通后,浸润的炎症细胞会产生大量炎症细胞因子加重组织损伤[15],因此控制炎症反应在缺血再灌注损伤中占有重要的位置。人参是指人参植物C.A.的根,是世界上使用历史最悠久、最广泛的草药产品之一。人参皂苷是人参中最重要的生物活性成分,其中人参皂苷Rg1 含量最高。Rg1 可减少脑缺血再灌注损伤后细胞坏死和凋亡,减轻细胞氧化应激和炎症反应,从而起到脑保护的作用[16]。
抵抗炎症反应,是减轻脑缺血再灌注损伤的重要一环。在脑缺血再灌注损伤初期的几个小时,复灌区小胶质细胞迅速聚集、增殖活化,启动吞噬功能,清除周围坏死细胞,分泌抗炎细胞因子和神经保护介质,发挥炎症反应的积极作用。随着病程的发展,小胶质细胞过度增殖活化,分泌促炎因子,加重组织损伤。因此控制小胶质细胞过度增殖活化是抑制脑缺血再灌注损伤炎症反应的首要任务[17]。CCK-8 检测结果显示,经OGD/R 处理后BV-2 小胶质细胞与对照组相比增殖能力明显增强,表明细胞激活。经不同浓度人参皂苷Rg1 处理后BV-2 小胶质细胞增殖效率明显下降,说明Rg1 可抑制细胞激活,且具有剂量依赖性。经过NLRP3 抑制剂MCC950 处理后的BV-2 小胶质细胞同样抑制了细胞增殖活化,提示了人参皂苷Rg1 可能是通过抑制NLRP3 炎症小体的激活从而抑制BV-2小胶质细胞活化。小胶质细胞活化分为M1(经典型)和M2(替代型)两种表型[18]。静息态的小胶质细胞呈“椭圆形”或“纺锤状”,形似眼睛,胞体两端发出细而短的突起。使用OGD/R 模型刺激BV-2 细胞后,细胞呈“阿米巴样”改变,胞体变大,突起回缩,细胞内出现空泡,此为M1 型[19]。经过不同浓度人参皂苷Rg1处理后,细胞变为“分枝状”,胞体较M1 型变小,突起增加,且与静息态相比突起较为粗长,此为典型M2型[20]。当用OGD/R 方法刺激BV-2 小胶质细胞时,细胞迅速由静息态转化为M1 型,M1 型为促炎状态,产生促炎细胞因子和趋化因子,具有神经毒性作用[21]。当加入人参皂苷Rg1 和MCC950 处理后,M1 型小胶质细胞逐渐转化为M2 型,表现为抗炎和吞噬功能,分泌抗炎细胞因子以及各种神经营养因子,同时吞噬细胞碎片,拮抗神经损伤[22]。M2 型小胶质细胞在抑制炎症,过敏反应,组织重塑,血管再生,免疫调节中和维护内环境稳态具有重要作用[23]。诸多因素可刺激静息状态小胶质细胞向M1 转化,其中NLRP3 炎症小体的蓄积是最重要的刺激因素之一[24]。从BV-2 小胶质细胞损伤后的形态变化,提示了人参皂苷Rg1 可能具有引导激活的小胶质细胞由M1型向M2型转化的能力,从而发挥抗炎功效,但是具体机制还有待研究。
炎症小体是先天免疫系统的固有受体,炎症小体主要由3 部分组成:NLRs、具有CARD 的凋亡相关斑点 蛋 白(apoptosis associated speck-like protein containing a CARD domain,ASC)以及包含半胱氨酸的天冬氨酸蛋白水解酶-1 前体(pro-cysteinyl aspartate specific proteinase 1,pro-caspase-1),NLRP3炎症小体是研究最为深入的炎症小体之一[25]。许多缺血再灌注损伤后的器官,例如脑,心脏,肾脏和睾丸缺血再灌注后均发现了NLRP3 炎症小体的蓄积[26]。NLRP3 广泛存在于多种细胞中,在神经系统内小胶质细胞是功能性NLRP3 炎症小体产生的主要场所[27]。已有实验证实抑制NLRP3 炎症小体途径介导的炎症反应,可显著改善脑缺血再灌注损伤[28]。
细胞内ROS 或ATP 蓄积到一定程度后会对下游NLRP3 产生刺激,形成蛋白复合体,该蛋白复合体由NLRP3 蛋 白,ASC 和pro-caspase-1 组 成,NLRP3 炎 性复合体也是pro-caspase-1 自我催化水解的平台,促使自身转化为成熟的Caspase-1。Caspase-1 能够刺激炎症因子IL-1β 和IL-18 释放,并参与到后续的炎症级联反应。我们的实验结果显示,经过OGD / R 诱导损伤 的BV-2 小 胶 质 细 胞 中,NLRP3、ASC 和 下 游 的caspase-1 及炎症因子IL-18、IL-1β 的表达水平均有所上升。而经过不同浓度人参皂苷Rg1 处理激活的BV-2 小胶质细胞后NLRP3 炎症小体及其下游产物caspase-1 均得到相应抑制,炎症因子IL-18,IL-1β 表达同样减少,与经典的NLRP3 炎症小体抑制剂MCC950 结果一致。
综上所述,人参皂苷Rg1 可抑制氧糖剥夺/复供损伤后BV-2 小胶质细胞炎症反应,可能与抑制NLRP3、ASC 和Caspase-1 蛋白的表达、干扰NLRP3 炎症小体合成,并减少相关炎症因子释放有关,但其分子机制还有待进一步研究。