黄芩苷通过PDGF/P38 MAPK 信号通路对肺动脉高压大鼠的保护作用
张晶晶, 王洪新*
锦州医科大学心血管药物重点实验室,辽宁 锦州 121001
肺动脉高压(pulmonary hypertension,PH)被定义为静息状态平均肺动脉压(mean pulmonary artery pressure,mPAP)≥25 mmHg[1]。肺部炎症、氧化应激和凋亡等发生,使得肺动脉压力异常增高,进而出现细胞增殖和病理性肺血管重构。P38 MAPK 作为重要的炎症分子,其磷酸化后可加速细胞凋亡发生,在PH发展中发挥重要作用[2]。研究表明,与健康成年人相比,PH 患者肺组织中血小板源生长因子(plateletderived growth factor,PDGF)水平显著升高;PDGF 可促进平滑肌细胞增殖、迁移,进而加速PH 进程[3];PDGF 通过激活P38 MAPK 途径诱导上皮-间质转化发生[4]。黄芩苷(Baicalin)作为黄芩的主要活性成分之一,具有抗动脉粥样硬化、保护心肌细胞和内皮细胞、抑制心肌重塑等药理作用[5]。黄芩苷可逆转野百合碱(monocrotaline,MCT)诱导的肺动脉高压大鼠的肺动脉重构,并抑制肺动脉中膜平滑肌细胞增殖[6],黄芩苷还可通过增强A2AR 活性下调PI3K/AKT 信号对临床PH 具有保护作用[7]。但黄芩苷对肺动脉高压的保护作用机制尚不明确。本研究以PDGF/P38 MAPK 信号通路为作用靶点探讨黄芩苷对PH 的保护作用和具体机制。
1 材料和方法
1.1 材料
1.1.1 药品与试剂 黄芩苷购自南京景竹生物科技有限公司(货号:21967-41-9),抗体bax,bcl-2 购自爱博克生物科技公司(货号:A19684,A11025),二氢乙锭染色液购自碧云天生物科技公司(货号:S0063),总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒和丙二醛(malondialdehyde,MDA)测定试剂盒购自南京建成生物技术有限公司(货号分别为:A001-3-2、A003-1-2),β-actin 抗体购自武汉三鹰生物技术有限公司(货号:66009)。
1.1.2 实验动物 健康雄性SD 大鼠40 只,体质量(200±10)g,由锦州医科大学实验动物中心提供,动物许可证号:SCXK(辽)2014-0004。
1.2 实验方法
1.2.1 实验分组 将40 只健康雄性SD 大鼠随机分为4 组:空白对照组(Control group)、模型组(Model group)、黄芩苷50 mg/kg 组(baicalin low-dose group)和黄芩苷100 mg/kg 组(baicalin high-dose group)。通过单次腹腔注射MCT(60 mg/kg)建立肺动脉高压模型。黄芩苷用0.5%羧甲基纤维素钠(CMC-Na)助溶,连续灌胃28 d,对照组0.5% CMC-Na 灌胃28 d。
1.2.2 右心导管法 通过对大鼠右颈静脉插管,采用多导生理记录仪进行数据采集,测定右心室收缩压(right ventricular systolic pressure,RVSP)和肺动脉平均压(mean pulmonary arterial pressure,mPAP)。将左心室壁(left ventricle,LV)、室间隔(spetum,S)和右心室壁(right ventricle,RV)称重,RV/(LV+S)即为右心肥厚指数(RVIH)。取左肺上叶用滤纸吸干水称重,为湿重(wet weight,W),放入烘箱80 °C 烘干72 h 称重,为干重(dry weight,D),W/D 即为肺干湿重比。
1.2.3 ELISA 法 按照ELISA 试剂盒说明书,测定大鼠血清中总超氧化物歧化酶(superoxide dismutase,SOD)、GSH-px、细胞间粘附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、血管细胞粘附分子-1(vascular cell adhesion molecule-1,VCAM-1)、IL-8 和IL-1β 含量。
1.2.4 DHE 染色法 根据DHE 试剂盒说明,检测大鼠肺组织肺组织活性氧(reactive oxygen species,ROS)的形成情况。
1.2.5 免疫荧光法 4%多聚甲醛固定肺组织,经石蜡包埋和切片后,进行高压抗原修复,0.5% Triton 浸泡20 min,5% BSA 封闭30 min。予以bax(1:500)和bcl-2(1:100)4 ℃孵育过夜,过夜后滴加相应荧光二抗,在荧光倒置显微镜下观察(避光),通过Image-Pro Plus 软件计算,平均荧光强度(mean density)=光密度总和(integrated optical density,IOD)/面积总和(area of interest,AOI)。
1.2.6 免疫蛋白印迹法 用裂解缓冲液(RIPA+1%PMSF)提取大鼠肺组织的蛋白。蛋白浓度用BCA蛋白检测试剂盒进行测定。将样品用10%~12%聚丙烯酰胺凝胶(SDS-PAGE)分离,转移至PVDF 膜上,用1% BSA 封闭1.5 h,然后与抗体P38 MAPK,PDGF 和β-肌动蛋白在4 ℃过夜孵育。用TBST 洗涤膜3 次,室温下二抗孵育2 h,结果用Image-J 软件进行分析。
1.3 统计分析
2 结果
2.1 黄芩苷对PH 大鼠血流动力学改善情况
与空白对照组比较,模型组大鼠mPAP、RVSP、RVHI 和W/D 显著升高(P<0.01);与模型组比较,黄芩苷(50 mg/kg 和100 mg/kg)大鼠mPAP、RVSP、RVHI和W/D 显著降低(P<0.01)(表1)。表明黄芩苷能够改善PH 大鼠血流动力学情况以及降低干湿重比值。
表1 黄芩苷对PH 大鼠血流动力学影响(±s,n=6)Tab.1 Effect of baicalin on hemodynamics in rats with PH (Mean±SD, n=6)
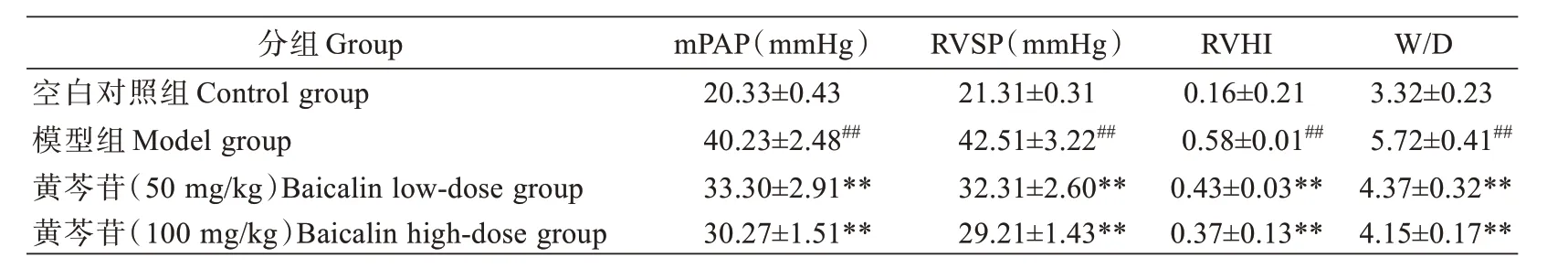
表1 黄芩苷对PH 大鼠血流动力学影响(±s,n=6)Tab.1 Effect of baicalin on hemodynamics in rats with PH (Mean±SD, n=6)
注:##P<0.01,与空白对照组比较** P<0.01,与模型组比较Note: Compared with Control group, ##P<0.01; Compared with Model group,**P<0.01).
W/D分组Group mPAP(mmHg)RVSP(mmHg)RVHI 3.32±0.23 5.72±0.41##4.37±0.32**4.15±0.17**空白对照组Control group模型组Model group黄芩苷(50 mg/kg)Baicalin low-dose group黄芩苷(100 mg/kg)Baicalin high-dose group 20.33±0.43 40.23±2.48##33.30±2.91**30.27±1.51**21.31±0.31 42.51±3.22##32.31±2.60**29.21±1.43**0.16±0.21 0.58±0.01##0.43±0.03**0.37±0.13**
2.2 黄芩苷减轻PH 大鼠炎症反应
与空白对照组比较,模型组大鼠血清中IL-18、IL-1β、ICAM-1 和VCAM-1 炎症因子表达水平显著升高(P<0.01);与模型组比较,黄芩苷(50 mg/kg 和100 mg/kg)大鼠血清中IL-18、IL-1β、ICAM-1 和VCAM-1炎症因子表达水平降低(P<0.01)(表2)。表明黄芩苷能够减轻PH 大鼠炎症反应。
表2 黄芩苷对PH 大鼠血情中炎症因子影响(±s,n=8)Tab.2 Effects of baicalin on serum inflammatory factors in rats with PH (Mean±SD, n=8)
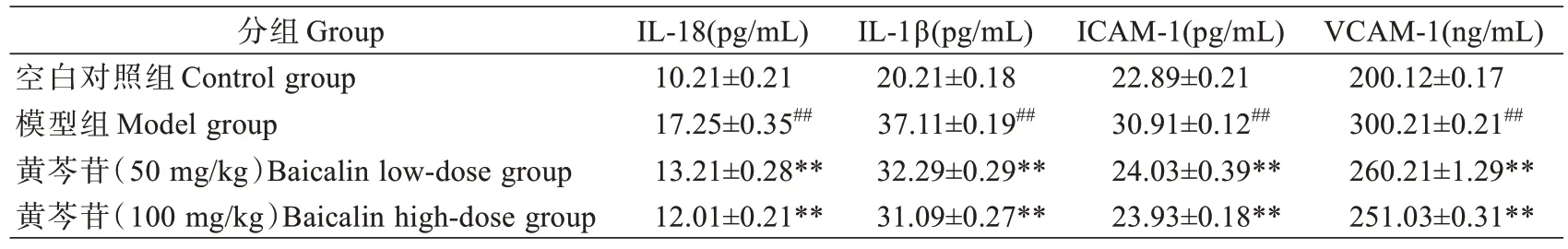
表2 黄芩苷对PH 大鼠血情中炎症因子影响(±s,n=8)Tab.2 Effects of baicalin on serum inflammatory factors in rats with PH (Mean±SD, n=8)
注:##P<0.01,与空白对照组比较**P<0.01,与模型组比较Note: Compared with Control group, ##P<0.01; Compared with Model group, **P<0.01.
VCAM-1(ng/mL)200.12±0.17 300.21±0.21##260.21±1.29**251.03±0.31**分组Group空白对照组Control group模型组Model group黄芩苷(50 mg/kg)Baicalin low-dose group黄芩苷(100 mg/kg)Baicalin high-dose group IL-18(pg/mL)10.21±0.21 17.25±0.35##13.21±0.28**12.01±0.21**IL-1β(pg/mL)20.21±0.18 37.11±0.19##32.29±0.29**31.09±0.27**ICAM-1(pg/mL)22.89±0.21 30.91±0.12##24.03±0.39**23.93±0.18**
2.3 黄芩苷抑制PH 大鼠氧化应激
与空白对照组比较,模型组大鼠肺组织中ROS水平显著升高(P<0.01),血清中SOD 和GSH-px 表达水平显著降低(P<0.01);与模型组比较,黄芩苷(50 mg/kg 和100 mg/kg)大 鼠ROS 水 平 显 著 降 低(P<0.01),血清中SOD 和GSH-px 表达水平显著升高(P<0.01)(图1)。说明黄芩苷能够抑制PH 大鼠氧化应激。
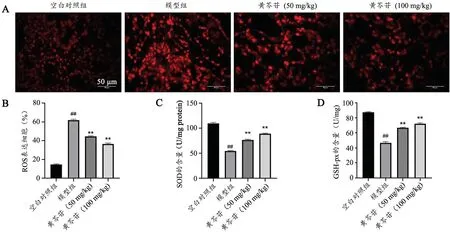
图1 黄芩苷对PH 大鼠氧化应激影响(±s,n=6)A:各组大鼠肺组织ROS 形成情况B:各组大鼠肺组织ROS 统计学情况C:各组大鼠血清中SOD 含量D:各组大鼠血清中GSH-px 含量##P<0.01,与空白对照组比较**P<0.01,与模型组比较Fig.1 Effect of baicalin on oxidative stress in rats with PH (Mean±SD, n=6). A: ROS levels in lung tissues of rats in each group; B:ROS statistical results in lung tissues of rats in each group; C: SOD content in serum of rats in each group; D:GSH-px content in serum of rats in each group. Compared with Control group, ##P<0.01; Compared with Model group, **P<0.01.
2.4 黄芩苷对PH 大鼠内皮细胞凋亡影响
与空白对照组比较,模型组大鼠肺组织中bax 阳性细胞显著增多,bcl-2 阳性细胞显著减少,且bax/bcl-2 显著增大;与模型组比较,黄芩苷(50 mg/kg 和100 mg/kg)大鼠肺组织中bax 阳性细胞显著减少,bcl-2 阳性细胞显著增多,且bax/bcl-2 显著降低(图2)。说明黄芩苷能够抑制PH 大鼠肺组织内皮细胞凋亡。
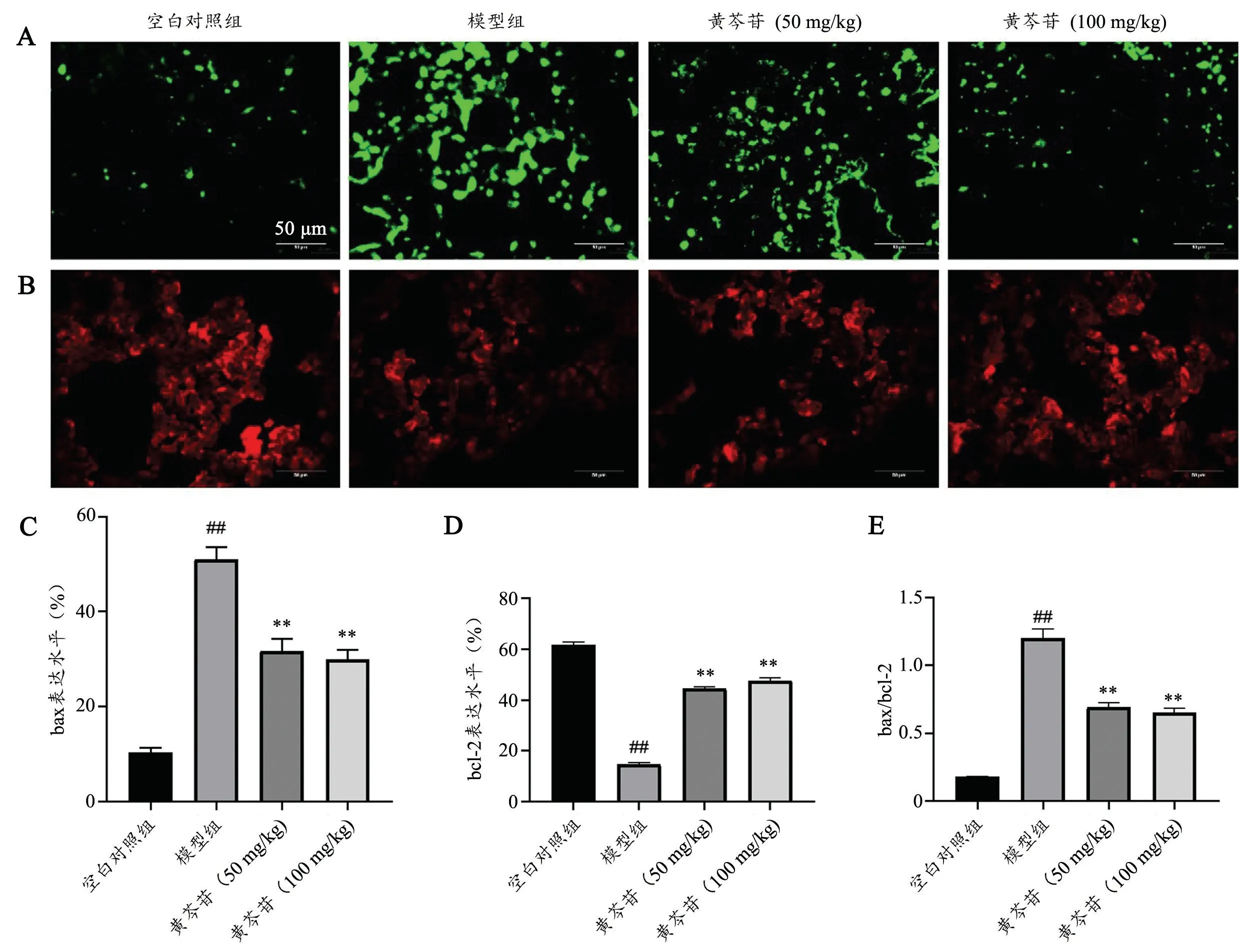
图2 黄芩苷对PH 大鼠内皮细胞凋亡影响(±s,n=6)A:各组大鼠肺组织bax 免疫荧光染色B:各组大鼠肺组织bcl-2 免疫荧光染色C:bax 统计学情况D:bcl-2 统计学情况E:bax/bcl-2 统计学情况##P<0.01,与空白对照组比较** P<0.01,与模型组比较Fig.2 Effect of baicalin on apoptosis of endothelial cells in rats with PH (Mean±SD, n=6). A: Immunofluorescence staining of bax in lung tissues of rats in each group; B: Immunofluorescence staining of bcl-2 in lung tissues of rats in each group; C: Statistical result of bax; D: Statistical result of bcl-2; E: Statistical result of bax/bcl-2; Compared with Control group, ##P<0.01; Compared with Model group, **P<0.01.
2.5 黄芩苷通过PDGF/P38 MAPK信号通路发挥作用
与空白对照组比较,模型组大鼠肺组织中PDGF和P38 MAPK 蛋白含量显著降低,与模型组比较,黄芩苷(50 mg/kg 和100 mg/kg)大鼠肺组织中PDGF 和P38 MAPK 蛋白含量显著升高(图3)。表明黄芩苷可能通过PDGF/P38 MAPK 信号通路为靶点发挥作用。
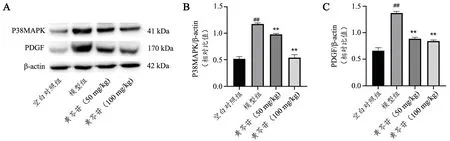
图3 黄芩苷对PDGF/P38 MAPK 信号通路影响(±s , n=3)A:免疫蛋白印迹检测PDGF 和P38 MAPK 蛋白表达代表图 B:各组大鼠肺组织P38 MAPK 相对表达量 C:各组大鼠肺组织PDGF 相对表达量 ##P<0.01,与空白对照组比较** P<0.01,与模型组比较Fig.3 Effects of baicalin on PDGF/P38 MAPK signaling pathway(Mean±SD, n=3). A: Western blot detection of PDGF/P38 MAPK protein expression; B: The relative expression of P38 MAPK in lung tissue of rats in each group; C: The relative expression of PDGF in lung tissue of rats in each group; Compared with Control group, ##P<0.01; Compared with Model group, **P<0.01.
3 讨论
肺动脉高压(PH)是一种影响肺动脉和静脉循环以及右心室功能的疾病[8]。本实验通过单次腹腔注射MCT 建立大鼠肺动脉高压模型,表明MCT 可选择性地损伤内皮细胞诱导肺动脉高压形成。PH 发生时,出现肺部炎症、氧化应激和凋亡等,使得肺动脉压力异常增高,进而出现细胞增殖和病理性肺血管重构。某些细胞因子和趋化因子,包括白介素IL-1β,IL-6,IL-8 和单核细胞趋化蛋白,其循环水平在PH 患者中异常升高[9]。另有研究表明,血清中细胞间粘附分子-1(intercellular cell adhesion molecule-1,ICAM-1)和血管细胞粘附分子-1(vascular cell adhesion molecule-1,VCAM-1)水平升高可能是系统性硬化症合并肺动脉高压的标志[10]。大量实验表明,在肺动脉高压发展过程中,机体氧化系统(ROS)与抗氧化系统(SOD 和GSH-px)的失衡,使得内皮细胞激活,致氧化应激发生,并加重内皮功能障碍、凋亡和平滑肌细胞增殖,进而使肺血管持续收缩,加重肺动脉压力升高[11]。本实验表明:黄芩苷给药组大鼠中,mPAP、RVSP、RVHI 和W/D 显著降低,说明黄芩苷能够改善PH 大鼠血流动力学情况且降低肺干湿重比值;血清中IL-18、IL-1β、ICAM-1 和VCAM-1 炎症因子水平显著降低,说明黄芩苷能够减轻PH 大鼠炎症反应;肺组织中ROS 水平显著降低,血清中SOD 和GSH-px 表达水平显著升高,说明黄芩苷能够改善PH 大鼠氧化应激;肺组织中bax 阳性细胞显著减少,bcl-2 阳性细胞显著增多,且bax/bcl-2 显著降低,说明黄芩苷能够抑制PH 大鼠内皮细胞凋亡。因此黄芩苷对野百合碱诱导的肺动脉高压具有保护作用。
P38 MAPK 信号通路是MAPK 通路的重要分支,其作为重要的炎症分子,磷酸化后可加速细胞增值、凋亡的发生,在PH 发展中发挥重要作用[12]。在PH 患者重塑的肺小动脉中表现出βPDGF 受体(βPDGFR)表达增强和磷酸化,PDGF 能够诱导PH 中肺血管重构[13]。PDGF 还可促进平滑肌细胞增殖、迁移,进而加速PH 进程[14]。研究表明:辣椒素预处理能够减轻P38 MAPK 途径介导的PH 大鼠炎症反应,逆转PH 发展[15]。PDGF 通过激活P38 MAPK 途径诱导上皮-间质转化发生[4]。因此推测黄芩苷可能通过PDGF/P38 MAPK 信号通路为保护PH 的作用靶点。结果表明,黄芩苷治疗后,野百合碱诱导的PH 大鼠肺组织中PDGF 和P38 MAPK 的蛋白含量显著减少。进一步说明,黄芩苷可通过PDGF/P38 MAPK 信号通路对肺动脉高压大鼠起保护作用。