饮用水中高分子量消毒副产物的检测识别方法*
韩亮亮 赵佳焱 李梦媛 董慧峪 楚文海 周 庆 施 鹏 潘 旸**
(1.污染控制与资源化研究国家重点实验室,南京大学环境学院,南京,210023;2.中国科学院饮用水科学与技术重点实验室,中国科学院生态环境研究中心,北京,100085;3.污染控制与资源化研究国家重点实验室,同济大学环境科学与工程学院,上海,200092)
饮用水消毒始于20 世纪初[1],它能有效杀灭水中的微生物病原体,大大降低了人们因饮水而感染痢疾、霍乱等水传播疾病而致死的几率,是人类公共卫生领域的一次重大突破.然而,在饮用水消毒工艺中,氯、氯胺等化学消毒剂可与水源水中的天然有机物(NOM)反应生成消毒副产物(DBPs)[2−4].毒理学和流行病学研究已经证明,饮用水DBPs 具有细胞毒性和遗传毒性,并且与癌症、流产和出生缺陷等风险呈正相关[5−8].尽管研究人员已在饮用水中发现700 多种DBPs[9],但已知DBPs 均为分子量小于800 Da 的低分子量DBPs,仍有超过50%的DBPs 处于未知状态[10−11].Kopfler 等[12]通过超滤实验证明了高分子量DBPs 的存在,且沙门氏菌突变试验表明DBPs 中高分子量组分有显著的致突变作用,从而证实了高分子量DBPs 的生物毒性.Zhang 等[13−14]研究发现,高分子量氯代DBPs 的平均分子量约为2000 Da 且分子量分布高度分散.由此可见,高分子量DBPs 是DBPs 的重要组成部分,亟需对其进行进一步探索.
目前对饮用水DBPs 的检测识别主要集中于小分子DBPs,而对单个高分子量DBPs 的检测与识别还非常缺乏.气相色谱/质谱法(GC/MS)是目前对于DBPs 常用的检测方法,但是GC/MS 不适合鉴定极性/亲水/非挥发性衍生物,尤其不适合鉴定高分子量化合物[15].而液相色谱/质谱法(LC/MS)对无机盐耐受程度低[16],并且电喷雾电离等电离方式会产生多电荷离子[17],这又会给未知DBPs 的识别带来很大挑战.因此,研究高分子量DBPs 的关键是选择合适的检测方法.基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)是测定高分子量物质的摩尔质量和摩尔质量分布的最有用的分析技术之一[18−20],并因其速度快,使用方便,灵敏度高,杂质耐受度较高,已被广泛应用在微生物、蛋白质、聚合物等大分子物质的检测领域[21−25].MALDI 是一种比电喷雾电离(ESI)更温和的电离技术,几乎只产生单电荷分子离子,能电离极性分子和非极性分子.MALDI-TOF MS 在分析中能够保持高分子量化合物的完整[26],同时具有高分辨率质谱的优势,具有较高的质量精度和分辨率[24].因此MALDI-TOF MS 对高分子量DBPs 样品的识别具有巨大潜力.
MALDI-TOF MS 的检测条件(如基质、阳离子化试剂、沉积方法、激光能量、检测模式等)应根据目标样品进行选择[27−28].尽管目前文献中已有一些样品制备和检测方法,但是由于高分子量DBPs 的结构未知,且分子量分散、结构复杂,如何针对其性质找到最佳的样品制备方案和仪器条件仍然是一个挑战.因此,筛选合适的基质、阳离子化试剂、仪器参数和点靶方法等,是基于MALDI-TOF MS 的高分子量DBPs 检测方法的关键.在没有大量精确数据的情况下,识别未知物质是一项非常具有挑战性的工作.仅使用低分辨率质谱,未知DBPs 可能有许多分子式(分子量在800 Da 以上的化合物则会有更多可能的分子式),且每个分子式都有多种可能结构.高分辨率质谱可以提供精确的质荷比(通常是小数点后3 位或4 位),这大大缩小了分子式的选择范围[29].MALDI-TOF MS 作为一种高分辨率质谱(HRMS),凭借超高分辨率可以明确地分配每种物质的元素组成.MALDI-TOF MS 还可以提供TOF/TOF 串联质谱,分析碎片离子的组成,从而得到分子的结构信息.因此MALDI-TOF MS 为高分子量DBPs 分子式和结构式的识别提供了可能.
本研究率先在高分子量DBPs 的检测中引入了MALDI-TOF MS,建立了未知高分子量DBPs 的检测方法,从检测模式、基质、激光强度、阳离子化试剂、点靶方法等进行优化,提高了未知高分子量DBPs 的响应信噪比(S/N),改善了样品间测量的重现性;在检测基础上,通过高分辨质谱数据、同位素模式分析、TOF/TOF 串联质谱提供的结构信息以及SciFinder 数据库,建立了高分子量DBPs 的分子式/结构式识别方法.
1 材料与方法(Materials and methods)
1.1 实验仪器与试剂
实验仪器:美国Bruker Daltonics 公司UltrafleXtreme 基质辅助激光解析飞行时间质谱仪;美国FEI 公司Quanta FEG 250 Environmental 扫描电子显微镜;美国Labacoco 公司CentriVap 离心真空浓缩机;美国Thermo Fisher Scientific 公司Barnstead Micropure 超纯水机.
实验所用试剂纯度均为质谱纯、色谱纯或优级纯.超级2,5-二羟基苯甲酸(Super-DHB,2,5-二羟基苯甲酸和 2-羟基-5-甲氧基苯甲酸的9:1 混合物)、α-氰基-4-羟基肉桂酸(CHCA)、地蒽酚(DIT)、2,4,6-三羟基苯乙酮(THAP)、芥子酸(SA)、2-(4-羟基苯基偶氮)-苯甲酸(HABA)、3-吲哚丙烯酸(IAA)、可溶性淀粉购自Sigma-aldrich 公司.反-2-[3-(4-叔丁基苯基)-2-甲基-2-亚丙烯基]丙二腈(DCTB)、三氟乙酸钠(NaTFA)、氯化钾(KCl)购自Tokyo Chemical Industry 公司.三氟乙酸银(AgTFA)购自J&K Scientific 公司.次氯酸钠(NaClO)储备溶液购自Sigma-aldrich 公司,并通过DPD 亚铁滴定法进行标准化[30].本研究中使用的其他所有化学品均从Sigma-Aldrich 公司购买.
1.2 氯化消毒
为简化实验过程,本研究选择淀粉作为模型天然高分子量有机物,在实验室条件下进行消毒.淀粉是分子结构为(C6H10O5)nŸH2O 的聚合碳水化合物.淀粉分子式为(C6H10O5)nŸH2O,广泛存在于藻类细胞、细胞外有机物中,是自然界中广泛存在的一种天然有机物[31−33].淀粉作为常用消毒场景下的模型化合物[31,34−35],其组成简单,结构已知,已被广泛应用在MALDI-TOF MS 检测中,因此是理想的高分子量DBPs 的前体物.
为验证消毒样品中高分子量DBPs 的产生,本研究中配制了以下模拟饮用水水源水水样:向1 L 超纯水中加入可溶性淀粉(5 mg·L−1以C 计)、NaHCO3(90 mg·L−1以CaCO3计)制备模拟原水样品.然后,向模拟原水样品加入2.0 mg·L−1NaClO(以Cl2计)进行氯化,并在20 ℃避光条件下无顶空接触24 h.通过 DPD 亚铁滴定法测量每个模拟饮用水样品中的氯残留量,并立即用硫代硫酸钠终止反应.将未消毒的模拟水样作为对照组,超纯水作为空白组.3 个实验组分别设置3 个平行样品.
1.3 水样预处理
样品预处理对于解决污染问题以及使用MALDI-TOF MS 来分析复杂的样品混合物很有帮助[36−37].首先利用离心真空浓缩机将1 L 水样浓缩10 mL,随后将水样放入经过预处理的透析袋(美国MYM 公司透析袋;截留分子量为500 Da)中脱盐.水样脱盐程序基于先前的研究[38].脱盐完成后,使用离心真空浓缩机对水样进行再次浓缩至0.5 mL,得到浓缩水样.
1.4 MALDI-TOF MS 分析
所有质谱均使用配备355 nm Nd:YAG 的Bruker Daltonics 公司UltrafleXtreme MALDI-TOF MS 质谱仪获得.分子量检测范围设置为500—5000 Da,以排除由低质量离子产生的高强度信号,并覆盖模型化合物整个质量分布范围,研究质量范围为 800—5000 Da.每个质谱是通过在样品的均匀区域上随机获得的,每个质谱总共有2000 次激光射击.使用flexAnalysis Version 3.4 质谱软件处理质谱数据.
1.4.1 基质配制与检测器参数比选的样品制备
将DHB、THAP、CHCA、DIT、SA、DCTB、HABA 和IAA 分别称重并溶解在TA30(H2O:乙腈=70:30,V/V,含0.1% TFA)中,制成20 mg·mL−1溶液.将阳离子化试剂称重并溶解在TA30 中以制备5 mg·mL−1溶液.以浓缩水样/基质/阳离子化剂为5/10/1(V/V/V)的混合比制备每一个质谱样品.然后将3 μL 样品沉积在MALDI 靶板上,并在环境条件下干燥,分别进行反射-正离子、反射-负离子、线性-正离子、线性-负离子4 种检测模式的不同激光强度下的检测.确定基质种类、检测模式以及激光强度后,则进一步对基质浓度进行优化.将不同浓度的基质溶液(浓度设置为0、5、10、20、30、40、50 mg·mL−1),与浓缩样品、5 mg·mL−1阳离子化试剂混合(负离子模式下不添加阳离子化试剂).进行上述实验时,使用干点法[39]点靶,阳离子化试剂为5 mg·mL−1NaTFA,检测器m/z 范围设置为500—5000 Da.
1.4.2 阳离子化试剂比选的样品制备
阳离子化试剂的作用则是通过阳离子加合物提高分析物的灵敏度和响应强度[18].根据1.4.1 节确定的基质、激光能量和检测模式,使用干点法将浓缩样品/基质/阳离子化剂按照5/10/1(V/V/V)分别与NaTFA、KCl 和AgTFA 混合.确定最佳阳离子化试剂种类后,将最佳阳离子化试剂配制为不同浓度的溶液(浓度设置为0、0.5、1、2、5、10、20、50 mg·mL−1),与浓缩样品、20 mg·mL−1基质溶液混合,干点法制备质谱样品.
1.4.3 不同点靶方法比选的样品制备
确定基质、激光能量、检测模式和阳离子化试剂后,本研究使用4 种不同的沉积方法,同时确保等量的分析物和基质进行MALDI-TOF MS 分析:(1)干点法(混合法),将浓缩水样和基质首先以体积比1:2 混合,然后将3 μL 所得样品点样到靶板上,自然风干;(2)薄层法(底层法),将2 μL 基质施加到靶板上,干燥后将1 μL 浓缩水样滴加在基质上并使其干燥;(3)种子层法,将1 μL 基质施加到靶板上,自然风干后,将浓缩水样和基质等体积混合的2 μL 样品点样到靶板上并让样品干燥;(4)三明治法(夹层法),将1 μL 基质点样到靶板上,干燥后,将1 μL 浓缩水样滴加到基质层上并使其干燥,最后将1 μL 基质点样到样品上.
1.5 扫描电子显微镜(SEM)
Quanta FEG 250 Environmental SEM 用于评估不同点靶方式干燥后样品的表面分布.SEM 图像是在高真空(130 Pa)下以200 倍放大倍数获得的,电子束以10 kV 电压和238 μA 电流运行.
1.6 高分子量DBPs 的识别
只在消毒水样(n=3)中重复出现、未消毒和空白水样中不存在的质谱出峰视为DBPs.因此,仅根据存在和不存在而不是出峰的高度差异,来确定形成的DBPs.根据高分子量DBPs 的同位素模式,判断结构中是否存在卤素(即Cl),从而对其进行进一步识别.对于质谱数据的处理,使用美国Bruker Daltonics 公司开发的质谱分析软件flexAnalysis Version 3.4 将特定的分子式分配给质谱中高分子量DBPs 的分子离子.分子式计算需要满足“氮原则”,元素个数约束需要根据分子量来确定,质量误差设为±10×10−6.同时需要舍弃不切实际的C、H、O 比例的分子式,只考虑C、H、O>0、0≤O/C≤1、0≤H/C≤2.5、双键当量(DBE)≥0 的分子式[40].软件计算进行分子式赋值后,随后根据文献报道的可能反应产物以及SciFinder 数据库进行合理性验证.
2 结果与讨论(Results and discussion)
2.1 基于MALDI-TOF MS 的高分子量DBPs 检测方法建立
建立高质量和可靠的MALDI-TOF MS 检测方法需要考虑许多因素,其中主要影响因素有基质(种类和浓度)、阳离子化试剂(种类和浓度)、激光能量、检测模式(线性/反射模式,正离子/负离子模式)以及点靶方式等[41].本研究比较了两个参数来评估高分子量DBPs 的出峰效果:信噪比和变异系数(CV)[42].信噪比反映了质谱出峰信号的强弱,CV 值则反映了结果的重现性的好坏.两个参数都是根据消毒水样中出现的新峰信噪比之和计算的.
2.1.1 基质、检测模式和激光强度的确定
基质在MALDI 分析中非常重要,因为它既是激光能量吸收剂,也是能量传输的工具.此外,理想的基质应具有以下特性:在所用波长处具有高电子吸收、良好的真空稳定性、低蒸气压以及与分析物的良好互溶性,从而导致均匀的共结晶[18].CHCA、DHB 和THAP 基质已被用于模型化合物淀粉的分析[43−45].SA、DCTB、DIT、HABA 和 IAA 作为常用基质也被纳入基质筛选的范畴.NaTFA 被用作基质比选阶段的阳离子化试剂.表1 显示了8 种基质的检测新的DBPs 的结果.通过对消毒前后水样的逐一比对发现,以SA、DCTB、DIT、HABA 和 IAA 为基质未检测到新峰,表明这些基质不适合淀粉的高分子量DBPs 分析,而DHB、CHCA 和THAP 均在反射-正离子模式下检测到了高分子量DBPs.以DHB 为基质,检测模式为反射-正离子模式时,高分子量DBPs 出峰信噪比远高于THAP 和CHCA,并且CV 值更小,结果重现性更好,因此以DHB 为基质,检测模式为反射-正离子模式时,高分子量DBPs 出峰效果最好.图1 为以DHB 为基质,检测模式为反射-正离子模式,激光强度设置为90%时,模拟水样消毒前后的全局对比图.图2 为m/z 889.2478、1051.3018、1213.3578、1375.4115 和1537.4675 的5 种高分子量DBPs 出峰情况.
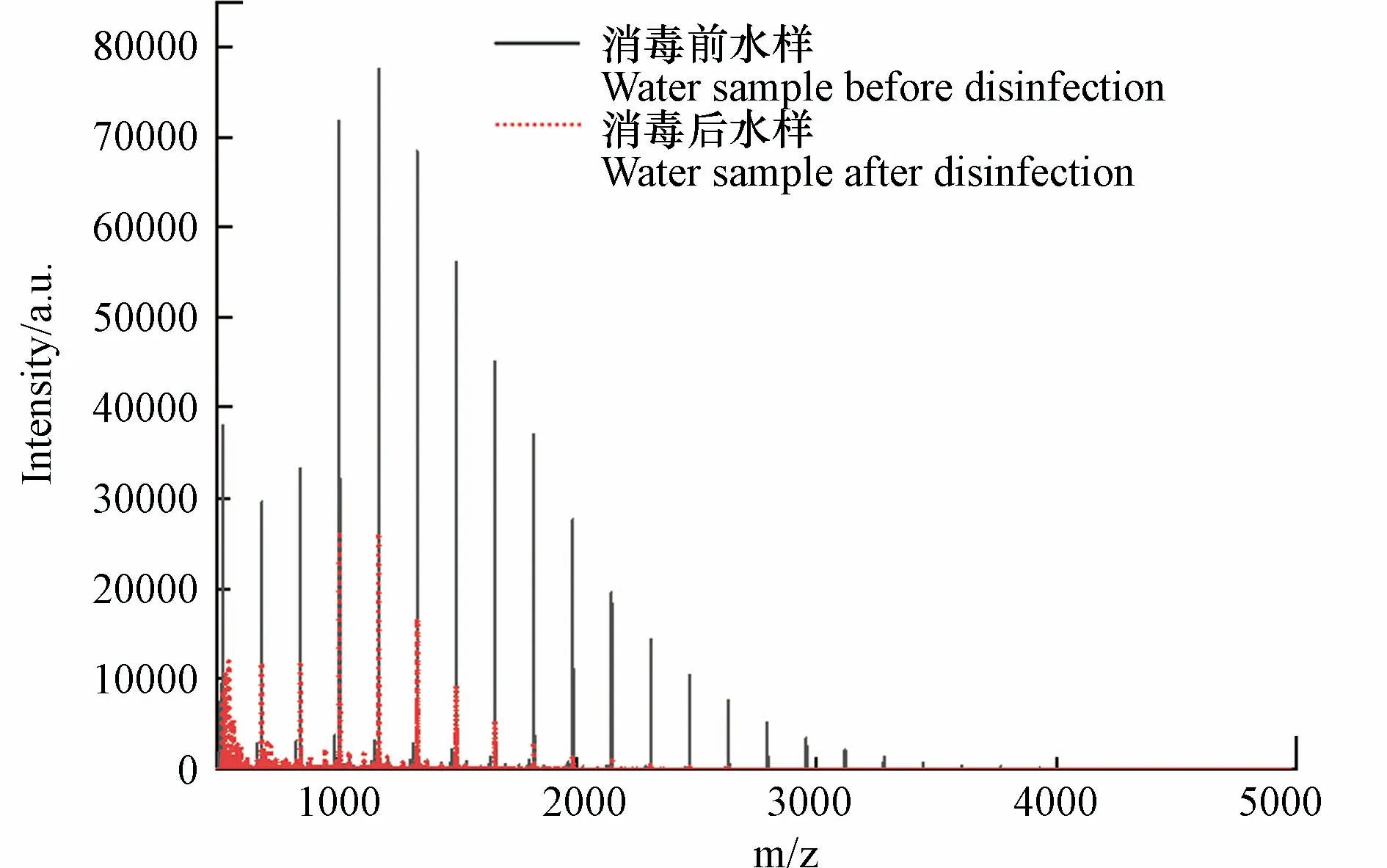
图1 模拟水样消毒前后在m/z 500—5000 的质谱出峰全局对比Fig.1 Global comparison of mass spectrometry peaks at m/z 500—5000 before and after disinfection of simulated water samples
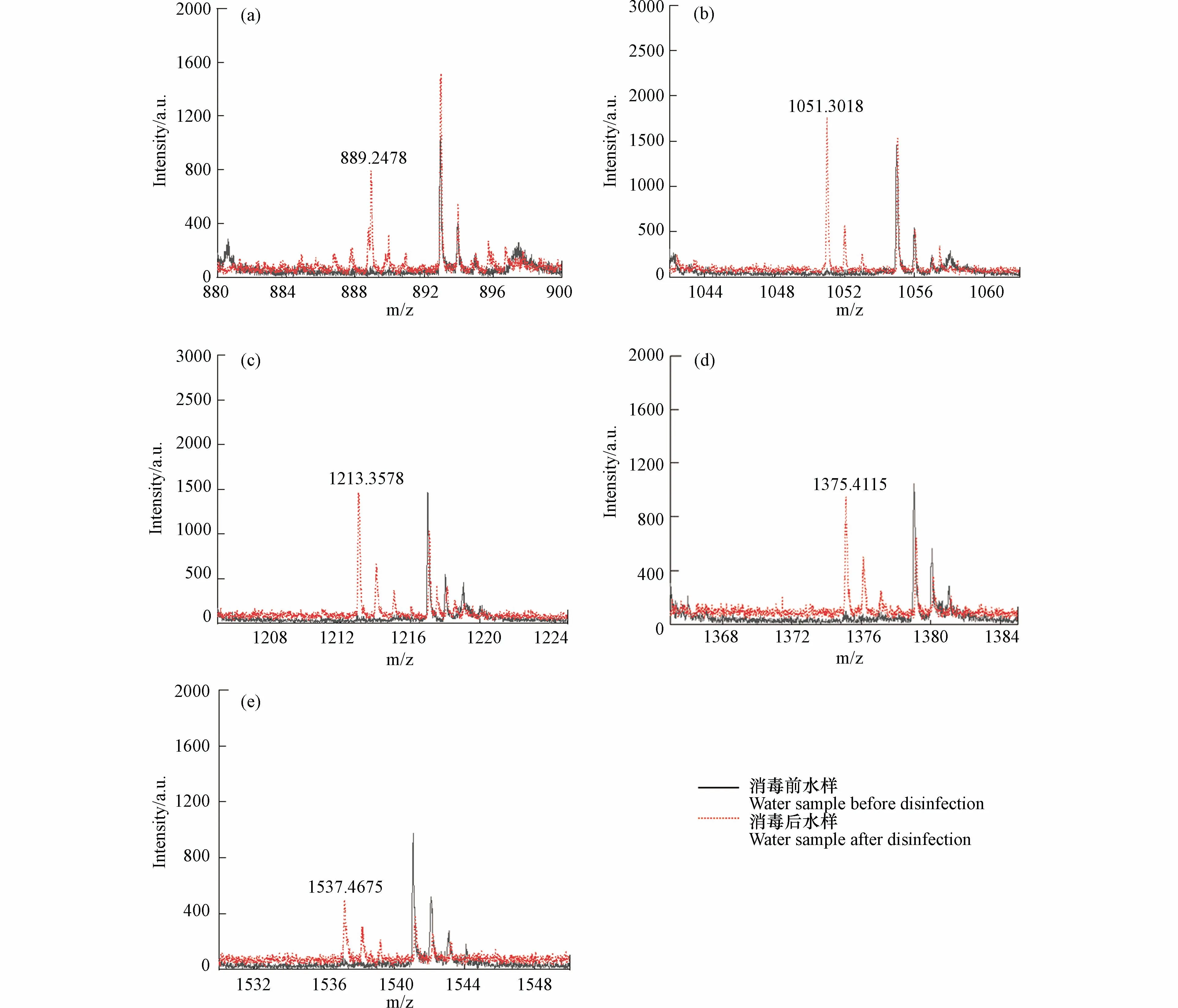
图2 (a)m/z 889.2478;(b)m/z 1051.3018;(c)m/z 1213.3578;(d)m/z 1375.4115;(e)m/z 1537.4675 处的5 种高分子量DBPs 出峰情况Fig.2 Peaks of 5 high molecular weight DBPs at(a)m/z 889.2478;(b)m/z 1051.3018;(c)m/z 1213.3578;(d)m/z 1375.4115;(e)m/z 1537.4675
高分子量DBPs 在负离子模式下无法出峰可能是由于高分子量DBPs 去质子化([M-H]-)的能力较弱.此外,DHB 作为基质时,高分子量DBPs 信噪比远高于其他基质.此外,通过将信噪比的标准偏差除以平均信噪比来计算它们的CV 值,且使用DHB 基质时,DBPs 信噪比的CV 值更小说明共结晶的均匀性更好,结果重现性更好.然而这些峰的信噪比不高,信号重现性较差.因此针对高分子量DBPs 的MALDI-TOF MS 检测方法亟待建立.
激光能量是决定解吸和阳离子化样品数量的一个关键因素,激光能量较低时,响应信噪比会显著降低或者无信号,过高的能量则可能会破坏样品,从而降低信噪比,而激光能量对信噪比影响的差异可归因于基质性质的差异[46−47].因此,本研究在各个检测模式下都进行了激光能量优化,只有在反射-正离子模式下可以检测到高分子量DBPs.各基质在反射-正离子检测模式下,高分子量DBPs 在不同激光能量下的信噪比如图3 所示.结果显示DHB 作为基质,在各激光强度下,高分子量DBPs 的信噪比均高于其他基质.DHB 作为基质的情况下,在激光强度为90%时信噪比达到最高.其原因可能是在90%激光强度以下时,激光能量不足,随着激光能量增加,电离水平提高,因而产生更高的信噪比峰[41],超过90%后,激光能量过高,在离子飞行过程中分子离子被破坏,增强了背景峰,从而导致信噪比降低.
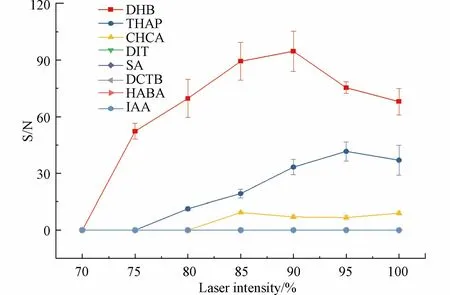
图3 反射-正离子模式下各基质在不同激光强度时的高分子量DBPs 的信噪比Fig.3 Signal-to-noise ratios of high molecular weight DBPs in reflection-positive ion mode for each substrate at different laser intensities
基质浓度直接影响基质与样品混合比例,因而可能会对分析物的响应产生影响[27,41,48].因此需要确定检测高分子量DBPs 的DHB 基质的最佳浓度.检测模式为反射-正离子模式,激光强度为90%,阳离子化试剂为5 mg·mL−1NaTFA,点靶方式为干点法.如图4 所示,在DHB 浓度从0 增加到50 mg·mL−1,高分子量DBPs 的信噪比先升高,在DHB 浓度为20 mg·mL−1时,达到最高信噪比,然后下降.结果表明,DHB 基质的浓度对高分子量DBPs 响应信噪比有明显的影响,因此,选择20 mg·mL−1作为合适的DHB 浓度.

图4 在不同DHB 浓度下的高分子量DBPs 的信噪比Fig.4 Signal-to-noise ratio of high molecular weight DBPs at different DHB concentrations
2.1.2 阳离子化试剂的比选
寡糖由于缺乏基本官能团及其高度亲水性,寡糖在包括MALDI-TOF MS 在内的质谱分析中电离效率较低,在质谱分析中很难形成质子化离子,通常需要使用碱金属离子来实现的寡糖的离子化,形成碱金属缔合离子[49−51].本研究测试了3 种阳离子化剂,包括NaTFA、KCl 和AgTFA,用于分析消毒水样中产生的高分子量DBPs.如图5(a)和(c)所示,当添加NaTFA 或AgTFA 时,高分子量DBPs 出现在m/z 889、1051、1213、1375 和1537 处.如图5(b)所示,添加KCl 时,高分子量DBPs 新增了m/z 905、1067、1229、1391、1553 系列峰(图中标“*”),在这种情况下,m/z 889、1051、1213、1375 和1537 系列峰也能在质谱中被明显观察到,并且两个系列峰m/z 对应相差约16,这与K 和Na 相对原子质量之差相同.这表明m/z 889、1051、1213、1375 和1537 系列峰为加钠峰,而m/z 905、1067、1229、1391、1553 系列峰为加钾峰.添加NaTFA 或添加AgTFA 时,高分子量DBPs 均以[M+Na]+离子的形式出现,并且添加NaTFA 的样品高分子量DBPs 响应信噪比更高,说明高分子量DBPs 与银离子亲和力很弱,而易与钠离子结合.而添加KCl 时,高分子量DBPs 则以[M+Na]+和[M+K]+离子的形式出现,质谱峰更加复杂,不利于质谱分析.因此,NaTFA 是分析高分子量DBPs 的最佳阳离子化试剂.
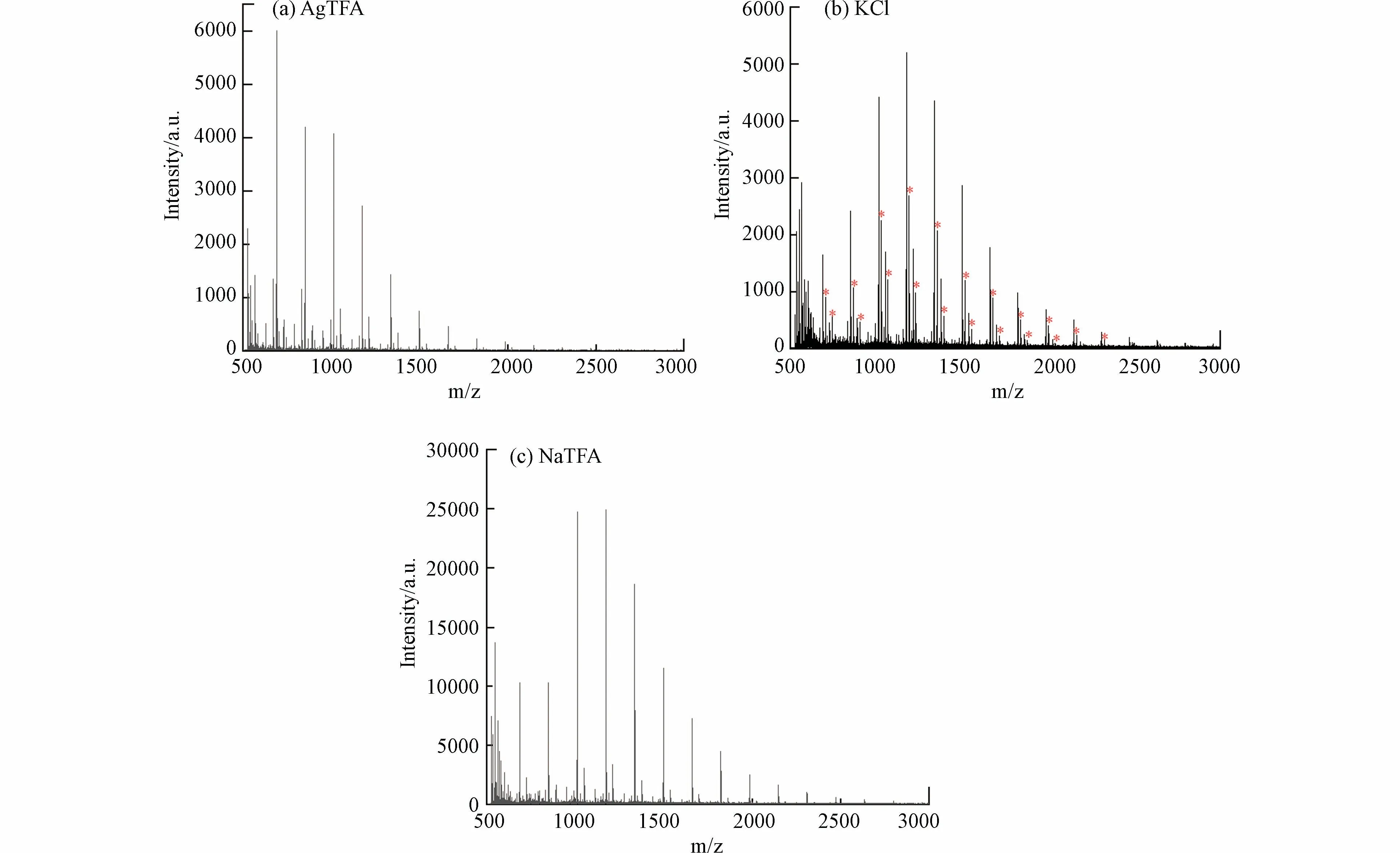
图5 (a)AgTFA,(b)KCl 和(c)NaTFA 作为阳离子化试剂的质谱出峰对比Fig.5 Comparison of mass spectrometry peaks of(a)AgTFA,(b)KCl and(c)NaTFA as cationization agents
随后,在反射-正离子模式,激光强度为90%,基质为20 mg·mL−1DHB,点靶方式为干点法的条件下,确定了NaTFA 的最佳浓度.如图6 所示,NaTFA 浓度在0 到2 mg·mL−1范围内,响应信噪比迅速增加,然后在超过2 mg·mL−1后降低.因此,选用了2 mg·mL−1作为NaTFA 的最佳浓度.因为消毒水样中钠离子的存在,所以即使不添加添加剂,仍然有一定强度的加钠峰.随着盐浓度增加,高分子量DBPs 信噪比先增高后降低.这是因为较低浓度下钠离子对高分子量DBPs 离子化有促进作用,而高浓度的钠离子又会使噪声升高,造成信噪比降低.
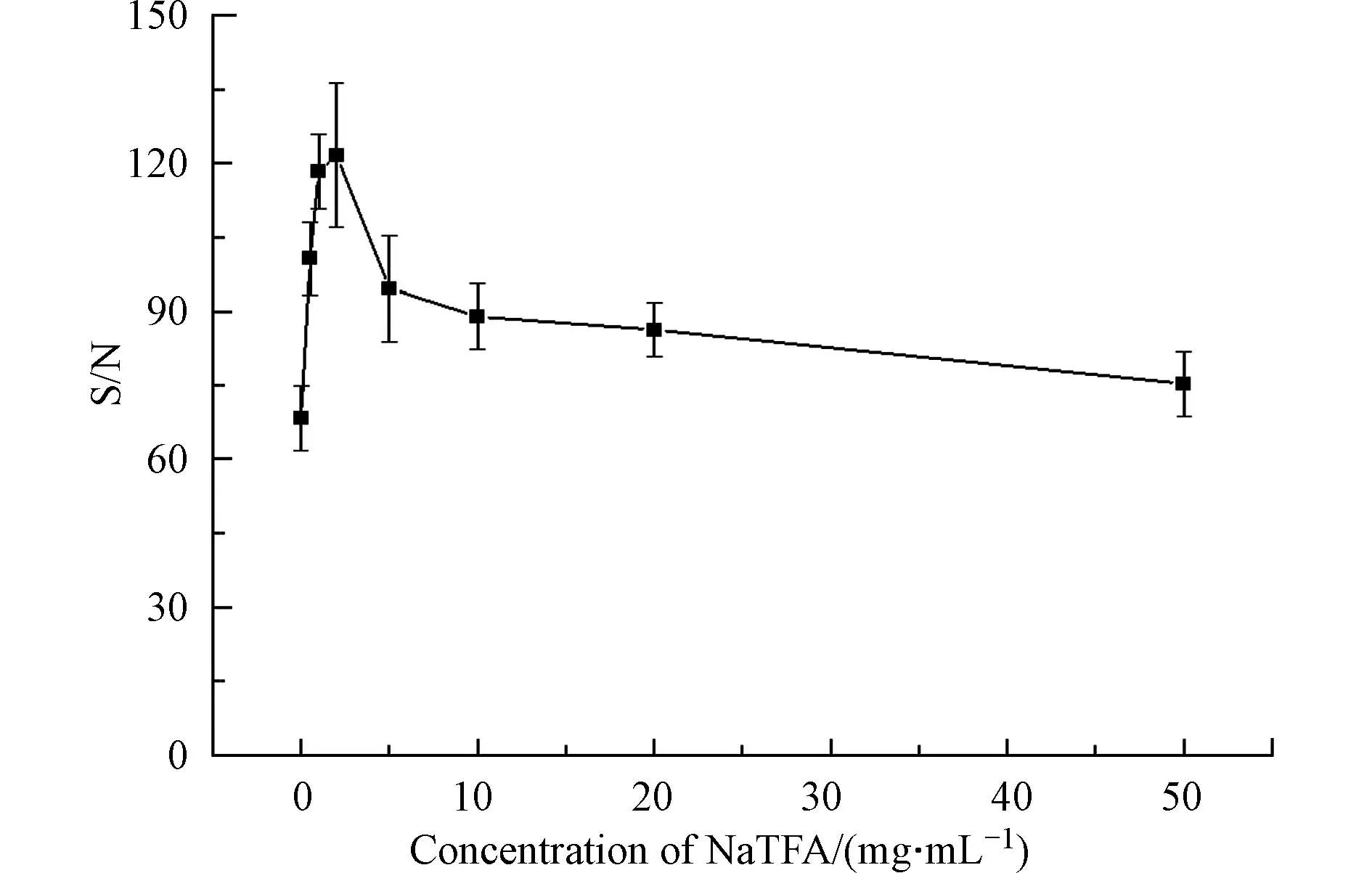
图6 在不同NaTFA 浓度下的高分子量DBPs 的信噪比Fig.6 Signal-to-noise ratio of high molecular weight DBPs at different NaTFA concentrations
2.1.3 点靶方法优化
在前面实验确定的最佳实验条件的基础上,评估了干点法、薄层法、种子层法、三明治法等4 种沉积方法的响应信噪比和结果重现性.如图7 所示,在200 倍的扫描电镜下研究了4 种不同沉积方法下,基质与样品的共结晶情况.在使用干点法的情况下,观察到直径超过200 μm 的晶体.其他3 种沉积方法的晶体均明显更小,结晶更加均匀.在使用三明治法时,晶体的直径<50 μm,至少小了4 倍.使用三明治法的靶板上形成了更薄更均匀的样品和DHB 的共结晶层.由于产生更小的晶体有利于提高信号信噪比和结果重现性,因此三明治法的共结晶效果最好.薄层法、种子层法更小晶体的形成可能是由于(1)薄层法、种子层法均有两次点靶过程,这使得大晶体可以再溶解和再结晶,这有利于形成更小的结晶;(2)此外,第一层基质干燥后,可以充当第二层样品分子的成核中心,增加了溶剂蒸发的速度,反过来阻止了大晶体的生长,并且这个过程使得样品更好地与基质结合,形成了更均匀分布的晶体层.而三明治法经历了两次再溶解和再结晶过程,加强了上述两种效果.

图7 (a)干点法,(b)薄层法,(c)种子层法和(d)三明治法的样品结晶在200 倍放大倍数下的SEM 图像Fig.7 SEM images of sample crystals with(a)dried droplet method,(b)thin-layered method,(c)seed-layered method,and(d)sandwich method at 200 magnifications
在反射-正离子模式,激光强度为90%,基质为20 mg·mL−1DHB,阳离子化试剂为2 mg·mL−1NaTFA 条件下,计算了4 种沉积方法的信噪比和CV 值(n=10).CV 值越小,数据越稳定.如图8 所示,在对高分子量DBPs 的检测中,观察到4 种沉积方法获得的响应信噪比为:三明治法>种子层法>薄层法>干点法,这表明三明治法获得了最好的信号响应,采用三明治法有助于提高检测方法灵敏度和降低检测限;而CV 值则为三明治法<薄层法<种子层法<干点法,这说明使用三明治法的样品,分析物和基质共结晶更好,形成最佳的共结晶层,获得了最佳的结果重现性.因此,对于高分子量DBPs,使用三明治法5 种高分子量DBPs 信噪比之和达到了136.2,CV 值则为4.77%,优于其他点靶方法.
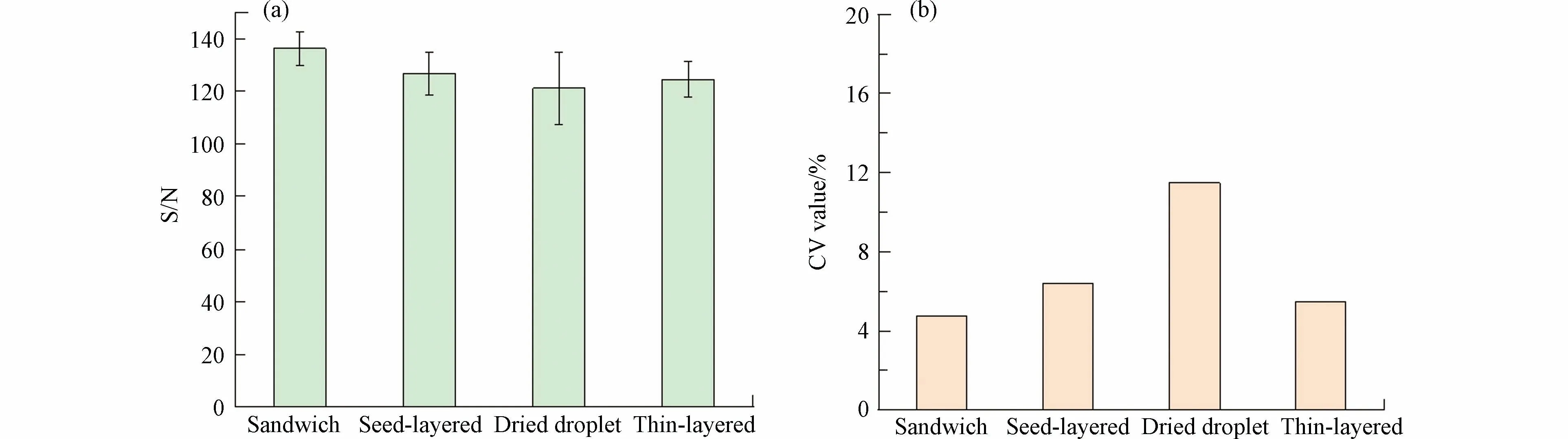
图8 不同点靶方式的(a)高分子量DBPs 信噪比和(b)CV 值(n=10)Fig.8 (a)Signal-to-noise ratio and(b)CV values of high molecular weight DBPs for different p deposition methods(n=10)
2.2 基于MALDI-TOF MS 的高分子量DBPs 识别方法建立
MALDI-TOF MS 在消毒样品中发现m/z 889.2478、1051.3018、1213.3578、1375.4115 和1537.4675共5 种新形成的高分子量DBPs.识别步骤如下,以m/z 1051 处出峰为例.
2.2.1 同位素模式评价
根据高分子量DBPs 出峰(图9),其同位素峰与碳同位素出峰情况相符,不符合Cl 的同位素出峰情况.因此可判断消毒过程中未发生卤素取代反应,其分子式中不含Cl.因此分子式分配的元素范围为12C: 0—100,1H: 1—200,16O: 0—100,23Na: 0—2.
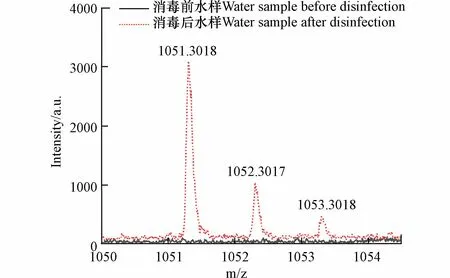
图9 高分子量DBPs 的同位素模式,以m/z 1051 处出峰为例Fig.9 Isotopic patterns of high molecular weight DBPs,taking the peak at 1051 as an example
2.2.2 MALDI TOF/TOF 串联质谱的碎片离子分析
以m/z 1051.3018 峰为例,根据其碎片离子质谱图(图10),m/z 1051.3018 母离子产生了一系列寡糖碎片离子(以※标记的峰),其中m/z 833 碎片离子为五糖结构.因此m/z 1051 分子中存在五糖结构,由此可判断高分子量DBPs 双键当量DBE≥5.
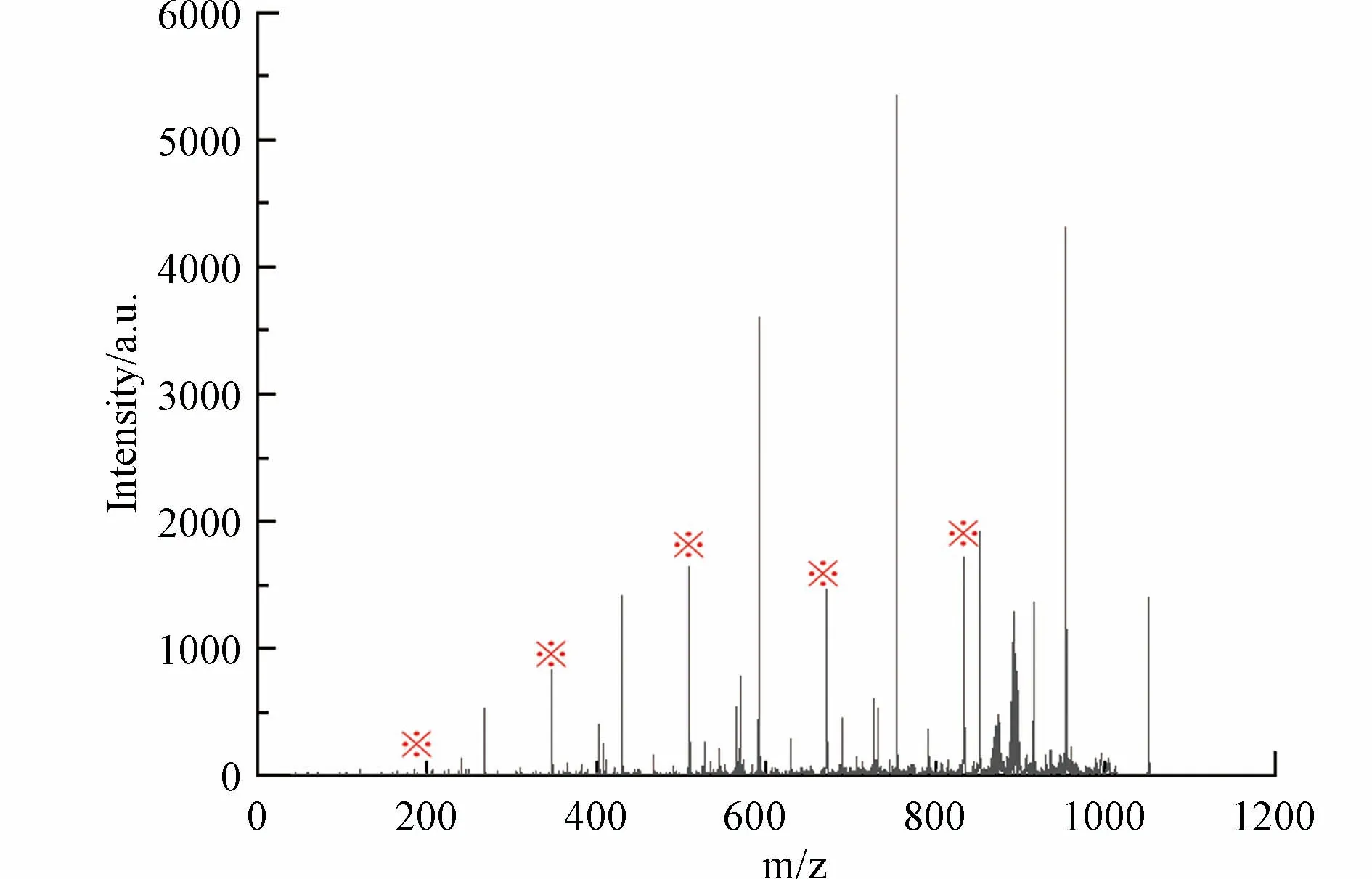
图10 m/z 1051 的碎片离子质谱图,图中“※”表示寡糖结构Fig.10 Fragment ion mass spectrum of m/z1051.3018,"※" in the figure indicates the oligosaccharide structure
2.2.3 高分子量DBPs 分子式分配
分子式计算中,设置质量误差为± 10×10−6,设置双键当量(DBE)≥ 5.若要在地球物理化学环境中存在,分子式的C、H、O 比例须满足:C、H、O > 0、0 ≤ O/C ≤ 1、0 ≤ H/C ≤ 2.5[40].根据MALDI-TOF MS 提供的精确质量1051.3018 以及上述筛选条件,得到分子式计算结果如表2 所示.
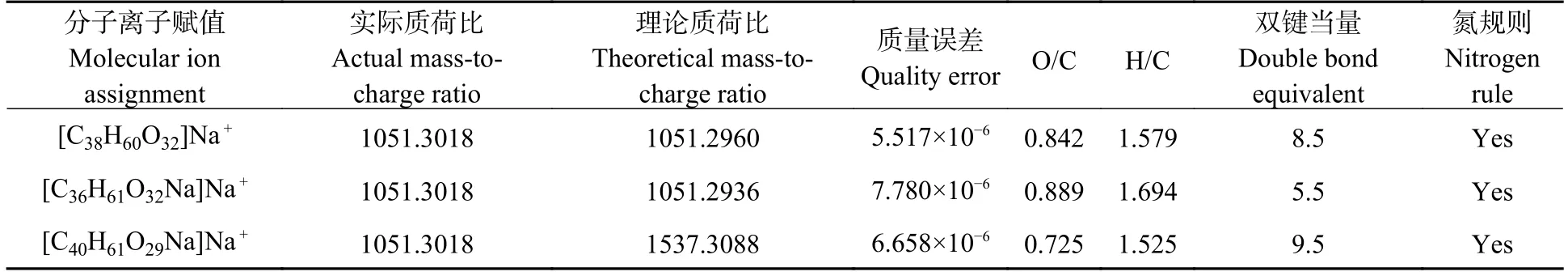
表2 m/z 1051.3018 的分子式计算结果Table 2 The calculation result of the molecular formula of m/z 1051.3018
2.2.4 高分子量DBPs 结构式确定
有文献报道,淀粉与次氯酸反应过程中,葡萄糖残基可被氧化为葡萄糖羧酸,高分子量DBPs 可能为寡糖羧酸或寡糖羧酸钠[52].因此若消毒过程与文献中报道的反应相同,则可认为C36H61O32Na 与C36H62O32(C36H61O32Na 的酸)是同种物质.过往文献中报道的可能产物结构见图11.

图11 已报道的可能产物结构,R=COOH 或CH2OH[52]Fig.11 Possible product structures have been reported,R=COOH or CH2OH[52]
通过SciFinder 数据库验证.候选分子式C38H60O32、C40H61O29Na 均未检索到对应物质,而C36H61O32Na(C36H62O32),得到了4 种对应物质,其结构式如图12 所示.考虑到消毒前体物淀粉的结构,产物结构可排除图12(c)和(d)结构.此外,图12(a)、(b)结构与文献中报道结构(图11)吻合.因此可确定高分子量DBPs m/z 1051.3018 的结构即为图12(a)或(b)结构.
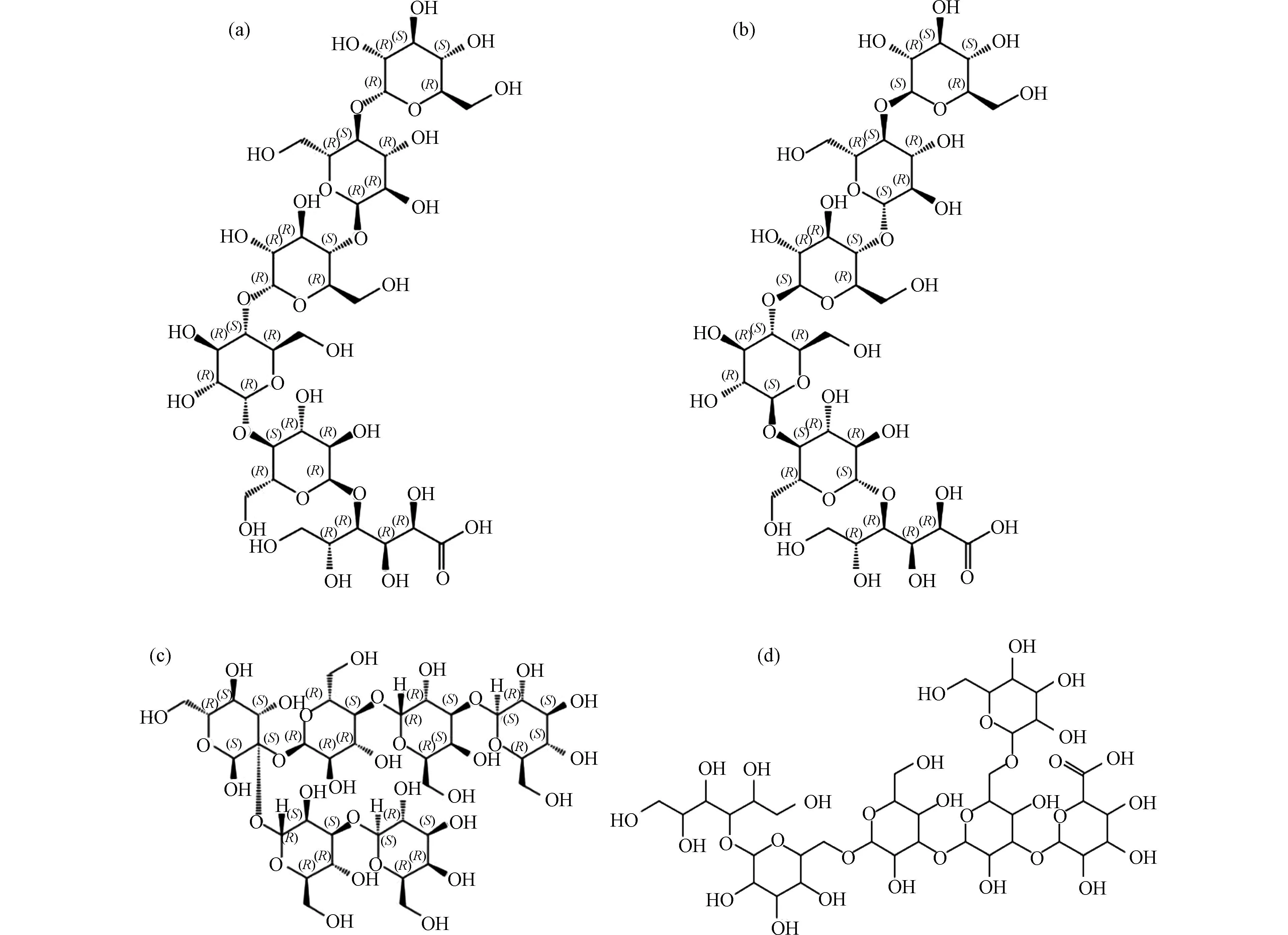
图12 C36H62O32 的四种结构式Fig.12 Four structural formulas of C36H62O32
同样的识别方法可以得到,5 种高分子量DBPs 分子式分别为C30H51O27Na、C36H61O32Na、C42H71O37Na、C48H81O42Na、C54H91O47Na(表3),并且通过数据库验证与以往研究证明5 种新形成的高分子量DBPs 同为羧酸糖类物质,新产生的高分子量DBPs 的分子量相邻物质质量差约为162.1 Da,与己糖残基质量相同,因此可推测5 种高分子量DBPs 为相差若干个己糖残基的同类型物质.
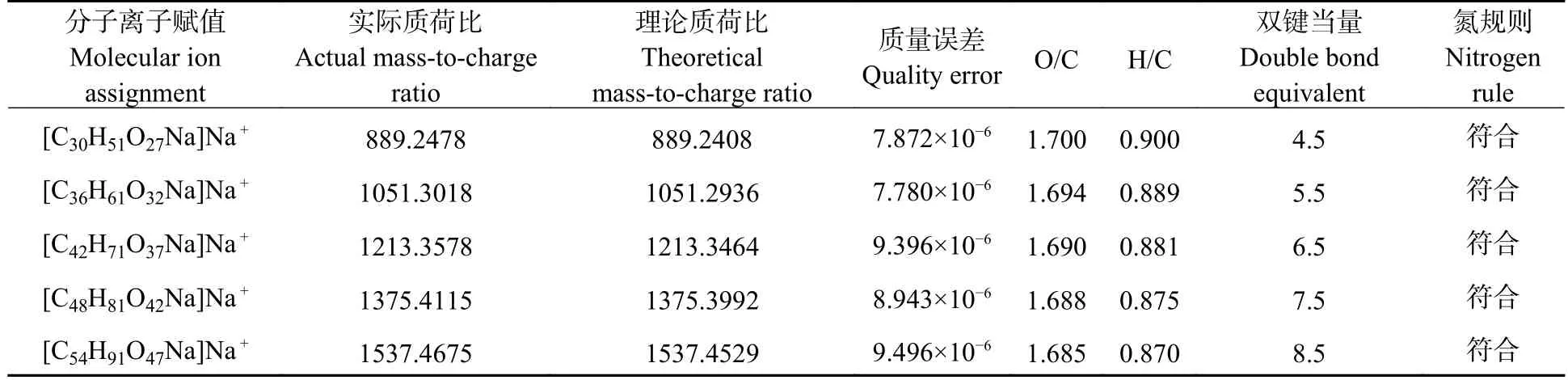
表3 高分子量DBPs 分子式识别结果Table 3 Molecular formula identification results of high molecular weight DBPs
在消毒过程中,淀粉中的还原端糖残基本身被氧化并开环,消毒模型化合物被氧化为寡糖醛酸或者寡糖羧酸钠.因此,高分子量DBPs 中未检测到含氯分子峰,可能是由于淀粉中糖苷键和还原端糖残基的存在,导致其消毒过程中更容易发生糖苷键断键、还原端糖残基开环和羟基-羧基转化,而不易发生卤素的取代反应.
3 结论(Conclusion)
(1)本研究引入MALDI-TOF MS,构建了针对高分子量DBPs 的检测方法,并通过对消毒前后水样的质谱出峰逐一比对,在模拟饮用水中发现了5 种新的高分子量DBPs.
(2)发现基质、检测模式、激光强度、阳离子化试剂和点靶方式均能对高分子量DBPs 信噪比和信号重现性产生影响.以DHB 为基质,NaTFA 为阳离子化试剂,三明治法为点靶方法,MALDI-TOF MS 在反射-正离子模式、90%激光强度下,高分子量DBPs 信噪比和信号重现性达到最优,信噪比达到136.2,CV 值为4.77%.
(3)通过高分辨质谱提供的精确质量和同位素评价,TOF/TOF 串联质谱提供的碎片离子特征以及SciFinder 数据库验证,建立了高分子量DBPs 的识别方法.最终确定5 种高分子量DBPs 为相差若干己糖残基的寡糖羧酸钠类物质.
本研究基于MALDI-TOF MS 的高分子量DBPs 检测识别方法可为实际饮用水中复杂DBPs 混合物的检测与鉴定提供新的技术支持.

