根系分泌物介导的土壤金属氧化物纳米材料对植物毒性作用的研究进展*
魏晓贺 苗欣宇 欧阳少虎 刘煜莹 何建荣 岳 晴 李 鑫
(1.天津理工大学环境科学与安全工程学院,天津,300384;2.南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津,300071;3.天科院环境科技发展(天津)有限公司,天津,300450)
纳米材料是指微观结构至少在一维方向上受纳米尺度(1—100 nm)调制的各种同体超细材料,其分类主要可分为无机材料和有机材料.无机材料包括金属纳米材料(Ag、Zn、Al、Ti、Cu、Au、Fe、Ni、Sn 等)、金属氧化物纳米材料(ZnO、CeO2、TiO2、Al2O3、CuO、Fe2O3、La2O3等)和量子点(QD),有机纳米材料是指基于脂质、蛋白、多糖及有机高分子聚合物的新型纳米材料[1],比如纳米纤维素、纳米聚四氟乙烯、富勒烯和碳纳米管等[2].由于其纳米尺寸效应,纳米材料与尺寸较大的材料相比具有特殊的物理和化学性质[3],因此,纳米材料越来越多地生产和应用于消费品、化学、医疗设备、信息技术和能源等领域[4],在不同纳米材料的制造和应用中,金属氧化物纳米材料(metal oxide nanomaterials,MONMs)占主要份额[5],而大规模的制造和生产会导致MONMs 排放到环境中并对周围环境以及生物造成不利影响[6],从环境污染的角度来看,无机纳米材料尤其是MONMs,由于其高热电阻率以及催化生物系统中一系列化学过程的能力起到了主要作用[7].例如,Lv[8]、Chen[9]、Sundaria 等[10]在土壤中种植的主要农作物(水稻、小麦、和玉米)体内均检测到了纳米Fe2O3和纳米ZnO 金属氧化物纳米材料(metal oxide nanomaterials,MONMs),且这些MONMs 在植物体内的浓度高于其在土壤中的浓度,表明释放到环境中的MONMs 可以进入植物,并在植物体内进行累积.MONMs 对生物体特别是植物的毒性,及其引起的环境生态风险和人体健康危害受到各界广泛关注,已成为当前研究前沿和热点之一.
植物作为土壤生态系统的重要组成部分,是MONMs 运输和生物积累到食物链中的潜在途径[11],植物根系分泌物(root exudates,REs)是植物根毛或须根系统中分泌到根际的一些重要生物活性分子,主要包含粘液、糖、氨基酸、酶以及各种含碳初级代谢物和多种次级代谢物[12].值得注意的是,REs 能够与MONMs 发生相互作用,从而显著影响其在土壤生态系统中的归趋和毒性[13−14].REs 与MONMs接触会对MONMs 表面进行修饰,影响其表面化学性质.MONMs 吸附REs 后其环境行为也会发生改变,从而影响毒性效应.因而,REs 修饰后MONMs 的生物毒性及其生物有效利用性更应为公众所关注.近年来,大多数研究工作聚焦于MONMs 诱导的植物生物毒性及其对根系代谢的影响.例如,向日葵暴露在纳米Fe2O3中5 d 后,枝条中的常量营养素和根部功能都有所降低[15].然而,对于REs 对于MONMs 的交互作用研究还比较少,其在土壤系统中介导的MONMs 植物毒性效应的研究零星和分散,亟需系统归纳和总结.因此,为了更好的认识土壤中MONMs 在环境中的生态健康风险,本文对MONMs 的来源,REs 与MONMs 之间的界面相互作用以及MONMs 在土壤环境中的植物效应进行全面而系统的归纳综述,并展望其未来发展趋势.本综述补充关键的知识缺口,并就MONMs 的生态健康风险以及它们在环境中的潜在应用提供了有价值的见解.
1 土壤中金属氧化物纳米材料的来源(Main sources of metal oxide nanomaterials in soils)
土壤中MONMs 来源主要分为人工来源、自然来源和偶然来源(如图1 所示),其中人类活动是造成MONMs 在土壤中积累的最主要因素.Tolaymat[16]提出纳米材料主要通过4 种途径排放到生态系统,即原材料的制造、纳米产品的制造、产品的使用和废物管理服务.ZnO、FeO、SiO2、CeO2和TiO2等金属氧化物纳米材料因为其独特的光催化性能常用于工业原材料的制造[17].MONMs 作为橡胶添加剂、催化转化器、生物医学成像、光伏电池、传感器等的成分,通常用于各种行业(油漆、化妆品和塑料产品等)[18].其中化妆品和个人护理产品(PCP)对环境有突出的危险性,因为94%的工程纳米材料是由于PCP 的使用而释放到环境或垃圾填埋场[19].而MONMs 的多种特性使得其在这些行业中广泛应用,例如它们的紫外线防御作用(例如纳米TiO2)、抗菌作用和抗氧化性能[20−22].使用纳米产品的过程也会导致MONMs 释放到环境中,尤其是农业纳米产品,包括纳米杀虫剂和纳米肥料.MONMs 因其具有伤害性常被用作杀虫剂,以避免或减少微生物的生长[23],但与此同时也会对土壤中的作物造成一定损害,比如纳米杀虫剂使用时会对作物进行大面积喷洒,其中的乳油和微乳大多是苯类、醇类和酮类等极性溶剂,具有高急性毒性,容易进入农田和地下水且不易降解,在环境中积累后会对作物产生不利影响[24].纳米材料的尺寸使肥料养分更容易被纳米级的植物孔隙吸收进一步有效利用,因此常用作纳米肥料[25].然而在达到植物有效浓度的同时想要控制纳米肥料的使用量,难免对肥料进行重复使用[26],这会对土壤造成一定影响.纳米产品使用后的废弃物也是土壤中MONMs 的重要来源.MONMs 或含有MONMs 的产品废弃后将在垃圾填埋场或垃圾焚烧厂延续其效果[27],进而渗透到土壤中.但目前关于纳米废物的管理和处置方法的研究还有待补充.

图1 土壤中金属氧化物纳米材料的主要来源Fig.1 Main sources of metal oxide nanomaterials in soils
自然存在的MONMs 也可以在土壤中找到.统计表明,仅在大气中,每年就会产生数吨天然尘埃纳米材料,其来源主要是野火、火山活动以及由风、水和沙漠风暴引起的土壤侵蚀,这些纳米材料在分散数千公里后自发沉降到土壤中并积累[28−29].除了人工来源和自然来源,偶然来源产生的MONMs 也会造成纳米材料的积累,比如工业过程的副产品(汽车发动机尾气、焊接产生的烟雾、燃烧过程等)甚至某些自然过程如森林火灾[30].偶然来源与人工来源的最大区别是人工来源的MONMs 具有可控性.当同时处理人工、自然和偶然的MONMs 时,确定任何特定纳米材料的来源都是困难的.此外,土壤中某些元素(例如Al)的背景水平可能很高,因此,在研究中把背景元素和人为来源区分开也是一项必要且复杂的任务.
2 根系分泌物对金属氧化物纳米材料的界面作用机理研究(Mechanisms of interfacial action of root exudates on metal oxide nanomaterials)
约30%—40%的光合固定碳以REs 的形式转移到根际,包括低分子量物质(例如单糖、有机酸和氨基酸以及脂肪酸)和高分子量物质(例如多糖和蛋白质)[31].MONMs 一旦进入到土壤环境,将与土壤中的物质进行相互作用(比如REs),最终决定其命运和毒性.REs 与MONMs 在植物根际界面上的相互作用,对MONMs 的行为转化及环境归趋起着至关重要的作用.MONMs 具有巨大的比表面积,能够吸附土壤环境中的各种污染物、天然有机质(NOM)或者REs.吸附是REs 与MONMs 之间最主要的相互作用机理,其影响着后续MONMs 在植物系统中的运输和生物利用性.吸附表明表面复合物的形成,也可以是金属离子和分子物理附着或键合到另一个组件的表面上.REs 与MONMs 界面之间可能存在的吸附机制,包括静电相互作用、疏水作用、螯合(络合)作用、配体交换、氢键结合(如图2 所示).
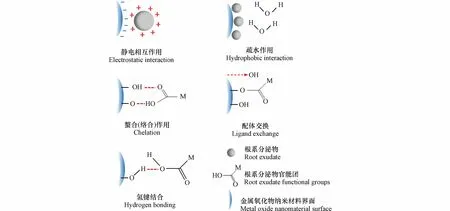
图2 根系分泌物对金属氧化物纳米材料界面作用机理Fig.2 Mechanism of interfacial action of REs on MONMs
2.1 静电相互作用
当静电相互作用是吸附的主要机制时,其效果受pH 和零点电势的影响.增加pH 会降低MONMs 表面电荷密度,从而降低REs 的吸附容量.比如纳米CeO2的表面电荷依赖于pH 值;表面在酸性pH 时带正电,在碱性pH 时带负电,并在pH 为8 的零点电势值附近迅速聚集,从而影响REs 的吸附[32].静电相互作用对两性离子分子(如氨基酸和两性羟基)在MONMs 上的吸附行为起着重要作用[33].半胱氨酸的吸附能力强,它能通过羧基和磁铁矿纳米粒子中的侧链相互作用,通过静电相互作用以多层方式结合,还可以与带正电的TiO2膜之间发生静电相互作用[34].REs 中带负电荷的有机酸的静电吸引使得纳米CeO2和纳米Mn3O4聚集体尺寸减小[35].静电相互作用还常发生在MONMs 和根部分泌的黏液中,带正电的纳米CeO2由于被带负电荷的黏液静电吸引而附着在根部表面[36].
2.2 疏水作用
疏水相互作用是MONMs 与REs 相互作用的另一个重要驱动力,它实际上是一种熵效应,源于从非极性表面排除有序水分子[37].疏水性被认为与定义MONMs 的生物学影响高度相关,因为MONMs 表面的疏水性与亲水性比率决定了MONMs 与REs 相互作用和粘附.一般来说,疏水表面倾向于粘附到其他疏水表面上,疏水相互作用可发生在特定材料的表面或MONMs 电晕的蛋白质或生物分子中[38].在植物的细胞中,能引起疏水相互作用的成分主要是脂磷壁酸、寡糖等化合物、原纤维和含有疏水残基的二级和三级结构的蛋白质(如丙氨酸、缬氨酸和苯丙氨酸)[39].如果蛋白质和MONMs 的净电荷相似,则蛋白质会通过疏水作用吸附到MONMs 形成“电晕”[40].通常REs 的吸附与MONMs 的亲水性呈负相关,这是由MONMs 表面的H 含量(即表面结合的水和羟基)决定的.
2.3 螯合(络合)作用
MONMs 与REs 相互作用的一个重要方面是有机官能团能够形成多齿配合物,从而增加了键的稳定性.MONMs 很容易与天然配体形成多齿络合物,称为螯合,螯合作用大大提高了金属的溶解度[41].REs 中的一些有机酸和氨基酸可作为配体与Cu 离子鳌合,阻碍植物对它们的吸收[42].低分子量有机酸可能带有不同的负电荷,只有一个羧基的有机酸(乙酸、乳酸和甲酸)的金属络合能力有限,而柠檬酸、苹果酸和草酸都对三价金属如Fe3+和Al3+具有高亲和力[43].此外,酚类物质也具有螯合金属离子的能力[44].络合反应分为表面络合和内球络合,其中表面络合表明溶解的离子和表面官能团之间形成半共价键,而REs 与MONMs 的络合基本上是金属离子和各自表面官能团的内球络合,内球络合物是由配体和金属之间形成共价键形成的,这在它们之间的吸附过程中十分重要[43].
2.4 配体交换
配体交换是根系REs 与MONMs 中常见的相互作用机制,通常用于合并改变MONMs 溶解度、引入电子转移或整合生物受体的官能团[45].MONMs 主要通过与REs 的表面羟基(单键OH)产生配体交换作用,MONMs 表现出强大的吸附亲和力.比如COOH 基团能够分别与纳米TiO2和纳米ZnO 的配体交换[46].这种相互作用也受到pH 和零点电势的影响,比如在高于零点电势下,纳米Fe2O3带负电,并且由于静电排斥和酸性官能团与氧化铁表面位点之间的配体交换减少,REs 的吸附受到抑制[47].
2.5 氢键结合
氢键指相同或不同分子间不引起化学性质的改变,而依靠较弱的键力(如配位共价键、氢键)结合的现象,不引起共价键的改变,是涉及氢离子H +的特定弱静电相互作用.当涉及质子供体和质子受体基团时,它会影响聚合物的吸附[48].MONMs 的官能团和REs 可能通过氢键相互作用影响它们之间的吸附.然而氢键结合作用更多的发生在金属基纳米材料以及碳基纳米材料与REs 的相互作用中,关于MONMs 的氢键结合作用研究较少.
3 根系分泌物介导下金属氧化物纳米材料对植物毒性作用的影响(Influence of phytotoxic effects of metal oxide nanomaterials mediated by root exudates)
3.1 根系分泌物对金属氧化物纳米材料植物吸收的影响
植物对MONMs 的吸收和积累一直是MONMs 健康和安全评估的主要关注点,因为食用受MONMs 污染的粮食作物可能是人类接触这些潜在危险材料的重要途径.REs 的存在能够增加根际MONMs 生物利用度[49].越来越多的证据表明,当植物暴露于MONMs 时,颗粒本身和溶解的离子都会导致植物组织中金属元素的浓度升高.REs 如有机酸和铁载体,会增强它们的溶解度,溶解的离子被植物根吸收并转移到植物地上部分,与不同的有机配体形成复合物[50],或通过抑制MONMs 的聚集促进植物吸收,因为分散在溶液中且尺寸较小的MONMs 更易被运输通过植物细胞膜[51].
MONMs 及其离子主要以两种途径穿透根系进入植物体内:质外体和共质体[52].质外体途径在细胞膜外,在相邻植物细胞壁之间的细胞外空间中进行,而共生通路依赖于相邻细胞之间,通过称为胞间连丝的特殊结构中的水和物质细胞运动进行[53].植物根部的孔道较小,很多MONMs 的尺寸无法使其直接穿透根系,因此吸收前的溶解是很多纳米材料在植物中吸收和积累的重要基础.REs 的存在倾向于增强MONMs 的溶解,特别是对于相对稳定的MONMs 而言,例如纳米CeO2.植物根系能够增强MONMs 的溶解效果主要是由于REs 中释放的低分子量有机酸,这降低了土壤根际pH 值,且REs 能够作为电子供体促进Ce4+还原为纳米材料表面的Ce3+[54].比如纳米CeO2在黄瓜REs(有机酸和还原物质)的作用下部分溶解,释放出Ce3+,一部分Ce3+与黄瓜根部的PO43-结合,以不溶性CePO4的形式沉淀固定在根部,一部分Ce3+以Ce(Ⅲ)-络合物的形式随水流沿维管束向上运输,最终积累在脉管中[55−56].除了以络合物形式吸收,离子型吸收也是MONMs 摄入的主要机制.Ag+通过根毛进入根,然后通过质外体内化,到达内皮层和维管组织,最终积累在植物中[57].
3.2 根系分泌物与金属氧化物纳米材料对植物产生的联合毒性
MONMs 易积累在粮食作物(包括可食用组织)中,而一旦MONMs 进入食物链,就会进一步在人类体内转移和积累.因此,MONMs 对食物链的潜在风险和影响成为深入研究的主题.MONMs 对根部的毒性影响可以通过氧化应激的产生、根部的损伤、根部生物量以及植物生长状况来表征.目前关于REs 与纳米材料联合毒性的研究更多集中在REs 与MONMs 的组合上,因为MONMs 本身和从中不断溶解出的金属离子会对植物以及周围环境产生一定毒性效果.比如Shang 发现在REs 的存在下,纳米CuO 的溶解促进了其被根系组织吸收,与对照组(4.89%)相比玉米幼苗的生长速率下降到了1.89%,根中的Cu 积累有所增加[58].Mousavi Kouhi 推测纳米ZnO 对甘蓝型油菜的不利影响(叶片黄化现象、Zn 在植物体内积累、超氧化物歧化酶活性降低、过氧化物酶活性增加等)与REs 引起的Zn2+溶解的毒性效应有关[59].除了促进溶解引起的化学毒性外,MONMs 还能与REs 形成沉淀阻塞在根部导致植物无法摄入养分,造成物理毒性[60].Kim 发现黄瓜细胞内存在纳米材料或纳米材料聚集体,一定量的纳米材料在细胞内溶解成Cu2+和Zn2+,这表明MONMs 极大地粘附在根表面,使其难以吸收生物可利用的Cu 和Zn[61].尽管如此,在研究中还是很难区分毒性来自于MONMs 还是其溶解的离子.
许多研究报道了MONMs 对植物的不利影响,然而毒性作用也分积极影响和消极影响.比如REs 与MONMs 的结合可以对纳米材料产生毒性抑制效果.小麦根部分泌出的丙二酸、苹果酸和柠檬酸与Cu 产生的络合物与植物对缩短根和茎长度和降低根干重的反应呈负相关,表明这些配体对小麦具有保护作用,降低了纳米材料的毒性[62].氨基酸与Cu 离子的络合也有助于限制Cu 离子向叶片的转移[42].除此以外,REs 包覆MONMs 也具有增加植物根部生物量和降低毒性的效果.带有柠檬酸涂层的纳米CeO2能够显著提高萝卜幼苗根生物量以及含水量[51],增加番茄的生长和色素含量[63],达到了毒性减少的效果.外层包裹有柠檬酸的纳米Fe2O3使得植物根长度增加,虽然增加了抗氧化酶活性,如过氧化氢酶、超氧化物歧化酶、抗坏血酸过氧化物酶,但未检测到毒性效果[64].
3.3 根系分泌物介导金属氧化物纳米材料的植物毒性机理
MONMs 可以在生物体和细胞中吸收和积累,导致目标组织的形态和功能发生变化.MONMs 产生植物毒性的分子机制主要是活性氧(ROS)的产生、关键细胞内蛋白质的功能障碍以及基因和蛋白质表达水平的变化[65-66].氧化损伤是植物最主要的毒性机制,ROS 水平是植物氧化应激的重要指标,由于一些MONMs 是部分可溶的,所以可溶性和颗粒状物质都能进入植物体内产生过量的ROS[49],通过损害脂类、蛋白质、DNA 等关键生物分子,引起植物氧化应激,从而对植物造成严重的氧化损伤[67].这种损伤可以通过丙二醛的增加、过氧化氢酶和谷胱甘肽表达的减少以及超氧化物歧化酶的变化来证明.
REs 介导MONMs 毒性的方式主要是通过促进MONMs 的溶解,或在MONMs 的表面形成有机涂层通过提高MONMs 的稳定性和运输效率来增加材料表面与植物细胞之间的接触可能和在土壤中的生物有效性[68].大量研究表明,植物根部分泌的有机质能够通过降低环境pH 或作为络合金属离子的有机配体,不断促进MONMs 的溶解[35,58,62],离子的释放是其在生物和环境中的重要转化途径,是许多纳米材料毒性的关键因素[69].比如高浓度Cu 离子的氧化还原活性使其可以与蛋白质的巯基相互作用,导致蛋白质功能障碍,从而使酶失活[70],而受影响的蛋白质会参与各种重要的生化过程,如氧化应激耐受、转录和蛋白质降解、细胞壁和DNA/RNA/蛋白质直接损伤、信号传导和凋亡等[71].植物根系分泌的有机酸诱导的纳米La2O3的溶解在其植物毒性中起重要作用[72].REs 在MONMs 表面形成的涂层会提高纳米材料在根部的转运效率.比如组氨酸对纳米ZnO 表面形成涂层,能够减少纳米ZnO 的聚集,增加其在根际环境的分布[73].在有机质含量低的土壤中,残留在土壤溶液中的柠檬酸盐包覆的纳米CeO2更容易分散和移动到达根部,有机涂层增强了Ce 从土壤溶液到植物根部的运输[74],纳米CeO2处理的莴苣根中过氧化氢含量增加,丙二醛产生量增加,表明根细胞的膜损伤,抗氧化酶活性增加,细胞死亡[69].
3.4 环境影响因素
除了MONMs 自身或经REs 作用后产生的毒性外,植物生长的环境条件也会影响其毒性效应以及植物对MONMs 的吸收.MONMs 的毒性和金属离子的溶解受到土壤质地、pH 值、离子强度、盐度和光照等因素的影响(如图3 所示).已有研究表明,在低和高pH、以及高离子强度下,纳米ZnO 的溶解度都有所增强[23].土壤pH 值是调节MONMs 行为的关键特性之一.在酸性条件下,MONMs 以高速率转化为离子物质,而碱性条件促进MONMs 的聚集[75],离子形式的MONMs 更易被植物吸收并对植物造成损伤.离子强度以及盐的存在和数量也会影响MONMs 行为和随后的植物反应.由于高盐度存在下会压缩MONMs 的静电双层,从而大多数MONMs 的静电排斥力降低,聚集程度增强[76−77].从机理上讲,高浓度的Ca2+、Na+或K+可以通过在根表面竞争性地结合MONMs 来减少植物对从中溶解出的离子的吸收,盐离子还可以改变小麦REs 的成分,从而调节Cu 或Zn 的螯合、溶解度和生物利用度[78].盐的类型和浓度对植物生长和从MONMs 中积累金属的程度有不同的影响,因此对它们的生产力和食物链也有不同的影响.土壤质地,特别是粘土的占比,是确定MONMs 行为和毒性的另一个重要参数.粘土含量高的土壤孔径小、表面积大,这种特点增加了静电相互作用和物理应变,导致MONMs 流动性更低[77,79].而质地较粗、有机碳含量较低的土壤使MONMs 表现出更高的可用性.比如当芸豆植物暴露在含有纳米CeO2的土壤中时,相同组织在有机质含量低的土壤中含有的Ce 浓度比在富含有机质的土壤中更高[80].土壤中粘土含量的增加会减少植物组织对MONMs 的吸收,这在Larue 和Zhang 的研究中都得到了证实,暴露在纳米TiO2和纳米CeO2的植物组织在壤土中比在粉质壤土中能积累更多的金属[79,81].

图3 环境影响因素Fig.3 Environmental Influence Factors
值得注意的是,除了土壤环境的不同带来不同的毒性影响,外界因素(如光照)也可能会影响MONMs 的物理化学性质.首先,光照射可以加速MONMs 的离子溶解.例如,紫外线或太阳辐射可以增强纳米ZnO 的溶解[82],这反过来也会影响纳米毒性的改变.其次,MONMs 的结晶度也可以改变.据报道,纳米TiO2的光致相变是由间隙内照射引发的[83].此外光照能够与纳米材料表面的物质发生反应,促进产生不同的ROS,如羟基自由基OH·,加剧其对生物体的毒性效应[84−85].然而进入土壤的光照有限,影响程度相比于土壤条件而言可能更小.
4 展望(Perspectives)
随着MONMs 在生产生活中越来越广泛的应用,与之带来的危害逐渐引起学者关注.REs 作为改变根际环境的复合活性物质,能够引起环境介质中MONMs 的表面化学性质的变化,从而进一步介导MONMs 在环境中的界面吸附以及对植物的毒性影响.除此以外,MONMs 所处的环境因素不同,比如土壤的质地、pH 值、离子强度以及光照强度等,都会对MONMs 造成毒性效应的差异.无论影响MONM 的是哪种环境因素,由于土壤的复杂性,MONMs 的毒性往往难以清楚地分解开,应该更好地协调暴露条件,包括介质的质地、剂量、持续时间和终点,尤其是中长期暴露的风险,并且应考虑到纳米材料与周围环境介质以及环境介质中的微生物的相互作用.这样可以获得关于MONMs 对植物的影响机制,以制定风险缓解措施,为纳米产品在农业中更好的应用提供理论基础.尽管目前REs 与MONMs 的研究已经取得了一定的进展,但仍有很多科学问题亟待解决:
(1)天然环境中MONMs 具有颗粒小、分散性强、成因复杂等特点,广泛地分布在环境中各个圈层中难以分离富集,不够清晰的信息使得MONMs 的相关研究十分困难.因此在环境样品中开发更好、更准确的分析监测仪器或方法来提取富集MONMs 必不可少,这能为MONMs 后续的环境行为及毒性研究提供更准确可靠的依据.
(2)现阶段大部分关于REs 与MONMs 的研究主要集中在实验室的模拟环境中,所用模拟材料的性质均可控.然而基于现实土壤的复杂性,MONMs 的行为规律尚不清晰,且实验模拟条件与现实具有差异性,因此研究实验室土壤环境与天然土壤环境之间MONMs 与环境中物质的相互作用以及迁移转化的差别至关重要.
(3)MONMs 在环境治理中具有广阔的应用前景,但是REs 介导下MONMs 对于人体健康和生态环境的影响还有待进一步研究.目前的MONMs 毒性机理研究仍旧停留在植物体内酶活水平上,未来应结合高通量组学等生物信息学手段,从内源代谢以及基因水平层面对MONMs 的致毒机理进行深层次的探讨,并对植物自身的解毒途径进行发掘,检查哪些解毒途径在整个系统中占主导地位,以及解毒途径如何随植物物种和材料类型的变化而变化.或可结合数学模型,对金属氧化物纳米材料在植物系统内的浓度变化和行为进行预测,尽可能减轻金属氧化物纳米材料的植物毒性作用.

