根际化学与生物多样性的表征方法:组学技术的机遇与挑战*
黄红林 吕丽丽,2 吕继涛 饶子渔 耿方兰 曹 冬 康跃惠 温 蓓,2
(1.中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京,100085;2.中国科学院大学,北京,100049)
根际(rhizosphere)是连接植物、土壤和微生物的核心,是土壤形成、碳循环和地球陆地生态系统最终生产力的基础,同时也是微生物在土壤中活动的关键场所[1−4].根际的概念是1904年德国科学家Hilter 首次提出.由此,根际化学与生物学过程的相关研究已经经历了一百多年[5].可以确定,根际是植物、土壤和微生物与环境交互作用的中心,是生物化学过程耦合最活跃的区域[6].
植物根系通过根系分泌、呼吸作用、养分吸收等各种形式和途径将有机或者无机化合物释放到周围土壤,进行着植物与土壤间物质交换的重要的界面过程,创造了根际区独特的化学环境.并且,这些物质在化学上具有多样性,从简单的低分子量的有机酸、糖、氨基酸,到复杂的维生素和植物激素;还有大分子的多种碳水化合物、肽和蛋白质,以及根组织的脱落物等[7](表1).
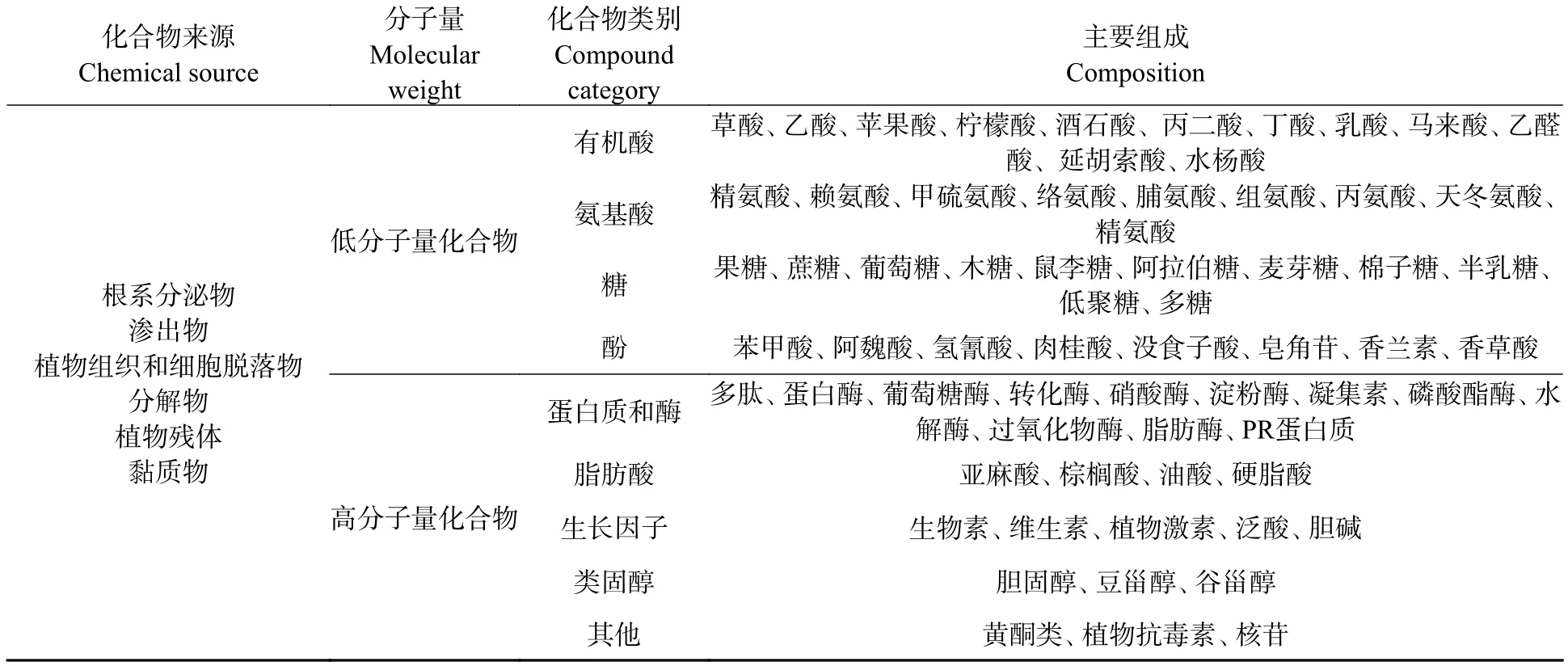
表1 根际主要化合物的来源、种类及组成Table 1 Source,category and composition of the main compounds in the rhizosphere
随着植物种属、发育进程、营养、土壤类型、环境特征及其他因素的改变,根系分泌物的组成也随之而变化[8],即根系分泌不是均匀或静态的.植物通过根系分泌物这个重要的媒介与外界进行物质交流,根系分泌组成从根本上决定了根际的化学多样性.其次,根际微生物涵盖细菌、真菌、藻类、原生动物等[9],其在数量上为根际外土壤的几至几十倍,存在着显著的多样性和复杂性.大量微生物聚集于根系周围,将有机物分解转化为植物可以吸收的养分;同时,植物生长过程中的根系分泌物、死根、根脱落物能够给予微生物必需的营养和能量[10].而且,根际微生物群即使在同一植物的不同品种也可表现出其高度的特异性[11].经过长达数亿年的共同进化,根际微域中植物与地下生物,尤其是微生物之间产生了繁杂的动态互作关系,即为根际效应[1,12−13].已证明根系分泌物会调控土壤微生物群落的组成、结构和功能[14].这表明,植物根系在不同时空分泌的物质特异性、种类和数量都可能介导了微生物群落的组装模式[15].但是,根系分泌物的化学性质和微生物底物的偏好性如何驱动根际微生物群落的构成与演替及其机制还需要深入的探讨[8].目前,受研究方法的局限,人们对根际中植物与微生物复杂的相互作用的认识还非常欠缺.本文综述了根际化学与生物学方法的最新进展,重点阐述了组学技术在根际科学研究中的机遇与挑战,强调了其在相关尺度上揭示根际过程与机制的必要性.
1 传统的根际化学与生物研究方法(Traditional analytical methods of chemicals and microorganisms in the rhizosphere)
1.1 根际化学组分的经典的研究方法
精确表征和准确定量根际土壤中的化合物类型是更好明晰根际化学过程的先决条件.但是,鉴于根际化学组分的庞杂性以及分离和提取根际土壤与土壤溶液的困难性,使得根-土界面化学组分的分析具有挑战性.一直以来,根际化学组分的测定主要聚焦于根系分泌物中的小分子如:低分子量有机酸的定性和定量测定[9−11],却对一些大分子化合物尤其是蛋白质、多糖和脂质的分析有所忽略,造成对根际化学多样性认识的偏差[16].检测根际化学组分的方法从最初的化学分析,逐渐发展到后来的光谱分析、色谱分析、质谱分析和色质联用技术等.
经典的根际化学分析方法包括滴定法和比色法,主要针对根际中的小分子化合物,如采用Folin-Ciocalteu 试剂比色法测定根际中酚酸类物质[9−10]、钼蓝法测定糖类物质[17].由于样品前处理简单、分析快捷、反映信息量大等特点,光谱法曾成为根际化学组分表征中应用最广泛的手段之一.光谱分析技术包括紫外、红外、荧光光谱和核磁共振谱(NMR)等,用于识别根际中化学组分的芳香性、官能团、疏水性和物质构成.比如,利用紫外光谱测定根际组分的特征参数A253/A203,这个参数的值大就说明芳香环上取代基类型以羧基、酯类、羰基、羟基等极性官能团为多,值小则表明主要为非极性的脂肪链官能团组成[18−19];根际组分的芳香性可以通过红外光谱的芳香性特征峰来判定[20];根际化学组分中类蛋白物质、类腐殖酸物质和类富里酸物质等可采用三维荧光光谱的不同激发波长、发射波长下的特征荧光峰进行指示[21];核磁共振谱能利用化合物在碳谱、氢谱上的化学位移等参数获得根际化合物的碳组分、氢组分信息[22−23].
色谱及色谱与质谱联用技术也是根际化学组分识别和鉴定的常用方法[24].利用得到的色谱和质谱信息,与相应的数据库匹配就可获取有关物质组成和结构的大量信息.色质联用技术包括气相色谱-质谱联用(GC-MS)和液相色谱-质谱联用(LC-MS).GC-MS 用于分离分析根际中挥发性和半挥发性的有机物,通过酯化、甲硅烷化、乙酰化和烷基化等衍生化反应后也可用来测定非挥发性和极性有机化合物[25−28].目前,GC-MS 已被广泛用于根系分泌物中低分子量有机酸的鉴定和定量研究[29],也有将其用于作物,如玉米、羽扇豆和小麦根系黏液中的脂肪酸、脂肪酸甲酯和脂肪酸酰胺的检测[30−33].然而,这些分析方法大多只是对根系分泌物进行了定性研究,并没有提供基于浓度的数据.HPLC 是检测分离非挥发性和极性根系分泌物最常用的方法[34],但灵敏度和选择性比GC-MS 低.作为替代技术,采用液相色谱-电喷雾电离质谱法(LC-ESI-MS),在正、负电离模式下对各种极性和中等极性化合物进行软电离,并提供高质量的选择性和灵敏度,从而使LC-ESI-MS 成为根际科学研究中一种有吸引力的技术[35−37].然而,ESI 与HPLC 流动相的兼容性方面存在一些缺陷,结合电化学抑制器的发展为LCMS 给根际研究的应用带来了更大的灵活性[38].总而言之,色谱及色谱串联低分辨质谱法适用于有标准品的目标物的测定,能够检测的化合物非常受限.因此,根系分泌物的相关分析在过去几十年仅实现了对诸如低分子量有机酸、部分糖、脂肪酸和氨基酸等少量化合物的识别.根际化学组成异常复杂,借助光谱手段、色谱分离技术及传统的低分辨质谱方法远不能解析根际化学分子的多样性.
1.2 根际微生物的传统研究方法
根际微生物通常采用培养和分离技术进行研究.微生物平板培养技术是一种传统的根际微生物研究方法[39].该法能大概估计土壤微生物的种类、数量和分布,但是,不能够对优势物种做进一步的鉴定,难以开展系统发育的分析.此外,培养基和培养条件的改变会对微生物形成选择性,且约99%以上的根际微生物不可培养[40].Biolog 氧化还原技术是以群落水平的碳源利用类型为基础,为研究根际土壤微生物功能多样性提供了一种简单而快速的方法[41−42].然而,源于不同微生物对同一碳源的利用不同,碳源的代谢指纹差异不能单纯地归因微生物群落数量和结构的差异,即代谢多样性不一定真实地反映整个根际微生物群落功能的多样性[43].而将微生物群落结构与其环境活性相关联的磷脂脂肪酸-稳定同位素探测(PLFA-SIP)的方法,可以获取根际微生物多样性更全面的信息[44−46].虽然这些方法克服了微生物培养技术的一些局限性,但是它们实现不了对根际微生物多样性更为精细的解析.
随后,分子生物学技术在根际微生物研究中得到越来越广泛的应用.1979年,Fischer 和Lerman 最先提出了变性梯度凝胶电泳(DGGE)技术,用于测定DNA 突变[47],并于1993年用于首次研究微生物群落结构[48].与DGGE 具有相似原理的温度梯度凝胶电泳(TGGE),利用温度梯度替代化学变性剂,也在微生物领域逐渐被应用.DGGE/TGGE 技术的优点是可重现性高、操作简单等,但对无荧光标记的DNA 不敏感,且只能分析微生物群落中数量超过1%的优势种群.末端限制性片段长度多态性(TRFLP)方法用来确定所选DNA 片段的长度多态性,并分析微生物群落结构和功能[49],在根际微生态研究方面的应用越来越普遍.但是,T-RFLP 法也存在很多潜在的缺陷,例如:单个峰包罗多个物种、单个物种分布在多个峰、物种和峰的随机错误匹配等等.DAN 测序Sanger 技术,具有读长长和准确性高等特点,也曾是根际微生物较为有效的鉴定方法[50].尽管根际中观察到的微生物差异和数量是巨大的,但尚缺乏有关其结构与功能多样性的详细信息.传统的聚合酶链反应方法逐渐被高速发展的高通量测序技术取代.
2 根际科学研究中组学方法的机遇与挑战(Opportunities and challenges of omics technology in rhizosphere science)
鉴于根际的异质性和复杂性,根际化学与生物多样性及其耦合关联性的研究要求采用先进的技术.新兴的技术需要同时满足灵敏度高、特异性强、重复性好,高时空分辨率、大动态范围和高通量等要求[51].最近,代谢组学、宏基因组学、转录组学和蛋白组学以及几者整合的多组学技术的发展拓展了根际科学研究的新方向,全方位、多层次提供植物根系分泌的动态变化特征和根际微生物群落结构与功能的详细信息,能够深入研究复杂的根际化学和微生物多样性,有助于深层次挖掘根-微生物-土壤界面的大量尚未揭示的关键过程与机制[52−55].根际科学中组学的研究方法、主要技术与平台、研究内容等汇总见表2.

表2 组学方法在根际科学研究中的汇总Table 2 Summary of the omics analysis in the study of rhizosphere science
2.1 根际科学中代谢组学研究
代谢组学研究策略中最实用的方法之一是代谢全谱的分析.它以组学的视角无偏向性地大规模检测分析所有的小分子代谢物,并采用生物信息学手段旨在发现整体代谢网络特征和涉及的代谢物变化特征,提升对基因、蛋白质和植物代谢之间联系的认识[56−57].代谢组学分析往往需要多个生物学重复,代谢物的提取、富集和去除杂质等样品前处理是关键.样本的前处理方法包括液-液萃取、固相萃取、加速溶剂萃取、超临界流体萃取、微波辅助萃取等[29].根和根际群落成员之间的相互作用主要是通过化学通讯来实现的,根际代谢组学有助于更好地理解这种化学对话[58].根际代谢组学聚焦于分析根-土壤界面的整个代谢组[24],即侧重于研究参与化学信号传递的初级代谢产物和植物天然产物以及与根系相关的微生物类群的分泌物.
GC-MS、LC-MS 以及NMR 是分析根际代谢组最为常用的技术,且GC-MS 和LC-MS 比NMR 更为灵敏[59−61].当前代谢组学研究对象面向微量化、复杂化及规模化,因此亟待发展更为高端的分析技术.相比于低分辨质谱,高分辨质谱因具有高灵敏度、高分辨率和精度、宽动态范围等优势逐渐成为组学研究不可或缺的工具[24].高分辨质谱提供化合物精确的质量数,能够区分复杂背景中的杂质及共流出物,降低了对样品前处理的要求.此外,根据精确质量数可以推测未知化合物的元素组成,为高通量筛选提供了线索.通过气相/液相色谱与高分辨质谱的联用的技术平台靶向和非靶向可以鉴定根际尽可能多的代谢物[62].气相色谱-飞行时间质谱(GC-TOF-MS)可用于快速,高灵敏度地检测植物根系大量代谢物小分子[63−64].应用GC-TOF-MS,Luo 等[56]分析了生态型东南景天根系分泌物的代谢谱,共检测出15 种潜在的生物标志物,具体包括有机酸、氨基酸、醇类、脂肪酸、酚类等组分.Zhao 等[65]通过氢核磁共振谱1H-NMR 结合GC-MS 的非靶向代谢组学分析,研究了水培体系中黄瓜幼苗植株对纳米铜的响应,发现纳米铜引发了黄瓜叶片和根系分泌物的代谢变化,成功地识别了纳米粒子诱导的生理反应.植物提取物中大部分代谢物都难挥发[66],不能采用GC 进行直接分析,而是需要将其转变为极性较小,挥发性更高的衍生物[62].而LC/MS 无需衍生,可以直接对代谢物进行代谢谱检测,是分析代谢物变异和生物代谢途径的理想平台[67].为了探索模式植物拟南芥根系分泌物的化学组分,Strehmel 等[68]开发了一种根系分泌代谢物的非靶向分析流程,以UPLC-ESI-QTOF/MS 为分析手段,共检测到100 多种代谢物,分类表征了90 种化合物的结构,其中42 种通过了已知化合物标准品的印证.Marti 等[69]基于UPLC-TOF-MS 的代谢组学方法评估了斜纹夜蛾侵染的玉米幼苗叶片、汁液、根系和根系分泌物的变化,鉴定出32 种差异代谢物,并通过微流核磁共振(CapNMR)对其进行结构表征,通过高通量直接纳米注入串联质谱(MS/MS)方法对9 种化合物进行了量化,研究表明食草动物的攻击会导致植物代谢物的诱导,这些代谢物对叶和根中的食草动物抗性具有不同的影响.采用HPLC、离子色谱结合GCTOF-MS,Carvalhais 等[70]分析了玉米根系分泌物中的氨基酸、有机酸和糖类,发现缺乏某些养分时根际代谢物的形态发生了定性和定量的变化,并且代谢物的分泌模式与土壤中养分的扩散特性存在联系.类似地,当植物叶片暴露于纳米二氧化硅(SiO2NPs)时,Tian 等[71]观察到根际代谢产物谱发生了显著变化,几种代谢物糖和糖醇、脂肪酸、少量有机酸包括的相对丰度显著增加;且氨基酸水平显著下降,表明根际碳氮库发生了变化.结合其他学者的多个研究[72−75]证实根际代谢组可以深入揭示生物体中污染物解毒的分子响应机制.
傅里叶变换离子回旋共振质谱(FT-ICR-MS)拥有超高的准确度、分辨率和超低的样品处理要求[76].能够进行非靶标代谢分析.FT-ICR-MS 可以同时检测数以千计的单个化学组分,通过内部校准来达成相对定量,它还可以根据精确的质量数确定根际代谢物所属的类别,是鉴定根际化学分子组成最有前途的分析技术之一[77].结合正、负离子模式,Miao 等[16]首次利用FT-ICR-MS 表征了植物根系分泌物的分子组成,共检测出8000 余种分子,研究发现与土壤DOM 相比,根系分泌物含有更多的蛋白质类、脂肪类和碳水类化合物,而木质素类化合物含量较少.Kaplan 等人[78]采用FT-ICR-MS 比较了湿地中植物根际土壤和本体土壤可溶性有机质组成,发现根际含有一些在非根际土壤中未鉴定的有机分子,且根际有机质分子通常具有更大的分子量,更少的芳香性,更多的羧酸盐和含氮COO 官能团以及更大的亲水性,表明不仅根际有机质的数量,而且其分子特征可能在一定程度上导致湿地中污染物的固定化增强,为污染湿地长期管理提供了启示.目前,FT-ICR-MS 易实现几十万甚至上百万的分辨率,以及亚ppm 级的质量准确度[79],提供可靠的元素组成和分子式信息,已成为研究根际中复杂化学组分的优选方法[80].然而,没有任何单一的分析方法或仪器组合能够覆盖给定样本的整个代谢组组成[60].在未来,扩展代谢组覆盖范围的新分析技术将非常重要.最近,静电场轨道阱(Orbitrap)质谱技术与LC 或GC 相结合,为植物分泌物和微生物的非靶向代谢组学提供了当前最佳选择.然而,在不久的将来,离子迁移光谱质谱法(IMS-MS)可能会成为非靶标代谢组学分析的拐点.其允许在一次运行中检测和表征数百种代谢物[81−82].因此,IMS-MS 代谢组学将在以前从未实现的时间范围内,从非常复杂的根际中快速准确地获得代谢组学图谱.此外,不同技术如:高分辨LC-MS 与GC-MS 和/或超高分辨FT-ICRMS 耦合起来,将有助于从复杂混合物中发现浓度极低的新化合物,获取广泛的代谢组学指纹.由此,基于高分辨质谱技术的高通量的组学技术有助于更加全面地分析根际化学分子多样性分布特征,逐渐成为根际科学的研究趋势.
尽管如此,根际代谢组学目前仍然是一个新兴领域,在理解根际复杂系统方面仍有很大的发展空间.一方面,由于根系分泌物取样的限制、组学分析平台的灵敏性以及相关尺度上实时追踪分泌物的时空动态的困难性[58],导致根际的代表性显示出明显不足.另一方面,为了准确理解代谢过程中植物和微生物两者复杂的相互作用,必须从微生物和植物以及它们相互作用的最终产物中获得单独的数据.研究者们通过不同的方法对植物渗出液收集进行了多次尝试[83],但根际代谢组学面临的最大挑战是区分微生物和植物各自的代谢产物,以及它们相互作用的最终产物.因此,有必要对根际不同部分进行精确取样和优化分析方案,以便更为精准表征根际和陆生生态系统中植物和微生物代谢过程的综合性质.
2.2 根际科学中宏基因组和转录组学研究
大多数栖息在根际区域的微生物是无法培养的,无从对其进行定性和定量分析.宏基因组、转录组等组学技术因突破了有些微生物不可培养的瓶颈而显示其优势.它们能够快速高效地获取植物根际专属微生物群落的详细信息[84−85].随着新一代高通量测序技术的创新与发展[86],宏基因组和转录组逐渐应用于研究根际微生物群落结构[87];推断根际核心微生物群落[88]及其代谢潜力[89];阐释植物-微生物相互作用[90];探讨外源有毒污染物处理下的根际微生物群落表达[91].利用宏基因组学和转录组平台对根际的研究主要集中于模式植物拟南芥[87−88]、豆类和谷物[89−91].这些研究提供了大量关于扰动响应以及根际群落的丰度、结构、多样性、空间分布和核心成员的信息,也为破译环境中有机和无机污染物解毒、积累、转运和降解的分子机制提供新的机遇[92].
宏基因组也称微生物环境基因组或元基因组,其以某一特定环境中微生物的基因组为研究对象,采用生物信息学的分析方法,研究微生物的多样性、微生物的群落结构,探索微生物的潜在功能以及与环境之间的互作关系.利用16SrDNA 测序的宏基因组学领域的第一项重大研究表明本体土壤和根际土壤的微生物群落显著不同,根际存在着多种特异的微生物种群[88].通过特定基因的扩增子靶向或鸟枪测序对植物根际、叶际或内生圈进行宏基因组分析,研究者们总结出寄主-微生物和微生物-微生物联合作用共同推动了根-土壤界面微生物的分化[87].Alzubaidy 等[93]运用宏基因组学方法研究了红海中红树林微生物群,结合454 焦磷酸测序技术探讨了与白骨壤相关的根际微生物群.这项研究首次深入了解了灰红树林根际土壤微生物的功能范围和多样性.Bhattacharyya 等[94]在他们的研究中描述了低地水稻的全基因组宏基因组测序分析,该结果筛选出优势细菌群落为扁平菌、变形菌和厚壁菌.Pascual 等[95]同时利用可培养和不可培养的策略来探索生长在西班牙内华达山脉国家公园的百里香根际的细菌群落,宏基因组学研究证明了居住在根际的一个小型“核心”微生物群落以及丛枝菌根真菌和其他有益微生物可以用作生物接种剂.下一代测序技术和相关生物信息学方法的发展使科学家能够设计策略和操作流程,以更好地了解亚基因组.Bell 等[86]进行了一项针对扩增子测序的研究发现,重金属对植物的胁迫决定微生物修复的强度,根际丛枝菌根真菌数量取决于重金属浓度水平[85].事实上,宏基因组学既可以通过靶向保守区域来确定群落结构,也可以使用重组DNA 的经典技术来确定任何环境中功能基因的可用性[92].因此,它有助于量化微生物群落内的转化效率.在植物修复过程中,一些功能未知的微生物菌株可能栖息在根际,并可能获取新污染物降解途径,为根际土壤中污染物去除的植物-微生物相互作用提供了见解.
转录组学关注整个微生物群落中的基因表达,并解释特定环境中微生物种群的动态功能,是研究复杂的微生物生理学、功能分析和未知的微生物群落结构的一种有力的技术.转录组还可以表征环境样本的实时mRNA 表达[96],通过阐明特定转录基因并对植物相关微生物群落进行功能分析,支持宏基因组学获得的数据.利用转录组学方法,研究人员比较了3 种不同作物:燕麦、豌豆和小麦的根际微生物群,发现豌豆根际比非根际中含有更多的微生物,并且微生物组表现出显著不同的根际特异性[5].此外,转录组法能够精确地表示复杂微生物群落中活跃表达的基因,从而剖析微生物组在特定污染环境下功能的改变,为土壤污染物转化或降解机制提供新见解.例如:de Menezes 等[97]研究暴露于菲的土壤微生物转录组,观测到双加氧酶及与解毒和应激反应相关的基因丰度增加.对田间生长的柳树根际和根的转录组进行测序时,Yergeau 等[98]发现与降解关联的转录物在污染土壤和柳树根际中明显富集,随后其消减与放线菌目、红螺旋菌目、伯克霍尔德菌目等相关[99].研究施加农药后玉米和大豆转录组时,发现草甘膦会影响作物细胞氨基酸代谢和碳水化合物的含量[91],mRNA 丰度与阿特拉津降解活性之间存在着密切的联系[100].转录组学分析结果表明,许多参与碳氢化合物生物降解的基因在种植园污染土壤中表达最为丰富,说明物种间的相互作用在污染物修复中具有越来越重要的意义.宏基因组学分析代表根际中微小数量的真核生物,而转录组学分析显示超过25%的真核生物能够被读取,这可能对受污染土壤根际的微生物功能起到重要指导作用[90].由此,宏基因组-转录组学方法的结合可能会解释根际微生物群在污染场地根际修复中的相对有效性.
2.3 根际科学中蛋白组学研究
蛋白组学对给定时间直接从环境样本中回收的所有蛋白质进行分析[101],在土壤研究方面有一定的优势.首先,由于mRNA 和蛋白质丰度之间的弱相关性,以及mRNA 转录后处理和修饰的复杂性,即使是基于核酸的方法也受到很大限制[102].其次,根际土壤中的生物过程也很复杂,不仅受到微生物的驱动,还受到生态系统中动植物的驱动,扩展土壤蛋白质鉴定对于理解土壤生态过程和影响根际土壤生态系统功能的环境因素至关重要[103].根际土壤蛋白质组学在蛋白水平上为土壤生态系统的生物过程提供了直接证据.因此,蛋白质组学可以作为研究根际土壤生物学的重要工具.
蛋白组学在根际中研究中的应用非常有限.Wang 等[104]建立了一种适用于不同土壤蛋白质的提取方法,利用双向凝胶电泳(2-DE)鉴定出接近1000 个具有高重现性的单独斑点,通过MALDI-TOF/TOFMS 成功识别了水稻土壤中122 种蛋白质的189 个斑点.对蛋白质组解析,发现根际大约三分之一的蛋白质点无法鉴定,且来自植物的保守蛋白构成了根际蛋白质组的特征分布;蛋白的功能揭示了土壤生物群落中涉及的各种代谢途径和信号转导,证实作物根际土壤中植物和微生物之间复杂的相互作用,为土壤生物学的宏蛋白质组学研究提供了一个范式.随后,Wu 等[105]发展了根际土壤的比较元蛋白质组学,阐释了糯稻连作障碍的潜在机制.根际土壤蛋白组学分析表明来源于植物和微生物的蛋白质在根际土壤生态系统的养分循环和能量流动中起着重要作用.进一步分析,发现根际土壤与非根际土壤中有33 个差异表达的蛋白质点.Hultman 等[106]在多年冻土中鉴定出7000 种蛋白质,无论是本体土壤还是根际土壤,其微生物多样性都远高于永久冻土;与低生长冻土相比,由于这些土壤类型中微生物的生长速率更高,散装土壤和根际土壤中独特蛋白质的数量可能比永久冻土多1 个数量级[107].迄今,蛋白质组学还被用于表征与凋落物分解相关的根际[108]、水稻根际/根组织中的甲烷诺菌[109]、作物根际[104,110]和黑块菌[111].水稻叶际、植物地上部和根际宏蛋白质组学分析识别了约4600 种蛋白质,主要功能涉及产甲烷和甲烷氧化.
同样,根际蛋白组学也是一种相对较新的方法,它面临着许多需要解决的经验、技术、计算和实验设计等挑战.根际存在高度的生物多样性、蛋白质冗余以及蛋白提取困难等普遍问题[112].由于生物体含有与其他许多蛋白质相似的冗余肽,通过将蛋白质消化成肽,其特异性丧失.这一挑战将基于自下而上的蛋白组学方法简化为一种主要用于评估相关生物群中蛋白质变化的技术.另一个值得注意的点是,自下而上蛋白质组学方法倾向于检测来自高度翻译蛋白质的肽,如核糖体蛋白、伴侣蛋白和其他参与细胞维持的蛋白.该方法测量完整的蛋白质,可以缓解冗余问题.因此,自上而下的蛋白组学为根际研究提供了另一个直接的机遇.即可以通过更佳的蛋白质组提取方法和分馏,降低肽的复杂性,提高蛋白质组的覆盖率.聚丙烯酰胺凝胶电泳(SDS)与下游代谢组学分析不兼容.一种从根际土壤中同时提取代谢物、蛋白质和脂质的新方法提供了改进的可能[113].进一步,在线2D 分离,包括直接电喷雾到质谱仪中的强阳离子交换,或高/低pH 反相的二维分离,也可以提高蛋白覆盖率[114−115].这些附加的分离技术降低了质量分析仪的复杂性,允许对单个蛋白质的覆盖范围进行更多检测.使用同位素标记相对和绝对定量(iTRAQ)以及串联质量标签(TMT)等标准肽标记方法不可能实现在一次分析中运行多个样本[116−117].此外,根际土壤样品的基质中含有丰富的腐殖酸,这阻碍了有效标记.而无标记样本无法多路复用,复接超蛋白质组学样品的首选方法是向微生物群落提供同位素标记的底物(例如13C、15N、18O 和2H),直接为根际和/或土壤样品中的定量蛋白质组学标记蛋白质[118].
2.4 多组学整合在根际科学中的研究
单一组学分析产生的数据仅仅提供了单一层次的理解,而生物数据集是异构的,因此需要多层网络关联来理解交互式作用,以概述生物学机制.多组学的整合使用整体而不是简化的生物学研究方法,在单个生物体和多生物体群落中,利用来自基因组、转录组、蛋白组和代谢组等,集成多个组学数据集信息[119].目前,根际复杂的相互作用的研究局限于尝试通过单一组学的方法来阐释[120],对根际科学中多组学方法的潜力仅仅进行了初步探讨.例如:联合DNA、mRNA 和蛋白组的多组学方法,Hultman 等[106]全面探索了永久冻土的微生物组,该研究是通过单独处理每个组,然后整合使用比率、基因组可视化和双标图来揭示所有组学的多重益处.多组学研究往往使用各种仪器直接收集和测量数据,至少分子生物学的“中心法则”:即遗传信息从DNA 到RNA 到蛋白质的流动仍适用,同时需要考虑多变量统计数据进行测量、分析和整合各组学.Larsen 等[121]的研究从基因组、蛋白质-蛋白质相互作用、DNA 结合基序和蛋白质组的先验知识与基于实验室的共培养和转录组学结合,以获得多组学关联结果,为植物-菌根相互作用提供了一个极好的框架,用于以综合的整体方法对各种组学进行建模.同时,基于网络分析和基于聚类方法是整合多个组学研究结果最流行的方法.Bersanelli 等[122]和de Keersmaecker 等[123]分别从数学和单一微生物基因组的角度对此进行了综述.此外,多组学将所获得的不同组学的信息关联,从整体研究生物系统对基因或环境变化的响应网络,有助于对机理的全面揭示.Haas 等[124]推荐了多组学方法,详细阐述了基因组学、宏转录组学和宏基因组学作为战略构建技术,以了解和丰富植物的根际,利用植物细菌相互作用来改善多环芳烃(PAHs)降解,在机理阐释的基础上作者提出并描述了使用组学方法对PAHs 降解的根际微生物组进行工程改造的前景.
虽然,多组学技术在根际科学中应用前景广阔,但新技术也面临一些困难和需要挑战的方面.首先,根际存在的大量微生物组,它们相互连接形成的微生物网络不仅与植物直接相互作用,也受根系分泌组分的驱动[125].由此,根际组学的数据体量大,数据整合异常复杂.其次,组学数据分布不规则,具有稀疏性,为确保统计学的有效性和可靠性,分析根际组学需要每个样本有更多的重复[126],这给根际组学的数据质量和数据管理带来新挑战.再者,组学中软件的大批数据是可用的,但不能充分分析和挖掘,即软件本身存在系统性问题,阻止了数据的有效利用.并且,传统的信息数据处理算法已不能满足大数据的处理要求.因此,多组学的大数据整合分析需要不断地更新软件、开发新算法和优化新方法[120,127].总之,多组学方法还存在着前期的实验设计和样品采集与制备,中期的数据文库系统的完善,后期生物学意义的阐释等多方面的挑战[128].
3 总结和展望(Research Outlook)
根土界面的化学反应与生物过程复杂.根际渗出物的化学表征和量化在很大程度上是一个分析挑战.根际科学正在迅速向跨学科方法过渡,需要多学科领域的交叉合作,包括化学、生物学、生物信息学、土壤学、数学、统计学和计算机科学等.针对土壤“黑箱”,传统的研究方法大大低估了根际化学和生物的多样性及其关联.近年,组学技术的出现将会推进根际科学的快速进展.本文综述了根际传统的化学与微生物分析方法,并重点讨论了新型组学技术在根际科学中应用进展与挑战.针对目前国内外研究的现状以及存在的问题,对本文作出如下总结和展望:
(1)全面了解根际化学多样性才能更好地理解根际界面过程.依靠光谱技术、色谱的分离手段以及传统的低分辨质谱分析方法,过去关于根系分泌物的检测只实现了对有限化合物的识别与鉴定.传统的研究方法远远无法解析根际分子组成的多样性.亟需开发和应用先进的采样程序,结合高选择性和高灵敏度的分析技术,准确量化根释放的多种化合物,开发研究自然条件下根际生态的新方法,完整理解根际动态过程.
(2)由于微生物的数量多样性,根际土壤代表了一个异常复杂的生态系统.传统的根际微生物培养法尚不能提供有关微生物种群结构和功能多样性的详细信息.典型的聚合酶链反应方法,逐渐被高速发展的高通量测序技术所替代.
(3)组学技术为根际科学的研究提供了良好的契机.基于高分辨质谱技术的组学方法已成为代谢物鉴定的重要手段,有助于深入揭示根际化学多样性过程.而基于宏基因组学、转录组学和蛋白组学等组学手段是研究根际微生物多样性的有力手段.它们能够识别基因、转录物和蛋白质,提供根际微生物组成及微生物组基因和蛋白的表达、功能特性等更详细的信息,全面揭示根际微生物的多样性.
(4)尽管单一组学技术可以表征根际化学和生物多样性丰富的信息,但是多组学的整合更是一种强有力的工具.多组学技术能够将根际微域群落结构的不同数据集与微生物功能、表达、翻译及最终的代谢物关联起来,有助于深层次挖掘根-微生物-土壤界面的大量尚未揭示的关键过程与机制.
(5)目前多组学技术在根际科学中的研究面临数据规模庞大、平行样品和大数据管理复杂、软件开发、模型构建、算法更新等直接的挑战.但总得说来,根际科学为多组学方法的应用提供了巨大的潜力.因此,应该强调的是,未来需要开发和应用先进的取样程序,发展更多的模型、框架和计算基础来实现根际多组学的全面整合.

