和厚朴酚对肺癌细胞紫杉醇耐药的逆转作用及对Notch信号通路的影响
尹波 黄海 刘勇 张金红 李俊 吴沣
肺癌是原发于气管、支气管和肺的恶性肿瘤,其发病率和死亡率正迅速上升,且呈世界性趋势[1-2]。此病发病隐匿,早期并无特异性症状,多数患者病情进展至晚期才确诊[3]。对于晚期肺癌患者,临床常用根治术联合术后化疗进行治疗,但术后产生肿瘤耐药严重影响化疗效果,不利于患者预后[4]。和厚朴酚分离自中药材厚朴,具有广泛的抗肿瘤活性,对肝癌、肺癌、胃肠道肿瘤等多种肿瘤均有抑制作用[5-6]。还有研究[7]报道,和厚朴酚可增加传统抗肿瘤药物的抗肿瘤作用,如紫杉醇、顺铂、多柔比星等。Notch信号通路不仅在细胞生长、增殖及凋亡中发挥重要的作用,而且持续激活可使得肿瘤细胞获得耐药性[8]。基于此,本研究拟探究和厚朴酚对肺癌细胞紫杉醇耐药的逆转作用及对Notch信号通路的影响,以期为提高肺癌治疗效果提供理论依据。
资料与方法
一、一般材料
1. 细胞株 紫杉醇耐药的肺癌细胞株A549/Taxol,上皮细胞样,贴壁生长,经STR鉴定,购自武汉普诺赛公司。
2. 主要仪器 Synergy HT多功能酶标仪购自美国伯腾公司;FACSCalibur流式细胞仪购自美国BD公司。
3. 药品与试剂 和厚朴酚纯度≥98%,购自成都徳思特公司;紫杉醇,国药准字H20057065,购自海南中化联合制药公司;1640培养基、胎牛血清购自美国Gibco公司;MTT试剂、Annecin V-FITC/PI细胞凋亡检测试剂盒购自上海碧云天生物技术公司;c-核蛋白类基因(c-Myc)、细胞周期蛋白D1(Cyclin D1)、切割后半胱氨酸蛋白酶-3(cleaved Caspase-3)、cleaved Caspase-9、E钙黏附蛋白(E-cadherin)、N钙黏附蛋白(N-cadherin)、波形蛋白(Vimentin)、Notch1、Jagged1和Hes1抗体,购自美国Cell Signaling Technology公司。
二、方法
1. 细胞分组与处理 (1)以不同浓度和厚朴酚(0、10、20、30、40、50 μmol/L)联合5 nmol/L紫杉醇[9]处理A549/Taxol细胞,筛选试验浓度。(2)将A450/Taxol细胞分为对照组(含10%胎牛血清的1640培养基正常培养)、紫杉醇组(5 nmol/L 紫杉醇处理24 h)、和厚朴酚+紫杉醇组(试验浓度和厚朴酚+5 nmol/L紫杉醇处理24 h)和Notch信号通路激活剂组(Jagged1/FC)(试验浓度和厚朴酚+5 nmol/L紫杉醇+500 μg/L Jagged1/FC处理24 h)。
2. MTT检测细胞增殖 取对数生长期A450/Taxol细胞,以1×105个/孔接种于96孔板,按分组给予相应处理24 h,再添加含有10%MTT试剂的培养基,继续培养4 h,弃去上清液,加入100 μL二甲基亚砜溶液溶解,放入多功能酶标仪,570 nm下测定各孔吸光度值,计算实验组吸光度/对照组吸光度×100%,表示细胞存活率。
3. 流式细胞术检测细胞凋亡 取对数生长期A450/Taxol细胞,以2×105个/孔接种于6孔板,按分组给予相应处理24 h,收集各组细胞,用预冷的PBS溶液洗涤3次,分别加入Annecin V-FITC、PI染液,暗室中反应30 min,上流式细胞仪检测细胞凋亡状态。
4. 划痕实验检测细胞迁移 取对数生长期A450/Taxol细胞,以2×105个/孔接种于6孔板,待细胞融合至80%左右时,用1 mL枪头垂直培养孔底部划线,再按分组给予相应处理24 h,光镜下观察并记录划痕宽度的变化,反映细胞迁移能力。
5. Western Blotting法检测细胞中相关蛋白表达 取对数生长期A450/Taxol细胞,以2×105个/孔接种于6孔板,按分组给予相应处理24 h,收集各组细胞,加入RIPA裂解液冰上反应40 min,收集上清液测定蛋白浓度,上样电泳后再电转,取出PVDF膜用5%脱脂牛奶液,室温下封闭2 h,4℃下分别孵育c-Myc、Cyclin D1、cleaved Caspase-3、cleaved Caspase-9、E-cadherin、N-cadherin、Vimentin、Notch1、Jagged1和Hes1抗体(1 ∶1 000)过夜,在37℃下孵育辣根标记的山羊抗兔/鼠IgG二抗30 min,最后滴加ECL发光剂显影,计算目的蛋白与内参β-actin灰度值比值表示目的蛋白相对表达量。
三、统计学分析
结 果
一、不同浓度和厚朴酚对A450/Taxol细胞增殖的影响
与0 μmol/L和厚朴酚组比较,30 μmol/L和厚朴酚组处理后细胞存活率明显降低(P<0.05);而5 nmol/L紫杉醇与20、30、40、50 μmol/L和厚朴酚联用时,细胞存活率较同组和厚朴酚组明显降低(P<0.05),其中30 μmol/L和厚朴酚抑制效果最佳,选用此浓度进行后续实验(见图1)。
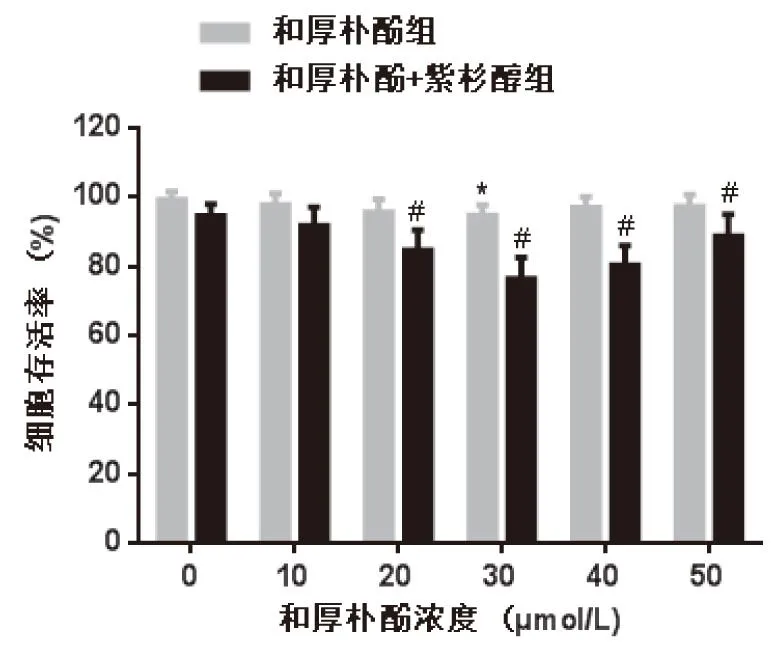
图1 不同浓度和厚朴酚对A450/Taxol细胞增殖的影响
二、和厚朴酚联合紫杉醇对A450/Taxol细胞增殖的影响
与对照组比较,紫杉醇组细胞存活率降低,c-Myc、Cyclin D1表达下调(P<0.05);与紫杉醇组比较,和厚朴酚+紫杉醇组细胞存活率降低,c-Myc、Cyclin D1表达下调(P<0.05);与和厚朴酚+紫杉醇组比较,Jagged1/FC组细胞存活率升高,c-Myc、Cyclin D1表达上调(P<0.05,见图2)。
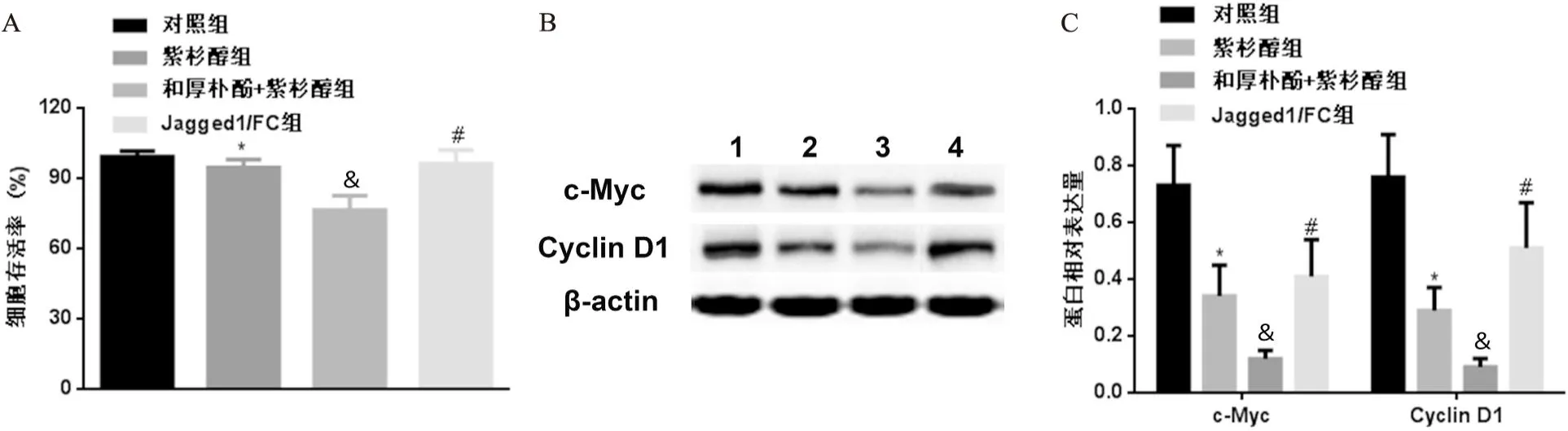
图2 和厚朴酚联合紫杉醇对A450/Taxol细胞增殖的影响
三、和厚朴酚联合紫杉醇对A450/Taxol细胞凋亡的影响
与对照组比较,紫杉醇组细胞凋亡率升高,cleaved Caspase-3、cleaved Caspase-9表达上调(P<0.05);与紫杉醇组比较,和厚朴酚+紫杉醇组细胞凋亡率升高,cleaved Caspase-3、cleaved Caspase-9表达上调(P<0.05);与和厚朴酚+紫杉醇组比较,Jagged1/FC组细胞凋亡率降低,cleaved Caspase-3、cleaved Caspase-9表达下调(P<0.05,见图3)。
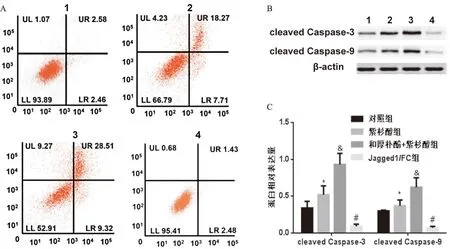
图3 和厚朴酚联合紫杉醇对A450/Taxol细胞凋亡的影响
四、和厚朴酚联合紫杉醇对A450/Taxol细胞迁移的影响
与对照组比较,紫杉醇组细胞迁移能力降低,E-cadherin表达上调,N-cadherin、Vimentin表达下调(P<0.05);与紫杉醇组比较,和厚朴酚+紫杉醇组细胞迁移能力降低,E-cadherin表达上调,N-cadherin、Vimentin表达下调(P<0.05);与和厚朴酚+紫杉醇组比较,Jagged1/FC组细胞迁移能力升高,E-cadherin表达下调,N-cadherin、Vimentin表达上调(P<0.05,见图4)。
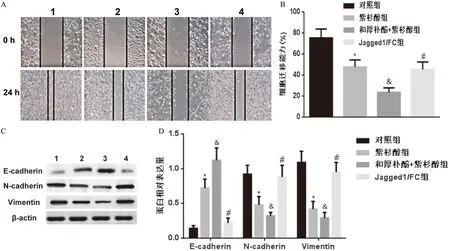
图4 和厚朴酚联合紫杉醇对A450/Taxol细胞迁移的影响
五、和厚朴酚联合紫杉醇对A450/Taxol细胞Notch信号通路的影响
与对照组比较,紫杉醇组Notch1、Jagged1和Hes1表达下调(P<0.05);与紫杉醇组比较,和厚朴酚+紫杉醇组Notch1、Jagged1和Hes1表达下调(P<0.05);与和厚朴酚+紫杉醇组比较,Jagged1/FC组Notch1、Jagged1和Hes1表达上调(P<0.05,见图5)。
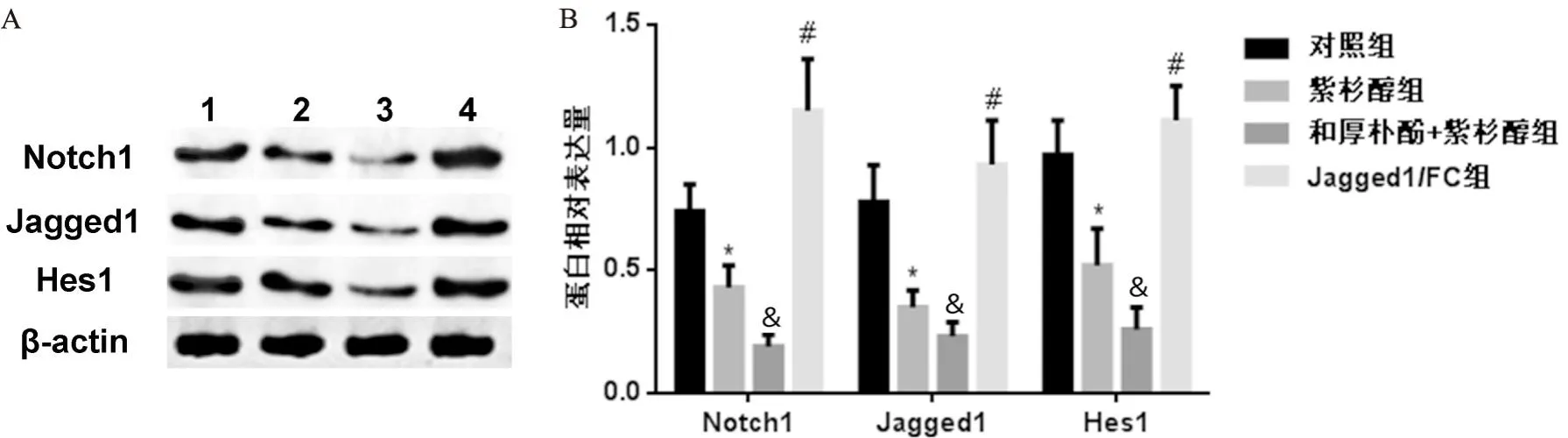
图5 和厚朴酚联合紫杉醇对A450/Taxol细胞Notch信号通路的影响
讨 论
紫杉醇是肺癌化疗中的常用药物,主要通过促进微管蛋白聚合,维持微管蛋白的稳定,抑制细胞有丝分裂,若出现耐药性提示紫杉醇治疗失败[10]。因此,临床亟需寻找可逆转紫杉醇耐药的方法,以提高疗效,改善患者预后。
联合用药是恶性肿瘤治疗的主要方式,生化调节剂通过作用于特定靶点或代谢环节,增强抗肿瘤药物疗效或降低不良反应,而且可逆转耐药性[11]。已有研究[12]报道,和厚朴酚与紫杉醇联用可发挥协同作用,诱导非小细胞肺癌凋亡。但和厚朴酚对肺癌细胞紫杉醇耐药是否可发挥逆转作用尚不清楚。本研究结果显示,和厚朴酚可促进紫杉醇对耐药细胞株A450/Taxol细胞增殖、迁移的抑制作用,并诱导其凋亡,提示和厚朴酚对肺癌细胞紫杉醇耐药具有逆转作用,紫杉醇方案中加用和厚朴酚有望成为治疗肺癌的新方法。
恶性肿瘤细胞具有增殖调控失调、浸润、转移等生物学特性[13]。c-Myc是Myc基因家族的重要亚型之一,被激活后可启动细胞分裂增殖程序,其表达不足的情况下,细胞增殖将受到抑制;Cyclin D1也是促进细胞增殖基因,可调控细胞从G1期向S期过渡[14-15]。细胞凋亡参与恶性肿瘤起始过程,并发挥负调控作用,该过程受多种基因控制,细胞内理化因素导致的DNA损伤等可降低线粒体膜电位,促进细胞色素C转入胞浆,活化Caspase-9,启动级联反应,最终活化Caspase-3,导致凋亡细胞解体[16]。上皮间质转化(EMT)是肿瘤细胞迁移的重要机制,具体表现为:(1)E-cadherin等上皮细胞标志物低表达或缺失,细胞骨架系统排列发生变化,细胞间黏附功能降低;(2)N-cadherin、Vimentin等间质细胞标志物高表达,细胞获得间质细胞特性,易向周围组织侵袭或转移[17]。本研究中,与紫杉醇组比较,和厚朴酚+紫杉醇组细胞c-Myc、Cyclin D1、N-cadherin、Vimentin表达下调,cleaved Caspase-3、cleaved Caspase-9、E-cadherin表达上调,进一步说明和厚朴酚可增强紫杉醇对A549/Taxol细胞增殖、凋亡及迁移的影响。
Notch信号通路与恶性肿瘤的发生发展密切相关,近期研究表明,Notch信号通路还与肿瘤耐药存在关联性:Takahashi[18]等研究显示,Notch信号通路参与非小细胞肺癌奥希替尼耐药,添加Notch信号通路抑制剂后可在体内外降低耐药性。陈立松等[8]发现,阻断Notch信号通路可抑制肺腺癌细胞的侵袭能力,并降低其对顺铂的耐药作用。Sun等[19]结果显示,阻断Notch信号通路可逆转EMT表型,增强宫颈癌细胞对紫杉醇治疗的敏感性。本研究通过Western Blotting法检测细胞中Notch信号通路蛋白Notch1、Jagged1和Hes1表达,发现单用紫杉醇处理后A549/Taxol细胞中Notch1、Jagged1和Hes1表达降低,与和厚朴酚联用后Notch1、Jagged1和Hes1表达进一步降低,但添加Notch信号通路激活剂Jagged1/FC后可逆转和厚朴酚的作用,表明和厚朴酚是通过抑制Notch信号通路的过度活化,逆转A549/Taxol细胞对紫杉醇的耐药作用。
综上所述,和厚朴酚可能抑制紫杉醇耐药肺癌细胞中Notch信号通路过度活化,增强紫杉醇对A549/Taxol细胞增殖、迁移的抑制作用,以及对凋亡的促进作用。但和厚朴酚对紫杉醇耐药的逆转作用是否还存在其他分子途径以及体内疗效如何,还有待深入分析。

