血清OPN、sPD-L1、miR-370在急性髓系白血病中的表达及与危险分层的关系
刘冰,王舒,杨莹
急性髓系白血病(acute myelogenous leukemia,AML)是因髓系造血干细胞发生恶性病变,诱使外周血与骨髓内的髓性细胞异常增生,从而转移入侵旁系器官与非造血组织,致使自发性出血、贫血、器官衰竭等恶性事件发生,甚至危及患者生命的恶性肿瘤[1]。据相关报道[2],AML发病率占白血病总发病率20%左右,其恶性程度高于其他类型白血病,60岁以上AML患者10年生存率低于5%。故及早发现并进行治疗,对延长患者预后生存时间极为重要。近年来,多位学者[3-4]发现AML发生发展与细胞凋亡、血管再生密切相关。其中,骨桥蛋白(OPN)是促进肿瘤血管生成的重要因子,可参与肿瘤浸润与转移的多项环节[5];可溶性程序性死亡因子配体-1(sPD-L1)通过与程序性死亡因子结合发生反应,进而保护肿瘤细胞免受免疫细胞杀死,最终促使肿瘤发生恶性病变[6];微小RNA-370(miR-370)属于肿瘤抑制因子,可抑制多种肿瘤的发生发展[7]。因此,本研究选取我院诊治的79例AML患者作为研究对象,分析血清OPN、sPD-L1、miR-370与不同危险分层AML的关联性。现报道如下。
1 资料与方法
1.1 一般资料 选取2021年11月—2023年2月我院诊治的79例AML患者作为研究对象,参照文献[8]中的分层标准将患者分为低危组(n=26)、中危组(n=39)和高危组(n=14)。3组一般资料比较,差异无统计学意义(P>0.05)。本研究已获得我院医学伦理委员会批准(伦理审批号:20231024-01)。

表1 3组一般资料比较
1.2 纳入与排除标准 纳入标准:(1)符合AML的诊断标准[8];(2)临床资料完整;(3)预计生存期>1年。排除标准:(1)重要脏器器官发生器质性病变患者;(2)并发全身性疾病患者;(3)精神系统、免疫系统疾病患者;(4)入组前已接受相关治疗患者;(5)其他类型白血病患者;(6)对本研究药物过敏患者;(7)存在心源性休克、永久性心脏内传导紊乱;(8)妊娠期或哺乳期女性。
1.3 方法
1.3.1 治疗方法 静脉注射盐酸阿糖胞苷1~3 mg/kg(国药一心制药,国药准字:H20040822,规格:0.3 g),1~2次/天,连续注射3 d;盐酸米托蒽醌(浙江瑞新,国药准字:H10960120,规格:5 mg)溶于NaCl注射液(50 mL)或5%葡萄糖注射液中滴注,一次4~8 mg/m2,1次/天,连续滴注3 d,间隔2~3周。根据患者临床治疗反应及时调整,周期为1个月。
1.3.2 检测方法 采集患者治疗前后清晨空腹静脉血5 mL。其中3 mL血液样本使用离心机(贝克曼Avanti J-15)3 500 r/min离心15 min分离血清,放置于-80 ℃冰箱冷冻保存。采用酶联免疫吸附法测定血清OPN、sPD-L1水平;采用荧光定量PCR仪(产地:美国ABI公司)应用2-△△Ct方法计算miR-370-3p;剩余2 mL血液样本放置于10%乙二胺四乙酸二钠30 μL试管混匀后,采用全自动血细胞分析仪(迈瑞6800)测定WBC、血红蛋白(Hb)水平。
1.3.3 分层标准 低危:Inv(16)or t(16;16);CBFB-MYH11;t(8;21) (q22;q22.1);RUNX1-RUNX1T1;NPM1突变不伴有FLT3—ITD突变或伴有ITD突变;以及双等位基因CEBPA突变。中危:NPM1突变和FLT3-ITD^high突变;野生型NPM1不伴有FLT-ITD突变或者伴有FLT3ITD^low突变(不伴有不良细胞遗传学异常);(t9;11)(p21.3;q23.3);MLLT3-KMT2A;未分到预后良好或者预后不良组的细胞遗传学异常。高危:(t6;9)(p23;q34.1);DEK-NUP214;(tv;11q23.3);KMT2A重排;(t9;22)(q34.1;q11.2);BCR-ABL1;inv(3)(q21.3q26.2)或者(t3;3)(q21.3;q26.2);GATA2,MECOM(EVI1)-5或者de(I5q);-7;-17/abn(17p)复杂染色体异常^2,染色单体野生型NPN1以及FIT3-ITD^high突变、RUNX1突变^3、ASXL突变^3、TP53突变。
1.4 观察指标 (1)比较3组治疗前后血清OPN、sPD-L1、miR-370水平;(2)比较3组治疗前后WBC、Hb水平;(3)采用Pearson分析治疗前后血清OPN、sPD-L1、miR-370水平与WBC、Hb水平的相关性;(4)采用受试者工作特征曲线(ROC)分析治疗前血清OPN、sPD-L1、miR-370水平联合检测对AML患者危险分层情况的诊断价值。
2 结果
2.1 3组血清OPN、sPD-L1、miR-370水平比较 3组治疗前后血清OPN、sPD-L1、miR-370水平低危组<中危组<高危组,差异具有统计学意义(P<0.05)。见表2。

表2 3组治疗前后血清OPN、sPD-L1、miR-370水平比较
2.2 3组WBC、Hb水平比较 3组治疗前后血清WBC水平比较:低危组<中危组<高危组,差异具有统计学意义(P<0.05);血清Hb水平比较:低危组>中危组>高危组,差异具有统计学意义(P<0.05)。见表3。

表3 3组治疗前后WBC、Hb水平比较
2.3 治疗前后血清OPN、sPD-L1、miR-370水平与WBC、Hb水平的相关性 AML患者治疗前后血清OPN、sPD-L1、miR-370水平与WBC水平呈正相关,与Hb水平呈负相关,差异具有统计学意义(P<0.05)。见表4。

表4 治疗前后血清OPN、sPD-L1、miR-370水平与WBC、Hb水平的相关性
2.4 血清OPN、sPD-L1、miR-370联合检测不同病情程度患者的诊断价值 以低危患者为阳性样本,以中高危患者为阴性样本绘制ROC曲线,结果显示,治疗前血清OPN、sPD-L1、miR-370联合检测的AUC为0.942,最佳敏感度、特异度分别为84.62%、92.45%(P<0.05)。见表5,图1。
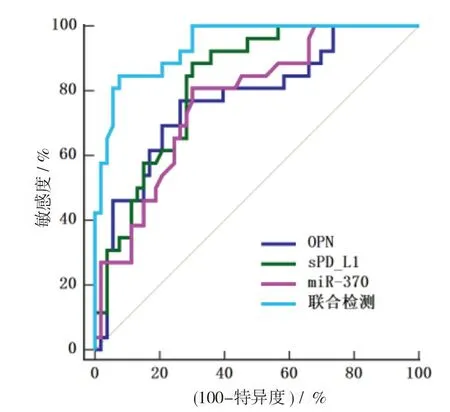
图1 血清OPN、sPD-L1、miR-370联合检测诊断AML的ROC曲线

表5 血清OPN、sPD-L1、miR-370联合检测不同病情程度患者的诊断价值
3 讨论
OPN是一种具有细胞因子活性的糖蛋白,由多种组织细胞合成分泌,可参与介导细胞黏附、免疫应答、肿瘤侵袭转移、血管生成及促炎症反应等多种生理病理生物学过程[9-11]。研究[12]发现,OPN通过与自身受体、CD44结合,以调控下游效应基因的表达,进而转导有关细胞信号通路,最终促使肿瘤血管生成。王海玲等[13]研究发现,白血病细胞基因表达与蛋白分泌水平会影响OPN表达。本研究针对危险分层进行分组,发现3组治疗前后OPN水平均随疾病程度加深呈下降趋势,表明OPN可能参与了疾病进展。后选取可直接反映疾病是否发生的“金标准”指标对比其治疗前后水平发现,WBC随疾病程度加深呈上升趋势,Hb水平随疾病程度加深呈下降趋势,均可直观反映疾病是否发生及疾病严重程度。本研究采用Pearson分析WBC、Hb与OPN的相关性发现,OPN与WBC水平呈正相关,与Hb水平呈负相关,证实OPN与疾病有关联性,与王海玲等[13]研究观点相似。其原因在于,白血病细胞为了获取足量营养成分,会激活有关信号转导途径,促使OPN浓度上升,建立新生血管通路,从而间接诱使病情恶化。
血清sPD-L1可作为反映细胞凋亡的细胞因子,主要分布于树突状细胞、淋巴细胞、肿瘤细胞内[14-15]。吴福群等[16]研究发现,AML患者治疗前后血清sPD-L1与血管内皮生长因子水平成正比(r1=0.447,r2=0.327),表明恶性细胞生长的内环境(sPD-L1)与恶性细胞增殖的外环境(血管内皮生长因子)互相影响。本研究Pearson分析显示血清sPD-L1与WBC、Hb密切相关,进一步说明了高浓度sPD-L1影响机体免疫功能运转,一定程度上会抑制Hb生成,使得机体处于恶性循环。本研究采用ROC发现,血清sPD-L1诊断AML,AUC为0.823,最佳敏感度、特异度为88.46%、69.81%,表明该指标具有较高的诊断效能,但特异性较低不利于临床辨别相似症状疾病,故建议与其他特异性较好指标联合使用以充分发挥该指标临床应用价值。推测其原因在于,当sPD-L1水平上升时,通过促使sPD-L1与自身受体程序性细胞死亡受体结合,传导抑制信号,抑制T细胞活化,影响免疫系统的正常运转,从而导致大量恶性造血干细胞避过免疫杀伤,影响细胞正常凋谢,最终致使疾病发生发展[17]。
miR-370是一种参与细胞增殖、转移、侵袭等活动的肿瘤标志物[18-20]。王庆义等[2]研究发现,miR-370-3p表达与治疗反应、风险状况、有无复发、WBC水平密切相关,且治疗完全缓解、无复发、高水平WBC患者miR-370-3p水平呈上升趋势。本研究发现不同危险分层患者治疗后疾病转归情况均不相同,治疗后低危患者miR-370水平趋于正常,中高危患者虽有较大改善,但仍处于危险范围,再次说明miR-370与风险状况、WBC水平密切相关,与王庆义等[2]研究观点相似。后经ROC分析结果显示,血清miR-370检测效能>0.7,表明miR-370具有一定临床使用价值且与疾病关联程度较高。
为深入验证血清OPN、sPD-L1、miR-370与AML的关联性及联合检测效能,故而绘制联合ROC曲线,发现治疗前血清联合检测可判断患者危险程度。
综上所述,血清OPN、sPD-L1、miR-370水平与AML病情程度、分层情况密切相关,可为临床诊疗提供参考。但本研究样本容量较小且未观察患者预后转归情况,其结果数据也可能存在偏倚,故后续研究者可进一步扩充样本量,以观察治疗前后缓解患者与未缓解患者间水平变化,从而为临床提供诊疗依据。

