中外创新药物医保支付的比较研究
于飞,卢静,高辰旭,李敬伟
(1.北京大学第一医院医保处,北京 100034;2.四川大学华西医院医保办公室,成都 610041;3.北京大学公共卫生学院,北京 100038)
近年来,药品研发市场规模逐步增长,创新药物获批数量表现平稳[1]。以2022年为例,美国、欧洲以及我国批准的创新药物数量分别为37、51、40个,虽增速较往年有所下降,但在基因治疗、细胞治疗等领域依然发展活跃[2]。与发达国家相比,我国创新药物仍存在原创能力不足、研发靶点集中度过高、成果应用转化能力匮乏[3]等问题,迫切需要相关政策进一步加强保障。医疗保险基金作为我国最大的医疗服务购买主体,更好地发挥其战略性购买作用对于规范引导创新药物发展具有重要意义。目前我国正着力推进创新药物国家医保谈判准入工作,期望“以量换价”实现患者与研发者的双赢局面,然而有研究表明,医保准入可以在短期内大幅提升药品使用量,但不一定能够带来药品销售收入的增长,政策理想效应仍受到诸多客观因素制约[4]。与此同时,在全面推进医保支付方式改革的背景下,创新药物的研发和应用面临的政策环境更加复杂。
目前多元复合式医保支付方式改革已全面启动,逐步探索康复、慢性病长期住院按床日付费,门诊特殊慢性病按人头付费,不宜打包付费的复杂病例和门诊费用按项目付费等。其中,按疾病诊断相关分组(diagnosis related groups,DRG)付费和按病种分值付费(big data diagnosis-intervention packet,DIP)的医保支付方式对提高医疗服务能力、保障医保基金合理使用具有重大意义,已成为我国当前医保支付改革的重点研究方向,同时也带来了各种效应。一方面,规范了医疗服务行为,促进了医保基金合理使用,减轻了患者经济负担;另一方面,尤其是药品和耗材等费用的控制,会制约创新药物这类价格相对高昂药品的应用,限制其临床的推广[5-6]。
如何在发挥按病种付费引导规范医疗行为作用的同时,给创新药物发展留出空间,是当前医保支付方式改革工作中亟需解决的问题。有研究显示,许多发达国家如美国、德国、法国等对创新药物实施额外支付政策[7-9]。我国部分省市也对按病种付费体系下创新药物的医保支付进行了积极探索,例如2022年7月,北京市医疗保障局印发的《CHS-DRG付费新药新技术除外支付管理办法(试行)》(京医保中心发〔2022〕30号)。但我国创新药物的支付还处于起步阶段,尚未建立明确标准。基于本文研究样本所在地区实行DRG政策,作者在本文比较国内外创新药物医保支付现状对创新药物的影响,探讨如何进一步建立和完善创新药物医保支付机制,为我国创新药物医保支付政策提供借鉴和参考。
1 我国DRG支付改革对创新药物的影响
我国《DRG/DIP支付方式改革三年行动计划》发布以来,医保支付改革工作正在全面加速推进。据统计,截至2022年底我国已有206个地区实施了DRG付费改革[10]。但在DRG付费改革中,创新药物因上市时间短、价格昂贵等原因,造成医疗机构使用即面临亏损,进而导致创新药物的临床应用受阻。
1.1我国创新药物DRG支付现状 目前,在DRG付费体系下,我国创新药物的支付方式主要分为除外/单独支付和补充支付两大类[8]。单独支付是将创新药物从DRG付费体系中剥离出来,予以单独付费,这种方式通常在创新药物临床使用和费用数据信息较少的情况下使用,操作简单,灵活性高,有利于鼓励创新。最有代表性的是2022年7月,北京市医疗保障局发布了《关于印发CHS-DRG付费新药新技术除外支付管理办法的通知(试行)》,允许对临床效果有较大提升且对DRG有较大影响的创新药物,进行申报后除外支付。这实际上是应对当前DRG付费机制不完善的一个过渡补充措施,从长远来看,两三年后还是要纳入DRG支付[11]。补充支付是在现有DRG付费标准基础上,对创新医药追加一定的点数补偿,相对单独支付而言,其更有利于对医保基金的控费。浙江省是我国最早实施DRG点数补偿的省份,其对机器人手术治疗、经导管主动脉瓣置入术、飞秒激光手术、肿瘤断层调强放疗4项新技术按级别给予不同激励点数,在结算时使用对应的DRG点数乘以差异系数等纳入补偿支付范围[12]。但补充支付操作复杂,需精密测算以保证创新药物在医疗机构有效使用并避免医保基金浪费。据报道,当前我国对创新药物推行除外/单独支付的城市主要包括北京、深圳、合肥、武汉、泉州、西安、济南、三明等;实施补充支付的城市主要包括金华、温州、杭州、宁波、梧州、南京等[13]。
整体而言,我国的创新药物医保支付机制还处于初步探索阶段,而且不同地区差异较大,比如北京虽率先出台了除外支付政策,但实施过程中如何进行动态调整,创新药物额外支付如何与长期DRG支付制度衔接也无具体说明,目前并没有实际运行的案例。
1.2我国DRG支付改革对创新药物的影响 近年来,我国已成为全球第二大医药市场,新药的研发投入增多,国产创新药物数量也逐渐增多[14-15]。DRG付费对控制医疗机构费用,提升医疗服务能力具有积极推进作用,但一定程度上限制影响了创新药物的临床使用和研发积极性。一方面,DRG付费改革的基本目标之一是控费,尤其是药耗占比,创新药物价格高,数据少,会影响临床的推广使用。另一方面,近年来国家医保大力推进创新药物纳入基本医保,从而改善了患者用药可负担性[16],但由于医保对这类药品价格压低,“以量换价”并未能使部分企业获得必要的市场价值回报和创新成本补偿,从而不得不将产品退出医保,企业的研发积极性也明显受挫。此外,如果创新药物仅依赖于基本医保,支付维度较为单一,无法支撑创新药物高质量发展[17]。如何在企业自主定价以鼓励药物创新和国家谈判价格以保证药物可及性之间寻求政策平衡,需要探索更加科学合理的创新药物管理和支付政策。
2 DRG支付方式改革对创新药物使用的国际经验
DRG支付标准基本上是依据3年内的历史费用数据进行测算,存在一定的延迟,对创新药物的临床推广使用带来挑战[18]。美国、法国和德国最早在医保支付改革中对创新药物采用短期单独支付或补充支付,经过一段时间的运行和调整后,最终将其纳入长期DRG分组[19-20]。
2.1美国的创新药物医保支付政策 美国是最早开始推行和实施DRG付费改革的国家,1983年在Medicare住院预付费体系中推行以DRG为基础的支付体系,后经多次调整更新,2007年开始使用按疾病严重级别分类的疾病相关分组(medicare severity diagnosis related groups,MS-DRG),并由美国医疗保险和医疗补助服务中心(Centers for Medicare &Medicaid Services,CMS)每年根据医院上一年度收集的数据对其进行调整,但MS-DRG调整后可能导致创新药物从上市到纳入DRG分组存在延迟,造成创新药物临床使用受限。为此,CMS推出了新技术额外支付项目(new technology add-on payments,NTAP)计划,对创新药物进行额外支付,直到将创新药物成本考虑到DRG的相对权重和支付标准中[21]。
CMS对纳入NTAP的创新药物提出明确的限定条件。首先,创新药物必须是近2~3年内被美国食品药品管理局(Food and Drug Administration,FDA)准许进入市场的药品;其次,使用创新药物后病例成本超过现有DRG组阈值;第三,与现有治疗药品相比具有显著临床获益[22]。只有满足上述限定条件,CMS才会对创新药物予以额外支付补偿,其支付标准为固定比例:取使用创新药物治疗费用超过DRG支付标准的65%和制造商提供的价格65%中较小值。一般经过2~3年额外支付,在数据积累充分后,CMS会通过调整权重、费率或增减DRG组别,将创新药物纳入DRG常规支付范围[23]。例如,美国嵌合抗原受体 T 细胞疗法 (chimeric antigenreceptor T cell therapy,CAR-T )于2017年上市,后于2018—2020年被纳入NTAP,在2021年CAR-T疗法临床应用数据积累充分后,纳入新建MS-DRG分组。
2.2法国的创新药物医保支付政策 法国1986年引入DRG分组,1992年发布首版DRG分组方案,命名为“groupehomogene de malades”(GHM))。2004年开始采用GHM用于医保支付,因GHM支付标准亦是依据历史费用计算,无法及时获得创新药物的使用数据,从而无法对创新药物给予合适的补偿支付,最终难以避免给医疗机构带来经济损失。为此于2004年起建立了附加清单(listeen sus,LES)政策,将创新药物纳入附加清单后,由法国卫生部门单独制定报销价格,予以单独支付,而不再将其纳入相应GHM病组打包支付,使医疗机构使用创新药物后得到充分补偿[24],对纳入附加清单的创新药物具有明确的限定标准,需同时满足“医保报销、住院使用、疗效显著、费用超标”4个要求,同时建立动态调整机制,每年根据“临床疗效”“治疗费用”“使用频率”3个维度对附加清单进行2次评估,从而决定是否对附加清单中的创新药物进行调整:如果临床疗效不达标则退出清单支付;在临床疗效达标基础上出现价格下降,不超过GHM付费标准的30%或使用频率在组内>80%,则纳入GHM组常规支付[25]。
2.3德国的创新药物医保支付政策 德国2003年开始实施German DRG(G-DRG)付费改革,德国医院赔付系统研究所(Institut für das Entgelt system imKrankenhaus,InEK)每年通过调整DRG分组规则、权重等对G-DRG目录进行更新,但G-DRG的分组及支付亦是依据前2年历史数据确定,进而对创新药物品在医疗机构中的推广使用造成了阻碍。2005年,建立了新诊断和治疗方法系统项目(Neue Untersuchungs und Behandlungsmethoden,NUB),用于DRG体系下的创新医药技术的额外支付[26]。同CMS相似,InEK对于纳入NUB的创新药物有以下规定条件:首先,申请的创新药物必须是近4年内进入临床使用的;其次,现有G-DRG无法对创新药物给出合理费用补偿;第三,创新药物在临床应用前应由医疗机构向InEK提出申请。创新药物只有经InEK审核通过后才可以获得NUB临时性支付,其支付标准由该医疗机构与当地疾病基金共同协商确定,而且NUB临时支付的有效期只有一年,故在纳入G-DRG报销之前,创新药物需要医疗机构每年向InEK申请并获得批准后才可以继续获得医保偿付。一般约在NUB临时支付3年,当创新药物的临床使用和支付费用获得充分信息后,InEK再将创新药物直接纳入DRG 常规支付[27]。
3 中外创新药物物医保支付机制的比较
国外发达国家及我国对创新药物DRG支付机制比较见表1—2。与我国相比,美国、法国、德国的创新药物的DRG付费机制起步较早、支付标准更加灵活、纳入审批标准也更加清晰。其发展经验,能够为我国相关政策的进一步完善提供有益启示。
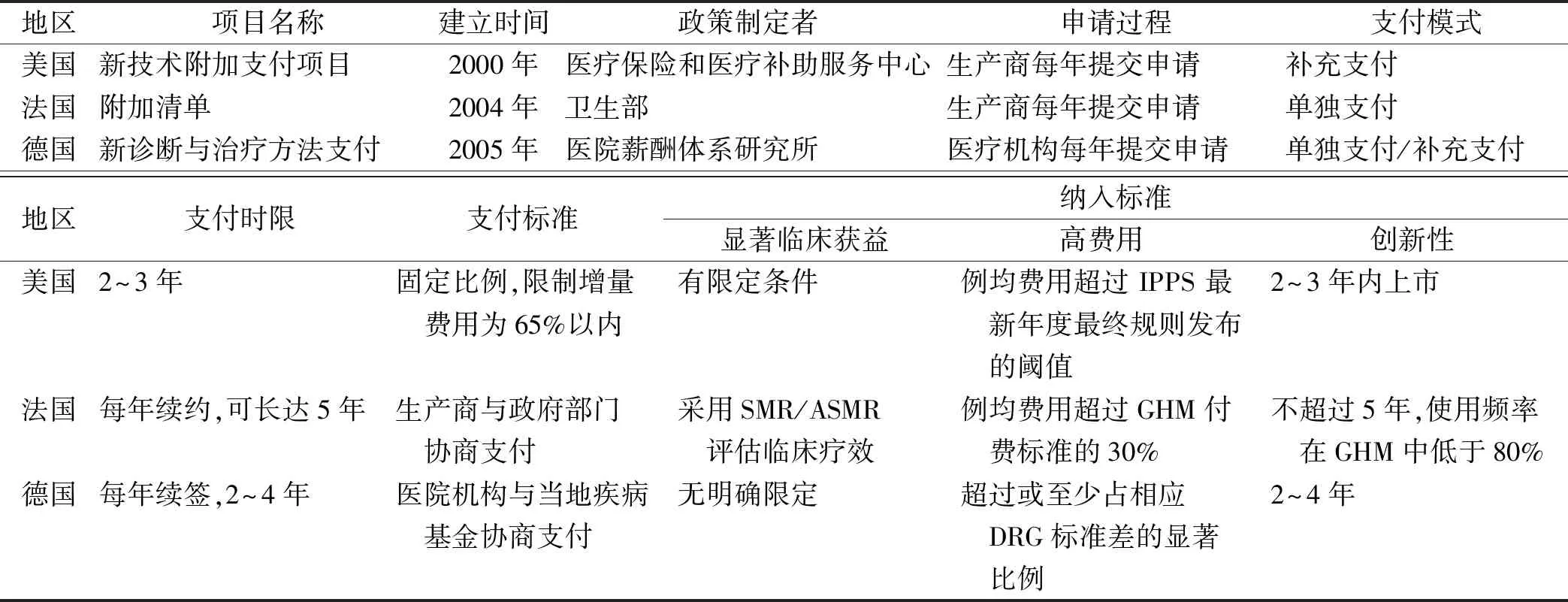
表1 美国、法国、德国创新药物医保支付情况

表2 我国浙江和北京创新药物医保支付情况
从政策制定和出台时间看,美国、法国、德国均在2005年以前由全国性机构负责实施修订DRG付费下对于创新药物的额外支付政策,目前已稳定运行多年,而我国相关政策设计才刚刚起步,且仅在浙江、北京等试点进行,处于初步探索阶段,缺乏统一顶层设计。在创新药物申请过程、支付模式方面,美国和法国是制造商提出申请,由多部门共同参与审核;德国是由医疗机构提出申请,并统一由InEK进行审批,我国北京也是由生产商提出申请;法国采用单独支付模式,美国采用补充支付模式,德国则采用单独/补充支付,而我国试点地区借鉴国外经验,如北京采用单独支付模式,浙江省则采用点数补偿模式。
相比而言,美国、法国及德国对创新药物额外支付的支付标准和纳入标准有明确的遴选要求和配套的审核流程,而我国处于起步阶段,尚未设立明确的药物遴选标准,存在较大差距。例如,美国CMS针对创新药物公布了明确的额外支付标准,采取固定比例补偿,如补偿金额为病例费用与DRG支付标准的差额的65%[28],从而保护生产商的研发积极性;法国与德国的支付标准设计则更加灵活,通过给予生产商或医疗机构充分的议价权,有助于保障政策的可接受性以及平衡各方需求[29];我国北京仅说明每年年终依据使用情况统一据实结算,但具体数据如何尚未可知。此外,美国、法国、德国等国家多对创新药物物的纳入标准有明确限定,主要体现为:是否有显著临床获益;高费用;创新性。在临床疗效方面,在美国申请补充支付的创新药物需满足“提供新的治疗选择”“改善疾病管理进程”“显著改善临床结局”三项条件之一[30];法国则对创新药物需考察临床效益水平(service médical rendu,SMR)与临床效益改善程度(amélioration du service médical rendu,ASMR),SMR等级越高,该药物则具有良好的获益风险,ASMR可分为Ⅰ-Ⅴ级,分别代表其临床疗效改善程度重大、重要、适当、较小、无明显改善5个级别,SMR和ASMR审核需达一定级别才可纳入附加清单[31]。我国北京市发布了《关于印发CHS-DRG付费新药新技术除外支付管理办法的通知(试行)》仅指出:3年内新上市的药品、医疗器械和新增医疗服务项目,符合临床效果有提升、对DRG 病组支付标准有较大影响,且病例数达到一定数目的,由企业自行申报除外支付。但怎样的符合临床效果有提升,如何判定尚无具体标准。在费用水平方面,美国、法国、德国对使用创新药物的病例费用设置有明确的阈值标准,位于阈值以上的高费用创新药物方能参与审核,如法国附加清单规定,使用创新药物的平均病例费用应超过相应病组付费标准的30%[32]。创新药物的创新性主要体现在上市时间、异质性及使用频率方面创新性方面,如上市时间,美国要求为2~3年[28],德国为2~4年[33],我国北京市、浙江省则规定为3年,法国虽对上市时间没明确要求,但在GHM组内使用频率低于80%[34]。由此可见,我国部分省市虽对创新药物除外支付发布操作方案,但对除外支付的纳入标准、流程及支付标准尚不明确,而通过深入剖析发达国家创新药物除外支付模式,可从操作层面为我国创新药物除外支付提供参考,建议后续设计除外支付政策时,合理选择除外模式,设置科学合理的纳入标准及支付标准。
4 我国创新药物医保支付改革思考及政策建议
我国多个地区对创新药物医保支付进行了积极探索,但目前尚处于起步阶段[17,35]。结合国外发达国家对创新药物支付模式的研究和解决方法,根据我国实践情况,对我国创新药物医保支付建立和完善提出以下几点建议。
4.1明确额外支付药物的纳入标准,规范操作流程 我国各地区对创新药物额外支付设置的入选标准较为宽泛。鉴于我国医保资金的有限性,建议我国对创新药物实施额外支付时,明确严格的纳入标准。比如对创新药物的上市时间一般要求在2~3年,后续如果获取充分的数据信息,则及时纳入DRG付费(如美国);在临床疗效评估方面,结合国外和我国实际情况制定科学、严谨、规范的评估体系,根据改进程度进行不同分级,如“填补临床空白”“扩展诊疗方案”“临床疗效更优”等级别,优先纳入级别更高的创新药物;对高费用进行科学测算,设定一个具体的阈值标准,一旦创新药物平均病例费用超过相应DRG付费标准阈值限制则纳入额外支付范围(如法国)。同时,可结合国际经验对纳入额外支付的创新药物建立规范的申请、审批流程,保证创新药物纳入、申请、审批、支付等全流程的规范化、合理化。
4.2选择合适的额外支付模式,兼顾控费与鼓励药物创新 目前,创新药物额外支付项目主要包括DRG体系外的单独支付(如法国)和DRG体系内的补充支付(如美国),一般是经过2~3年的短期额外支付,在积累数据获取充分信息后,以长期机制纳入DRG付费组进行常规打包支付。在我国,北京地区出台的新药新技术除外支付属于单独支付,而其他地区则通过调整补偿点数、权重及分组纳入DRG体系内的补充支付。不同的支付方式具有各自的优缺点,可借鉴国外经验及结合我国实践选择合适的支付模式,比如从短期支付来看,对于创新药物应用程度高、医保基金结余富足的一线大城市可采用单独支付模式;而对创新药物应用较少、医保结余较少的二三线城市则更适用补充支付模式。最终通过收集数据信息,调整DRG分组、权重及费率,将创新药物纳入长期DRG支付体系进行常规支付。因此,我国对创新药物选择额外支付时应充分考虑医保基金结余情况和创新药物发展水平,同时加强使用监测和评价,统筹兼顾医保基金合理使用和鼓励创新。
4.3建立动态调整机制,做好纳入常规DRG支付的准备 在DRG付费体系下,创新药物的除外支付具有短暂性、过渡性、动态性等特点,在其临床使用成熟、数据积累充分后最终会纳入长期DRG常规支付。各国在实施创新药物额外支付期间充分收集数据信息,并进行全面分析评估,为过渡转化为长期DRG支付做好衔接,比如美国通过调整DRG支付标准将创新药物纳入DRG组常规支付;法国每年会对创新药物进行重新评估,决定是否纳入长期DRG付费组。因此,我国在对创新药物实施额外支付同时应建立动态调整机制,借鉴国外经验,建立一套短期额外支付-数据分析评估-长期转入DRG支付的操作流程,首先建立数据收集系统,然后收集创新药物临床使用、费用、疗效等相关数据信息,进行充分分析评估,最终根据评估结果调整DRG分组、权重和费率,及时将创新药物品转入DRG付费体系中。
4.4完善多层次的保险体系,发挥多元化协同支付 多元协同的支付体系对保障创新药物的可及性具有重要意义,目前发达国家通过多方共付模式,极大推进了创新药物的临床使用和企业创新积极性,例如美国是多元保险支付体系和多方共付模式,并对创新药物给予不同支付比例[7];英国政府采取多种灵活准入的政策和方式,如创新支付准入协议、设立癌症基金等对创新药物进行补充支付的模式[36-37]。我国多层次医疗保障体系尚不健全,基本医保准入是当前创新药物支付的主要方式,但基本医保的主要功能是保基本,且医保定价偏低,这在一定程度上限制了创新药物的推广使用。因此,建议我国建立基于药物经济学的药品定价机制,科学合理地确定谈判价格,完善创新药物的支付体系,在基本医疗保险基础上,考虑设计相应的商业医疗保险和补充医疗保险等,充分调动社会资源,发挥多元化协同支付作用,从而切实降低患者费用负担,使得创新药物得到补偿,有助于创新药物发展。

