呼伦贝尔羊不同生长阶段瘤胃微生物变化与羊肉膻味相关微生物分析
赵烨嬋 欧慧敏 谭支良 焦金真*
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,畜禽养殖污染控制与资源化技术国家工程实验室,湖南省动物营养生理与代谢过程重点实验室,长沙 410125;2.中国科学院大学,北京 100049)
羊肉作为一种优质的蛋白质来源,以其营养丰富、肉质鲜美和独特风味深受消费者的喜爱[1]。作为养羊大国,我国的羊肉生产与消费一直处于世界首位,且近5年来国内产能及消费规模均保持着稳步增长的态势,2022年存栏量更是超过32亿只[2],但年人均消费量仅有3.6 kg,造成存栏量与人均消费量不匹配的原因是部分消费者无法接受羊肉所具有的特殊膻味[3]。因此,降低羊肉中的膻味将提升消费者对羊肉品质的接受度,进而提升其对羊肉的购买力。
众多研究结果显示,分布在不同脂肪组织的3种挥发性支链脂肪酸是羊肉特殊膻味的主要贡献者[4],包括4-甲基辛酸(4-methyloctanoic acid,MOA)、4-乙基辛酸(4-ethyloctanoic acid,EOA)和4-甲基壬酸(4-methylnonanoic acid,MNA)。这3种膻味脂肪酸微小的含量变化对羊肉膻味强弱有极大的影响[5],其含量与动物的年龄等因素有关。Gravador等[6]研究结果显示,293日龄绵羊皮下脂肪中的MOA和MNA含量是196日龄的3倍。本团队前期的研究结果也表明,呼伦贝尔羊背部皮下脂肪组织、肠系膜和肾周脂肪组织中的MOA、EOA及MNA的含量均随日龄增长而不断增加,各部位的膻味脂肪酸含量从断奶期(2.5月龄)到育肥中期(5月龄)有3~10倍的增加[7],提示此时期是羊肉中膻味脂肪酸大量沉积的关键生理时期。
瘤胃微生物参与反刍动物体内70%营养物质的分解代谢,通过其强大的酶系功能成为机体三大营养素代谢的重要参与者[8]。有报道称,瘤胃微生物与羊肉中的氨基酸及膻味脂肪酸等风味物质的沉积有关,风味氨基酸大多来自于菌体蛋白质以及瘤胃微生物对蛋白质原料的分解[9];瘤胃微生物生成的挥发性脂肪酸(VFA)在为机体供能的同时也为膻味脂肪酸的合成提供了短碳链[10]。由此可以推测,膻味脂肪酸在机体中的沉积规律可能与瘤胃微生物群落的定植有关,且羔羊生长发育过程中瘤胃微生物群落的重大改变同样值得关注[11]。本研究以呼伦贝尔羊各生长阶段间的瘤胃微生物变化为切入点,首先明确其定植规律,进而探寻其与羊肉膻味脂肪酸含量间的相关性,旨在寻找降低羊肉膻味的微生物靶点,并为下一步制定改善羊肉膻味的策略提供参考。
1 材料与方法
1.1 试验设计与饲养管理
本试验选取体况良好、初生体重[(3.63±0.46) kg]近似的新生呼伦贝尔羊32只,按照生长阶段(新生期、断奶期、育肥中期、育肥后期)分为4个处理,每个处理8只(公母各占1/2)。新生期羔羊在出生后1~2 d内屠宰采集样品,其余3组羔羊跟随母羊生活,自由吮乳,于6周龄起每日在08:00及16:00 2个时间段单独进入补饲栏内补饲固体开食料,直至2月龄断奶。羔羊断奶后单笼饲养,2~3月龄饲喂固体开食料,断奶期羔羊在2.5月龄屠宰采样。育肥期羊在3~6月龄饲喂育肥料,其中育肥中期于5月龄屠宰采样,育肥后期于6月龄屠宰采样[7]。开食料及育肥料组成及营养水平见表1。动物试验总饲养时长180 d,于2021年4~10月在内蒙古自治区呼伦贝尔鄂温克旗中国科学院草牧业工程试验站开展,本试验的所有程序遵循《实验动物管理与使用指南》要求,试验动物的使用经中国科学院亚热带农业生态研究所动物伦理委员会批准。

表1 开食料及育肥料组成及营养水平(干物质基础)
1.2 试验样品采集与保存
4个处理分别在对应采样节点进行屠宰采样,宰前禁食24 h,禁水2 h。背部皮下脂肪组织样品的采集和保存参考本团队之前的方法[7];屠宰后采集经4层无菌纱布过滤后的瘤胃液样品及瘤胃内容物样品于10 mL离心管中,投入装有液氮的泡沫箱暂存,后移入-80 ℃超低温冰箱中冷冻保存。
1.3 主要试剂与仪器设备
VFA标准溶液:乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸标准品(Sigma公司,色谱纯);偏磷酸(中国医药集团有限公司,分析纯);SENO粪便基因组DNA提取试剂盒(赛诺生物科技有限公司,SN0240);AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,美国)。
气相色谱仪(GC,Agilent-7890,美国);紫外可见光分光光度计(UV2450,天美科学仪器有限公司);超微量紫外分光光度计(Thermo Nano Drop-2000);0.22 μm滤膜(希波氏,天津市富集科技有限公司)。
1.4 试验方法
1.4.1 饲粮营养水平的测定
干物质(DM)含量根据GB/T 6435—2006测定,粗蛋白质(CP)含量根据GB/T 6432—1994测定,中性洗涤纤维(NDF)含量根据GB/T 20806—2006测定,酸性洗涤纤维(ADF)含量根据NY/T 1459—2007测定。代谢能(ME)计算公式如下:
代谢能(MJ/kg)=∑(A×B)。
式中:A为某种饲粮原料的代谢能(MJ/kg);B为该饲粮原料占饲粮的百分比(%);代谢能为所有饲粮原料的代谢能与其占饲粮的百分比的乘积之和。
1.4.2 瘤胃液VFA含量的测定
取适量样品稀释后加入25%偏磷酸溶液固定,经0.22 μm滤膜过滤至上样瓶,利用气相色谱仪参照Wang等[12]的方法进行检测。
1.4.3 瘤胃内容物16S rDNA的测序
1.4.3.1 内容物总DNA的提取及质量检测
利用SENO粪便基因组DNA提取试剂盒提取瘤胃微生物总DNA,用超微量紫外分光光度计检测A260/A280值,使用1%的琼脂糖凝胶进行电泳,以检测提取DNA的完整性和纯度。
1.4.3.2 PCR扩增及质量检测
采用通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-ACCTTGTTACGACTT-3′)对16S rDNA基因的V1~V9区进行PCR扩增。PCR反应程序为:95 ℃预变性2 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共27个循环;72 ℃终末延伸5 min。反应体系为:5×Fast Pfu Buffer 4.0 μL,2.5 mmol/L dNTPs 2.0 μL,上、下游引物(5 mmol/L)各0.8 μL,Fast Pfu Polymerase 0.4 μL,模板DNA 10 ng。使用2%琼脂糖凝胶电泳来分离提取相对应片段大小的PCR产物,并使用AxyPrep DNA凝胶提取试剂盒纯化。最后使用上海凌恩生物科技有限公司的PacBio Sequel Ⅱe平台测序。
1.4.3.3 生物信息数据处理
PacBio数据下机后,使用仪器自带的SMRTLINK 9.0软件进行一致性CCS序列(circular consensus sequencing)的获得。原始读取数据通过SMRT Portal进行质量控制,对包含10个连续相同碱基的序列进行过滤,并去除Barcode和引物序列。
对得到的序列使用UPARSE 7.1软件(http://drive5.com/uparse/)[13]以99%的相似度对操作分类单元(OTU)进行聚类,并使用UCHIME识别和去除嵌合序列[14]。采用RDP classifier贝叶斯算法(http://rdp.cme.msu.edu/)与Silva数据库(SSU132)比对,根据OTU代表序列进行分类注释,置信阈值为70%。
微生物α多样性的分析基于Mothur 1.21.1[15],使用OTU数目、Chao1指数及ACE指数反映微生物物种丰富度;用Shannon指数及Simpson指数反映微生物物种多样性;用覆盖率反映测序情况是否能说明样品真实情况。β多样性分析使用基于Bray-Curtis距离的主坐标分析(PCoA)。
将LefSE分析筛选出的标志性差异菌种相对丰度与本团队之前研究中所测定呼伦贝尔羊背部皮下脂肪的3种膻味脂肪酸含量[7]进行相关性分析,使用R 4.3.0软件psych包,进行斯皮尔曼(Spearman)相关系数(r)计算,r>0.5为正相关、r<-0.5为负相关,P<0.05作为相关性显著判断标准,应用R 4.3.0软件corrplot包,对矩阵基于欧几里德距离,按行以最长距离法进行层次聚类并绘图展示。
1.5 数据处理与统计分析
试验数据使用Excel 2016进行整理,采用SPSS 22.0统计软件one-way ANOVA程序进行单因素方差分析,差异显著时采用Duncan氏法进行多重比较检验,以P<0.05为差异显著。α多样性指数、微生物的门、属及种水平的相对丰度差异采用SPSS 22.0统计软件非参数Kruskal-Wallis检验分析,使用Duncan氏法进行多重比较,以P<0.05为差异显著;β多样性使用Adonis多因素方差分析评估不同生长阶段之间的差异,以P<0.05为差异显著。
2 结果与分析
2.1 不同阶段呼伦贝尔羊瘤胃VFA含量的变化
由表2可知,瘤胃液TVFA含量在新生期仅为11.27 mmol/L,与新生期相比,断奶期TVFA含量显著升高(P<0.05),育肥中期相较于新生期及断奶期均显著升高(P<0.05),育肥后期相较于育肥中期显著降低(P<0.05)。与新生期相比,断奶期乙酸摩尔比例显著下降(P<0.05),之后保持相对稳定;丙酸摩尔比例在育肥中期之前的变化很小,育肥后期较断奶期显著提升(P<0.05);断奶期的乙丙比显著低于其他3个阶段(P<0.05)。断奶期丁酸摩尔比例较新生期显著升高(P<0.05),育肥中期相较于断奶期有显著升高(P<0.05)。异丁酸、戊酸和异戊酸的摩尔比例均在断奶期最高,显著高于育肥期(P<0.05)。

表2 不同生长阶段呼伦贝尔羊瘤胃VFA含量
2.2 不同阶段呼伦贝尔羊瘤胃微生物多样性
2.2.1 不同阶段呼伦贝尔羊瘤胃微生物的α多样性
由表3可知,表征物种丰富度的3个指数(OTU数目、Chao1和ACE指数)在断奶期比新生期显著上升(P<0.05),在育肥后期比育肥中期显著上升(P<0.05),此变化规律表明瘤胃微生物物种随日龄增长而逐渐丰富。值得注意的是,反映多样性的Shannon指数在断奶期相较于新生期有显著提升(P<0.05),而Simpson指数这一时期显著下降(P<0.05),均提示瘤胃微生物的多样性在新生期至断奶期显著增加。4个生长阶段的覆盖率都大于97%,测序结果能较好地反映微生物真实情况。

表3 不同生长阶段呼伦贝尔羊瘤胃微生物的α多样性
2.2.2 不同阶段呼伦贝尔羊瘤胃微生物的β多样性
如图1所示,PCoA结果显示不同生长阶段的瘤胃微生物群落结构在主坐标系上有明显的分离,经Adonis检验差异显著(P<0.05),经配对Adonis检验得出每2个处理间都存在显著差异(P<0.05)。以上结果表明不同生长阶段间瘤胃微生物群落结构不同。

*表示差异显著(P<0.05)。下图同。*indicated significant difference (P<0.05). The same as below.
2.3 不同阶段呼伦贝尔羊瘤胃微生物群落组成
如图2-A所示,在相对丰度排在前15位的门中,厚壁菌门(Firmicutes,45.01%)、拟杆菌门(Bacteroidetes,43.14%)和变形菌门(Proteobacteria,5.28%)的相对丰度在各生长阶段均排前3位。拟杆菌门及变形菌门相对丰度均呈现随日龄增长而降低的变化规律,其中变形菌门相对丰度在新生期高达21.31%,至断奶期(1.84%)显著降低(P<0.05),随后相对稳定;拟杆菌门相对丰度在育肥中期(42.55%)较新生期(49.89%)无显著变化(P>0.05),育肥后期(37.10%)较育肥中期显著降低(P<0.05)。厚壁菌门相对丰度的变化规律恰恰相反,新生期(21.51%)相对丰度最低,断奶期相对丰度(50.42%)较新生期显著提升(P<0.05),随后保持相对稳定。互养菌门(Synergistetes)相对丰度的变化呈现随日龄增长而降低的变化规律;放线菌门(Actinobacteria)、螺旋菌门(Spirochaetota)及纤维杆菌门(Fibrobacteres)的相对丰度随日龄增长而显著升高(P<0.05)。
当时,我给这个戏乃至我们这个创作团队的定位就是——坚实的现实主义表演与中国戏曲传统程式美相融合;坚定的表现美学与中国戏曲写意美学相融合。
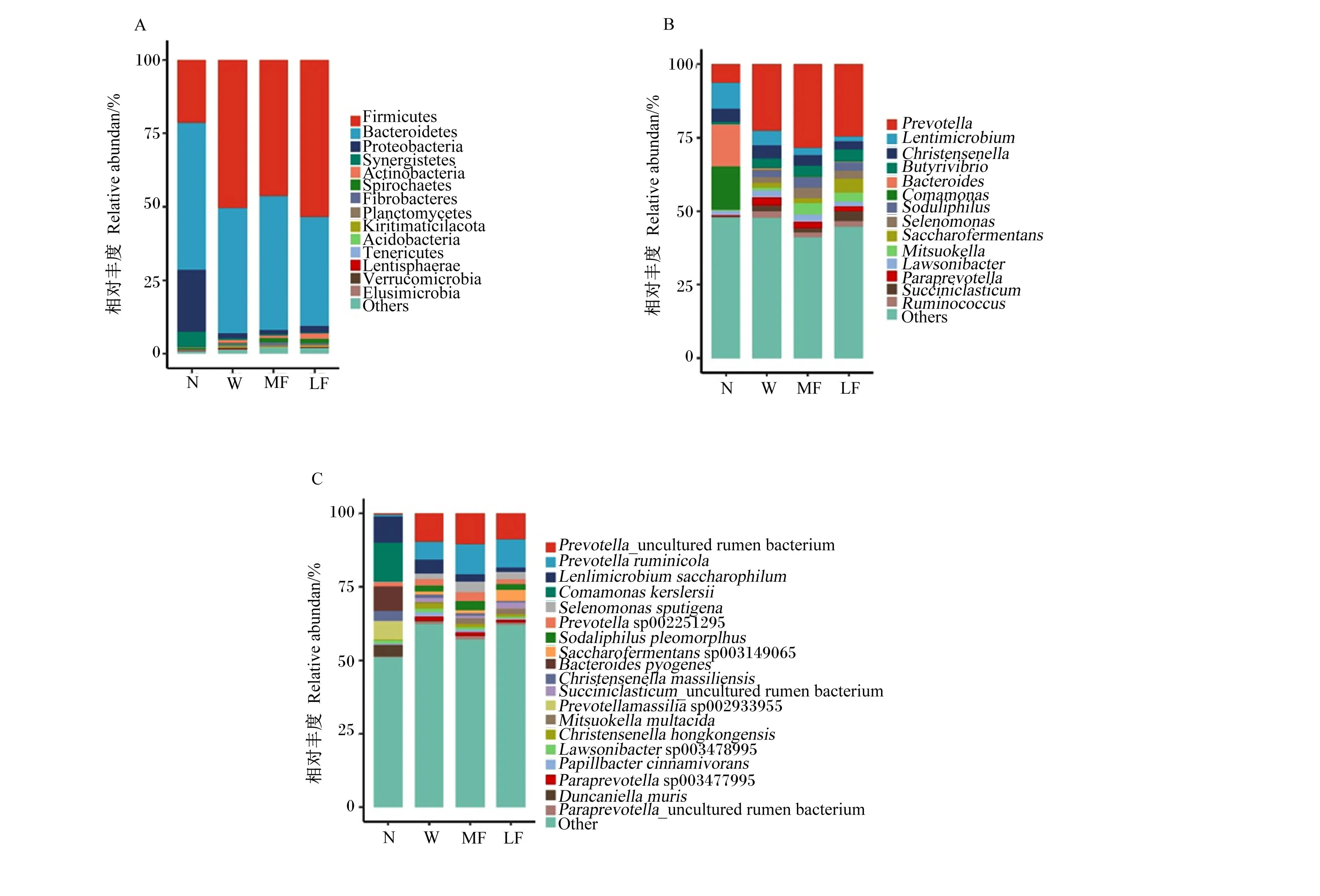
A:门水平 phylum level;B:属水平 genus level;C:种水平 species level。Firmicutes:厚壁菌门;Bacteroidota:拟杆菌门;Proteobacteria:变形菌门;Synergistetes:互养菌门;Actinobacteria:放线菌门;Spirochaetota:螺旋菌门;Fibrobacteres:纤维杆菌门;Planctomycetes:浮霉菌门;Acidobacteria:酸杆菌门;Tenericutes:软壁菌门;Lentisphaerae:黏胶球形菌门;Verrucomicrobia:疣微菌门;Others:其他;Prevotella:普雷沃氏菌属;Christensenella:克里斯滕森菌属;Butyrivibrio:丁酸弧菌属;Bacteroides:拟杆菌属;Comamonas:丛毛单胞菌属;Selenomonas:月形单胞菌属;Saccharofermentans:产乙酸糖发酵菌属;Mitsuokella:光冈菌属;Paraprevotella:帕拉普氏菌属;Succiniclasticum:解琥珀酸菌属;Ruminococcus:瘤胃球菌属;Prevotella_uncultured rumen bacterium:普雷沃氏菌属未培养瘤胃细菌;Prevotella ruminicola:栖瘤胃普雷沃氏菌;Prevotella sp002251295:普雷沃氏菌属sp002251295;Saccharofermentans sp003149065:产乙酸糖发酵菌属sp003149065; Succiniclasticum_uncultured rumen bacterium:解琥珀酸菌属未培养瘤胃细菌;Mitsuokella multacida:多酸光岗菌;Paraprevotella sp003477995:帕拉普氏菌属sp003477995; Paraprevotella_uncultured rumen bacterium:帕拉普氏菌属未培养瘤胃细菌。
如图2-B所示,前14个属中有12个属的相对丰度在各生长阶段间有显著差异(P<0.05)。拟杆菌属(Bacteroides,14.47%)、丛毛单胞菌属(Comamona,14.64%)及Lentimicrobium(8.81%)在新生期相对丰度最高,其相对丰度呈现随日龄增长而显著下降的变化规律(P<0.05)。普雷沃氏菌属(Prevotella)、光冈菌属(Mitsuokella)及月形单胞菌属(Selenomonas)的相对丰度在新生期~断奶期并无显著差异(P>0.05),至育肥中期相对丰度较新生期有显著提升(P<0.05)。丁酸弧菌属(Butyrivibrio)、Sodaliphilus、帕拉普氏菌属(Paraprevotella)、解琥珀酸菌属(Succiniclasticum)及瘤胃球菌属(Ruminococcus)的相对丰度在新生期均小于1.00%,断奶期相对于新生期显著上升(P<0.05),此后无显著变化(P>0.05)。产乙酸糖发酵菌属(Saccharofermentans)的相对丰度也呈现随日龄增长而上升的变化规律,断奶期相较于新生期及育肥后期相较于育肥中期均有显著升高(P<0.05)。
在种水平上(图2-C),前19个菌种的相对丰度在各生长阶段间均有显著差异(P<0.05)。在新生期相对丰度最高的6个优势菌种Comamonaskerstersii(13.39%)、Lentimicrobiumsaccharophilum(8.80%)、Bacteroidespyogenes(8.30%)、Prevotellamassiliasp002933955(6.14%)、Duncaniellamuris(3.94%)及Christensenellamassiliensis(3.47%)的相对丰度均是新生期相比于断奶期显著下降(P<0.05),在之后的阶段一直保持在1.00%以下的稳定水平。栖瘤胃普雷沃氏菌(Prevotellaruminicola)、Selenomonassputigena及多酸光岗菌(Mitsuokellamultacida)的相对丰度在断奶期相较于新生期无显著差异(P>0.05),而育肥中期较断奶期相对丰度显著上升(P<0.05),随后保持相对稳定。产乙酸糖发酵菌属sp003149065(Saccharofermentanssp003149065)、Sodaliphiluspleomorphus、解琥珀酸菌属未培养瘤胃细菌(Succiniclasticum_uncultured rumen bacterium)、帕拉普氏菌属sp003477995 (Paraprevotellasp003477995)、帕拉普氏菌属未培养瘤胃细菌(Paraprevotella_uncultured rumen bacterium)及Christensenellahongkongensis的相对丰度变化规律均是随日龄增长而上升,其中产乙酸糖发酵菌属sp003149065的相对丰度在断奶期相较于新生期及育肥后期相较于育肥中期均有显著提升(P<0.05),其余6个菌种的相对丰度在断奶期比新生期均显著上升(P<0.05),随后保持稳定。
2.4 不同生长阶段呼伦贝尔羊瘤胃标志性差异菌群
如图3所示的LefSE分析结果在属、种水平分别筛选出15、19个不同生长阶段间的瘤胃标志性差异菌群。属水平上(图3-A),以拟杆菌属、瘤胃球菌属为代表的12个标志性差异菌属均在2.3中进行过分析,其相对丰度较高且在各生长阶段间有显著差异。值得注意的是,未在2.3所分析过的肠单胞菌属(Intestinimonas)、脱硫弧菌属(Desulfovibrio)及卟琳单胞菌属(Porphyromonas)均是在新生期显著富集(P<0.05,LDA>4)。种水平上(图3-B),以栖瘤胃普雷沃菌、Sodaliphiluspleomorphus、产乙酸糖发酵菌属sp003149065为代表的14个标志性差异菌种相对丰度的显著变化与2.3中结果相吻合。值得关注的是解肝素拟杆菌(Bacteroidesheparinolyticus)、牙髓卟啉单胞菌(Porphyromonasendodontalis)、普雷沃氏菌属sp002298815(Prevotellasp002298815)、Bacteroidespyogenes_A及Desulfovibriopiger_A 5个未在2.3分析过的菌种均在新生期显著富集(P<0.05,LDA>4)。

A:属水平 genus level;B.种水平 species level。g_Comamonas:丛毛单胞菌属;g_Bacteroides:拟杆菌属; g_Porphyromonas:卟琳单胞菌属;g_Intestinimonas:肠单胞菌属;g_Desulfovibrioi:脱硫弧菌属;g_Ruminococcus:瘤胃球菌属;g_Paraprevotella:帕拉普氏菌属;g_Prevotella:普雷沃氏菌属;g_Mitsuokella:光冈菌属;g_Selenomonas:月形单胞菌属;g_Saccharofermentans:产乙酸糖发酵菌属;g_Butyrivibrio:丁酸弧菌属;g_Succiniclasticum:解琥珀酸菌属; s_Bacteroides heparinolyticus:解肝素拟杆菌; s_Porphyromonas endodontalis:牙髓卟啉单胞菌;s_Prevotella sp002298815:普雷沃氏菌属sp002298815; s_Prevotella uncultured rumen bacterium:普雷沃氏菌属未培养瘤胃细菌;s_Prevotella ruminicola:栖瘤胃普雷沃氏菌; s_Mitsuokella multacida:多酸光岗菌;s_Prevotella sp002251295:普雷沃氏菌属sp002251295;s_Saccharofermentans sp003149065:产乙酸糖发酵菌属sp003149065 s_Succiniclasticum uncultured rumen bacterium:解琥珀酸菌属未培养瘤胃细菌。
2.5 膻味脂肪酸含量与瘤胃差异微生物的相关性分析
不同生长阶段呼伦贝尔羊背部皮下脂肪膻味脂肪 MOA、EOA和MNA含量数据来自本团队之前的研究[7]。总体来说,3种膻味脂肪酸的含量随日龄增长而显著升高,且在断奶期~育肥期增长速率最快。如图4所示,相关性聚类分析共筛选出15个与膻味脂肪酸含量显著相关的标志性差异菌种,聚为2大类:解肝素拟杆菌、牙髓卟啉单胞菌及Prevotellamassiliasp002933955等11个菌种与膻味脂肪酸含量呈显著的负相关(P<0.05,r<-0.5);而显著正相关(P<0.05,r>0.5)的菌种则仅筛选出普雷沃氏菌属未培养瘤胃细菌(Prevotella_uncultured rumen bacterium)、栖瘤胃普雷沃菌、产乙酸糖发酵菌属sp003149065及多酸光岗菌4种。

*:P<0.05;**:P<0.01;r value:相关系数 relative coefficient。
3 讨 论
3.1 不同生长阶段瘤胃内VFA含量的变化分析
反刍动物的瘤胃微生物发酵饲料生成VFA,为机体提供了超过75%的能量[8],同时未被机体利用的短链脂肪酸也为合成肌肉及脂肪组织中的膻味脂肪酸提供短碳链[17]。随着羊的生长发育,瘤胃功能逐渐趋于完善,发酵能力也有相对应的提升。
本试验中,新生期羔羊瘤胃内VFA含量虽然总体较低,但可达到检测限,这与王彩莲等[18]及Abecia等[19]在出生后2~3 d的羔羊及犊牛中的发现结果一致,其可能的原因是羔羊在出生后1~2 d内随母羊生活时有母乳进食,一些厌氧瘤胃微生物也随之迅速定植[20],未发育的瘤胃也具有一定的消化及产生VFA的能力。有研究表明,瘤胃内TVFA含量会随固体采食量的上升而增加[21]。本试验结果显示,瘤胃TVFA含量在新生期至育肥中期随生长发育有持续的显著上升,能够解释这一现象的可能原因除了瘤胃发酵能力的发育性变化之外,还有从母乳转变为高蛋白质开食料又转变为高碳水育肥料的饲粮结构的影响[22]。而解释TVFA含量在育肥中期至育肥后期显著下降的可能原因则是为了满足机体快速育肥时需要大量能量,成熟的瘤胃具有快速吸收VFA进入血液循环的能力[23]。以上瘤胃TVFA含量的变化规律可以与前人在牛[24]及绵羊[25]上的试验结果相印证。从瘤胃VFA的组成来看,在新生期之后呼伦尔羊瘤胃乙酸摩尔比例随羊日龄增长而显著降低,而丁酸和丙酸的摩尔比例分别在断奶期及新生期之后显著增加,说明随着羊日龄的增长,瘤胃发酵逐渐趋向于产生更多丁酸及丙酸,解释这一现象的可能原因一方面是羊饮食结构由母乳向开食料及育肥料的转变[26],另一方面则是瘤胃微生物区系呈现发育性改变[11]。
3.2 不同生长阶段瘤胃微生物微生物群落变化及差异分析
反刍动物的瘤胃微生物区系是一个复杂而功能强大的系统,能够帮助机体降解饲料而从中获得营养物质,并且还有调节机体的免疫反应、维持瘤胃内环境稳态等重要作用。本试验的α多样性结果显示,瘤胃微生物丰富度和多样性随着呼伦贝尔羊的生长发育而增加,在断奶期的增加最明显,同时β多样性的结果表明,每个发育阶段的瘤胃具有其独特的微生物。可能的原因一方面是饲粮的影响,即断奶期羔羊的营养来源由母乳变为固体开食料,底物的改变可以直接影响瘤胃微生物的定殖和繁殖[26];另一方面则是由于新生期至断奶期羔羊处于快速生长发育阶段,受采食的刺激,瘤胃需要快速地消化吸收营养物质[27],导致瘤胃菌群多样性显著增加。
反刍动物瘤胃微生物群落随年龄呈现发育性变化,且所有年龄阶段的优势菌门均为拟杆菌门、厚壁菌门和变形菌门[28]。在本试验中,厚壁菌门相对丰度在断奶期突增,而变形菌门的变化规律与之相反;新生期羔羊瘤胃拟杆菌门占比达到50%,在断奶期和育肥后期有所下降。本试验中,断奶期至育肥期羔羊的营养结构从高蛋白质转变为高碳水化合物,这一底物的改变也可能导致了瘤胃优势菌门相对丰度的改变。
在属水平上,丛毛单胞菌属、肠单胞菌属等在新生期显著富集,而在其后相对丰度显著降低至接近0水平。前人研究发现,新生期羔羊瘤胃微生物区系中存在一些与母乳的消化或免疫功能相关的暂时性菌群,开食料的摄入及周围环境微生物的进入促使羔羊瘤胃建立新的优势菌群[29],与本试验中这一结果相符。瘤胃球菌属、丁酸弧菌属、Sodaliphilu等的功能均与纤维降解[30]相关,其相对丰度在断奶期显著上升的可能原因是羔羊饲粮由母乳向含有粗纤维的固体饲料转变而导致的微生物区系的适应性改变[31]。普雷沃氏菌属作为反刍动物瘤胃中核心菌属,在降解多糖和蛋白质的过程中都发挥着积极作用[32],其相对丰度在育肥期的显著上升可能与此时期机体的快速育肥相关,其代谢产物为丙酸盐及琥珀酸盐等VFA前体物[33]也可解释这一时期瘤胃TVFA含量的上升。据报道,光冈菌属的发酵产物主要是乳酸盐[34],而月形单胞菌属可利用乳酸盐为底物生成丙酸盐[35],其相对丰度在育肥中期的显著上升,或许可以解释该时期丙酸摩尔比例显著上升。这一结果与Koike等[36]在断奶犊牛上发现,光冈菌属相对丰度与瘤胃液丙酸摩尔比例呈显著正相关相吻合。值得关注的还有产乙酸糖发酵菌属,在多种碳水化合物的发酵过程中发挥着重要作用[37],其功能可以解释其相对丰度在新生期至断奶期和育肥中期至育肥后期的2次显著上升。
在种水平上,栖瘤胃普雷沃氏菌及多酸光岗菌等相对丰度在育肥中期的显著提升也与其功能有关。Nathani等[38]报道称,栖瘤胃普雷沃氏菌不仅直接参与蛋白质和可溶性碳水化合物的降解,而且还通过与瘤胃球菌等纤维分解菌的协同作用加速纤维的分解。Luo等[39]研究发现,多酸光岗菌因其以乳酸盐及乙酸盐为发酵底物而生成丙酸盐的功能特性,且其相对丰度与后肠段中丙酸盐的含量呈显著正相关。Selenomonassputigena在瘤胃中的主要作用是分解乳酸并转化为VFA为宿主供能[40],LefSE结果表明其在育肥中期显著富集,也与该时期机体所需大量能量相关。产乙酸糖发酵菌属sp003149065、解琥珀酸菌属未培养瘤胃细菌及帕拉普氏菌属sp003477995等菌种功能尚不明确,仍需进一步探究。此外,值得注意的是LefSE结果显示,解肝素拟杆菌作为一种潜在的母畜子宫蓄脓致病菌[41]在新生期瘤胃显著富集,可能的原因是母体对新生羔羊的微生物垂直传递。综上所述,瘤胃微生物群落整体呈现生长发育性变化,随日龄增长,逐步由母乳消化相关的兼性厌氧菌转变为碳水化合物发酵相关的严格厌氧菌。
3.3 膻味脂肪酸含量与瘤胃微生物的相关性分析
有研究表明,瘤胃微生物生成大量VFA,当其生成的丙酸盐含量超过肝脏的糖异生能力时,丙酸盐在转化成琥珀酸的中间体甲基丙二酸会被脂肪组织利用,成为脂肪酸从头合成途径的底物,最终生成支链脂肪酸,其中就包括3种膻味脂肪酸[42]。与此同时,饲粮中支链氨基酸为膻味脂肪酸的合成提供支链碳链,可在瘤胃微生物分泌的脱氢酶及羧化酶等作用下,可进一步生成支链脂肪酸[43]。
本研究其中之一的目的就是筛选与膻味脂肪酸合成相关的瘤胃微生物种群。值得注意的是,普雷沃氏菌属未培养瘤胃细菌和栖瘤胃普雷沃菌的相对丰度与膻味脂肪酸含量呈显著正相关,且在育肥期相对丰度最高。以上菌均可利用多种底物,直接或间接生成大量VFA[39],结合此生长阶段机体处于快速育肥,亟需合成、累积大量脂肪[44],可推测它们可能在膻味脂肪酸的合成通路上扮演重要角色。另一正相关菌种-产乙酸糖发酵菌属sp003149065在育肥后期显著富集,该菌种除了具有生成乙酸的功能还可能具有促进丁酸的生成的作用[37],此结果提示丁酸可能与膻味脂肪酸大量合成相关。有趣的是,多酸光岗菌相对丰度与丙酸盐的大量生成相关[39],此结果进一步提示膻味脂肪酸的合成或与瘤胃发酵类型从乙酸型向丙酸或丁酸型的转变有关。VFA的种类对膻味脂肪酸合成的影响及其具体机制有待进一步研究。同样重要的是,在我们筛选的11种负相关菌群中,Sun等[45]研究发现,Lentimicrobiumsaccharophilum可利用多糖底物,生成大量乙酸盐,其余10种负相关菌种的具体功能尚不清楚,仍待进一步探索。综上所述,在找准降低羊肉膻味的关键窗口期之后筛选出可能与膻味脂肪酸合成及沉积相关的关键菌种后,对其具体机制的阐释及如何靶向调控以实现降膻目的便是下一步研究的重点。
4 结 论
呼伦贝尔羊瘤胃微生物的组成和群落结构存在生长阶段间的差异性:随着羊的生长发育,瘤胃微生物表现出更高的丰富度和多样性,菌群构成呈发育性变化。瘤胃微生物组成由母乳消化相关的兼性厌氧菌逐步向碳水化合物发酵相关的严格厌氧菌转变。筛选出与膻味脂肪酸沉积存在相关性的标志性菌种15个,其中解肝素拟杆菌、Lentimicrobiumsaccharophilum等11个菌种相对丰度呈显著负相关;栖瘤胃普雷沃氏菌及多酸光岗菌等4个菌种相对丰度呈显著正相关,可作为后续阻抑膻味物质沉积的微生物调控靶点。

