道路运输对羔羊体重、血液生化及临床指标的影响
■ 杨欣雨 陈聪慧 夏 翠 段春辉* 刘月琴 王 媛 张英杰 马玉忠
(1.河北农业大学动物科技学院,河北保定 071000;2.河北农业大学动物医学院,河北保定 071000;3.衡水志豪畜牧科技有限公司,河北衡水 053401;4.河北省肉羊产业研究院,河北衡水 053401)
应激反应是指动物在受到各种刺激时所做出的本能反应,过度应激反应常常引起动物机体代谢和机能紊乱,导致其行为改变、免疫力降低甚至死亡[1]。研究表明,运输应激可使动物的死亡率高达30%以上,给养殖业造成巨大损失[2]。由于我国肉羊异地育肥模式较普遍,道路运输产生的应激对羊只健康状况的影响越来越受到养殖者关注。
应激动物的行为以及血液生理生化指标的变化常作为动物是否发生应激反应的有效指征[3]。运输应激条件下,一方面,动物表现为体温升高,呼吸和脉搏频率加快等一系列行为变化,另一方面,机体启动以下丘脑-垂体-肾上腺皮质轴(HPA)兴奋为代表的神经内分泌反应,使血液内激素、内分泌物、抗体水平发生改变,从而调控机体的免疫和炎症反应[4]。血液是维持生命的重要组成部分,参与体内多种代谢过程,具有运输、缓冲和防御等功能,血液生理生化指标会随着周围环境的变化发生改变,可以反映出动物的代谢状况和健康程度,因此,血液生化指标的分析可直接用于临床检测和诊断[5]。
目前,针对运输应激的研究多限于鸡[6]、牛[7]、猪[8]等,但关于运输应激对羊的研究报道较少,本试验通过建立8 h道路运输模型,研究运输对羔羊体重、血液免疫指标、应激指标、抗氧化指标及临床指标的影响,旨在为生产中缓解羊只运输应激提供理论依据。
1 材料与方法
1.1 时间与地点
本试验开展于河北省张家口某羊场,试验羊运输时间为2021年6月8日。
1.2 试验动物及试验设计
选取10 只4 月龄健康羔羊,平均体重(21.52±1.22) kg,试验羊进行8 h 的长途运输,运输前后测定羔羊的临床指标,并采集静脉血液,用于后期指标监测。
运输模型:运输车为三层半挂车,其车厢长宽高为13 m×2.55 m×4 m。运输前彻底消毒运输车,于2021年6月8日09:00将试验羊抱入运输车,当天17:00运输结束,共8 h道路运输,运输前6 h禁饲,运输途中禁食禁水,到达目的地后1 h 内不提供饲料饮水。运输道路选择外环公路和坑洼公路,时速30~70 km/h,运输当天平均温度和平均湿度分别为22 ℃和21%。
1.3 样品采集
运输前后羔羊颈静脉采取5 mL 血液置于加抗凝剂的EDTA 试管,盖上试管塞并轻轻摇匀用于血常规检验;另外,再取5 mL 血液室温静置0.5 h 后放入离心机(LDS-10G 型低速大容量离心机,北京雷渤尔离心机有限公司),3 500 r/min 离心10 min 分离血清于-20 ℃保存,用于血液其他指标监测。
1.4 测定指标及方法
1.4.1 临床指标
运输前后立即测定羔羊的呼吸频率(观察胸腹起伏2 min,取均值)、体温(将兽用体温计用医用乙醇消毒并涂抹凡士林后由肛门插入湖羊直肠约2/3 处,5 min 后读数作为羔羊体温)、心率(使用兽用听诊器记录3~5 肋间心跳次数2 min,取均值),运输前称量空腹重,运输结束后立即称重。
1.4.2 应激激素和酶指标
采用酶联免疫分析法(ELISA),按照试剂盒说明书检测血清应激指标:促肾上腺皮质激素(ACTH)、皮质醇(COR)、肌酸激酶(CK)、乳酸脱氢酶(LDH)、谷丙转氨酶(ALT),试剂盒购自南京建成生物工程研究所有限公司。
1.4.3 免疫指标
采用酶联免疫分析法(ELISA),按照试剂盒说明书检测血清应激指标:免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、白介素-1β(IL-1β)含量,试剂盒购自南京建成生物工程研究所有限公司。
1.4.4 生化指标
采用江苏泽诚生物技术有限公司生产的CLS880型全自动生化分析仪测定葡萄糖(GLU)、血清总蛋白(TP)、血清白蛋白(ALB)等生化指标。
1.4.5 血常规指标
采用深圳市普康电子有限公司生产的PE-6800型全自动血细胞分析仪测定白细胞总数(WBC)、红细胞总数(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、红细胞平均体积(MCV)、血红蛋白含量(MCH)、血红蛋白浓度(MCHC)、血小板总数(PLT)、红细胞分布宽度变异系数(RDW)、血小板平均体积(MPV)、血小板分宽度布(PDW)等血常规指标。
1.5 数据统计分析
试验数据采用统计学分析软件SPSS 19.0 进行单因素ANOVA检验,以P>0.05表示差异不显著,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 道路运输对羔羊临床指标的影响
由表1 可知,经道路运输后羔羊的体温、呼吸频率和脉搏极显著升高(P<0.01),体重降低了15.31%,差异显著(P<0.05)。
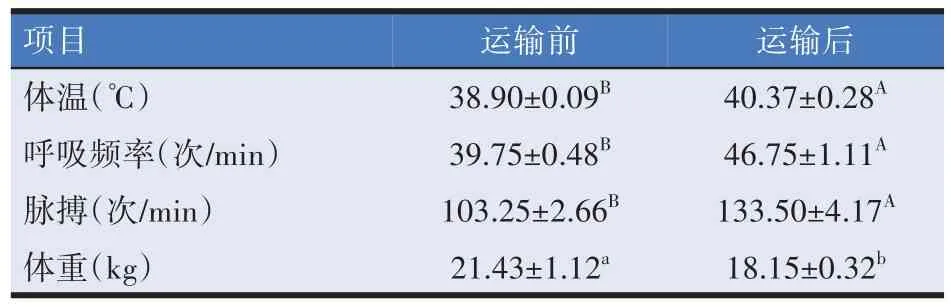
表1 道路运输对羔羊临床指标的影响
2.2 道路运输对羔羊应激激素和酶水平的影响
由表2可知,羔羊运输后血清中ACTH、LDH 水平极显著升高(P<0.01),COR 和CK 水平显著升高(P<0.05),ALT水平没有显著变化(P>0.05)。
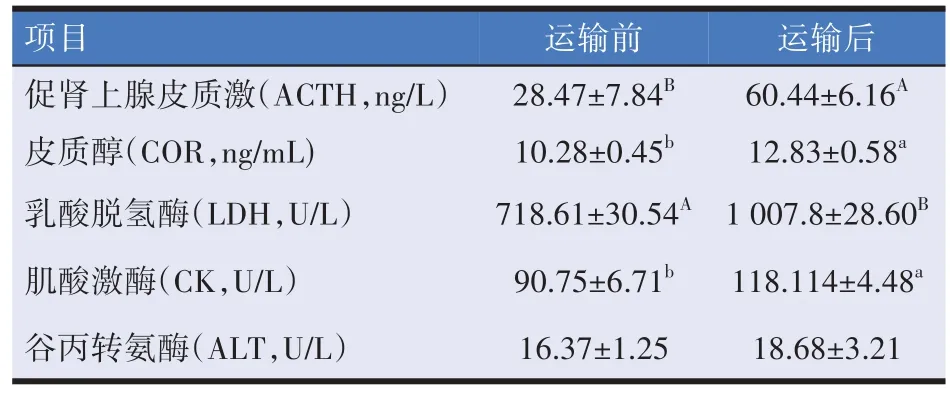
表2 道路运输对羔羊应激激素和酶水平的影响
2.3 道路运输对羔羊免疫指标的影响
由表3 可知,与运输前相比,羔羊运输后血清中IgA、IgG 水平显著降低(P<0.05),IL-6 水平显著升高(P<0.05);运输后羔羊血清中IgM、IFN-γ、TNF-α、IL-1β水平与运输前差异不显著(P>0.05)。
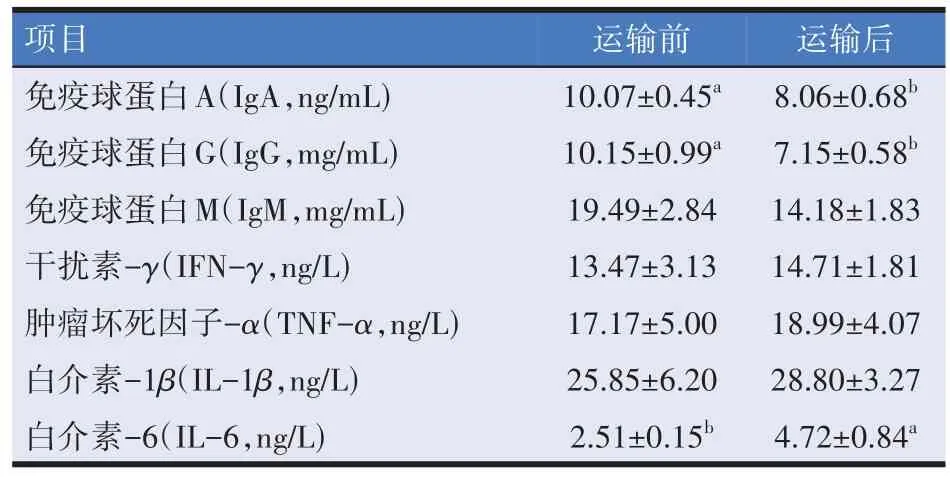
表3 道路运输对羔羊免疫指标的影响
2.4 道路运输对羔羊生化指标的影响
由表4 可知,羔羊血清运输后血清中GLU、TP、ALB水平显著降低(P<0.05)。
2.5 道路运输对羔羊血常规指标的影响
由表5 可知,羔羊运输后血液中RBC、HCT、MCH水平显著降低(P<0.05),MCV 水平极显著降低(P<0.01)。运输后羔羊血液中WBC水平显著高于运输前(P<0.05),道路运输对血液中HGB、MCHC、PLT、RDW、MPV、PDW水平无显著影响(P>0.05)。
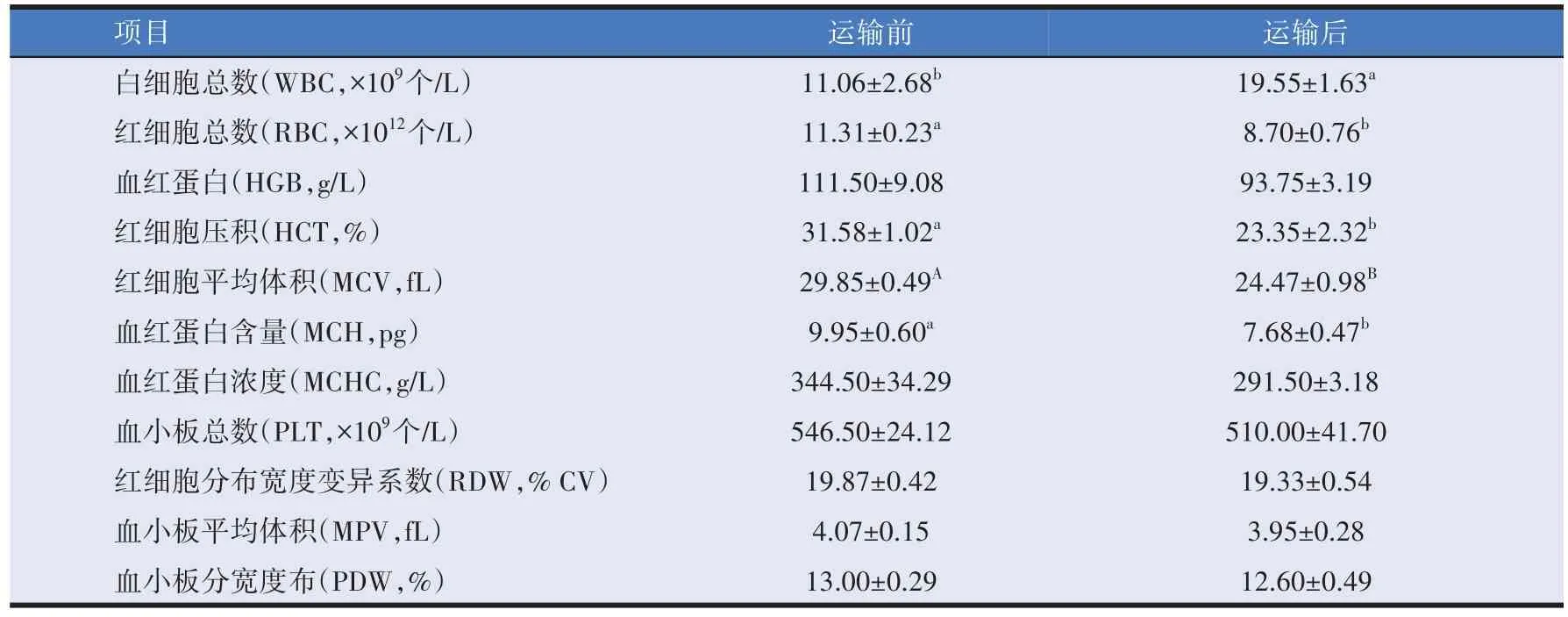
表5 道路运输对羔羊血常规指标的影响
3 讨论
3.1 道路运输对羔羊临床指标的影响
长途运输过程中,噪音、拥挤、温度和禁食禁水等应激源首先会使动物发生体温升高、呼吸频率、脉搏加快等临床现象,这些现象是判断动物是否发生应激最直观的方法之一,故临床上常用体温、呼吸频率、脉搏三大指标来判断动物机体的健康状况,同时也是衡量羊[9]、牛[10]、马[11]应激的常用指标。Dixit 等[12]对肉牛分别进行30 min和14 h运输,发现短时间和长时间运输均使肉牛体温显著升高。卢曾奎等[13]研究发现,热应激后湖羊的呼吸频率显著加快、体温显著升高。以上研究表明,应激会使反刍动物体温和呼吸频率升高,本研究也取得一致的结果。本试验中,与运输前相比,羔羊运输后体温、呼吸频率和脉搏均极显著升高,说明8 h 的长途运输使羔羊发生了应激反应。运输后羔羊体温、呼吸频率和脉搏升高的原因可能是由于羊汗腺不发达,通过增加表皮蒸发散热能力有限,因此增加呼吸频率是羊最有效的散热方式[14],而在运输时,羔羊长时间处于应激状态,应激原持续刺激使机体促肾上腺皮质激素分泌增加,机体能量代谢增强,产热量增加,从而导致呼吸频率加快,持续一段时间后,动物因无法利用呼吸道和表皮驱散额外热量,其机体体温就会升高[15],当体温升高时呼吸频率、脉搏也会加快。
当动物发生运输应激时,首先表现为体温升高、呼吸频率和脉搏加快,随着运输时间的延长,机体消耗大量的能量去抵抗应激,主要表现为糖、蛋白质、脂肪等营养物质和水分转化成小分子物质,被机体消耗利用,运输过程中动物禁食禁水无法及时补充营养物质,从而导致动物体重下降,体重是衡量动物抗运输应激能力大小的重要指标之一[16]。研究表明,肉仔鸡和肉鸡在经过不同时间段的运输后均会导致体重下降[17-18],Fisher 等[19]和Zhong 等[20]研究发现,8、12、30 h和48 h的长途运输均会导致绵羊体重显著下降,与本试验结果一致。本试验中,与运输前相比,羔羊经历8 h 道路运输后体重降低了15.31%,可能是运输途中禁食禁水,而机体代谢增强,加速营养物质分解代谢所致。
3.2 道路运输对羔羊应激激素和酶水平的影响
应激能够刺激下丘脑-垂体-肾上腺皮质轴(HPA轴)兴奋,使下丘脑分泌促肾上腺皮质激素释放激素(CRH),CRH 刺激垂体释放ACTH,进而活化肾上腺皮质,促进糖皮质激素(GC)的释放,而COR 是最主要的糖皮质激素[21-22]。大量研究表明,ACTH、COR 水平是反映机体应激变化的重要指标[23-24]。Guay 等[25]研究发现,马在24 h的长途运输中,COR浓度显著升高。李留安等[26]研究表明,运输可导致猪血清中ACTH 水平升高。韩瑾瑾等[27]对肉牛进行3 h 的运输,发现ACTH、COR 水平显著升高。本研究也获得一致的研究结果,与运输前相比,羔羊运输后ACTH水平极显著升高,COR水平显著升高,说明8 h的道路运输对羔羊造成了强烈的应激反应。COR 含量的升高有抗炎作用,但同时也能促使糖异生,加速组织蛋白质分解[28],这与本试验中羔羊运输后体重降低的结果一致。
肌酸激酶(CK)和乳酸脱氢酶(LDH)是反映运输应激的两个关键酶,且CK是肌细胞特异酶,其活性升高是肌细胞膜系统受损的一个指示剂。ALT 是反映肝实质损伤的关键酶[29]。大量研究表明,CK 和LDH均属于细胞内酶,当由于应激使细胞发生损伤时,细胞膜被破坏,CK和LDH透过细胞膜大量涌入血液,血清中CK、LDH 水平有不同程度的升高[30-32]。在运输应激状态下,肝细胞发生损伤时,ALT 在血清中的浓度甚至可以增加一倍[33],应激程度越大血液中LDH水平越高[34]。吴荣华等[10]对西门塔尔牛进行3 h 的运输后,CK、LDH 水平极显著升高。熊兆龙[35]诱导小公鸡建立氧化应激后发现血清中ALT 水平显著升高。本试验中,与运输前相比,羔羊运输后LDH 水平极显著升高,CK 水平显著升高,说明长途运输导致羔羊比较疲劳,肌肉能量供应不足导致肌细胞膜损伤,肌细胞中的CK 和LDH 大量涌入血液。但本研究中羔羊运输后ALT 水平未见显著升高,但有升高趋势,张灿等[36]对肉牛进行33 h长途运输,发现ALT水平没有显著变化,与本研究结果一致。结合本试验其他应激指标水平变化可以发现,运输中羔羊发生了应激反应但并未对肝脏造成剧烈伤害,可能是因为ALT含量在应激初期才会发生改变,而随着运输时间的延长,血清酶含量的变化表现一定的复杂性,因此进一步研究长途运输过程中ALT 含量变化有助于观察运输期间肝脏受损程度[37]。
3.3 道路运输对羔羊免疫指标的影响
免疫球蛋白IgA、IgG、IgM 在特异性免疫中发挥重要作用,当动物受到细菌或病毒等抗原刺激时,能特异性地与之结合,使其丧失致病作用,其中IgA 和IgG的水平变化会影响单核巨噬细胞吞噬作用和细胞介导的毒性作用;IgM 的水平变化会影响单核巨噬细胞杀菌和溶菌的作用。因此,血清中免疫球蛋白水平与免疫功能密切相关,是反映抗病力高低的重要指标之一[38]。张灿等[36]研究发现,热应激会导致山羊血清中IgA、IgG、IgM 水平显著降低,与本试验结果相似。本试验中,羔羊运输后IgA、IgG 水平显著降低,IgM 水平有降低趋势但差异不显著,说明经过8 h 运输后羔羊单核巨噬细胞的吞噬作用以及溶菌作用下降,IgG是机体体液免疫的主要成分,IgG 水平可以反应机体的抵抗力高低,而导致免疫球蛋白水平均降低的原因可能是运输使羔羊产生了免疫抑制反应,使羔羊免疫力下降[39]。
细胞因子被认为是体内参与免疫反应的小分子多肽类物质,是免疫和神经内分泌之间的主要联系物质。研究表明,IL-6、TNF-α、IFN-γ与神经系统关系最为密切,由单核细胞、巨噬细胞等细胞合成并分泌,可激发机体炎症,与发热有关[40]。Johnson等[41]研究报道,应激过程中IL-1β、IL-6 和 TNF-α等促炎症细胞因子水平变化会导致动物机体免疫力下降,生产性能降低,造成机体代谢紊乱等症状。在许多有关应激的研究中,细胞因子在应激中变化也不相同。赫荣贺等[42]对猪进行2 h 模拟运输,发现IL-6 水平无显著变化,TNF-α浓度降低。崔亮亮[43]采用敞篷车对猪模拟公路运输4 h 后发现,IL-1β、IL-6 表达量上升,而TNF-α相对表达量无显著差异。许利凡等[40]对夏南牛进行20 h 的运输试验,发现IL-6 在运输4 h 时显著升高,在运输15 h 时极显著升高。本试验中,羔羊运输后血清中IL-6 水平显著升高,IFN-γ、TNF-α和IL-1β水平均有上升趋势,但差异不显著,可能是由于运输应激引起ACTH 和COR 分泌的改变,这些激素作用于免疫系统,使参与炎症反应的单核细胞、巨噬细胞及淋巴细胞等被激活,引起细胞因子分泌增加[44],说明道路运输使羔羊发生了炎症反应,这与本试验中运输后羔羊体温显著升高的试验结果一致,而与其他试验结果不一致的原因可能与运输应激强度、持续时间以及动物品种和体况有关,且细胞因子在应激过程中处于一种动态的变化,这也就导致各种应激研究中没有一个统一的变化规律。
3.4 道路运输对羔羊血清生化指标的影响
血糖(GLU)是动物机体中重要的功能性物质,是中枢神经系统和红细胞等组织器官的唯一能源物质,GLU 水平与机体应激反应系统下丘脑-垂体-肾上腺轴(HPA 轴)的活动密切相关,正常情况下机体GLU水平保持相对稳定,当动物遭受运输应激时,能量需求大量增加,进而导致血液中能源物质GLU的水平降低[27]。动物遭受应激时会造成GLU 水平有不同的变化,研究表明夏南牛运输3 h使血清GLU水平升高[45]。胡鹏等[28]研究运输时间对沂蒙黑山羊生理指标的影响时发现,与运输时长1 h 相比,对山羊进行5 h运输其GLU水平显著降低。以上研究说明,短时间运输对动物血清中GLU水平无影响,长时间运输会降低GLU水平。本试验中,与运输前相比,羔羊经历8 h运输后GLU 水平显著降低,这有可能是长时间的运输会造成机体代谢增加,机体通过消耗大量肝糖原分解成的GLU 来进行能量补给,运输期间禁食禁水,随着羔羊饥饿程度的增加和运输时间的延长,机体营养储备过度消耗,导致血液中的血糖浓度降低[46]。
血清总蛋白(TP)代表了畜禽利用蛋白质的能力,即对蛋白质的消化和吸收程度。动物处于应激状态下,机体蛋白质分解代谢增强,引起血清中蛋白质含量降低。研究发现,白蛋白(ALB)可以作为衡量动物(尤其是反刍动物)肝脏功能的指标[32]。刘圈炜等[47]研究表明,长时间处在高温环境中的猪血液中TP 水平显著降低。高维平等[48]研究表明,驴进行长途运输后ALB 水平无变化。热应激能降低了鹌鹑[49]和鹅[50]血浆中ALB 水平。本试验中,羔羊运输8 h 后血清中TP、ALB水平均显著降低,说明8 h运输使羔羊产生了应激反应,有少量的体组织降解,可能是应激状态下蛋白质和脂肪分解加剧,运输途中禁食禁水又导致营养物质摄入缺乏,与其他试验得到不同结果的原因,可能是试验条件的区别,也可能与不同动物品种、生长阶段和运输时间长短有关[51-52]。
3.5 道路运输对羔羊血常规指标的影响
血液中白细胞的变化是动物运输应激过程中的生理和病理反应。王子豪等[53]对马进行运输后发现WBC 水平显著升高。吴荣华等[10]对西门塔尔牛进行8 h 运输发现WBC 水平显著升高。研究证实,运输可损害机体的免疫系统,导致WBC 升高[54]。本试验中,与运输前相比,羔羊运输后血液中WBC 水平显著升高,可能是运输使羔羊发生了应激反应,导致机体发生炎症反应,白细胞增多,说明机体免疫系统受到一定的损害。这可能与本试验中皮质醇升高有关,糖皮质激素可以引起白细胞聚集,而皮质醇是主要的糖皮质激素[7]。血液中红细胞(RBC)的数量最多,大约占血细胞总量的1/2,RBC 中行使功能的主要是血红蛋白(HGB),红细胞压积(HCT)是红细胞总数(RBC)和红细胞平均体积(MCV)等共同作用的结果,是血液中RBC 所占的比值。一般来说,动物的血红蛋白浓度(MCHC)与RBC 的数量呈现正相关,RBC 数量减少,MCHC 也会降低[28]。高秀秀[55]对小型猪进行公路运输,MCV在运输后显著降低。余传辛等[56]对新西兰兔进行公路运输,MCV在运输后极显著降低。胡鹏等[28]发现,长时间运输后黑山羊的HCT水平显著低于运输前,而Blecha 等[57]报道,禁食运输8 h后荷斯坦公牛的HCT没有变化,运输后HCT的不同变化结果可能与运输环境温度和运输结束体温升高有关。研究发现,高温会降低绵羊的HCT 和RBC 含量[58]。本试验中,与运输前相比,羔羊运输后血液中RBC、HCT、MCH水平显著降低,MCV 在运输后极显著降低,可能是由于羔羊受到了强烈的运输应激,表现为机体携氧能力下降等症状,同时运输途中禁食禁水致使羔羊体内营养元素铁含量降低,HGB 合成减少,进而也降低了RBC 的合 成[59],运 输 前 后HGB、MCHC、PLT、RDW、MPV、PDW 水平无显著变化,可能与不同的遗传基础与品种特性有关,血液指标在不同品系中表现出不同的特征特性。
4 结论
羔羊经过8 h 道路运输后,COR 水平显著升高,发生了明显的应激反应,导致羔羊体重下降了15.31%。同时,IL-6 水平显著升高,IFN-γ、TNF-α、IL-1β等水平也有提高,机体炎症反应增强,免疫系统受到了一定程度的损伤。

