蛛丝丝素蛋白膜的制备及其释药性能评价
刘欣欣,曾惠娜,纪晨然,高鹏飞,赵昱,张成桂*
(1.大理大学 云南省昆虫生物医药研发重点实验室暨药学院,大理 671000;2.大理大学 药用特种昆虫开发国家地方联合工程研究中心,大理 671000;3.大理大学 中国西南药用昆虫及蛛形类资源开发利用协同创新中心,大理 671000)
蜘蛛丝是由位于蜘蛛腹部后端的不同丝腺产生的多种丝的复合体,主要由蛋白质构成[1]。蛛丝的应用涉及一维缝合线、二维薄膜、三维多孔支架、水凝胶等剂型,用作伤口敷料、支持组织再生、周围神经再生等用途,同时蛛丝涂层可增加细胞黏附率,发挥生物相容性优势减轻机体炎症反应[2]。天然蛛丝是自然界已知的强度最高的天然蛋白纤维[3],其特殊的蛋白质链结构、聚集态结构及其独特的自组装性能使蛛丝纤维具有包裹药物的天然优势[4]。同时天然蛛丝材料独有的力学性能、降解性能、高度的人体生物相容性显现出广阔的发展前景[5-6]。蛛丝医学研究领域涉及心脏支架、血管支架、医美线雕[7-9]等。
丝素蛋白具有良好的生物相容性,在生物组织工程支架、药物输送领域具有广阔的应用前景,近年来研究者们多以蚕丝[10-12]或合成蛛丝[13-14]为对象进行丝素蛋白纤维的研究。基于丝素蛋白的敷料具有抗炎、促血管生成特性,有显著加速皮肤伤口愈合的功效[15],蜘蛛丝在特定条件下自主卷曲并装配成生物骨架,其形成的蛛丝丝素蛋白膜又能顺利载进药物分子,且能够维持药物分子稳定释放属于业内尚未解决的技术难题。使用蛛丝丝素蛋白液制膜并解释其复杂的药物释放行为,研发难度大,然而其表现出的优异的生物相容性、潜在的缓释性能也正激励着当代医药工作者在蛛丝研发上前仆后继。
本文以天然蛛丝为原料,通过对其成膜参数进行优化,探索蛛丝丝素蛋白膜作为膜剂载体的医用价值。
1 实验材料及方法
1.1 原材料
六氟异丙醇(HFIP)(工业级,上海钰康生物科技有限公司);敬钊缨毛蛛蛛丝(海南蛛王生物科技有限公司);甲酸(色谱级,江苏强盛功能化学股份有限公司);三氟乙酸(色谱级)、甲醇(色谱级),美国天地有限公司;罗丹明B (RhB,天津市科密欧化学试剂有限公司);小鼠胚胎成骨细胞MC3 T3-E1 (中国中科院上海细胞库);MEM-α培养基(Minimum essential medium α,武汉普诺赛生物科技有限公司);二甲基亚砜、噻唑蓝(北京Solarbio公司)。
1.2 蛛丝丝素蛋白膜的制备
1.2.1 溶解溶剂的选择
称取3份等质量同批次的洁净蛛丝,分别剪碎后各自置于西林瓶中,设置1∶1 (mg∶mL)料液质量体积比,向西林瓶中分别加入甲酸、三氟乙酸(Trifluoroacetic acid,TFA)、HFIP溶剂,室温条件下磁力搅拌溶解,每隔2 h观察1次,直至所有溶液无明显变化。溶液经干燥至恒重的38 µm金属滤网过滤后,滤网及滤渣于通风橱中挥干至恒重,妥善保存滤液。称量滤网滤渣总重并按下式计算蛛丝在各溶剂中的溶解率:
其中:S为蛛丝在溶剂中的溶解率;M1为称取的蛛丝原料实际质量;M2为洁净金属滤网质量;M3为过滤并风干后滤渣滤网总重。
1.2.2 成膜方法的选择
溶剂浇铸法:将1.2.1项下制备得到的3种天然蛛丝丝素蛋白滤液,分别倒入形制相同的玻璃模具中,于通风橱中的圆周型摇床(SK-O330-Pro,大龙兴创仪器有限公司)上以100 r/min的转速挥干溶剂,观察其成膜情况。
静电纺丝法:将1.2.1项下得到的3种天然蛛丝丝素蛋白滤液,分别注入玻璃注射针筒内,通过微量注射泵以60 µL/min的速率挤出,针头内径选用0.8 mm的不锈钢针头。电纺过程中电压控制在16 kV,针头至接收器的接收距离为10 cm,下方用锡箔纸接收纺丝液经挤压后形成的“泰勒锥”,观察纳米纤维形成情况。
1.2.3 正交试验确定蛛丝最佳溶解条件
前期预试验结果表明,在同一溶解溶剂下影响蛛丝溶解率的主要因素有溶解时间、蛛丝与溶剂的料液质量体积比及溶解温度,每个因素下分别设定3个水平,选用正交试验设计表,筛选最佳溶解条件(表1)。
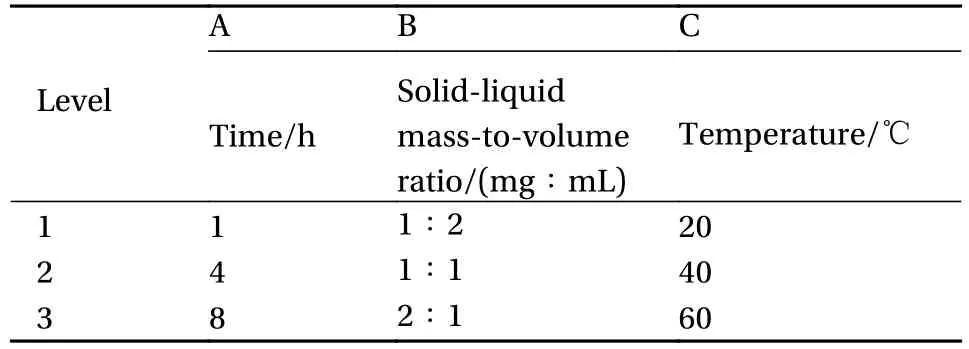
表1 蛛丝丝素蛋白膜正交试验因素水平表Table 1 Level of factors in orthogonal test of silk fibroin protein membrane
1.2.4 空白蛛丝丝素蛋白膜的制备
根据1.2.3项下筛选得到的成膜参数对蛛丝进行溶解,溶解后的蛛丝丝素蛋白液倾倒于平底玻璃容器中,于通风橱中的摇床上以100 r/min的转速挥干溶剂成膜,膜剂回软后揭膜。
1.2.5 载药蛛丝丝素蛋白膜的制备
前期预试验发现对制得的蛛丝丝素蛋白液进行不同程度的浓缩,膜剂表现为不同的外观形态,同时膜剂厚度及光滑度亦不同,由此猜测不同浓度蛛丝丝素蛋白液成膜对膜剂的释药性能可能产生影响。根据1.2.3项下筛选得到的成膜参数进行5份等质量蛛丝的溶解,冷凝回流浓缩获得2、6、10、15、20 mg/mL的蛛丝丝素蛋白液,每个浓度下的蛋白液均分3组,分别倒入形制相同的平底玻璃模具中;因RhB具有红色荧光,便于观察,因此在载药量范围内精密称取15份RhB各5 mg加入上述溶液中,使用超声波清洗器(SK8200 HP,上海科导超声仪器有限公司)超声5 min完全溶解混匀,在通风橱中于圆周型摇床上以100 r/min的转速挥干溶剂成膜。
1.3 蛛丝丝素蛋白膜相关表征
1.3.1 宏观观察及微观形貌观察
宏观观察:选取不同成膜浓度下的蛛丝丝素蛋白膜,按从左到右的顺序依次排列并拍照。
微观形貌观察:取小块膜剂直接粘在导电胶上喷金后观察表面,取另一块膜剂液氮淬断并喷金后观察截面,上述膜剂均使用扫描电镜(TESCAN MIRA LMS,泰斯肯扫描电镜)拍摄样品形貌。
1.3.2 载RhB蛛丝丝素蛋白膜厚度测量
按照国标GB/T 21389-2008《游标、带表和数显卡尺》[16],将1.2.5项下制得的不同膜剂分别随机选取9个间隔均匀的不同位置用数显测厚规(awt-chy01,商丘埃维特工具有限公司)进行测量,记录膜厚并计算平均值,测量位置如图1所示,膜剂外环、中环、内环均随机均匀选取3个点测量。
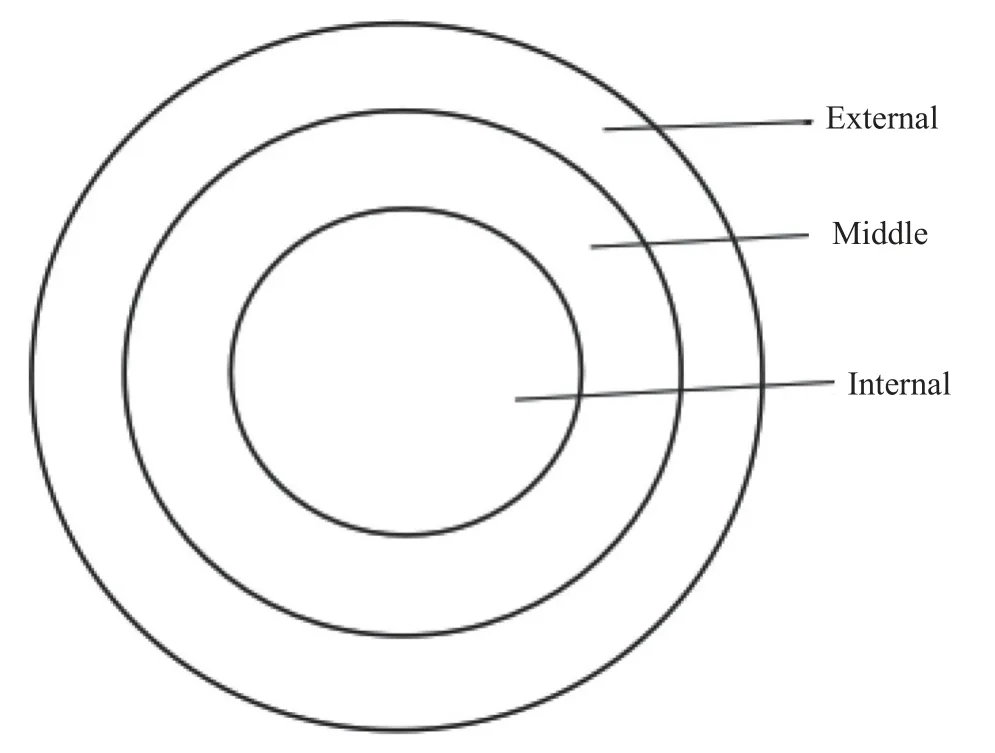
图1 厚度测量位置示意图Fig.1 Schematic diagram of thickness measurement position
1.3.3 结晶度分析
将20 mg/mL载RhB蛛丝丝素蛋白膜裁剪成合适大小,用导电胶粘于玻璃样品支架上,使用X-射线衍射仪(Rigaku SmartLab SE,日本理学(Rigaku)公司)进行检测;设置实验参数:铜离子阳极靶、扫描速度为5°/min、扫描范围2θ=5°~60°。
1.3.4 拉力测试
分别将1.2.5项下制备的载RhB蛛丝丝素蛋白膜裁剪出大小相同的长条状,固定于拉力强度试验机(TM2101-T7-01,东莞市汇泰机械有限公司)上测拉伸强度及断裂伸长率。
1.4 以RhB为模型药物的载药蛛丝丝素蛋白膜体外释药性能分析
1.4.1 RhB测定系统性试验及载RhB蛛丝丝素蛋白膜释药含量测定
1.4.1.1 标准溶液的配制
精密称取2.5 mg RhB标准品于烧杯中用少量去离子水溶解后,置于25 mL容量瓶中定容,获得100 µg/mL的标准品母液,分别量取母液8 mL、5 mL、1 mL、0.8 mL、0.5 mL、0.1 mL、0.08 mL、0.05 mL、0.01 mL于10 mL容量瓶中,去离子水定容,配制一系列浓度梯度的标准品溶液并用紫外分光光度仪(UV-6000 PC,上海元析仪器有限公司)于550 nm[17]波长处进行检测。
1.4.1.2 RhB-HFIP共存13 h的药物稳定性考察
试验验证HFIP为最佳溶解溶剂,并对RhB在HFIP中的稳定性进行考察:将RhB在HFIP中分别放置0、1、3、5、7、9、11、13 h,到达取样时间点时取样并迅速于5 min内挥干溶剂,用等量去离子水进行复溶。使用硅胶G色谱板,正丁醇∶无水乙醇∶1%氨水=6∶2∶2为展开剂的薄层色谱法进行稳定性考察。
1.4.1.3 重复性、精密度和回收率考察
精密称取2.5 mg RhB标准品于烧杯中用少量去离子水溶解后,置于25 mL容量瓶中定容,配制成RhB标准品溶液,重复此操作,平行配制6组标准溶液。使用紫外-可见分光光度计于550 nm波长处分别测定各组RhB标准品的吸光度值,验证检测方法重复性;
将配制好的RhB标准品溶液分别取40 µg/mL、4 µg/mL、0.4 µg/mL共3个浓度,连续3日,每日于550 nm紫外波长下各重复检测3次,测试日内精密度及日间精密度,并计算相对标准偏差(RSD)值。
分别精密称取已知含量的RhB样品9份,分为3组,分别按样品中成分含量的80%、100%和120%加入RhB标准品,控制加样前后浓度均在线性范围内,于550 nm波长处进行紫外检测,并按以下公式计算加样回收率p:
其中:T1为测得药品量;T2为已知药品量;T3为加入药品量。
1.4.2 载RhB蛛丝丝素蛋白膜的释药性检测
取1.2.5项下制备膜剂各30 mg,照2020版《中华人民共和国药典》四部《0931溶出度与释放度测定法》[18]指导原则中的小杯法于溶出试验仪(RC806D,天津市天大天发科技有限公司)中进行体外释药试验,设置温度(37±0.5)℃,搅拌速度50 r/min。设置取样时间点0 h、0.25 h、0.5 h、1 h、1.5 h、2 h、3 h、4 h、5 h、6 h、8 h、10 h、12 h、24 h、36 h到达取样时间点取样4 mL并加入同温同体积释放介质。释药液于550 nm波长处进行紫外检测,计算累计释药率如下:
其中:Q为累计释药率;K1为释出药物总量;K为30 mg各膜剂中所含总药量。
1.5 空白蛛丝丝素蛋白膜毒性检测
通过体外细胞毒性试验检测膜剂毒性。选用小鼠胚胎成骨细胞MC3 T3-E1,培养于含10%胎牛血清、1%双抗(青霉素、链霉素)的MEM-α完全培养基中,置于37℃、5%CO2培养箱中培养。参照ISO-10993-12-2021[19]及GB/T 16886.5-2017[20]选用噻唑蓝(MTT)法对空白蛛丝丝素蛋白膜进行毒性检测。按6 cm2∶1 mL的浸提比例,裁取面积60 cm2的空白蛛丝丝素蛋白膜加入10 mL MEMα完全培养基,于37℃无菌培养箱中浸提24 h。将空白蛛丝丝素蛋白膜浸提液稀释成100%、75%、50%、25%的终浓度作实验组,另设高密度聚乙烯(High density polyethylene,HDPE) 100%浸提液阴性对照组、含10%二甲基亚砜(Dimethylsulfoxide,DMSO)阳性对照组、仅加培养基空白对照组。将培养至对数生长期的细胞按1×104个细胞/孔在96孔板中加100 µL细胞悬液;培养24 h后去除培养基加入100 µL蛛丝丝素蛋白膜浸提液;细胞与浸提液共培养24 h后加入20 µL MTT,于培养箱中孵育4 h后加入100 µL DMSO,用多功能酶标仪(SpectraMax M2,美谷分子仪器(上海)有限公司)在490 nm波长处测试OD值,按下式计算细胞存活率r:
其中:OD1为实验样品组光密度平均值;OD2为空白对照组光密度平均值。
2 结果与讨论
2.1 蛛丝丝素蛋白膜的制备
2.1.1 溶剂及成膜方法的选定
表2为天然蛛丝在不同溶剂中的溶解率。蛛丝在不同溶剂中的溶解率为TFA>HFIP>>甲酸。溶剂浇铸法制膜中:以甲酸为成膜溶剂挥干速度最慢,12 h后仍以溶液形式存在,无法成膜,TFA和HFIP溶液易挥干,制剂易成膜,膜剂可完整剥离、取出。但以TFA为蛛丝溶解溶剂制备得到的蛛丝丝素蛋白膜中间与边缘颜色差别大,外观均一度差。因此选用HFIP作蛛丝溶解及成膜溶剂。
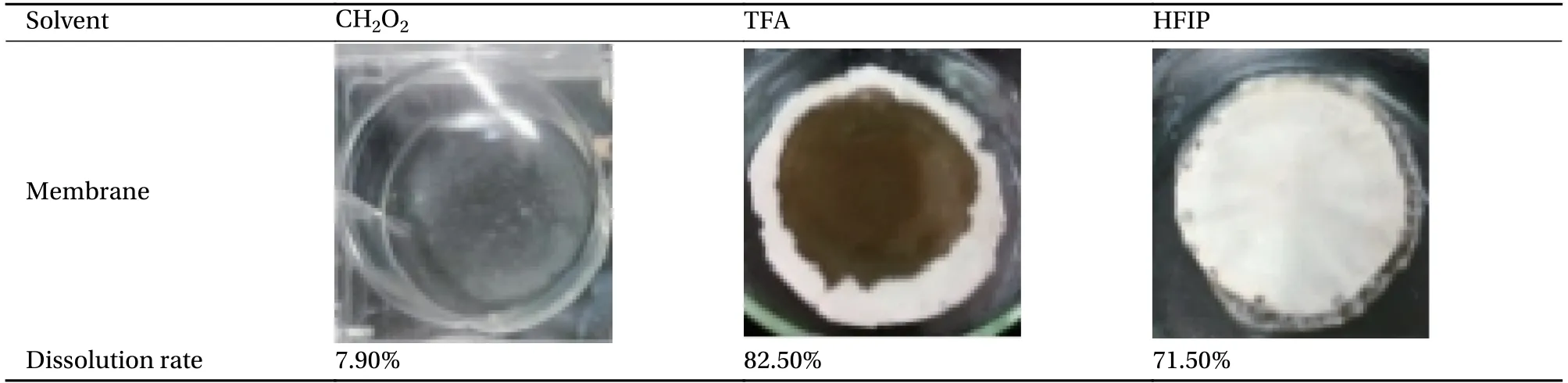
表2 天然蛛丝在不同溶剂中的溶解率Table 2 Solubility of natural spider silk in different solvents
静电纺丝法制膜:TFA及甲酸作为纺丝液无法形成“泰勒锥”,仅以HFIP溶液中溶解蛛丝可形成完整“泰勒锥”,存在后续形成膜剂实体的潜力。综上,选用HFIP作为蛛丝溶解溶剂,溶剂浇铸法作为成膜方法。
2.1.2 影响天然蛛丝溶解条件考察
表3展示了天然蛛丝溶解条件正交设计试验结果,分析可知,第4组试验的蛛丝溶解率最高,为进一步确定各因素对蛛丝溶解率的影响,对正交试验结果进行方差分析,由表4中概率P值可以看出,各因素对试验结果的影响大小顺序为A>C>B,即溶解时间>溶解温度>料液质量体积比。溶解时间对蛛丝溶解率有显著影响(P值<0.05),溶解温度及料液质量体积比对蛛丝溶解率影响不显著。因此在实验合理范围内,优化蛛丝溶解条件为A3B2C3,即以1 : 1 (mg : mL)的料液质量体积比进行投料,在60℃条件下溶解8 h为最优,蛛丝溶解率为74.85%。本文蛛丝丝素蛋白膜均在此条件下制备。
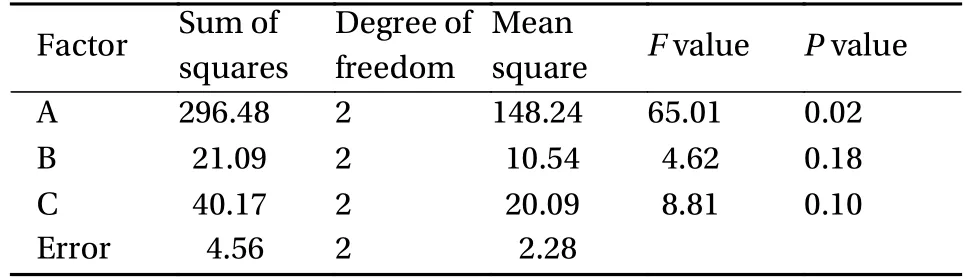
表4 正交实验方差分析Table 4 Orthogonal experimental analysis of variance
2.2 蛛丝丝素蛋白膜相关表征
2.2.1 不同成膜浓度下载RhB蛛丝丝素蛋白膜的宏观及微观形貌
图2和图3分别为蛛丝丝素蛋白膜宏观图和SEM图像。如图2所示,可以观察到随着蛛丝丝素蛋白液成膜浓度的升高,膜剂完整度及光滑度依次提高。如图3所示,不同成膜浓度下制备得到的蛛丝丝素蛋白膜,其微观结构大有不同。随着蛛丝丝素蛋白液成膜浓度的升高,膜剂表面孔隙由稀疏逐渐变得紧实,当蛛丝丝素蛋白液浓度达到20 mg/mL时,表面近乎平整,孔洞微小,同时结合截面图可以发现其截面结构的变化与表面结构变化趋势一致。值得一提的是在蛛丝丝素蛋白液浓度为10 mg/mL的蛋白膜截面结构中,观察到一侧稀疏、一侧紧实的结构,表面宏观观察其一面光滑、一面粗糙,由此推测此浓度的蛛丝丝素蛋白液恰好介于形成表面光滑膜剂的临界范围。

图2 蛛丝丝素蛋白膜宏观图:(a) 2 mg/mL;(b) 6 mg/mL;(c) 10 mg/mL;(d) 15 mg/mL;(e) 20 mg/mLFig.2 Macroscopic plots of drug-loaded silk protein membrane: (a) 2 mg/mL; (b) 6 mg/mL; (c) 10 mg/mL; (d) 15 mg/mL; (e) 20 mg/mL

图3 载罗丹明B (RhB)蛛丝丝素蛋白膜表面((a)~(e))及截面((a1)~(e1))的SEM图像:((a),(a1)) 2 mg/mL;((b),(b1)) 6 mg/mL;((c),(c1)) 10 mg/mL;((d),(d1)) 15 mg/mL;((e),(e1)) 20 mg/mLFig.3 SEM images of surface ((a)-(e)) and cross-section ((a1)-(e1)) for rhodamine B (RhB) loaded silk protein membrane: ((a),(a1)) 2 mg/mL;((b),(b1)) 6 mg/mL; ((c),(c1)) 10 mg/mL; ((d),(d1)) 15 mg/mL; ((e),(e1)) 20 mg/mL
2.2.2 载药蛛丝丝素蛋白膜的厚度
不同浓度的蛛丝丝素蛋白液,通过溶剂浇铸法在通风橱中完全干燥后得到厚度不同的蛛丝丝素蛋白膜,使用数显测厚规测试得到不同膜厚。由表5及图4可知,在总蛛丝量相同条件下,随着蛛丝丝素蛋白液浓度的不断升高,膜剂厚度呈下降趋势。
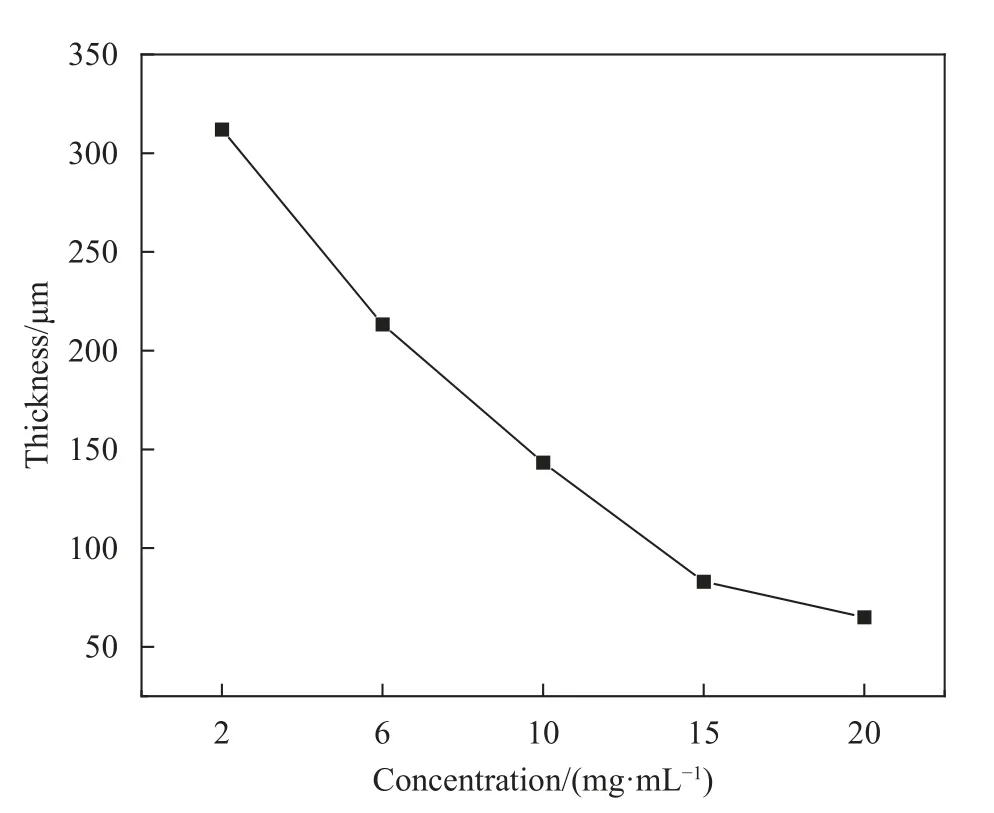
图4 成膜蛛丝丝素蛋白液浓度与膜厚关系Fig.4 Relation between filamentin protein solution concentration and membrane thickness
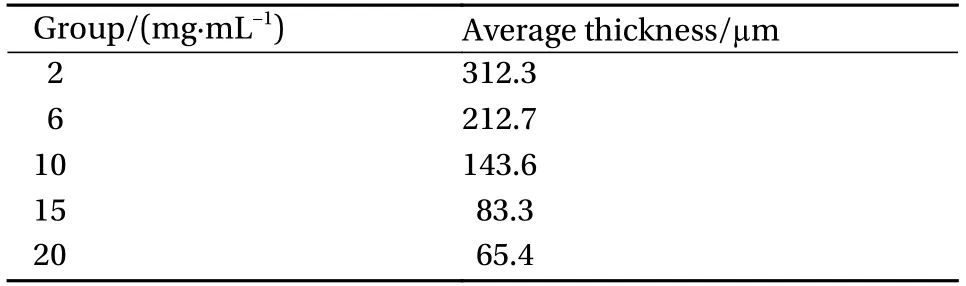
表5 不同成膜浓度载药蛛丝丝素蛋白膜厚度Table 5 Membrane thickness of silk protein protein loaded at different membrane-forming concentrations
2.2.3 蛛丝丝素蛋白膜的物相结构和结晶度
XRD衍射峰的位置和强弱可反映蛋白膜的物相结构和结晶度。结果如图5所示,蛛丝丝素蛋白膜(Blank)的主衍射峰在2θ=10.6°、21.5°附近,其衍射峰宽而平,表明丝蛋白主要以无定形聚合物形式存在;模型药RhB粉末在9°~35°之间有较尖锐的衍射特征峰;载RhB蛛丝丝素蛋白膜(Blank-RhB)衍射峰与未载药蛛丝丝素蛋白膜(Blank)峰形一致,整体看峰形相差不大,这表明模型药物可以较均匀地包裹在蛛丝丝素蛋白膜中,引入模型药物后,膜剂骨架基本没有受到干扰。
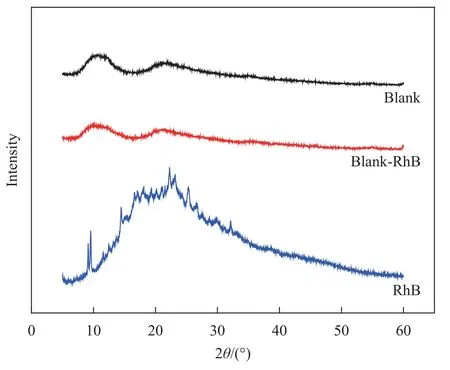
图5 RhB及其载药蛛丝丝素蛋白膜的XRD图谱Fig.5 XRD patterns of RhB and its loaded spider filament protein membrane
2.2.4 蛛丝丝素蛋白膜的拉力性能
对1.2.5项下制备的2、6、10、15、20 mg/mL的蛛丝丝素蛋白液干燥膜剂进行拉伸强度和断裂伸长率测试,结果如图6所示。随着蛛丝丝素蛋白液浓度的增加,所制备膜剂拉伸强度表现为上升趋势,断裂伸长率表现为先上升后下降趋势,这可能与其内部孔隙在受到拉伸时产生的形变有关。当低浓度的蛛丝丝素蛋白液成膜时,内部疏松部分孔隙产生拉伸形变使断裂伸长率迅速上升,当高浓度蛛丝丝素蛋白液成膜时内部孔隙收缩紧实,在外力作用下仅产生微小形变而断裂。有研究认为,由于随着蛛丝丝素蛋白液浓度的升高,蛋白分子间距离减小,碰撞几率增大,分子间作用力增加,从而诱导了蛋白分子间的积聚[21],由此也可以解释成膜浓度越高膜剂厚度越低的现象。高浓度下蛛丝丝素蛋白分子间距离的减小会诱导其分子重排,从而增加蛋白分子向β折叠构象的转变,这也为其体外释药时间的延长、力学性能强度的增加提供了理论依据[22]。
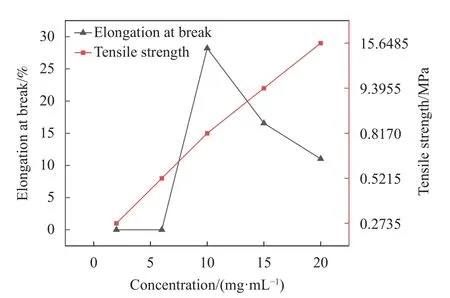
图6 蛛丝丝素蛋白膜拉伸强度及断裂伸长率Fig.6 Tensile strength and elongation at break of silk protein membrane
2.3 不同密度载RhB蛛丝丝素蛋白膜释药规律分析
2.3.1 药物-溶剂共存13 h的稳定性考察
图7为药物在HFIP中不同时间段的稳定性薄层色谱图。由图可知,与HFIP共存13 h内的RhB薄层色谱斑点清晰,结果稳定。

图7 药物在HFIP中不同时间段的稳定性薄层色谱图Fig.7 Thin-layer chromatogram of drug stability in HFIP for differenttime periods
2.3.2 线性关系、精密度及回收率试验
以峰面积为纵坐标、浓度(µg/mL)为横坐标得到RhB在纯水中的线性范围为0.1~100 µg/mL,线性方程:y=0.0139x+0.0379,线性相关系数R2=0.9998。
各浓度RhB标准品溶液日内精密度及日间精密度RSD均在0.44%~2.56%之间,表明仪器及检测方法的精密度良好。
不同浓度RhB标准品在样品溶液中的平均加样回收率分别为103.67%、98.6%、100.19%,此方法可作为定量检测依据。
2.3.3 载RhB蛛丝丝素蛋白膜体外释药规律分析
由2、6、10、15、20 mg/mL的蛋白液制备的载RhB蛛丝丝素蛋白膜到达平台阶段时释药率分别为93.9%、92.1%、90.2%、87.3%、86.6%,结合图8可知,载总蛛丝量及载药量一定条件下,蛛丝丝素蛋白液浓度越高,对应膜剂释药曲线越平缓。2 mg/mL、6 mg/mL蛋白液制备的载RhB蛛丝丝素蛋白膜突释现象明显,观察其表面疏松多孔,药物通过疏松的孔道快速释放。随着成膜蛋白液浓度的不断升高,前30 min释药率逐渐降低,到达释药平台期时间逐渐延长,以15 mg/mL、20 mg/mL蛋白液制备的载RhB蛛丝丝素蛋白膜缓释效果较明显,缓释时间可达24~36 h。释药过程中,吸附在膜剂表面或填塞至与外界连接的孔洞中的药物最先释放,贡献了最开始的快速释药部分;随着膜剂在介质中释药时间的增加,膜剂不断溶胀,药物在浓度差的推动下由内向外溶出直至到达平台阶段,与课题组前期试验结果一致[23]。对比上市药物枸橼酸芬太尼口腔黏膜贴片Fentora释药5 min[24]、口腔贴剂意可贴释药2~3 h,及用于阴道给药的复方炔诺酮膜每日用药一片,本课题组制备的蛛丝丝素蛋白膜均可以通过调节成膜浓度达到相应释药效果。
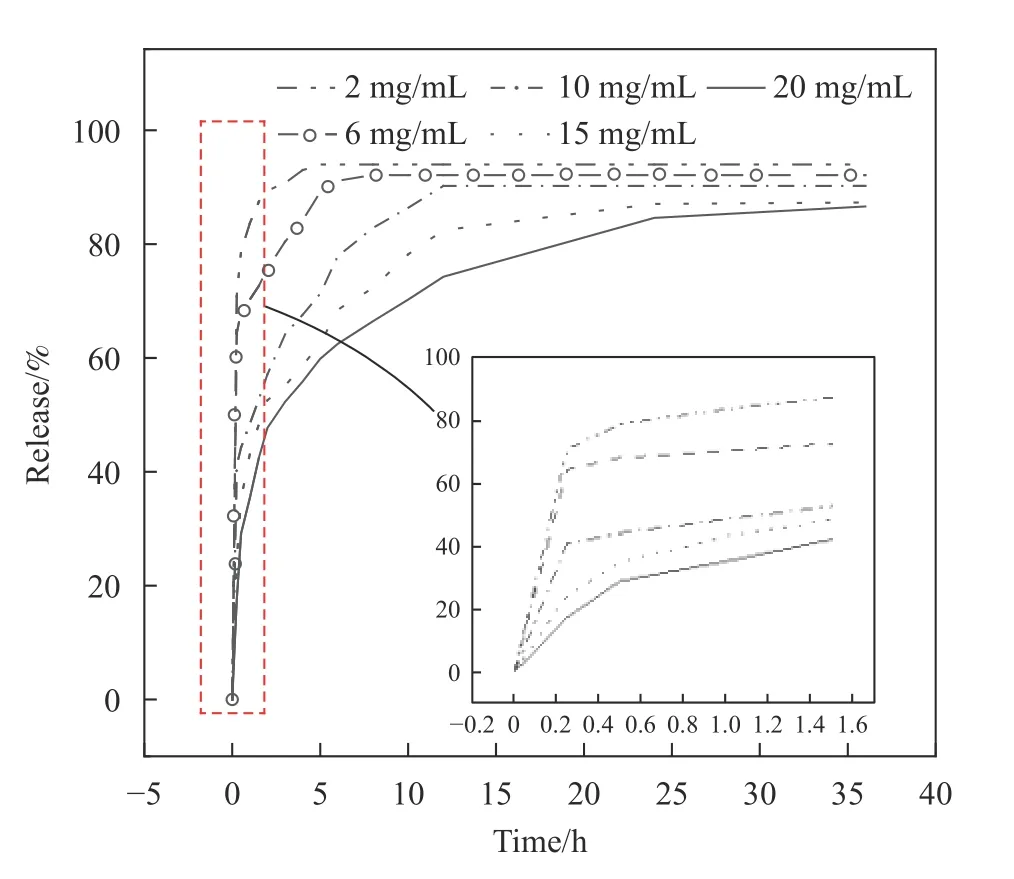
图8 不同浓度蛛丝丝素蛋白液成膜释药曲线Fig.8 Membrane release curves of different concentrations of spider filamin protein solution
2.4 体外细胞毒性结果分析
图9展示了空白蛛丝丝素蛋白膜浸提液细胞共培养24 h结果。由图结果可知,阳性对照组细胞增殖率为11.7%,具有明显细胞毒性;实验组(蛛丝丝素蛋白膜组)样品的100%浸提液细胞增殖率为75.4%,符合GB/T 16886.5-2017[20]规定的样品浸提液最高浓度(100%浸提液)细胞相对活性大于空白组70%要求,认为该材料无细胞毒性。因此,本试验方法制备出的蛛丝丝素蛋白膜对MC3 T3-E1细胞无显著潜在细胞毒性。
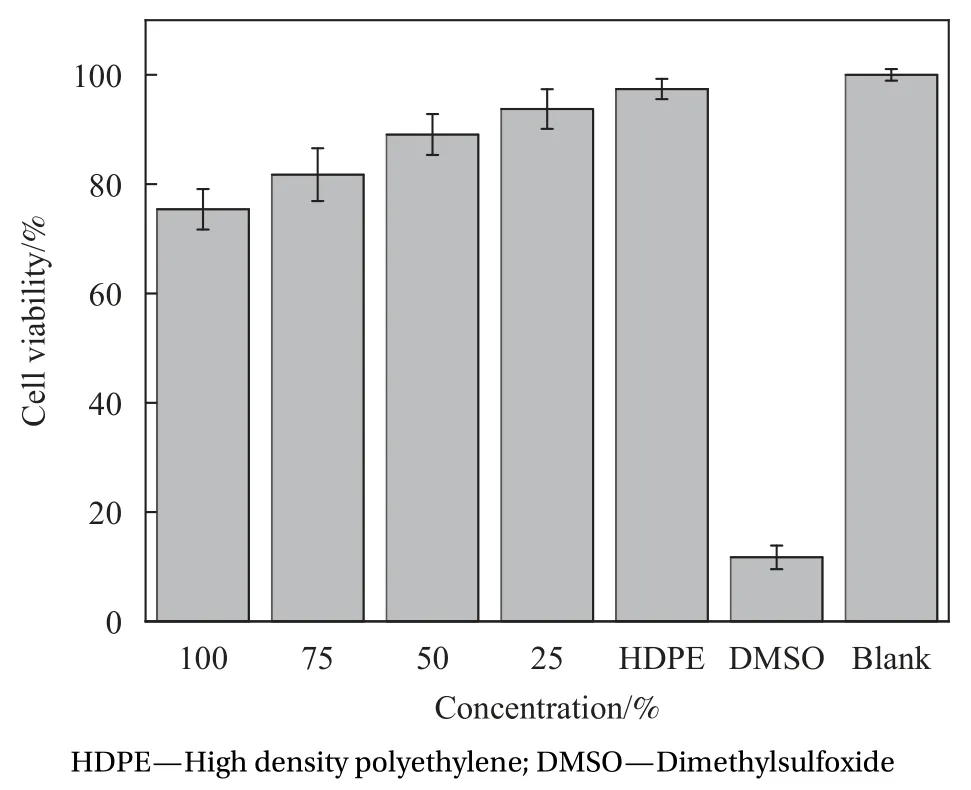
图9 空白蛛丝丝素蛋白膜浸提液细胞共培养24 h结果Fig.9 Results of cell co-culture of extracts for 24 h
3 结 论
(1) 本文以敬钊缨毛蛛蛛丝为原料,通过正交试验法优化制备工艺,采用溶剂浇铸法成功制备出了载药蛛丝丝素蛋白膜。提供了一种产率高、操作简单的蛛丝丝素蛋白膜制备方法。
(2) 不同成膜浓度下的蛛丝丝素蛋白膜表现为不同的释药效果,可解决不同需求,应用于不同领域,其中20 mg/mL的蛛丝丝素蛋白液制备的膜剂在体外释药中表现出长达24~36 h的缓释效果。
(3) 在膜厚度与释药关系的研究中发现当蛛丝蛋白质量相同时,蛛丝丝素蛋白液浓度越大,形成的膜剂厚度越小,释药越缓慢。
(4) 本文通过浸提法对蛛丝丝素蛋白膜进行毒性检测,体外细胞试验表明膜剂对小鼠胚胎成骨细胞MC3 T3-E1无显著潜在细胞毒性。

