miR-200c 靶向ZEB1 调控宫颈癌细胞的增殖和凋亡
冯宝菊,江英,吕希俊
武汉市红十字会医院急诊科 武汉市,430015
宫颈癌是女性第四类常见恶性肿瘤,全球每年新发病例约60 万例,死亡病例超过30 万人[1]。尽管在宫颈癌的治疗上不断有所突破,但研究证实其总体5 年生存率仍不容乐观[2]。因此,亟需探索新的潜在的治疗措施及方案。越来越多的研究证实了microRNA (miRNA) 在肿瘤发生发展中的作用[3-4]。miRNA 是一类内源性的非编码RNA,可以在转录后水平上抑制大多数蛋白编码基因的表达[3]。另外,miRNA 还能以碱基互补模式与mRNA 的非翻译区相互作用,直接抑制其翻译或靶向降解[5]。已证实miRNA 在调节真核生物中重要的生物学和生理过程,其异常表达与包括癌症在内的多种疾病密切相关[3,5]。近年来,miRNA 被报道也可以参与肿瘤微环境中肿瘤细胞与其他间质细胞的相互作用,影响肿瘤免疫微环境的功能进而促进或抑制恶性肿瘤的发生发展[6]。研究表明,多种miRNA 与宫颈癌细胞的增殖、凋亡、侵袭、迁移等密切相关,且被认为是宫颈癌诊断、治疗和预后评估的新靶点[7]。既往研究已证实,miR-200c 在胃癌组织中低表达,其过表达可通过抑制TGF-β信号通路抑制上皮-间质转化过程,进而抑制肿瘤的侵袭转移[8]。在女性生殖系统中,miR-200c 已被报道可通过靶向调控Neuropilin 1 的表达显著增强奥拉帕尼对耐药卵巢癌细胞的抗肿瘤作用[9];此外,miR-200c 可通过上调PAI-2 的表达和促进M2 型巨噬细胞极化促进三阴性乳腺癌的恶性进展[10]。然而在宫颈癌中,仅有一项研究报道miR-200c 通过靶向MAP4K4 抑制宫颈癌细胞的转移和生长[11],关于miR-200c 对宫颈癌细胞增殖和凋亡的影响及其潜在机制仍需研究。基于此,本研究拟通过临床样本检测和细胞实验探究miR-200c 对宫颈癌细胞增殖和凋亡的影响及具体分子机制,以期为宫颈癌的预防和临床治疗提供一定的理论依据。
1 材料与方法
1.1 组织收集
收集2020 年1 月至2020 年12 月在我院妇科接受手术治疗的52 例宫颈癌患者的癌组织及邻近正常组织,所有组织均经临床病理活检证实,所有患者术前均未接受放射治疗或化学治疗。宫颈癌分期标准参照2014 年FIGO 分期标准。手术过程中对所有组织进行取样,液氮罐中保存。本研究经武汉市红十字会医院医学伦理委员会审批,所有患者/家属均已签署知情同意书。
1.2 实时荧光定量PCR (RT-qPCR)
从液氮灌中取出冻存组织或收集转染的细胞,Trizol 法提取总RNA。利用Bulge-LoopTM miRNA qRT-PCR Starter Kit 进行miRNA 的逆转录反应,再采用Bulge-LoopTM miRNA qRT-PCR Starter Kit 进行miRNA 的RT-qPCR 反应;利用逆转录试剂盒(TaKaRa,日本) 进行mRNA 的逆转录反应,再采用SYBR-Green PCR Mix (TaKaRa,日本) 进行mRNA 的RT-PCR 反应。以U6 或GAPDH为内参。ZEB1 基因引物为: 5′-TTACACCTTTGCATACAGAACCC-3′ 和 5′-TTTACGATTACACCCAGACTGC-3′;miR-200c的引物为: 5′-TAATACTGCCGGGTAATGATGGA-3′ 和 5′-CTCAACTGGTGTCGTGGA-3′;U6 的引物为: 5′-GCTTCGGCAGCACATATACTAAAAT-3′ 和U6-R 5′-CGCTTCACGAATTTGCGTGTCAT-3′;GAPDH的引物为: 5′-CACTGGGCTACACTGAGCAC-3′和5′-AGTGGTCGTTGAGGGCAAT-3′。
1.3 蛋白质印迹
从液氮灌中取出冻存组织,研磨成组织匀浆,每管组织液中加入预冷的80~100 μL 新鲜配置的裂解液,超声处理1 min 后低温离心机12 733 r/min 离心30 min,将上清转移至新的EP 管中,利用BCA 试剂盒(Beyotime Biotechnology,上海) 测定蛋白浓度。通过SDS-PAGE 胶(Servicebio,武汉) 分离目标蛋白,再将其转印至PVDF 膜上,经5 %脱脂奶粉封闭后,使用一抗稀释液稀释抗体(ZEB1、GAPDH 均来自于美国proteintech 公司) 后孵育PVDF 膜,4 ℃过夜;经TBST 洗涤后,使用二HRP 标记的二抗孵育PVDF 膜,再次经TBST 洗涤后,采用ECL 化学发光试剂(Servicebio,武汉) 进行显色,Bio-Rad 化学发光成像仪(Bio-rad,美国) 获取图片,用Image J 软件评估蛋白的表达水平。
1.4 细胞培养与转染
人宫颈癌细胞系(HeLa、C33A 和HT3) 和原代正常宫颈鳞状细胞(NCSC) 均购自中国科学院细胞库(上海)。所有细胞均培养于含有10 %胎牛血清(FBS) (Invitrogen,美国) 的RPMI-1640培养基(Sigma-Aldrich,美国) 中,在37 ℃、含5 % CO2的培养箱中培养。miR-200c 模拟物、抑制物及相应对照均由上海吉玛公司合成和纯化。转染前一天,将细胞接种在6 孔板上,并加入2 mL 含10 % FBS 的培养基。待细胞融合率达70 %时,使用Lipofectamine 3000 体系转染miR-200c 模拟物、抑制物或正常对照转染细胞,37 ℃、5 % CO2培养箱中下培养24~48 h,收集细胞,RT-PCR 检测各组miR-200c 的表达,蛋白质印迹法检测靶基因的表达。
1.5 CCK8 实验
通过CCK8 试剂盒(Servicebio,武汉) 测量宫颈癌细胞的增殖情况。简单步骤如下: 将宫颈癌细胞接种到96 孔板中,经Lipofectamine 3000 转染后在37 ℃下孵育,在转染后24、48 和72 h 使用CCK8 试剂盒检测进行检测。使用Spectra 酶标仪(BioTek,美国) 测量450 nm 的吸光度以评估细胞增殖水平。
1.6 Annexin V 实验
在使用miRNA-200c 模拟物或抑制物转染宫颈癌细胞后,使用FITC Annexin V/PI 凋亡检测试剂盒(DOJINDO,日本) 通过流式细胞仪检测上述细胞的凋亡水平。简单步骤如下: 将宫颈癌细胞接种到24 孔板中,经Lipofectamine 3000 转染后在37 ℃下孵育,转染后24 h 收集上述细胞,4 ℃避光染色10 min,加入缓冲液,流式细胞仪 (FACSCantoⅡ,BD 公司,美国) 在10 min 内进行检测。
1.7 双荧光素酶报告基因实验
使用mirTarBase、targetScan 和miRDB 预 测miR-200c 的靶基因。使用Easy Mutagenesis System试剂盒构建wt-ZEB1-3′UTR 和mut-ZEB1-3′UTR 质粒。将HT3 细胞接种到6 孔板中,使用Lipofectamine 3000 将miR-200c 模拟物或模拟物对照与wt-ZEB1-3′UTR 或mut-ZEB1-3′UTR 质粒进行共转染,并利用双荧光素酶报告基因检测试剂盒(Promega,美国) 检测其荧光素酶活性,具体操作步骤根据说明书进行。
1.8 统计学方法
使用SPSS 22.0 (SPSS Statistics,美国) 进行统计分析。正态分布数据表示为平均值±标准差,并使用独立样本/配对样本t检验进行分析;以例数(n) 表示计数资料,利用卡方检验进行统计学分析。通过Pearson 相关检验分析宫颈癌组织中miR-200c 表达与ZEB1 mRNA 表达的相关性。P<0.05 被认为具有统计学意义。
2 结果
2.1 宫颈癌组织中miR-200c 的表达水平
我们首先利用RT-qPCR 检测52 例患者宫颈癌组织及癌旁组织中miR-200c 的表达,结果显示,与癌旁组织相比,宫颈癌组织中miR-200c 的表达水平显著降低(图1)。根据癌组织中miR-200c 表达的中位值,我们将宫颈癌患者分为低表达组(n=26) 和高表达组(n=26),结果发现,miR-200c低表达与肿瘤分化程度、浸润深度、淋巴结转移、淋巴脉管浸润及FIGO 分期密切相关 (P均<0.05),而与患者年龄和肿瘤大小无关 (P均>0.05) (表1)。

表1 宫颈癌组织中miR-200c 表达与患者临床病理特征的关系(n=52)

图1 miR-200c 在宫颈癌和对应癌旁组织中的表达水平
2.2 miR-200c 对宫颈癌细胞增殖和凋亡的影响
为了探索miR-200c 对宫颈癌细胞的调控作用,我们选择宫颈癌细胞系进行后续研究。我们利用RT-PCR 检测了NCSC 及几种宫颈癌细胞系中miR-200c 的表达水平。结果显示,miR-200c 在NCSC中的表达水平显著高于宫颈癌细胞(P均<0.05);而在宫颈癌细胞系中,HeLa 细胞miR-200c 的表达最高,而HT3 细胞miR-200c 的表达水平最低(图2A),因此在后续实验中,我们分别在HeLa 细胞中转染miR-200c 抑制物,在HT3 细胞中转染miR-200c 模拟物,对miR-200c 进行功能丧失和功能获得实验。结果显示,miR-200c 模拟物显著上调HT3 中miR-200c 的表达,而miR-200c 抑制物显著下调miR-200c 在HeLa 中的表达(图2B)。同时,我们利用CCK8 检测了转染细胞的增殖水平,利用Annexin V 实验检测了转染细胞的凋亡水平。结果显示,与miR-对照相比,miR-200c 模拟物显著抑制HT3 细胞的增殖能力(图2C),而miR-200c 抑制物显著促进HeLa 细胞的增殖水平(图2D);miR-200c 模拟物显著增加HT3 细胞的凋亡水平(图2E),而miRNA-200c 抑制物显著降低HeLa 细胞的凋亡水平(图2F)。
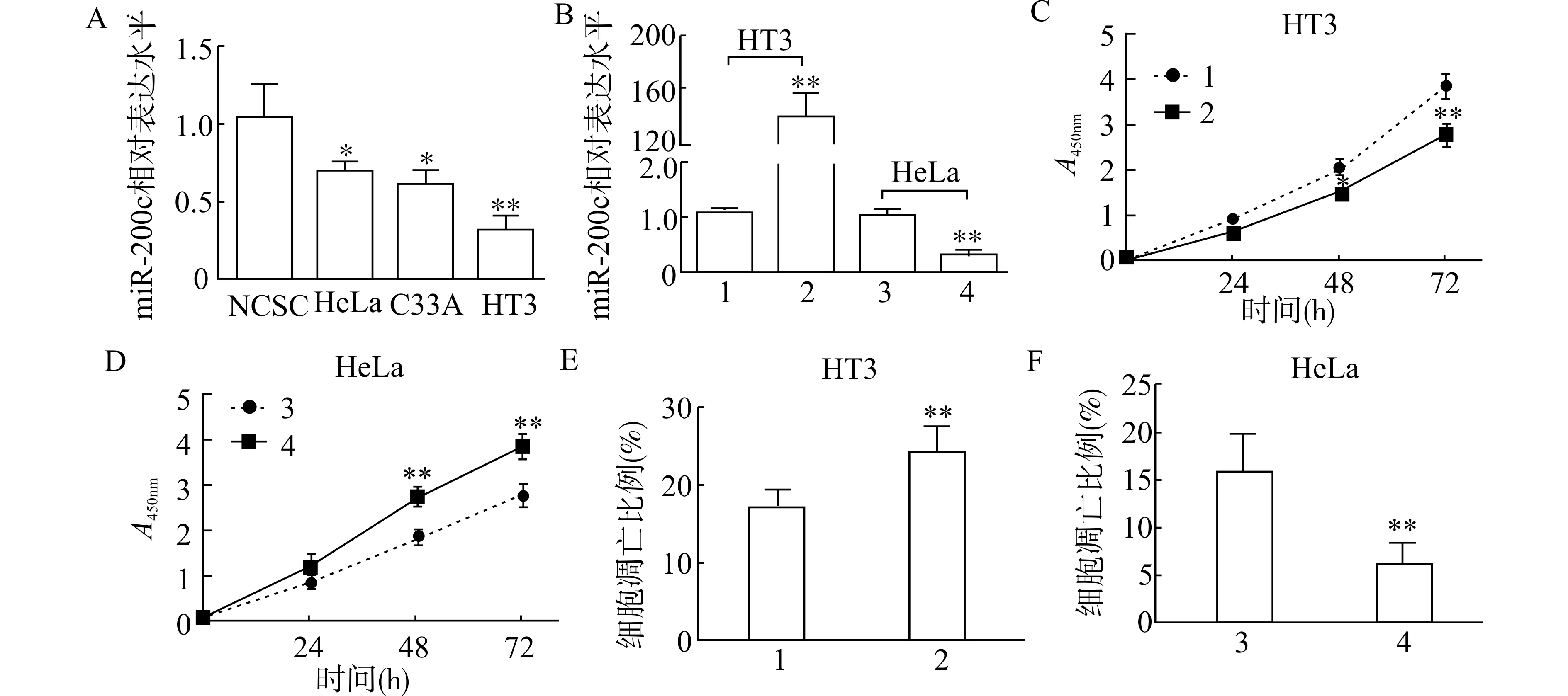
图2 miR-200c 对宫颈癌细胞增殖和凋亡的影响
2.3 miR-200c 通过靶向ZEB1 影响宫颈癌细胞的增殖和凋亡
为了明确miR-200c 如何参与调控宫颈癌细胞的增殖和凋亡,我们首先利用miRTarBase、TargetScan 和miRDB 数据库进行生物信息学分析。结果发现,ZEB1 是miR-200c 潜在的下游靶基因,miR-200c 与ZEB1 mRNA 的3′UTR 存在结合位点(图3A)。为了明确ZEB1 是否是miR-200c 的靶基因,我们进行了荧光素酶报告基因试验,结果发现,与模拟物对照相比,miR-200c 模拟物和wt-ZEB1-3′UTR 质粒共转染显著降低HT3 细胞的荧光素酶活性,而miR-200c 模拟物和mut-ZEB1-3′UTR质粒共转染时,则没有此效应(P<0.01,图3B)。为了进一步证实miR-200 对ZEB1 的靶向作用,我们检测了miR-200c 模拟物或抑制物转染的宫颈癌细胞中ZEB1mRNA 和蛋白质表达水平。结果表明,miR-200c 模拟物显著降低HT3 细胞中ZEB1 的mRNA 和蛋白质表达水平,而miR-200c 抑制物显著上调HeLa 细胞中ZEB1 的mRNA 和蛋白水平(图3C、D)。此外,我们比较了癌组织和癌旁组织中ZEB1 的表达水平,发现癌组织中ZEB1 mRNA 表达水平显著增加(图3E)。相关性分析结果表明,miR-200c 与ZEB1 mRNA 的表达水平呈显著负相关关系(r=-0.614,P=0.001,图3F)。以上结果证实,miR-200c 可以靶向调控宫颈癌细胞中ZEB1的表达。
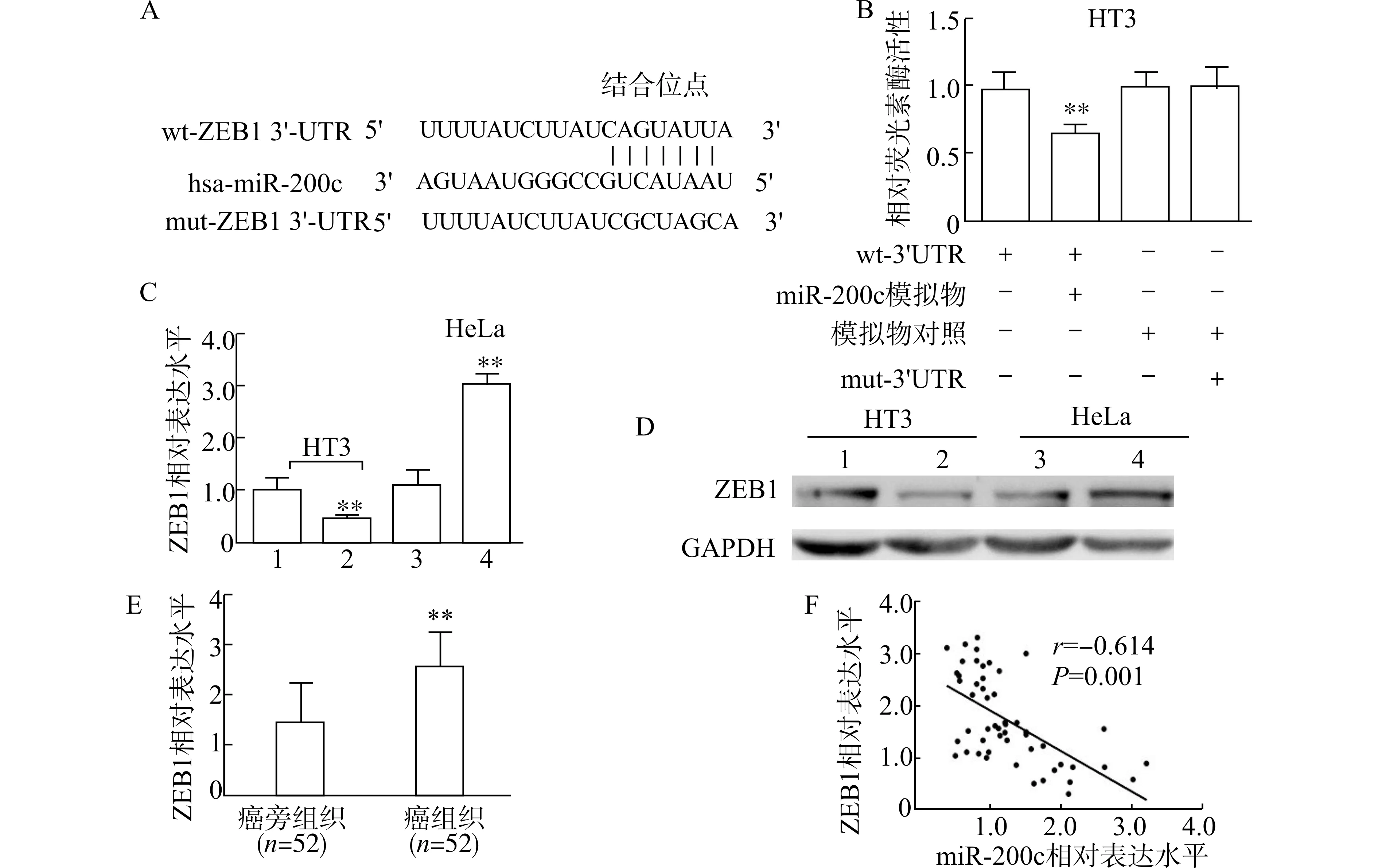
图3 miR-200c 靶向调控宫颈癌中ZEB1 的表达
2.4 ZEB1 对宫颈癌细胞增殖和凋亡的影响
为了明确ZEB1 对宫颈癌细胞增殖和凋亡的影响,我们分别用siRNA (si-ZEB1) 敲低HT3 细胞和质粒(p-ZEB1) 过表达HeLa 细胞中的ZEB1。蛋白质印迹结果证实,si-ZEB1 显著降低HT3 细胞中ZEB1 蛋白水平(图4A),而p-ZEB1 显著增加HeLa 细胞ZEB1 的蛋白表达水平(图4B)。接下来,我们利用CCK8 和Annexin V 实验分析了ZEB1对宫颈癌细胞增殖和凋亡的影响。结果证实,与对照相比,si-ZEB1 显著抑制HT3 细胞的增殖水平(图4C),而p-ZEB1 显著增加HeLa 细胞的增殖情况(图4D);si-ZEB1 显著促进HT3 细胞的凋亡水平(图4E),而p-ZEB1 则抑制了HeLa 细胞的凋 亡(图4F)。

图4 ZEB1 对宫颈癌细胞增殖和凋亡的影响
3 讨论
宫颈癌是世界上严重危害妇女生命和健康的恶性肿瘤之一,复发和转移是宫颈癌治疗失败的主要原因[2]。因此,宫颈癌严重影响了女性的生活和健康。miRNA 芯片数据表明,宫颈癌组织和细胞系中存在多种异常表达的miRNA,这些异常表达的miRNA 影响宫颈癌的发生和发展。例如,miR-203 和miR-125b 可以调控HPV 病毒的DNA 的复制过程[12]。miR-34a 和miR-125b 还可以通过调节HPV 的表达,从而促进宫颈癌的发生发展[13]。miR-200a 也可以影响宫颈癌的转移,研究表明,宫颈癌中miR-200a 和miR-9 的表达水平可以预测患者的存活率[14]。miR-200 是抑制肿瘤的miRNA家族,包括miR-200a、miR-200b 和miR-200c,参与肿瘤的发生发展[15]。有研究证实,miR-200b 在上皮性卵巢癌中异常表达,血浆miR-200b 可作为早期诊断上皮性卵巢癌的分子标志物[16]。miR-200c 也在肿瘤发生发展中发挥重要作用,参与调控肿瘤细胞的增殖、凋亡、侵袭和迁移等诸多生物学过程。例如,miR-200c 可以抑制膀胱癌细胞的增殖、侵袭和迁移[17],同时miR-200c 在结直肠癌中的下调[18]。本研究结果显示miR-200c 在癌组织中的表达低于癌旁组织,与Mei 等[11]的研究结果一致;细胞功能实验证实,miR-200c 通过调控宫颈癌细胞的增殖与凋亡,从而参与宫颈癌的发生发展过程。
miRNA 通过与靶基因的3′-UTR 区域结合从而影响其表达,参与调控多种生理病理过程[4-5]。为了探索miR-200c 调节增殖、凋亡的分子机制,我们根据多个数据库推测ZEB1 为其潜在的靶基因。ZEB1 作为锌指E 同源盒结合转录因子,主要功能是调控上皮间质转化(EMT) 过程[19]。近年的研究证实,ZEB1 的功能也不限于调节EMT 过程。有研究在非侵袭性肿瘤病变中观察到ZEB1 表达,如原位胰腺腺癌或胰腺上皮内病变,证实ZEB1 是胰腺肿瘤发生早期步骤的关键驱动因素,可能与肿瘤的增殖和凋亡有关[20]。另外,有研究证实,ZEB1也是滋养细胞增殖、凋亡、迁移、侵袭和存活的关键,敲低滋养细胞中ZEB1 的表达可以通过Akt 信号通路影响其增殖、凋亡、迁移、侵袭和EMT 过程[21],而抑制ZEB1 的表达可促进细胞凋亡,并通过上调血管内皮生长因子A 的表达来促进血管生成活性[22]。因此,ZEB1 不仅可以促进细胞的侵袭和迁移,还可以改变其增殖、凋亡、成管等。既往研究表明,ZEB1 和P53 家族成员之间在增殖和细胞存活方面存在复杂的相互作用。除此之外,ZEB1 已被证明通过影响P53 和RB 依赖的抑制途径来抑制肿瘤细胞的凋亡过程[23]。通过数据库我们预测ZEB1 是miR-200c 的潜在靶标,而荧光素酶报告基因检测也表明ZEB1 是miR-200c 的直接靶标。本研究证实miR-200c 可以负向调控ZEB1,两者的表达水平在宫颈癌组织中呈负相关关系。另外,miR-200c 可以通过靶向ZEB1 的表达,调控宫颈癌细胞的增殖和凋亡过程,从而参与宫颈癌的发生。
综上所述,本研究结果表明miR-200c 可通过靶向抑制ZEB1 表达调控宫颈癌细胞的增殖与凋亡,从而参与宫颈癌的发生发展。miR-200c/ZEB轴有望成为宫颈癌治疗的潜在分子靶标。

