基于TLR4/NF-κB 通路探究NLRP3 对铜绿假单胞菌的清除机制
刘鑫,李茂新,闫丙健,续宗杰
山东第一医科大学附属人民医院烧伤整形科 济南市,271199
铜绿假单胞菌(Pseudomonasaeruginosa,PA)是烧伤科最常见的革兰阴性菌,大面积深度烧伤患者由于伤口开放、愈合及用药时间长,易导致该细菌的感染,该病菌也是引起医院获得性感染的主要致病菌之一,可在人机体的任何部位定植,进而导致不同程度的感染发生[1-2]。临床数据统计,目前肺炎患者因感染PA 死亡的人数超过40 %,且感染同时伴随其它并发症的死亡率已超过70 %[3]。目前临床上常用抗菌药物治疗PA[4],虽能一定程度改善患者病情,但由于抗生素的滥用及PA 天然的耐药性等问题,导致治疗效果并不理想。核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptors,NLR) 是目前研究较广泛的模式识别受体之一,主要存在于胞浆中,可介导机体的天然免疫应答[5]。目前,NLR家族成员热蛋白结构域蛋白3 (NOD-like receptor pyrin domain containing3,NLRP3) 炎症小体是目前研究最多的炎症小体之一,其能激活胱冬肽酶-1(caspase-1),进而对白细胞介素(IL) -1 家族细胞因子的加工及成熟发挥促进作用[6]。有研究发现,在胆囊纤维化患者的支气管上皮细胞和巨噬细胞中PA 能够激活NLRP3 炎症小体,但PA 感染人巨噬细胞炎症小体的激活情况及炎症对PA 感染的清除机制鲜有报道[7]。Toll 样受体(Toll-Like receptors,TLRs) 是Ⅰ型跨膜蛋白,是一类保守的模式识别受体 (pattern recognition receptor,PRR),可通过识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs) 而激活下游的核因子κB (nuclear factor κB,NF-κB) 信号通路,调控多种炎症介质和细胞因子的表达,启动针对病原体的天然免疫和获得性免疫[8]。有研究发现[9],TLR4在肺部感染发生时被激活,从而对肺内成纤维细胞中脂多糖诱导的促炎细胞因子的产生发挥促进作用,因此猜测TLR4/NF-κB 信号通路引发的过度炎症可能是导致PA 感染死亡的重要原因。因此,本研究旨在探究NLRP3 对PA 的清除作用及TLR4/NF-κB 信号通路能否成为NLRP3 影响PA 清除的作用机制。
1 材料与方法
1.1 试剂与仪器
铜绿假单胞菌 (招远拓普生物工程有限公司);人单核细胞系THP-1 细胞(ATCC 公司);佛波酯(PMA) (美国Sigma 公司);淋巴细胞分离液(中国TBD sciences 公司);CD14 磁珠(美国BD 公司);人重组细胞因子M-CSF (美国Peprotech 公司);ELISA 试剂盒(美国BD 公司);Trizol 试剂、TLR4 干扰RNA (si-TLR4)、TLR4 激活剂LPS (美国Invivogen 公司);TLR4 抗体、p-NFκB P65 抗体 (美国Invivogen 公司);PCR 引物(上海生工合成);PCR 仪(Gene Inc 公司)。
1.2 细胞培养
取THP-1 细胞,将PMA 加入到THP-1 细胞中诱导分化为巨噬细胞,16 h 后将巨噬细胞置于含10 %胎牛血清和双抗的完全DMEM 培养基中培养,将培养基置于恒温培养箱中培养,设置培养箱条件为37 ℃、5 % CO2。收集生长良好的巨噬细胞接种于24 孔板中,用PA 刺激巨噬细胞24 h,随后收集细胞上清液,用于后续实验。
1.3 人外周血巨噬细胞的分离培养
在人外周抗凝血中加入等体积的培养基,充分混匀后,将淋巴细胞分离液按照1∶2 的比例加入到人抗凝外周血中,在20 ℃环境,以1 800 r/min 的速度离心人抗凝外周血30 min,分离血细胞。将位于中间的单核细胞层收集于离心管中,加入PBS溶液,在4 ℃环境,离心机1 500 r/min 速度离心10 min,PBS 洗涤细胞2 次后,收集细胞沉淀。将CD14 磁珠加入到细胞沉淀中,分选出的人单核细胞并培养,置于含10 %胎牛血清的DMEM 培养基上,并加入100 ng/mL 的人重组细胞因子M-CSF,根据细胞计数结果进行铺板,培养于37 ℃环境中。第3 天换液,7 d 后诱导呈巨噬细胞备用。用PA刺激巨噬细胞24 h,随后收集细胞上清液,用于后续实验。
1.4 细胞培养及感染菌液制备
使用前,将PA 接种于假单胞菌琼脂平板,在常规的培养箱中培养,设置温度恒定37 ℃;使用时挑取单菌落,并接种于LB 培养基中,将培养基置于恒温摇床上,37 ℃、200 r/min 的条件下培养12 h,梯度稀释菌液,直至菌液终浓度为109CFU/mL 备用;使用时以MOI=5 感染细胞,即感染时1 个细胞对应5 个细菌。
1.5 ELISA 检测细胞中IL-1β、IL-8 水平
收集细胞培养上清液,按照ELISA 试剂盒说明书检测细胞上清液中IL-1β、IL-8 水平。
1.6 RT-PCR 检测细胞中NLRP3、caspase-1 mRNA 表达
取THP-1 巨噬细胞和hMDMs,用PA 刺激巨噬细胞24 h,后用Trizol 裂解细胞并提取细胞中总RNA,提取步骤按照试剂盒说明书进行。逆转录总RNA 为cDNA,操作步骤按照试剂盒说明书操作。NLRP3 上游引物5′-CAGCGATGAAGACGCGAGAG-3′,下游引物5′-AGAGATATGGCACGAAAGCTATCCA-3′;caspase-1 上游引物5′-ACTGCTACACCTGTTGCGCCTCA-3′,下游引物5′-CTGCCGACGCAGGAAATTC-3′;GAPDH上游引物5′-CAACTCCCTCAAGATTGTCAGCAA-3′,下游引物GGCATGGACTGTGGTCATGA。瞬时离心引物,加入去离子水,充分混匀并制成100 μmol/L 的贮存液;把上游、下游引物稀释成终浓度10 μmol/L 的溶液。PCR 反应条件: 95 ℃预变性3 min;95 ℃变性10 s;60 ℃退火30 s;共计40 个循环。用2-△△CT法分析表达量。
1.7 蛋白质印迹检测细胞中TLR4、p-NF-κB P65 蛋白表达
蛋白裂解液充分提取各组THP-1 巨噬细胞和hMDMs 总蛋白,DAB 法检测细胞中蛋白浓度。配置等浓度蛋白溶液为2 μg/mL,按照6∶1 的比例加入相应的体积的蛋白负载缓冲液,煮沸溶液10 min后保存蛋白溶液于-20 ℃的冰箱。取蛋白样品30 μg,电泳蛋白样品后转移到PVDF 膜上,加入5 %的脱脂奶粉到PVDF 膜上,封闭PVDF 膜1 h,分别加入一抗(1∶1 000),在4 ℃环境中孵育一抗过夜,后清洗PVDF 膜,加入相应的二抗 (1 ∶1 000),室温孵育二抗2 h。将ECL 发光剂加入到细胞中曝光,用显影液显影,用Image Lab 软件分析各条带灰度值。
1.8 小RNA 干扰实验及PA 感染
按照转染试剂LipofectamineTM2000 说明书,分别将si-NLRP3 及阴性对照si-NC、si-TLR4 转染到THP-1 巨噬细胞和人单核细胞来源巨噬细胞(hMDMs) 中,分别设为si-NC 组、si-NLRP3 组和si-TLR4 组。将各组THP-1 巨噬细胞和hMDMs 加入到铜绿假单胞菌中共孵育1 h,后进行后续实验。
1.9 细菌平板计数实验
取THP-1 巨噬细胞和hMDMs 加入PA 共孵育1 h后,更换含300 μg/mL 庆大霉素的培养基培养30 min,以清除胞外菌;将孔板用PBS 溶液清洗干净,后将0.1 % TritonX-100 加入到孔板中,将孔板置于冰上裂解10 min,待细胞充分裂解并释放出大量的细菌,梯度稀释细胞裂解液,在PA 平板上将细胞均匀的涂布,每个稀释浓度设置3 个平板;将平板置于37 ℃环境中过夜,次日对平板菌落计数。细胞清除率=[CFU (1 h) -CFU (2 h)]/CFU (1 h) ×100 %。
1.10 统计学分析
实验数据采用Graphpad priam 8.0 软件进行统计学分析。计量资料均用均数±标准差() 表示。不同组间数据采用单因素方差(one-wayANOVA) 分析,各组间两两比较采用LSD-t检验,实验结果以P<0.05 表示差异有统计学意义。
2 结果
2.1 PA 感染巨噬细胞后IL-1β、IL-8 水平比较
PA 感染的THP-1 诱导分化的巨噬细胞和原代人单核来源巨噬细胞hMDMs 上清液中IL-1β、IL-8水平明显增加(P<0.05) (图1)。和si-NC 组相比,THP-1 诱导分化的巨噬细胞和原代人单核来源巨噬细胞hMDMs 沉默NLRP3 和TLR4 后的si-NLRP3 和si-TLR4 组上清液中IL-1β、IL-8 表达水平明显降低(P<0.05),且si-NLRP3 和si-TLR4 组上清液中IL-1β、IL-8 表达水平相比无统计学意义(P>0.05) (图2)。

图1 PA 感染巨噬细胞后IL-1β、IL-8 表达比较
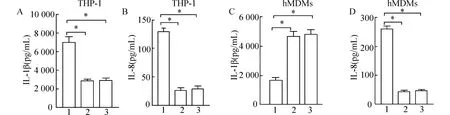
图2 巨噬细胞沉默NLRP3 和TLR4 后上清液中IL-1β、IL-8 表达比较
2.2 PA 感染巨噬细胞后NLRP3 和caspase-1 mRNA 表达比较
PA 感染的THP-1 诱导分化的巨噬细胞和原代人单核来源巨噬细胞hMDMs 中NLRP3、caspase-1 mRNA 表达明显升高(P<0.05) (图3)。

图3 PA 感染巨噬细胞后NLRP3 和caspase-1 mRNA 表达比较
与si-NC 组比较,THP-1 诱导分化的巨噬细胞和原代人单核来源巨噬细胞hMDMs 沉默NLRP3 和TLR4 后的si-NLRP3 和si-TLR4 组细胞中NLRP3、caspase-1 mRNA 表达明显地降低(P<0.05),并且si-NLRP3 和si-TLR4 组细胞中NLRP3、caspase-1 mRNA 的表达相比较无明显的差异 (P>0.05)(图4)。
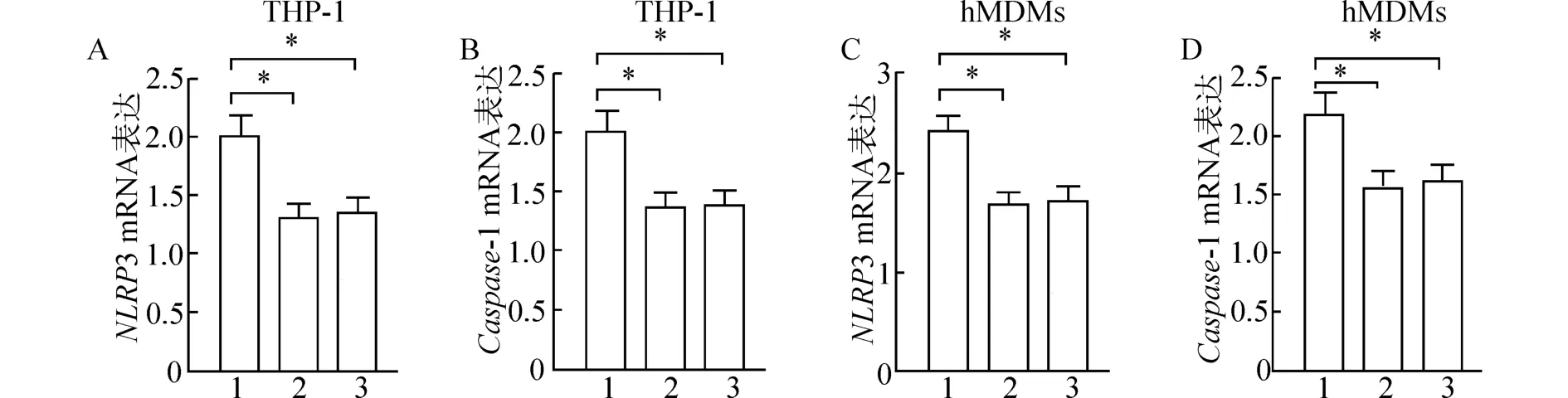
图4 巨噬细胞沉默NLRP3 和TLR4 后细胞中NLRP3 和caspase-1 mRNA 表达比较
2.3 PA 感染巨噬细胞后TLR4、p-NF-κB P65 蛋白表达比较
PA 感染的THP-1 诱导分化的巨噬细胞和原代人单核来源巨噬细胞hMDMs 中TLR4、p-NF-κB P65 蛋白表达明显增加(P<0.05) (图5、图6A)。和si-NC 组相比,THP-1 诱导分化的巨噬细胞和原代人单核来源巨噬细胞hMDMs 沉默NLRP3 和TLR4 后的si-NLRP3 和si-TLR4 组细胞中TLR4、p-NF-κB P65 蛋白表达明显降低(P<0.05),且si-NLRP3和si-TLR4 组细胞中TLR4、p-NF-κB P65 蛋白表达相比无明显差异(P>0.05) (图6B、图7)。

图5 PA 感染巨噬细胞后TLR4、p-NF-κB P65 蛋白表达比较

图6 巨噬细胞中TLR4、p-NF-κB P65 蛋白表达
2.4 细胞清除率比较
和si-NC 组相比,沉默PA 感染的THP-1 巨噬细胞和原代人单核来源巨噬细胞hMDMs 中NLRP3 和TLR4 表达细胞清除率明显增加(*P<0.05) (图8)。

图8 沉默NLRP3 和TLR4 抑制铜绿假单胞菌的清除
3 讨论
PA 是烧伤科及院内感染的一种常见病原体,可通过感染不同部位引发多种严重症状的发生,包括肺炎、脑膜炎、心肌炎等[10]。由于PA 的细胞膜通透性较差,导致多数的抗生素在菌体内不能发挥很好的疗效,因此临床上用抗生素治疗铜绿假单胞菌感染性疾病的效果并不理想[11]。目前关于PA 导致炎症及感染发生的机制鲜有报道,因此,本研究旨在探究PA 诱导巨噬细胞分泌炎症因子的具体机制,为临床研发新药物提供更多的实验依据,对临床治疗感染PA 所致疾病尤为重要。
NLRP3 作为固有免疫系统重要组成部分的炎症小体,其在髓样细胞中广泛表达,包括中性粒细胞和单核巨噬细胞等,且能识别细胞、病毒等病原体及LPS 等危险信号分子[12]。在巨噬细胞中,NLRP3 炎症小体的表达是感染性疾病的典型特征[13]。研究发现,NLRP3 炎症小体可由环境刺激物、内源性危险信号以及致病菌如PA 等激活,进而通过促进炎症小体的集合而分泌大量的炎症细胞因子[14]。本研究通过培养THP-1 诱导分化的巨噬细胞及原代人单核来源巨噬细胞hMDMs,并用PA 感染THP-1 和hMDMs 发现,巨噬细胞中NLRP 和caspase-1 的相对表达明显增加,且会分泌大量的IL-1β 和IL-8。有研究发现,IL-1β 是目前研究最关键的免疫调节及促炎细胞因子,其不仅可被caspase-1 加工,还能被炎症小体所激活[15]。在单核细胞分化过程中,IL-1β 可通过促进分化为M1样巨噬细胞而促进B 淋巴细胞的增殖和分化。由此可见,IL-1β 可能参与PA 的免疫应答过程,并且还能对炎症小体的激活发挥促进作用。有学者通过对感染铜绿假单胞菌的肺炎研究发现,机体内IL-1β 和IL-18 水平增加会减弱对PA 的杀伤力[16];还有学者研究发现,当小鼠caspase-1 缺陷时,PA感染的小鼠眼部炎症和角膜荷菌量明显减少[17]。本研究通过进一步转染沉默si-NLRP3 发现THP-1和hMDMs 细胞上清液中IL-1β 和IL-8 水平降低,同时抑制细胞中NLRP3 和caspase-1 表达,增加对PA 的清除率。因此提示NLRP3 炎症小体的激活有可能是PA 逃避免疫杀伤的策略,但其具体的机制尚不清楚。
在固有免疫应答中,TLRs 是重要的蛋白调控分子之一,激活TLRs 可和特异性免疫及非特异性免疫应答相连接[18]。TLR4 是TLRs 家族成员之一,其可对革兰阴性菌的脂多糖进行识别,进而通过激活不同的信号通路对促炎细胞因子的分泌发挥诱导作用。本研究结果显示,PA 感染巨噬细胞THP-1和hMDMs 后,细胞中TLR4 的表达明显增加,猜测在PA 激活炎症反应时TLR4 是主要受体。当细胞膜上的TLR4 和PA 相结合时会激活NF-κB 信号传导通路,进而对细胞炎症因子的基因转录及蛋白表达发挥调节作用。Lee 等[19]研究发现,用PA 感染肺上皮细胞后会激活NF-κB 信号通路,进而介导炎症的发生发展;还有学者研究发现[20],不同浓度的PA 刺激U937 后可激活NF-κB 信号通路,进而对炎症因子IL-8 的产生发挥促进作用。本研究结果显示,PA 感染巨噬细胞THP-1 和hMDMs后,NF-κB 信号传导通路的P65 蛋白被磷酸化,且蛋白表达明显增加,由此提示,在PA 感染巨噬细胞时TLR4 及其下游因子在引发炎症反应中发挥重要作用,可能是帮助NLRP3 激活时PA 逃避免疫杀伤策略的机制之一。本研究通过进一步转染沉默si-TLR4 时发现THP-1 和hMDMs 细胞上清液中IL-1β 和IL-8 水平降低,抑制细胞中NLRP3 和caspase-1 表达及TLR4 和P65 表达,增加对PA 的清除率,提示抑制PA 感染巨噬细胞中TLR4/NFκB 的激活,可能是增加巨噬细胞对PA 杀伤的机制。
综上所述,沉默NLRP3 可增加巨噬细胞对铜绿假单胞菌的清除作用,其作用机制可能和抑制TLR4/NF-κB 信号通路激活有关。由于时间和成本等因素,本研究尚未对活化的TLR4/NF-κB 信号通路能都影响巨噬细胞对PA 杀伤作用进行研究,使研究结果存在一定局限性。在今后的研究中,会增加激活TLR4/NF-κB 信号通路及作用于其它下游分子的研究,为临床治疗感染PA 所致的疾病提供更多的实验数据。

