气肿疽梭菌C54-1株的制备与检定
任小侠,冯 妍,马 欣,刘 燕,王团结,杜吉革,潘晨帆,刘世博,张一帜
(中国兽医药品监察所(农业农村部兽药评审中心),北京 100081)
气肿疽梭菌病,俗称“黑腿病”,是由气肿疽梭菌(Clostridiumchauvoei)引起的一种急性传染性疾病[1],多发于牛、羊、鹿、猪等。该病有一定的地方流行性和季节流行性,地势相对低洼的地区、夏季多发。自20世纪以来,气肿疽已在国内20多个地区的暴发,给我国畜牧业发展带来了严重的经济损失。气肿疽主要为动物采食气肿疽梭菌感染的饲料或饮水后通过消化道传播,潜伏期为2~5 d[2],自然感染后病程发展迅速,患病动物通常在1~3 d内出现死亡[3]。该病主要症状是肌肉组织水肿、产气、坏死,体温出现升高,或伴有败血症症状,肌肉丰富部位肿胀,按压紧张且有捻发音,行动障碍等。气肿疽梭菌通常危害牛、羊等反刍动物的健康,但据近年来的相关报道,日本[4]、美国[5]已出现感染人类并引起高热、肺炎等细菌感染典型症状导致死亡的病例,这说明气肿疽不仅对养殖业造成危害,也威胁到了人类健康。
气肿疽梭菌又称肖氏梭菌,属细菌纲,芽孢杆菌科,梭菌属(Clostridium)。气肿疽梭菌的菌体长度为1.5~8.5 μm,菌体两端圆滑,无荚膜,因其有周身鞭毛而能够运动,芽胞通常位于菌体中央,也有可能偏向其中一端[6]。气肿疽梭菌C54-1株(CVCC60001),由山西省家畜防疫处于1949年自山西省和顺县气肿疽牛上分离所得,现保存于国家兽医微生物菌(毒)种保藏中心[7]。气肿疽梭菌C54-1株属于强毒株,为气肿疽梭菌灭活疫苗效力检验用强毒菌种,也是气肿疽梭菌灭活疫苗生产用菌种。该菌为专性厌氧菌,对环境的温度、湿度等因素有较强的抵抗力,在土壤或者不利生长条件下,可形成芽孢并长期生存,用浓度为3%的甲醛溶液浸泡或高压20 min以上才能失活[8]。该菌对于青霉素、四环素、土霉素、恩诺沙星、环丙沙星等药物敏感[9]。由该菌制成的气肿疽灭活疫苗以及气肿疽牛出败二联干粉菌苗均有良好的防护效果,有报道该菌制成的核酸疫苗也能对小鼠起到良好的免疫效果[10]。
《中华人民共和国兽用生物制品规程》二〇〇〇年版[11](以下简称《规程》)中规定该菌种在冻干状态下2~8 ℃的保存期为15年。新制备的菌种应按照《规程》进行检定,本文将介绍气肿疽梭菌C54-1株(CVCC60001)的制备和检定方法及结果,通过16S rDNA鉴定从分子水平对其进行进一步鉴定,并对其以及对适宜该菌生长的培养基进行比对,将为该菌检定和相关标准的制修订提供参考。
1 材料与方法
1.1 菌种 气肿疽梭菌C54-1株,CVCC60001,1995年7月10日冻干,F4,由国家兽医微生物菌(毒)种保藏中心提供。
1.2 培养基及试剂 厌气肉肝汤培养基、普通琼脂培养基、胰蛋白胨大豆琼脂(TSA)培养基、普通肉汤培养基、液体硫乙醇酸盐培养基(TG)、胰酪大豆胨液体培养基(TSB)、生理盐水、5%蔗糖脱脂牛奶、石蕊牛乳小管、醋酸铅小管均购自北京中海生物技术有限公司;强化梭菌培养基(RCM)、细菌微量生化鉴定管、氧气指示剂购自青岛海博生物;革兰氏染色液、无菌脱纤维绵羊血购自北京索莱宝;50%葡萄糖溶液,购自上海源叶生物;新生牛血清,购自VivaCell;甲醛溶液,购自MACKLIN;灭菌10%钾明矾溶液和25%碳酸钠溶液,实验室自制;4%多聚甲醛溶液,购自国药集团。
1.3 实验动物 SPF豚鼠购自维通利华实验动物技术有限公司;实验用兔购自中国食品药品检定研究院;健康黄牛购自新疆某养殖场。
1.4 复壮用菌种的毒力监测 开启1995年7月10日冻干的气肿疽梭菌C54-1株1支,用0.6 mL普通肉汤溶解后,各取约0.2 mL接种于厌气肉肝汤小管(以下简称肉肝汤小管)1支、普通琼脂斜面小管1支、普通肉汤小管1支,37 ℃培养24 h。肉肝汤小管应长菌、产气旺盛,普通琼脂斜面小管和普通肉汤小管上不生长。之后吸取肉肝汤小管培养物3.0 mL,接种于厌气肉肝汤中管,37 ℃培养24 h。将肉肝汤中管培养物混匀后,分别按0.1 mL/只、0.2 mL/只、0.3 mL/只,股内侧肌肉注射350~450 g SPF豚鼠,每个滴度1只。
1.5 菌种的牛体复壮 将菌种按照1.4项方法复溶、接种并传代1次后,取3.0 mL菌液接种于8月龄的健康黄牛臀部肌肉,牛于33.5 h左右死亡,解剖取少量组织(心血、肝脏、肌肉、肌肉渗出液)接种于肉肝汤小管中,37 ℃厌氧培养24 h;并用接种环取心血、肝脏接种于血平板中, 37 ℃厌氧培养48 h。
1.6 菌种的冻干制备 挑取1.5项血平板培养的菌落接种厌气肉肝汤进行传代培养,收集菌液,3000 r/min离心30 min,弃去上清,保留菌体,加入5%蔗糖脱脂牛奶作为冻干保护剂,重悬混匀。将菌体悬液分装安瓿瓶中,入箱,按照厌氧菌冻干曲线进行冻干。冻干结束后,将安瓿瓶抽真空,封口后置2~8 ℃保存。
1.7 菌种的检定
1.7.1 真空度测定、纯粹检验及剩余水分检定 根据2020年版《中国兽药典》进行检验[12]。
1.7.2 培养特性检定 用接种环刮取少量菌体在含10%绵羊脱纤血葡萄糖普通琼脂平板上划线培养,37 ℃厌氧培养48 h,观察菌落形态。
1.7.3 形态和生化特性检定 取新鲜培养的血平板上的菌体进行革兰氏染色,进行判定。使用细菌微量生化鉴定管参照使用说明书进行生化特性检查。
1.7.4 培养基比对研究 分别使用《规程》中要求的厌气肉肝汤以及目前商品化培养基——强化梭菌培养基对于C54-1株进行培养,同时进行毒力(豚鼠、家兔)、免疫原性的测定,观察记录结果。
1.7.6 毒力检定 按照1.4项下方法复溶、接种并传代1次后,分别攻毒黄牛、豚鼠、兔。
1.7.6.1 黄牛 取24 h培养物2.0 mL,接种于8月龄的健康易感黄牛,臀部肌肉注射。规程要求黄牛注射后60 h内死亡[11]。
1.7.6.2 豚鼠 取24 h培养物0.1~0.3 mL,接种于体重350~450 g的豚鼠2只,股内侧肌肉注射。规程要求豚鼠注射后16~48 h内死亡[11]。取攻毒后16~48 h内死亡豚鼠的注射部位的肌肉,置于4%多聚甲醛溶液中固定,按常规程序制备石蜡切片,进行HE染色。
1.7.6.3 兔 取48 h培养物1.0 mL,接种于体重1.5~2.0 kg的家兔2只,臀部肌肉注射。规程要求家兔注射后不应死亡。本实验中家兔注射后,观察10 d[11]。
1.7.7 免疫原性检定 按照《规程》制备气肿疽灭活疫苗(明矾苗)[6],2~8 ℃保存。分别免疫体重350~450 g的豚鼠4只,1 mL/只,免疫21 d后使用C54-1株对免疫组、对照组豚鼠进行攻毒,观察各组豚鼠状态持续10 d,记录结果[11]。取观察10 d的免疫组豚鼠的注射部位的肌肉,置于4%多聚甲醛溶液中固定,按常规程序制备石蜡切片,进行HE染色。
1.8 16S rDNA鉴定 取C54-1株的24 h培养物2.0 mL置于EP管中,2~8 ℃冷链寄送至上海派森诺生物科技有限公司进行测序:对细菌基因组DNA提取、PCR 扩增及产物纯化,将菌种纯化后的PCR产物用NCBI Blast程序将拼接后的序列文件与NCBI 16S数据库中的数据进行比对,得到相似性最高的物种信息,即为鉴定结果。
2 结果与分析
2.1 真空度测定、纯粹检验及剩余水分检定 对冻干的菌种进行真空度测定,C54-1株300/313支安瓿呈现白色或粉色或紫色辉光,符合规定;将不符合规定的冻干菌种进行无害化处理。
2.2 纯粹检验 分别各抽取5支真空度测定良好的C54-1株菌种进行纯粹检验,结果均为5/5符合规定。
2.3 剩余水分测定 分别各抽取4支真空度测定良好的C54-1株菌种进行剩余水分测定,剩余水分测定结果为1.2%、0.8%、1.7%、1.4%,均符合规定。
2.4 培养特性检定 肉眼观察培养48 h的C54-1株菌落状态:灰白色,外圈为不规则圆形,内圈为规则圆形、边缘不整齐,中间凹陷或凸起的典型纽扣状菌落,菌落周围呈透明状,呈双环β溶血(图1),符合培养特性规定。
图1 C54-1株菌落培养形态Fig 1 Colony culture morphology of strain C54-1
2.5 形态和生化特性检定
2.5.1 形态检定 挑取新鲜培养物进行革兰氏染色,结果为革兰氏阳性中等大小杆菌,两端钝圆,单个散在,偶有双联,大小不一(图2),符合形态检定规定。
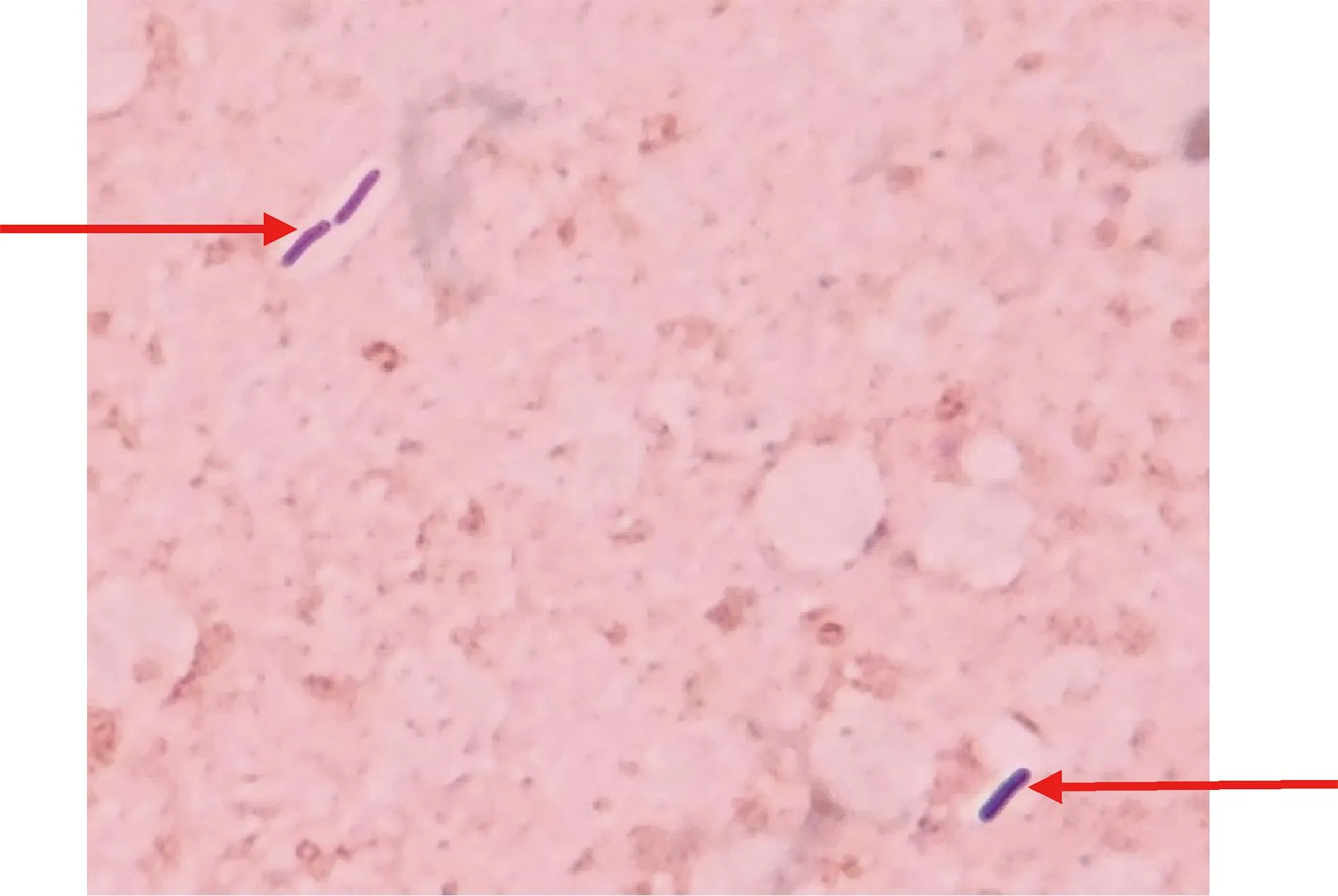
图2 C54-1株形态特征Fig 2 Morphological characteristics of strain C54-1
2.5.2 生化特性检定 从平板上挑取1~3个单一菌落接种于细菌微量生化鉴定管,糖发酵管中需加入新生牛血清,100 μL/管。C54-1菌种反应结果具体详见表1,气肿疽梭菌发酵半乳糖、麦芽糖、果糖、葡萄糖、蔗糖等,产气产酸;不发酵棉子糖、水杨素、甘露醇、卫矛醇等;硝酸盐还原,产硫化氢;石蕊牛乳不定,或微产酸,或没有变化,还原中性,明胶液化[13]。生化特性检定结果符合规定。

表1 C54-1菌种生化特性检定结果Tab 1 Biochemical characteristics results of strain C54-1
2.6 16S rDNA鉴定结果 将测序得到的序列在 NCBI中比对,鉴定结果为气肿疽梭菌(Clostridiumchauvoei),相似度为99.93%。目前,细菌学家普遍认为,当16S rDNA序列同源性高于97%时,可以认为是属内的同种[14-15]。说明该菌种为气肿疽梭菌。
2.7 适宜液体培养基研究 平板挑取单菌落,分别培养于厌气肉肝汤小管和强化梭菌培养基小管,培养24 h。培养结果可以看到,相同的接种量和培养时间,无论是厌气肉肝汤还是强化梭菌培养基均产气、生长良好,说明两种培养基均可以为气肿疽梭菌C54-1株生长提供足够的营养(图3),而强化梭菌培养基没有固体成分,其浑浊度与菌液浓度具备相关性,可根据实际需求选择适宜的培养基。

左到右分别为:接种C54-1株的厌气肉肝汤小管、未接种C54-1株的厌气肉肝汤小管、接种C54-1株的强化梭菌培养基小管、未接种C54-1株的强化梭菌培养基小管图3 C54-1株菌种不同培养基培养结果Fig 3 Bacteria culture results of strain C54-1 with different media
2.8 毒力检定与比对 将C54-1株的厌气肉肝汤培养物,分别注射豚鼠、家兔、黄牛,攻毒剂量分别为0.1 mL/只、1.0 mL/只、2.0 mL/头,在注射后24 h,豚鼠及黄牛全部死亡,注射后观察10 d,家兔均存活(表2)。C54-1株毒力检定符合规定。同时用相同试验方法,将C54-1株24 h强化梭菌培养基培养物进行攻毒,在注射后16~48 h内,豚鼠全部死亡;注射后10 d,家兔均存活(表2)。试验表明,经过两种培养基培养的菌液制备的攻毒菌液毒力均符合现行规定。HE染色结果(图4):与空白对照组(A)相比,可见经厌气肉肝汤(B)和强化梭菌培养基(C)培养的气肿疽梭菌均可导致豚鼠肌肉组织出现化脓性肌炎,肌纤维间聚集大量中性粒细胞,部分肌纤维溶解或萎缩。

表2 C54-1菌种毒力检定试验结果Tab 2 Virulence test results of strain C54-1 with different media
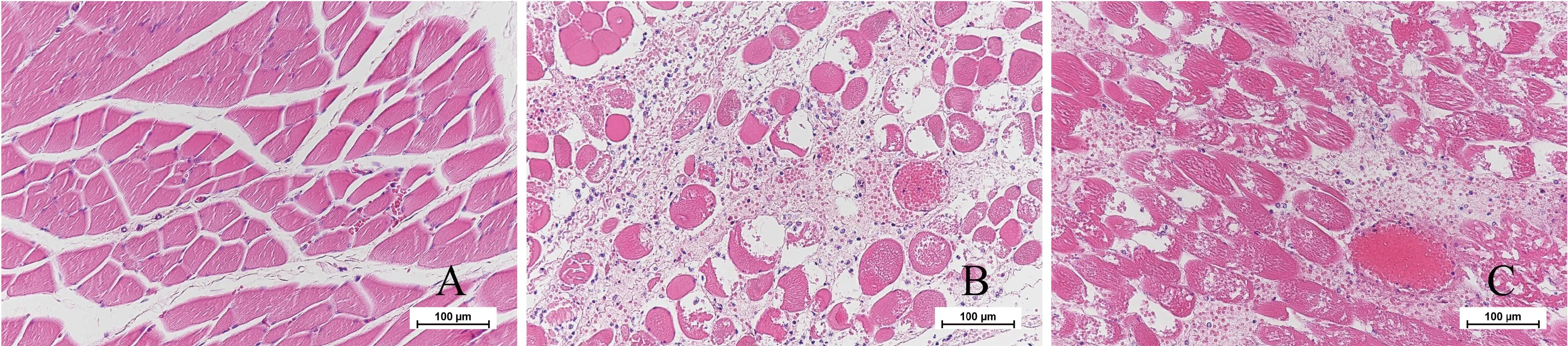
A:空白对照组;B:厌气肉肝汤毒力组;C:强化梭菌培养基毒力组图4 C54-1株毒力豚鼠肌肉HE染色Fig 4 HE staining of guinea pig muscle of strain C54-1
2.9 免疫原性检定与比对
2.9.1 配制明矾苗 将C54-1株的厌气肉肝汤24 h培养物,经纯粹检验合格后,按菌液总量的0.5%加入甲醛溶液充分振荡混匀并置 37 ℃灭活96 h,灭活检验合格后,加入灭菌的25%碳酸钠溶液,将pH值调至7.9~8.1,然后按照9∶1的体积比将菌液与灭菌的10%钾明矾溶液混合均匀,经无菌检验合格后,置于2~8 ℃保存。
2.9.2免疫程序 取350~450 g体重的豚鼠6只,其中4只设为免疫组,每只股内侧肌肉注射接种明矾苗1 mL,另2只不接种,作为对照组。21 d后,用C54-1株的厌气肉肝汤24 h培养物作为攻毒用菌液,分别对免疫组和对照组进行攻毒,攻毒剂量为规定最小剂量0.3 mL/只。
2.9.3 结果 攻毒后72 h内,C54-1株的厌气肉肝汤24 h培养物的对照组豚鼠2/2死亡,免疫组豚鼠4/4存活。C54-1株免疫原性检定符合规定。同时用相同试验方法,将C54-1株的强化梭菌培养基24 h培养物进行攻毒,对照组2/2死亡,免疫组4/4存活(表3)。试验表明,经过两种培养基培养的菌液制备的明矾苗,均可产生良好的保护作用。HE染色结果(图5):经过厌气肉肝汤培养的菌液制备的明矾苗免疫21 d后使用厌气肉肝汤培养的气肿疽梭菌攻毒的免疫组(B)、经过强化梭菌培养基的菌液制备的明矾苗免疫21 d后使用强化梭菌培养基培养的气肿疽梭菌攻毒的免疫组(C)与空白对照组(A)相比,两组豚鼠肌肉组织结构清晰,肌纤维整齐有序,均未见明显异常;同时,未经免疫并使用厌气肉肝汤培养的气肿疽梭菌攻毒的对照组(D)、未经免疫并使用强化梭菌培养基培养的气肿疽梭菌攻毒的对照组(E)与空白对照组(A)相比,两组豚鼠肌肉组织出现化脓性肌炎,肌纤维间聚集大量中性粒细胞,部分肌纤维溶解或萎缩。

表3 不同培养基培养C54-1菌种免疫原性检定试验结果Tab 3 Immunogenicity test results of strain C54-1 with different media

A:空白对照组;B:厌气肉肝汤免疫组;C:强化梭菌培养基免疫组;D:厌气肉肝汤对照组;E:强化梭菌培养基对照组图5 C54-1株免疫原性豚鼠肌肉HE染色Fig 5 HE staining of immunogenic guinea pig muscle of strain C54-1
3 讨论与小结
本研究检定该批气肿疽梭菌C54-1株培养特性、形态及生化特性、血清学特性、毒力、免疫原性、纯粹、剩余水分及真空度项目,结果均符合《规程》标准的规定。在毒力检定中显示C54-1株经培养24 h,对于豚鼠的致死剂量为0.1 mL、对于黄牛的的致死剂量为2.0 mL;经培养48 h后,对家兔进行攻毒,攻毒剂量为1.0 mL时,至观察结束,家兔均存活。结果表明,气肿疽梭菌对黄牛、豚鼠敏感且具有较强致病力,而家兔对该菌存在抵抗力,这与目前报道的研究结果相一致。值得注意的是,在《规程》中使用不同培养时间的菌液攻毒不同敏感程度的动物,不能很好的说明毒力效果, 建议通过进一步研究为气肿疽梭菌菌种的毒力检定方法修订提供参考意见。在免疫原性检定中显示C54-1株培养物经甲醛灭活后加入钾明矾制成的灭活疫苗(明矾苗),在攻毒剂量为0.3 mL时仍对豚鼠全部保护,说明其免疫原性良好。在毒力与免疫原性检定中,通过HE染色方法,能够更为清晰的观察和对比攻毒死亡及免疫保护的豚鼠的注射部位的肌肉组织形态变化:肌肉组织作为气肿疽梭菌的靶器官,在攻毒后肌纤维受损明显,出现化脓性肌炎,而通过明矾苗的免疫保护,肌肉组织结构保持清晰,肌纤维整齐有序,这也从组织学层面验证了C54-1株的毒力特性及良好的免疫原性。随着分子生物学、蛋白组学等技术的发展,对于菌种的功能研究也不断深入,现已发现气肿疽梭菌的4种主要抗原和毒力因子与该菌的致病能力密切相关,分别为细胞毒素A(CctA)、鞭毛蛋白(flagella)、神经氨酸酶(NanA)和透明质酸酶(nagH)[16]。对于这4种主要抗原和毒力因子的深入研究,不仅能为优化气肿疽梭菌菌种检定的精确性和科学性提供思路,也能为气肿疽梭菌检验检测方法和新型疫苗的研究提供参考。另外,本研究在《规程》要求检定项目的基础上,增加了16S rDNA鉴定,通过分子生物学手段对该菌进行鉴定,不仅能够更加准确确定细菌的属种及纯净性,也有利于气肿疽梭菌菌种资源信息的完善,为该菌种标准的修订提供了分子水平的检定依据。
《规程》中规定该菌种培养时使用厌气肉肝汤进行培养[11]。但在实际检定和研究过程中,由于厌气肉肝汤在制备中需要使用牛肉和牛肝等天然性成分,可能会导致这种培养基不同批次的促生长能力出现差异。另外,在培养过程中厌气肉肝汤培养基底部的肝块会产生絮状杂质,对菌体或菌液的收集纯化造成一定影响,并且不能用于菌液浓度测定。强化梭菌培养基作为一种商品化厌氧菌培养基,配制简便,标准明确,质量稳定可控,不仅可以用于梭菌的增菌培养,也对菌液浓度进行测定,能够在一定程度上更加准确的反映细菌的生长情况并且对在攻毒实验中控制攻毒剂量提供一定的参考意义。本研究将厌气肉肝汤与强化梭菌培养基(RAM)对于气肿疽梭菌C54-1株的促生长情况、毒力、免疫原性进行了比对,两者均能满足气肿疽梭菌生长所需营养并对该菌种的毒力及免疫原性影响差异不大,在气肿疽梭菌的菌种制备与检定中,强化梭菌培养基(RAM)能够替代厌气肉肝汤,这为相关标准和规程中对于该菌的培养基的优化和修订提供了参考。

