甘氨酸钾溶液吸收二氧化碳的结合能及动力学分析
刘均隆,成怀刚,2,刘 倩,,王 瑾,潘子鹤
(1.山西大学资源与环境工程研究所,CO2减排与资源化利用教育部工程研究中心,太原 030006;2.青海大学化工学院;3.山西大地生态环境技术研究院)
随着经济和科技的快速发展,我国能源消耗日益增加,化石能源的使用导致二氧化碳(CO2)排放量大幅增长。中国炼油行业是CO2排放的重点领域,故CO2捕集利用成为一个重大难题。在CO2捕集过程中,吸收剂普遍受到腐蚀问题的限制,因而开发耐腐蚀吸收剂是学者探索的方向之一。
目前,主流的CO2吸收剂仍是液体吸收剂,包括醇胺类、碳酸钾溶液、氨水、离子液体以及相变吸收剂等[1]。醇胺类吸收剂能够有效吸收CO2,但其在吸收CO2过程中会腐蚀设备,同时其易挥发性会对大气造成二次污染且再生能耗高[2-3]。氨基酸盐具有和醇胺类吸收剂相当的吸收能力和反应速率[4],同时具有良好的抗氧化降解和热降解能力;相较于其他氨基酸盐,甘氨酸钾(PG)具有较好的 CO2吸收特性[5]。Lee等[6]研究发现,PG与碳酸钾溶液混合物吸收CO2的能力明显比碳酸钾溶液强;Fukumoto等[7]发现由氨基酸合成的离子液体可用于吸收CO2;胡一雯等[8]发现解吸PG溶液时加入甘氨酸,PG再生率提高约26%,吸收单位量CO2的能耗降低30%左右;张卫风等[9]发现经过20次吸收-解吸CO2循环后,PG溶液的吸收负荷为新鲜PG溶液的46.48%。
上述研究普遍聚焦于吸收剂的微观结构变化[10]、负载量[11]、活化效果[12]以及混合吸收剂的协同增效[13]和传质特性[7]等,而对CO2吸收过程动力学的研究仍较少见,尤其对吸收过程结合能、功能基团与CO2的交互作用、动力学差异缺乏定量分析。甘氨酸钾的表面张力比醇胺溶液更高[14],意味着甘氨酸钾混合吸收体系挥发性可能更低或吸收体系极性和吸收-解吸性能可能更易受到弱酸[15]等的影响;同时,在吸收CO2的过程中,中间产物可能会影响甘氨酸钾和醇胺的吸收动力学性能[16-17]。然而,由于缺乏定量的动力学研究,上述推测无理论依据,因而无法指导新型吸收剂的研发。可见,动力学研究对新型吸收剂研发非常重要,有必要开展相应的研究工作。
基于前期对氨基酸盐结合能的计算,笔者优选PG作为CO2吸收剂,并以氢氧化钾和甘氨酸合成PG,对其吸收CO2的动力学进行研究,考察环境条件对PG吸收CO2过程的影响;进而结合模拟与试验结果,定量对比分析PG-CO2分子间和乙醇胺(MEA)-CO2分子间的结合能,以指导基于PG的新型吸收剂研发。
1 实 验
1.1 试 剂
甘氨酸(质量分数不小于 99.5%),氢氧化钾(分析纯),CO2(体积分数不小于99.5%),上海麦克林生化科技股份有限公司产品。
1.2 反应机理
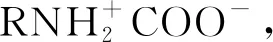
(1)
1.3 CO2吸收试验
CO2吸收装置如图1所示,该装置由煤气分析仪(型号Gasboard-3100,湖北锐意自控系统有限公司产品)、冷凝管、烧瓶组成。冷凝管与烧瓶相连接,用于回流挥发的PG溶液。CO2吸收时,将CO2通入烧瓶,未被吸收的CO2经冷凝管流出至煤气分析仪,通过进、出口质量流量计的数值差以及煤气分析仪的CO2含量差值来计算CO2的吸收量。若进、出口质量流量计的示数相同样且煤气分析仪CO2含量不再发生变化,则说明吸收反应达到平衡。
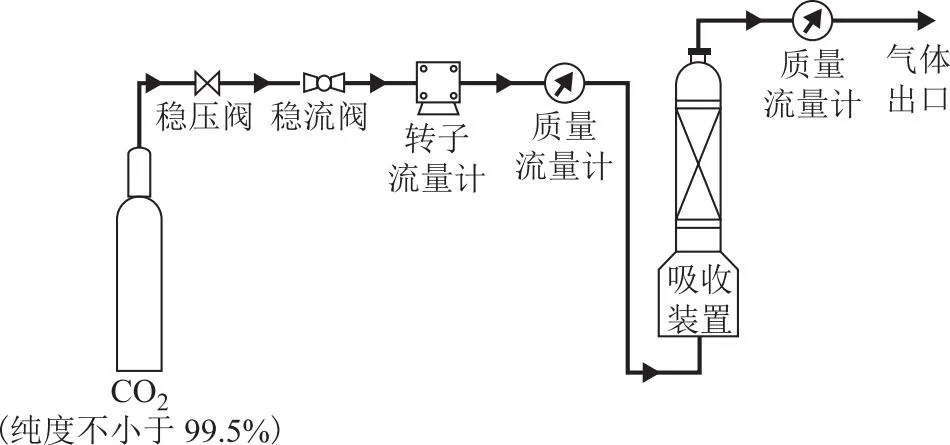
图1 CO2吸收流程
CO2与PG溶液的反应动力学方程见式(2)。
(2)
由于试验中压力恒定,转化可得二级动力学方程:
1/cPG-1/cPG0=k′t
(3)
式中,cPG和cPG0分别为PG溶液的浓度和初始浓度,mol/L。
1.4 结合能计算
氨基酸盐与CO2的反应机理和醇胺与CO2的反应机理相似[16],故将PG和MEA分子中氨基上H原子与CO2分子中O原子间的初始距离设置为0.3 nm,构建PG-CO2双分子体系和MEA-CO2双分子体系结构模型(见图2),并以双分子体系能量最低为目标对其进行几何优化,优化的最大迭代次数设置为500次,交换关联泛函设置为广义梯度近似,模拟方法基于密度泛函理论。用双分子体系的总能量减去单分子的能量,即为两种分子的结合能。

图2 双分子模型
此外,为计算溶液模型能量,先分别构建PG分子、乙醇胺分子、CO2分子、水分子的模型,然后构建PG水溶液-CO2、MEA水溶液-CO2模型,如图3所示。其中,PG水溶液-CO2模型由500个水分子、10个PG分子、230个CO2分子组成,上方为CO2,下方为PG水溶液;MEA水溶液-CO2模型由500个水分子、10个MEA分子、230个CO2分子组成,上方为CO2,下方为MEA水溶液;二者晶胞尺寸皆为2.56 nm×2.56 nm×8.97 nm。对PG溶液-CO2体系、MEA溶液-CO2体系分别进行分子动力学模拟,模拟计算的系综采用正则系综NVT,初速度选取Random,温度设置为298 K,时间步长为1 ps,总步数为100 000,每100步输出一帧,计算模拟吸附过程中每一帧模型体系的结合能。

图3 溶液模型
2 结果与讨论
2.1 PG-CO2双分子体系的结合能
分别对PG-CO2、MEA-CO2两种双分子体系进行几何优化,结果如图4。由图4可知,经过几何优化之后,MEA和PG分子中氨基上H原子与CO2分子中O原子间的距离分别为0.343 9 nm和0.356 4 nm时,体系能量最低。
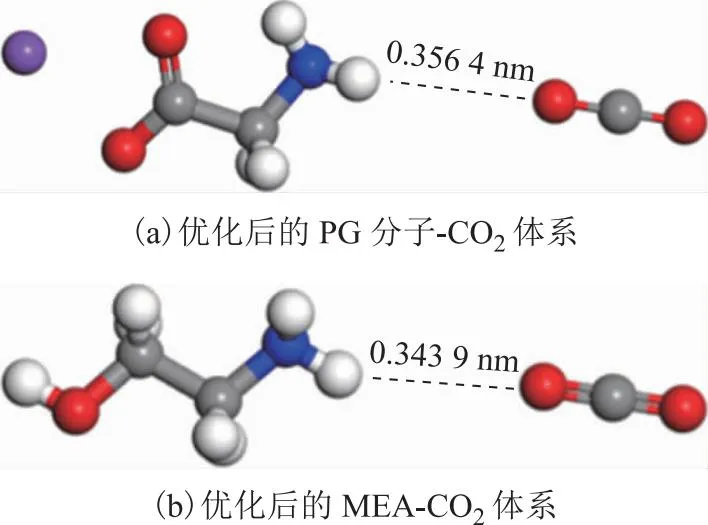
图4 优化后的双分子模型
对几何优化后的体系能量和双分子结合能进行计算,主要对比计算PG-CO2与MEA-CO2双分子体系的能量,并以其他氨基酸盐-CO2双分子体系作参考,如表1所示。由表1可知:模拟计算得到的分子结合能为负值,说明分子结合时放出热量,体系能量降低从而达到更稳定的状态;同时,结合能的大小反应了分子间的结合程度,PG-CO2的结合能明显大于MEA-CO2和其他氨基酸盐- CO2体系,一定程度上说明PG对CO2的吸收能力强于MEA及其他氨基酸盐。因此,相对于MEA和其他氨基酸盐,PG是一种性能更好的新型绿色CO2吸收剂。

表1 不同体系的分子与CO2的结合能
2.2 PG溶液-CO2体系的结合能
对PG水溶液-CO2、MEA水溶液-CO2体系进行分子动力学模拟,分子间相互作用产生的结合能如图5所示。模拟前期,随着时间的增加,两种吸附剂溶液与CO2的结合能均快速增大,说明两种吸附剂溶液均与CO2快速发生了反应,体系剧烈释放能量;模拟后期,随着时间的增加,吸附剂溶液与CO2的结合能增长变缓,并在一定区间范围内波动,说明吸收过程达到平衡。PG溶液-CO2体系结合能在928 ps时出现最大值,约释放出1 225.70 kJ/mol的能量;MEA溶液-CO2体系结合能在829 ps时出现最大值,约释放出1 206.18 kJ/mol的能量。在模拟吸附开始的100 ps内,PG溶液-CO2体系的结合能一直比MEA溶液-CO2大,体系释放能量多,因而更加稳定;但总体而言,两个体系结合能的能量区间波动相差不大,说明两种溶液体系对CO2分子的吸收效果相近。

图5 吸附剂溶液吸附CO2的动力学变化过程
由于PG-CO2的分子结合能明显大于MEA-CO2(表1),两种溶液的作用效果相近说明吸附剂与水分子间的相互作用可能影响其吸收能力。Yu Jiamei[18]等在研究金属有机框架HKUST-1作为CO2吸附材料时也发现引入水分子可增强CO2和HKUST-1之间的结合能,从而显著改善其CO2的捕获能力。根据结合能与过渡态理论,分子结合能可抵消部分反应所须的活化能,因此分析PG与CO2的反应动力学十分重要。
2.3 PG的合成及其吸收CO2效果
在温度为40 ℃下,以相同浓度的甘氨酸溶液与氢氧化钾溶液进行中和反应,得到PG溶液。然后,分别以1 mol/L的甘氨酸溶液、氢氧化钾溶液、PG溶液为吸收剂进行CO2吸收试验,结果如图6所示。甘氨酸溶液为吸收剂时,装置前后质量流量计数值基本相同,说明甘氨酸对CO2无吸收能力。由图6可知,PG溶液吸收CO2的量为0.58 mol/L,氢氧化钾溶液吸收CO2的量为0.82 mol/L,说明氢氧化钾溶液吸收CO2的能力明显高于相同浓度的PG溶液;而且在相同条件下,氢氧化钾溶液与CO2的反应速率比PG溶液更高,原因在于氢氧化钾属于强碱,与CO2反应能力更强。但是,强碱溶液吸收CO2后解吸难度大,而PG可吸收-解吸CO2,循环利用吸收剂,有利于降低CO2捕集成本。

图6 氢氧化钾溶液、PG溶液对CO2吸收能力的比较
2.4 PG浓度对CO2吸收动力学过程的影响
在40 ℃下,分别以浓度为0.5,1.0,1.5,2 mol/L的PG溶液吸收CO2,考察PG溶液浓度对其吸收CO2能力的影响,并以CO2吸收负荷(单位摩尔甘氨酸钾溶液吸收 CO2的容量)表示PG溶液吸收CO2的能力,结果见图7。

图7 PG溶液浓度对其吸收CO2能力的影响
由图7可见:随着PG溶液浓度的增加,其吸收CO2的反应速率增大;随着反应时间的增加,PG不断与CO2反应,溶液浓度不断降低导致吸收速率不断下降。浓度为0.5,1.0,1.5,2.0 mol/L的PG溶液与CO2反应达到平衡的时间分别为19,36,46,67 min。浓度为1.5 mol/L与2.0 mol/L的PG溶液吸收了全部的CO2。在相应的反应时间内,随着PG溶液浓度的增加,其CO2吸收负荷降低,这是因为随着PG溶液浓度增加,体系的传质阻力增大,阻碍了CO2的溶解和传质,导致溶液的CO2吸收负荷降低。
理论上,浓度1 mol/L的PG溶液的CO2吸收负荷为1 mol/mol,但吸收反应过程中的多种副反应(如PG水解等)会影响PG溶液的CO2吸收负荷。因此,浓度为0.5,1.0,1.5,2.0 mol/L的PG溶液的CO2吸收负荷分别为0.623,0.584,0.571,0.565 mol/mol,与文献[19]测定的MEA吸收负荷(0.5 mol/mol)相近,说明两种溶液吸收CO2的容量相近,二者对于CO2的吸收能力相近,与二者有相近的结合能相一致。
2.5 温度对CO2吸收过程动力学的影响
为探究不同温度下PG溶液吸收CO2的规律,分别在30,40,50,60 ℃的条件下,以流速200 mL/min向浓度为1 mol/L的 PG溶液中通入CO2进行反应,结果见图8。

图8 温度对PG溶液吸收CO2过程的影响
由图8(a)可见:随着温度从30 ℃升至40 ℃,CO2吸收量增大,继续升高温度时,吸收容量反而下降;随着温度从30 ℃升至60 ℃,PG溶液吸收CO2反应达到平衡的时间逐渐缩短,从52 min缩短至22 min。这是因为:PG溶液吸收CO2与CO2解吸的过程为可逆过程,反应需要一定的活化能,温度升高,有利于加快吸收反应;但当温度升高到其促进解吸的作用大于其促进吸收的作用时,再升高温度会导致吸收容量下降。因此,PG的最佳CO2吸收温度为40 ℃。
2.6 流速对CO2吸收动力学过程的影响
为探究流速对PG溶液吸收CO2过程的影响,在CO2流速分别为100,200,300,400 mL/min条件下进行PG溶液吸收CO2动力学试验,结果如图9所示。

图9 CO2流速对吸收过程的影响
由图9可知,随着CO2流速提高,反应结束时间逐渐缩短;在开始的5 min内,流速为100,200,300,400 mL/min时的CO2吸收率分别为100.00%,80.00%,73.33%,45.00%。这是因为增加CO2流速缩短了气相和液相的接触时间,流速增大使吸收速率明显提高,但部分CO2没有足够的时间与PG反应就流出装置,导致单位时间内的CO2吸收率下降,整体上削弱了CO2在溶液中的吸收过程。
2.7 CO2吸收活化能
以反应时间t为自变量,1/cPG-1/cPG0为因变量,作二者关系变化曲线,斜率即为反应速率常数,如图10所示,并对4个温度下的反应速率常数进行线性拟合,如图11所示。根据阿伦尼乌斯方程lnk=-Ea/RT+lnA,拟合直线的斜率即为PG溶液吸收CO2的反应活化能(Ea),计算得PG溶液吸收CO2的Ea=28.0 kJ/mol,与文献[7]计算的PG吸收CO2反应活化能(34.2 kJ/mol)相近,比常用CO2吸收剂反应活化能更低(MEA,MDEA,DEA的Ea分别为41.2,41.93,53.1 kJ/mol)[20]。

图10 不同温度下PG与CO2反应的

图11 PG-CO2体系的阿伦尼乌斯拟合曲线
活化能的大小反映了吸收剂与CO2反应的难易程度,与传统醇胺类吸收剂相比,PG吸收CO2的反应更易进行,可减少能耗。另一方面,降低活化能会促进CO2吸收反应的进行,以PG为基材开发新型吸收剂有助于提高CO2吸收反应的动力学速率。
3 结 论
采用试验与模拟相结合的方法,研究了PG 吸收CO2的过程动力学过程。在双分子体系中,PG-CO2的结合能比MEA-CO2高0.42 kJ/mol;而在水溶液体系中,两种吸附剂溶液与CO2的结合能在吸收过程达到平衡时整体相差不大,说明吸附剂与水分子间的相互作用可能影响其吸收能力。
试验发现:温度升高,PG溶液的CO2吸收速率加快,但过高的温度反而会促进PG解吸反应,40 ℃下PG溶液的CO2吸收量最高;由于传质阻力的影响,随着PG溶液浓度升高,其吸收负荷反而降低,0.5 mol/L的PG溶液CO2吸收负荷比2 mol/L的多0.058 mol/mol。增大CO2流速可以提高反应速率,但CO2吸收率明显降低,在反应开始的5 min内,流速为400 mL/min时CO2的吸收率仅为流速100 mL/min时的45%。
PG与CO2反应的活化能较低,为28.0 kJ/mol,反应易于进行。因此,基于PG开发新型节能、抗腐蚀、抗氧化降解的CO2吸收体系是一个优选的研究方向。

