水稻维生素B1 合成相关基因OsTHIC 的功能研究
张超 王子瑞 孙亚丽 毛馨晨 唐家琪 于恒秀
(江苏省作物基因组学和分子育种重点实验室 植物功能基因组学教育部重点实验室 扬州大学农学院,扬州 225009)
维生素B1又名硫胺素,是人体必需的微量元素之一。维生素B1有助于促进人体神经健康、改善情绪、增强心脏和减少胃灼热[1-2]。同时,维生素 B1也是一种抗氧化剂[3]。当维生素B1摄入量不足时,往往会出现微量营养素缺乏症。若严重缺乏维生素B1,则会干扰中枢神经和循环系统,并导致“脚气病”[4-6]。
维生素B1在植物的生长发育、非生物和生物胁迫的响应中发挥着重要的作用[7]。维生素B1缺乏会导致植物新陈代谢速率减慢,呼吸作用减弱,光合作用下降,蔗糖和氨基酸残基的累积量增高[8]。在玉米维生素B1合成缺陷的突变体中,新生叶的数量和花序的形成都会受到影响[9]。维生素B1能够触发植物的防御系统[10]。当病原体侵染植物时补施维生素B1,植物会大量且迅速地积累致病相关蛋白(pathogenesis related protein,PR)的mRNA,使植物抵抗病原体的能力增强[11]。此外,维生素B1处理会增加拟南芥对丁香假单胞菌(Pseudomonas syringae)的抗性、水稻对纹枯病及白叶枯病的抗性以及黄瓜对白粉病的抗性[12]。当植物遭受非生物胁迫(例如渗透压、盐和氧化应激胁迫)以及暴露于冷、热和强光条件下时,维生素 B1含量会增加,且维生素B1生物合成途径关键酶的 mRNA 转录水平也会增加[13-15]。对向日葵根部外源施加维生素B1发现,其叶绿素含量、相对含水量、可溶性糖和维生素 B1含量均升高,K+含量升高,Na+、Ca2+和 Cl-含量降低,叶片水势降低[16]。此外,有研究发现植物对非生物胁迫所诱导损伤的耐受度与维生素 B1的含量呈正相关性[17]。
在植物体内,维生素 B1主要以硫胺素(thiamin)、硫胺素单磷酸(thiamin monophosphate,TMP)及硫胺素焦磷酸(thiamin pyrophosphate,TPP)三种形式存在。硫胺素焦磷酸作为主要活性物质在细胞代谢途径中起到辅酶的作用。植物中维生素B1的生物合成途径在拟南芥中已有较深入研究[7,18]。维生素B1主要由嘧啶环(4-氨基-5-羟甲基嘧啶)和噻唑环(4-甲基-5-β-羟乙基噻唑)两部分组成。嘧啶部分的生物合成是通过嘧啶合成酶(HMP-P synthase,THIC)催化底物5-氨基咪唑核糖核苷酸(5-aminoimidazole ribonucleotide,AIR)合成4-氨基-2-甲基-5-羟甲基嘧啶单磷酸(4-amino-2-methyl-5-hydroxymethylpyrimidine monophosphate,HMP-P)。HMP-P 在硫胺素磷酸合成酶(thiamine phosphate synthase,TH1)的催化下形成4-氨基-2-甲基-5-羟甲基嘧啶焦磷酸(4-amino-2-methyl-5-hydroxymethylpyrimidine diphosphate,HMP-PP)。噻唑部分的生物合成是通过噻唑合成酶(HEP-T synthase,THI1)催化底物甘氨酸(Glycine,Gly)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)和硫化物基团形成腺苷二磷酸-5-(β-乙基)-4-甲基噻唑-2-羧酸(adenylated thiazole,ADT)。ADT 随后形成4-氨基-2-甲基-5-羟甲基嘧啶磷酸(4-amino-2-methyl-5-hydroxymethylpyrimidine phosphate,HET-P)。硫胺素从头合成的两个前体HET-P 和HMP-PP 在硫胺素磷酸合成酶(thiamine phosphate synthase,TH1)的催化下连接在一起形成TMP。TMP 在原核生物中可以直接转化为TPP[19],但在拟南芥中,TMP 首先被TMP 磷酸酶(TMP phosphatase,TH2)脱磷酸为硫胺素[18,20]。然后硫胺素转运至细胞质溶胶,被细胞质中的两种硫胺素焦磷酸激酶(thiamine pyrophosphokinase,TPK1 和TPK2)焦磷酸化成TPP[21-22]。
拟南芥THIC 基因编码一种铁硫簇蛋白,该基因突变导致拟南芥黄化并在子叶期之前死亡。拟南芥thic 突变体维生素B1含量仅为野生型的30%,外施维生素B1可以恢复thic 的突变表型[23-24]。水稻作为最重要的粮食作物之一,其维生素B1合成途径尚未完全解析;水稻THIC 基因在水稻生长发育过程中的作用以及其是否调控维生素B1合成仍不清楚。本研究从一个水稻叶色突变体克隆了OsTHIC 基因,并对其功能进行解析,为明确水稻维生素B1生物合成途径及生物强化提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 wll1 来自本实验室EMS 诱变突变体库,背景为粳稻品种日本晴。日本晴作为对照组。水稻材料种植于扬州大学水稻试验田和光照培养箱。试验田播种时间为每年5 月中旬。光照培养箱光周期设定为14 h 光照/10 h 黑暗,培养温度设定为28℃,相对湿度设定为70%。外源施加维生素B1,以100 μmol/L 的维生素B1溶液喷施水稻苗,每2 d 喷施一次,持续喷施20 d,自然光温培养。
1.1.2 菌株及载体 本研究所用菌株主要有根癌农杆菌菌株EHA105(用于侵染水稻愈伤组织),大肠杆菌菌株DH5α(用于载体的克隆);所用载体包括亚细胞定位载体 pJIT163-GFP,为本实验室保存;CRISPR/Cas9 载体pYLCRISPR/Cas9-MH(用于基因编辑)。
1.1.3 主要试剂 常规分子克隆限制性内切酶和T4 DNA 连接酶,10×Ligation buffer 购自TaKaRa 公司(用于基因编辑载体及亚细胞定位载体构建);高保真DNA 聚合酶KOD-plus 采购于TOYOBO,普通DNA 聚合酶购自北京天根生化(用于基因型鉴定及亚细胞定位载体构建所涉及的PCR 反应);总RNA提取试剂TRIzol、RNA 逆转录试剂盒(SuperScript III)以及荧光定量试剂盒SYBR Green 均为 Invitogen公司产品(用于基因相对表达量测定);引物序列合成和DNA 测序由上海天霖和浙江尚亚公司完成;凝胶回收试剂盒和质粒小提试剂盒为易思得公司产品;维生素B1含量检测试剂盒购于上海酶联生物;植株代谢组检测由上海拜谱公司完成。
1.2 方法
1.2.1 叶绿素含量测定 测定方法主要参照已有文献报道,并做小幅改动[25]。取野生型和突变体叶片组织并去除叶片中脉,分别称取 0.1 g,剪成 1 mm左右大小,放置于15 mL 离心管中,加入10 mL 丙酮、乙醇等比混合溶液,在30-40℃的黑暗环境下,避免光照,浸泡12 h 左右,直到组织彻底脱色为止。用丙酮和乙醇等比例的混合液作对照,利用分光光度计检测样品在663 nm、645 nm、470 nm 波长处的吸光值,3 次生物学重复。光合色素的浓度通过下列公式进行计算:
Chla(mg/g)=(12.72A663-2.69A645)×V/(1000 W)
Chlb(mg/g)=(22.90A645-4.68A663)×V/(1000 W)
Car(mg/g)=(1000A470×V/W-3.27 Chla-104 Chlb)/198
其中Chla、Chlb、和Car 分别代表叶绿素a、叶绿素b、类胡萝卜素,A663、A645、A470分别为相应波长的吸光值,V 为提取液体积(mL),W 为所取叶片鲜重(g)。
1.2.2 Mutmap+从 M3 某分离群体中随机选取野生型和突变体各18 株,送诺禾致源生物信息有限公司进行混池重测序,利用测序数据分别计算野生型池和突变体池中所有突变位点的突变指数[26]。
1.2.3 CRISPR/Cas9 选择基因编辑的靶序列并合成寡核苷酸序列。通过PCR 方法将靶序列与U6a 启动子及gRNA 连接。采用边酶切边连接的方法,将所得DNA 片段与pYLCRISPR/Cas9-MH 连接,转化大肠杆菌Trans5α 感受态。菌液PCR 阳性克隆送公司进行测序。提取质粒转化农杆菌,农杆菌侵染水稻愈伤组织,经筛选、分化、生根等步骤获得转基因植株。经潮霉素抗性基因检测及目的基因的基因型检测,获得敲除突变体。
1.2.4 维生素B1含量测定 采用上海酶联生物公司试剂盒测定水稻叶片维生素B1含量。其原理为维生素B1在碱性条件下还原铁氰化钾生成亚铁氰化钾,亚铁氰化钾与Fe3+在弱酸条件下生成普鲁士蓝,在704 nm 有特征吸收峰。按操作说明对样品进行研磨、提取及测定。利用吸光值及标准曲线计算维生素B1含量。每组样品6 次生物学重复。
1.2.5 RT-qPCR 比较野生型与wll1 相关基因表达量时,取对应材料幼苗提取RNA,反转录为cDNA。利用实时定量PCR 仪及各基因特异性引物对基因进行实时定量。在比较外施维生素B1对基因表达量影响时,对野生型植株进行了外源维生素B1喷施处理,并在处理4 h 后取样进行RT-qPCR 分析。未喷施处理的野生型作为对照。所有RT-qPCR 均以Ubiquitin作为内参。RT-qPCR 所用引物见表1。

表1 RT-qPCR 所用引物序列Table 1 Sequences of primers used in RT-qPCR
1.2.6 非靶向代谢组分析 取四叶期水稻幼苗的心叶,液氮速冻。冷冻寄送至上海拜谱生物科技有限公司进行代谢组检测及数据分析。取每个样品40 mg,加入钢珠,再加300 μL 预冷的甲醇-水溶液(体积分数4∶1),于组织破碎仪中匀浆破碎。加入700 μL 预冷的甲醇-水溶液(体积分数4∶1),冰浴中超声20 min,-20℃静置1 h,4℃ 16 000×g 离心20 min,取上清,上清在高速真空浓缩离心机挥干。质谱检测时加50 μL 甲醇-水溶液(体积分数1∶1)复溶,20 000×g 4℃离心15 min,取上清进样测定。采用超高效液相色谱系统 SHIMADZU-LC30(UHPLC),使用 ACQUITY UPLCR HSS T3(2.1 mm×100 mm,1.8 μm)(Waters,Milford,MA,USA)色谱柱进行样品分离,再用QE Plus 质谱仪(Thermo Scientific)进行质谱分析。通过对质控样本(quality control,QC)和检测样本进行预处理即包括缺失值过滤、模拟(missing value recoding)、数据归一化(normalization)、QC 验证和数据转换。以正交偏最小二乘判别分析(OPLS-DA)建立代谢物表达量与样品类别之间的关系模型。以单变量统计分析筛选出的差异代谢物。差异代谢物的筛选主要参考VIP、FC 和P-value 三个参数,VIP(variable importance in the projection)是指第一主成分的变量投影重要度,VIP 值表示代谢物对分组的贡献;FC 表示倍数变化,即每一代谢物在对照组所有生物中重复定量值的平均值之比;P-value 是通过t 检验计算得到,表示差异显著性水平。以VIP score > 1.0,FC >1.5 或FC<1/1.5,且P-value<0.05 作为筛选标准,筛选出差异代谢物[27]。
2 结果
2.1 突变体表型鉴定
wll1 在四叶期之前与野生型相比无明显差异(图1-A)。从第四叶开始,wll1 出现心叶基部白化表型(图1-B)。随着幼苗生长,白化表型向叶片顶部扩展,并蔓延到其他叶片,最终幼苗在萌发后 4 周左右死亡。在植株四叶期测定野生型和wll1 第三、四片叶的光合色素含量。结果表明,野生型与wll1 第三片叶光合色素含量无显著差异(图1-C)。在第四叶片中,wll1 的叶绿素a、叶绿素b 和类胡萝卜素含量与野生型相比都显著下降(图1-D)。这表明wll1 中光合色素的代谢过程存在异常。

图1 wll1 表型及光合色素测定Fig.1 Phenotypic characterization and photosynthesis pigment measurement of wll1
2.2 通过Mutmap+分离候选突变位点
杂合突变体材料自交后,其后代群体中可以分为差异明显的正常绿叶表型植株和心叶白化表型植株2 种类型,经卡方(χ2)检验,这两种表型植株的分离比(正常叶∶心叶白化)符合孟德尔经典遗传分离比 3∶1(127∶46,χ2=0.156,P>0.05),这说明心叶白化表型受单个隐性基因控制。
我们采用Mutmap+技术分离候选突变位点。高通量测序在表型池及非表型池共得到23 538 个SNP(single nucleotide polymorphisms)及3 695 个Indel(insertion/deletion),并计算得到所有突变位点的突变指数。突变指数是指某突变位点测到的突变次数占该位点测到的总次数的比值。基于遗传学原理,我们设定了如下突变位点筛选参数:(1)表型池混池单株表型准确,因此引起突变表型的位点在混池单株中全部发生突变,突变指数应为1。(2)非表型池为野生型单株(引起突变表型的位点均未发生突变,突变指数为0)及杂合突变单株(引起突变表型的位点在同源染色体中的一条染色体发生突变,理论突变指数为0.5)的混合,因此突变指数小于0.5。以该参数筛选过后,得到15 个SNP 位点,均位于水稻第3 号染色体24.8-27.5 Mb 的物理区间内(表2)。

表2 候选突变位点Table 2 Candidate mutation sites in wll1
15 个突变位点中,4 个位点位于基因外显子区,4 个位点位于基因内含子区,1 个位点位于启动子区,6 个位点位于基因间区。突变位于外显子区的4 个基因中,LOC_Os03g46590 编码转座子蛋白,在各水稻组织中均不表达。LOC_Os03g47610 编码硫胺素合成蛋白THIC。LOC_Os03g47740 编码同源结构域蛋白,在水稻抗病响应中起正调控作用。LOC_Os03g48140 编码肌球蛋白。有文献报道,拟南芥中LOC_Os03g47610 的同源基因THIC 突变导致褪绿表型及生长停滞,因此将该基因作为候选基因,并命名为OsTHIC。为了验证Mutmap+定位结果,随机选取分离家系的20 株单株进行一代测序验证。突变表型单株在OsTHIC 的突变位点处均为纯合突变,非突变表型单株为野生型序列及杂合突变。
OsTHIC 包含7 个外显子,有较长的3'非编码区(untranslated region,UTR)(图2-A)。开放阅读框为1 920 bp,编码蛋白含639 个氨基酸。wll1 中的突变导致OsTHIC 第355 位的谷氨酸替换为赖氨酸。蛋白序列比对发现,OsTHIC 在植物和细菌中存在同源蛋白,在真菌和动物中无同源蛋白。前人报道动物不能从头合成维生素B1,且真菌维生素B1中嘧啶环的合成采用不同的生化途径,这与蛋白比对结果相一致。多重序列比对表明OsTHIC 的同源蛋白均包含一个ThiC_Rad_SAM 结构域。wll1 中突变的Glu355位于该结构域,并且在不同物种中是保守的。
2.3 OsTHIC基因功能验证
为了进一步验证OsTHIC 功能,利用CRISPR/Cas9 基因编辑技术在野生型中敲除该基因。选取的靶序列位于OsTHIC 第二个外显子(图2-A)。转基因植株经基因型鉴定,得到了敲除突变体OsTHICCr。OsTHIC-Cr 发生单碱基的插入,导致蛋白翻译移码(图2-B)。OsTHIC-Cr 幼苗在4 叶期出现心叶白化表型。白化部位逐渐扩大到整个幼苗并最终导致幼苗死亡(图2-C)。OsTHIC-Cr 表型与wll1 一致,表明wll1 的突变表型的确是由OsTHIC 突变所致。
2.4 OsTHIC表达模式及OsTHIC亚细胞定位模式分析
为了分析 OsTHIC 基因的组织表达模式,提取野生型日本晴萌发后7 d 的幼苗和萌发后50 d 的根、茎、叶、穗,以及不同发育时期种子中的 RNA,经反转录得到其cDNA,对其进行RT-qPCR 分析。结果显示,OsTHIC 基因在水稻幼苗、根、茎、叶、穗和种子中都有表达,叶片中的表达量最高。OsTHIC表达量随着种子的发育进程而降低(图3-A)。
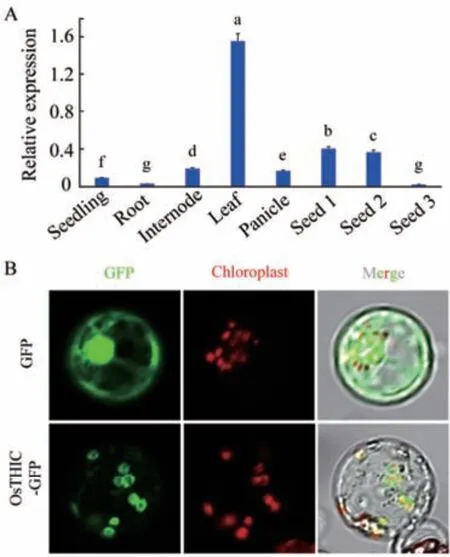
图3 OsTHIC 表达模式及OsTHIC 亚细胞定位模式Fig.3 Expression pattern of OsTHIC and subcellular localization of OsTHIC
为了确定 OsTHIC 的亚细胞定位模式,将OsTHIC 的编码区构建到pJIT163-GFP 载体上,使OsTHIC 的编码区与GFP 报告基因融合表达。以pJIT163-GFP 空载转染原生质体作为阴性对照,将载体转入水稻原生质体进行瞬时表达。激光共聚焦显微镜观察发现,OsTHIC-GFP 与叶绿体自发荧光共定位,说明OsTHIC 蛋白定位于叶绿体中(图3-B)。
2.5 OsTHIC突变导致维生素B1含量降低
OsTHIC 注释为硫胺素生物合成蛋白,在四叶期检测了野生型、wll1 及OsTHIC-Cr 第四片叶的维生素B1含量。结果显示,与野生型相比,wll1 及OsTHIC-Cr 中的维生素B1含量与野生型相比显著降低(图4-A)。从三叶期开始对野生型和wll1 植株进行了外源维生素B1(100 μmol/L)喷施处理。结果显示,wll1 在外源维生素B1喷施处理后不再表现白化致死表型,植株可以正常生长发育(图4-B)。这表明wll1 的突变表型是由维生素B1缺乏导致的。

图4 OsTHIC 突变体维生素B1 含量及外施维生素B1 表型Fig.4 Vitamin B1 content and phenotype after exogenous vitamin B1 treatment of OsTHIC mutant
2.6 OsTHIC突变及外施维生素B1均影响维生素B1合成相关基因表达
为了探究OsTHIC 突变对水稻维生素B1合成途径的影响,利用RT-qPCR 比较野生型与wll1中维生素B1合成相关基因的表达量。结果显示,OsTHIC、OsTHI1、OsTH1、OsPALE1、OsTPK1 及OsTPK3 在wll1 中的表达量与野生型相比存在显著差异。OsTPK2 的表达量在野生型与wll1 中无显著差异(图5-A)。利用RT-qPCR 探究外施维生素B1对维生素B1合成相关基因表达量的影响。结果显示,外施维生素B1显著降低OsTHIC、OsTHI1、OsTH1、OsPALE1、OsTPK1、OsTPK2 及OsTPK3 的表达量(图5-B)。这表明OsTHIC 突变及外施维生素B1均影响维生素B1合成相关基因表达。

图5 OsTHIC 突变及外施维生素B1 对维生素B1 合成相关基因表达量影响Fig.5 Influences on expressions of vitamin B1 biosynthesis genes by mutation of OsTHIC and exogenous vitamin B1 treatment
2.7 OsTHIC突变影响水稻代谢过程
维生素B1以辅酶的形式参与多个重要的细胞代谢过程。为了探究wll1 中维生素B1含量降低对水稻代谢过程的影响,采用LC-MS 对野生型及wll1进行非靶向代谢组检测。主成分分析(principal component analysis,PCA)表明,野生型与wll1 样本显著分离,且生物学重复间相互聚类,表明野生型与wll1 间代谢过程差异较大(图6-A)。比较野生型与wll1 代谢组数据,共筛选出415 种有差异的代谢物,其中上调的代谢物有206 种,下调的代谢物有209 种(图6-B)。

图6 野生型与wll1 非靶向代谢组分析Fig.6 Analysis of untargeted metabolomics of wild type and wll1
将得到的差异代谢物进行 KEGG(Kyoto encyclopedia of genes and genomes)注释,并对差异代谢物进行代谢通路富集分析。结果表明野生型与wll1的差异代谢物主要富集在以下过程:氨基酸的生物合成,氨酰基-tRNA 的生物合成,ABC 转运蛋白,辅因子的生物合成,缬氨酸、亮氨酸和异亮氨酸的生物合成,D-氨基酸代谢等过程(图6-C)。表明维生素B1可能是通过影响这些代谢途径来参与水稻生长发育调控。
3 讨论
与植物和微生物不同,人类和其他动物不能从头合成维生素B1,必须从饮食中获取。水稻是我国最重要的粮食作物之一,而稻米的出精过程(去除种皮和胚)会丢失多至90%的维生素B1[28]。这使得稻米仅能提供人体所需维生素B1的10%[29]。长期以稻米为单一主食,容易导致人体维生素B1缺乏,造成“隐形饥饿”[30-31]。因此,解析水稻维生素B1的生物合成途径,并在此基础上对水稻维生素B1含量进行生物强化具有重要意义。本研究从一个水稻白化致死突变体wll1 克隆到维生素B1合成相关基因OsTHIC,并对基因功能开展研究。
wll1 从四叶期表现心片白化,随后白化部位逐渐扩大并导致幼苗死亡。该表型与拟南芥thic 突变体表型相似类[23-24]。拟南芥thic 突变体表现黄化表型,并在子叶期之前死亡。拟南芥thic 突变体中维生素B1含量仅为野生型的30%。持续外源施加维生素B1可以使拟南芥thic 突变体存活。与拟南芥相类似,wll1 中维生素B1含量与野生型相比显著降低,外源补施维生素B1可挽救wll1 的致死表型,使之进行正常的生长发育。这表明,水稻OsTHIC 与拟南芥THIC 基因均参与维生素B1的代谢过程,具有保守的生物学功能。与拟南芥thic 萌发即白化不同,wll1 与OsTHIC 的敲除突变体(OsTHIC-Cr)均在四叶期出现心叶白化表型。推测wll1 种子中储存的维生素B1可供给幼苗的早期发育。种子储存的维生素B1随幼苗发育逐渐消耗,而又没有新合成的维生素B1,在四叶期表现出了发育缺陷表型。
有研究表明,水稻维生素B1合成途径中OsTH1基因的功能缺失同样导致幼苗在四叶期出现心叶白化表型,与OsTHIC 的突变表型类似[32]。维生素B1多以辅酶的形式参与代谢调控。三羧酸循环中,维生素B1作为丙酮酸脱氢酶和酮戊二酸脱氢酶的辅酶参与能量代谢过程。在磷酸戊糖途径和卡尔文循环中作为转酮酶的辅酶[8]。因此,影响维生素B1代谢的基因发生突变,会对细胞代谢物含量产生影响。非靶向代谢组测序表明,wll1 与野生型相比,差异表达的代谢物主要富集在氨基酸的生物合成、氨酰基-tRNA 的生物合成及ABC 转运蛋白等过程。拟南芥中研究表明,THIC 突变导致部分氨基酸含量升高,包括丙氨酸、天冬酰胺、甲硫氨酸、苯丙氨酸及色氨酸等。此外,三羧酸循环中的苹果酸含量在thic中含量升高,而延胡索酸的含量显著降低[23]。水稻中OsTH1 突变导致氨基酸和核苷酸含量升高,糖类与脂肪酸的含量降低。研究者认为脂肪酸生物合成的缺陷影响了叶绿体膜结构的形成与维持,造成OsTH1 突变后产生叶片褪绿表型[32]。
拟南芥中研究表明,THIC 基因的表达受“核糖开关”(riboswitches)的调控[33]。“核糖开关”是最初在原核生物中发现的一种RNA 元件,其通过与小分子代谢物结合在转录后水平进行基因表达调控[34-35]。基因序列比对发现,拟南芥THIC 基因的3'-UTR 含有“核糖开关”序列,且可与TPP 进行结合[36]。晶体结构分析表明,拟南芥THIC 基因的“核糖开关”通过两个平行螺旋间的保守残基识别TPP[37]。外源施加维生素B1可降低拟南芥THIC基因的表达水平[23]。水稻中OsTHIC 基因的3'-UTR区同样具有“核糖开关”序列,表明OsTHIC 的表达可能同样受到“核糖开关”的调控[36]。外源施加维生素B1可降低OsTHIC 基因的表达量,而wll1中OsTHIC 基因的表达量显著高于野生型,这表明,OsTHIC 的表达受到维生素B1含量的负反馈调节。水稻基因注释信息显示,OsTHIC 基因在3'-UTR 至少含有7 种可变剪接,表明可能存在更为复杂的基因表达调控方式(rice genome annotation project)。对OsTHIC 的“核糖开关”序列进行编辑和修饰,解除维生素B1对OsTHIC 表达量的抑制作用,可作为OsTHIC 表达量及水稻维生素B1含量调控的手段。验证提高OsTHIC 及维生素B1合成通路的其他基因的表达量能否增加稻米中的维生素B1含量是下一步工作的的重点。
4 结论
OsTHIC 通过调控维生素B1含量,参与氨基酸合成等代谢过程,在水稻生长发育过程中发挥重要作用。

