‘红满堂’苹果MbbZIP43 基因的克隆与功能研究
杨艳 胡洋 刘霓如 殷璐 杨锐 王鹏飞 穆霄鹏 张帅 程春振 张建成
(山西农业大学园艺学院,太谷 030801)
碱性亮氨酸拉链(basic leucine zipper,bZIP)家族是植物最大的转录因子家族之一[1]。其典型特征是包含高度保守且富含碱性氨基酸残基的DNA 结合域和亮氨酸拉链结构域[2]。bZIP 转录因子通常以同源或异源二聚体形式结合到下游基因启动子的G-box、C-box 和ABRE 等元件上[3],广泛参与植物器官和组织的分化[4]、种子成熟[5]、光反应[6]以及光信号调节[7]、抗逆防御[8]、ABA 信号传导[9]和生物胁迫[10]等多种生物学过程。
花青素属于类黄酮类化合物,通过苯丙烷代谢途径合成。参与该途径中的关键酶由早期生物合成基因(CHS、CHI、F3H 和F3'H)和晚期生物合成基因(F3',5'H、DFR、ANS 和UFGT 等)编码[11-12]。研究表明,bZIP 在植物花青素等类黄酮类物质的生物合成过程中也发挥着重要调控作用。其中,与植物光形态建成密切相关的bZIP 基因HY5(Elongated hypocotyl 5),在植物花青素合成中的调控作用在多种植物中被证实。例如拟南芥HY5 可通过结合PAP1 启动子区的G-box 和ACE 元件调节PAP1 基因的表达,进而影响花青素生物合成[13]。桃PpHY5通过激活花青素生物合成相关基因的表达,来调节花青素积累[14]。梨PyHY5 通过与PyMYB10 和PyWD40 启动子的G-box 基序结合,增强它们的表达进而促进红‘云红梨1 号’果皮花青素的积累[15]。草莓FaHY5 与FaBBX22 相互作用促进草莓果实花青素的积累[16]。过表达FaHY5-VP16 和FaBBX22 可以促进转基因草莓和拟南芥植株花青素的积累[17]。除HY5 外,其他bZIP 转录因子也被证实参与植物花青素合成调控。光照条件下,梨PybZIPa 通过与花青素合成相关的转录因子(PyMYB114、PyMYB10和PyBBX22)和结构基因(PyUFGT)启动子上的G-box 元件结合调控它们的表达,从而促进花青素的生物合成[18]。番茄SlAREB1 通过影响SlDFR 和SlF3'5'H 的表达调节幼苗花青素积累[19]。
苹果(Malus spp.)属蔷薇科(Rosaceae)苹果属(Malus)落叶乔木。根据叶片与果实形态结构,苹果属植物可被分为真苹果组、花楸苹果组和移海棠组3 组。其中,由山荆子系(M.baccata(L.)Borkh.)和苹果系(M.domesica Borkh.)组成的真苹果组被研究最多。bZIP 在调控苹果属植物花青素合成中的作用已有报道,但多集中于真苹果组苹果系的栽培苹果。如ABA 处理后,苹果MdbZIP44可与花青素合成调控关键MYB 转录因子MdMYB1互作,并增强其与下游靶基因启动子MdDFR 和MdUF3GT 的结合能力,进而正调控花青素积累[20]。MdABI5 通过增强MdbHLH3 与MdMYB1 之间的相互作用,参与ABA 诱导的花青素生物合成调控[21]。MdbZIP23 可通过与编码基因受ABA 强烈诱导的MdNAC1 互作,进而促进MdMYB10 和MdUFGT 的表达和花青素的积累[22]。目前尚无关于真苹果组山荆子系bZIP 调控花青素相关的报道。
‘红满堂’苹果系从‘舞美’苹果(Malus×domestica Borkh.‘Maypole’)和‘山定子’(Malus baccata(L.)Borkh.)杂交F1代群体中选育的果肉全红株系,其果实幼果期果皮和果肉均为红色(俗称“胎里红”),至成熟期果皮和果肉转为深红色[23]。‘红满堂’果实富含花青素、类黄酮等物质[24],是研究苹果花青素等黄酮类物质代谢的理想材料。前期研究发现一个‘红满堂’bZIP 基因(C1H46-028789),在果实成熟过程中差异表达显著,且与花青素含量显著相关[25]。本研究对该基因进行克隆和序列分析,利用洋葱表皮细胞瞬时转化研究其编码蛋白亚细胞定位情况,利用实时荧光定量PCR 研究其在不同成熟时期‘红满堂’果实中的表达情况,并对其表达水平与果实总黄酮、总酚、黄酮醇和花青素含量进行相关性分析。此外,为验证该基因在花青素合成调控中的作用,构建该基因的过表达载体,并基于烟草叶片、苹果叶片和果实瞬时转化体系,研究其对花青素合成的影响。本研究可为揭示bZIP 转录因子调控‘红满堂’苹果花青素生物合成中的作用奠定基础。
1 材料与方法
1.1 材料
‘红满堂’苹果果实采自山西农业大学果树研究所苹果资源圃。于花后7 周(PS1)、11 周(PS2)、15 周(PS3)、19 周(PS4)、23 周(PS5)选取大小均匀一致、无病虫害和机械伤的果实,液氮速冻后迅速转移至-80℃超低温冰箱保存备用。本氏烟草和‘八棱海棠’苹果植株培养于人工培养室中,培养室温度为(25±2)℃,湿度为80%-85%、光周期为光照16 h/黑暗8 h,光强为1 500 lx。
1.2 方法
1.2.1 核酸提取及反转录 使用多糖多酚植物基因组DNA 提取试剂盒(天根)提取‘红满堂’果实gDNA。使用多糖多酚植物总RNA 提取试剂盒(离心柱型)(天根)提取5 个时期的‘红满堂’果实RNA,采用PrimeScriptTMII 1ststrand cDNA Synthesis(TaKaRa,大连)试剂盒反转录获得cDNA。
1.2.2 基因全长克隆与载体构建 使用NCBI 设计基因全长扩增引物(表1)用于基因克隆。PCR 反应体系:Dream TaqTMGreen PCR Master(2X)12.5 μL,ddH2O 9.5 μL,gDNA/cDNA 模板及上下游引物各1 μL。反应条件:95℃预变性5 min;95℃变性30 s,53℃退火30 s,72℃延伸1 min,34 个循环;72℃终延伸10 min。胶回收PCR 产物后进行TA 克隆并转化大肠杆菌DH5α 感受态细胞。将菌液PCR 检测为阳性的克隆送至生工生物工程(上海)股份有限公司进行测序验证。根据测序结果进一步设计基因载体构建的引物(表1)用于扩增带有同源臂序列基因,使用生工生物工程(上海)股份有限公司生产的即用无缝克隆试剂盒连接到BamH I 和Spe I双酶切的pBI123 载体,获得35S∷MbbZIP43-GFP重组质粒并转化农杆菌GV3101。

表1 本研究所用引物信息Table 1 Information for the primers used in this study
1.2.3 生物信息学分析 从蔷薇科基因组官网(https://www.rosaceae.org/)下载‘山荆子’苹果基因组CDS、cDNA 和蛋白序列文件,利用TBtools[26]预测MbbZIP43 基因结构及其编码蛋白理化性质;利用CDD 在线网站进行MbbZIP43 保守结构域验证。参考刘嘉鹏等[27]的方法对MbbZIP43 进行亚细胞定位、跨膜结构、信号肽、蛋白磷酸化位点、蛋白二级结构、蛋白三级结构等进行预测。从基因组提取MbbZIP43 起始密码子上游2 000 bp 的序列的片段作为启动子,利用PlantCARE 预测其启动子顺式作用元件分布情况。利用NCBI BLASTP 搜索并下载MbbZIP43 同源蛋白,同时从NCBI 下载已报道花青素相关bZIP 蛋白序列,利用Jalview 绘制多序列比对图;利用MEGA X 软件进行系统发育树构建(neighbor-joining tree,bootstrap 设定初始值为1 000次);采用在线软件MEME 分析MbbZIP43 保守基序(基序数目阈值设为15,其余为默认值);采用在线软件TFBS 预测花青素合成结构基因启动子区转录因子结合位点进行预测。所用生物信息学网址信息如表2 所示。
表2 本研究所用生物信息学分析网站信息Table 2 Information for the software used for the bioinformatic analysis in this study
1.2.4 亚细胞定位 分别将携带35S∷MbbZIP43-GFP 重组质粒的农杆菌培养至OD600=0.8,6 000 r/min离心5 min 后弃上清液。随后采用农杆菌介导法侵染预培养24 h 的洋葱表皮细胞,吸干菌液后培养于MS 培养基上,23℃下暗培养24-36 h 后,在正置荧光显微镜(Leica DM6B)下观察GFP 荧光信号并拍照[28]。
1.2.5 实时荧光定量PCR(RT-qPCR)基于测序结果,使用Primer3(https://bioinfo.ut.ee/primer3-0.4.0/)设计MbbZIP43 基因定量引物(表1)。RT-qPCR 反应体 系:TB Green®Premix Ex TaqTMII(Tli RNaseH Plus)荧光染料(TaKaRa)10 μL,ddH2O 7 μL,上下游引物各0.8 μL,cDNA 模板1 μL,ROX Reference Dye 0.4 μL。反应程序为95℃预变性30 s;95℃变性15 s,60℃退火30 s,72℃延伸30 s,共45 个循环。使用QuantStudio 3 实时荧光定量PCR 仪(Ap-plied Biosystems)进行RT-qPCR。以Actin 作为内参基因,使用2-ΔΔCt法计算基因在不同时期果实中的相对表达量[29]。使用SPSS 分析各样品中MbbZIP43表达差异显著性并使用Graphpad Prism 作图。
1.2.6 总酚和黄酮类物质含量测定 将‘红满堂’果实样品液氮速冻后研磨成粉末,取2.5 g 溶于10 mL 80%乙醇中,超声提取15 min 后4℃条件下5 000 r/min 离心10 min 后收集上清液至25 mL 棕色容量瓶中,重复提取一次后定容至20 mL,即获得提取液,用于总酚和总黄酮含量测定。总酚含量测定采用福林酚法,具体步骤参照Slinkard 和Singleton方法[30]。总黄酮含量测定参照Zheng 等[31]的方法。使用苏州科铭生物技术有限公司生产的黄酮醇含量测定试剂盒(分光光度计法)测定‘红满堂’果实总黄酮醇含量。花青素提取与测定参考仝月澳等[32]的方法。
1.2.7 MbbZIP43 基因瞬时转化 分别将携带35S∷MbbZIP43-GFP 重组质粒和pBI123 空载体(EV)的农杆菌培养至OD600=0.6-0.8,6 000 r/min 离心5 min后弃上清液。使用MES 缓冲液(含10 mmol/L MES、10 mmol/L MgCl2和200 μmol/L 乙酰丁香酮(AS),pH 为5.8 左右)重新悬浮,调节至OD600=0.8,然后于28℃下200 r/min 振荡培养30 min 后用于瞬时转化。
烟草叶片瞬时转化参照Wang 等[33]的方法。用针头轻轻刺破本氏烟草的叶片,并用1 mL 注射器从背面注射40 μL 的农杆菌菌液。随后,将烟草移至培养室[(25±2)℃,相对湿度约80%]中暗培养2 d 后恢复正常光照,5 d 后测定叶片花青素含量。
采用真空渗透法进行苹果叶片瞬时转化[34]。将‘八棱海棠’叶片分别浸入携带35S∷MbbZIP43-GFP重组质粒和pBI123 空质粒的农杆菌侵染液中,真空渗透40 min 后使用滤纸吸干叶片表面菌液,平铺于铺有无菌水湿润的滤纸的培养皿上。暗培养1 d后恢复正常光照,9 d 后收集叶片用于RNA 提取和花青素含量测定。苹果果实瞬时转化参照An 等[35]的方法。使用1 mL 注射器注射50 μL 农杆菌菌液至套袋未转色的成熟‘嘎啦’苹果,随后将果实置于培养室[(25±2)℃,相对湿度约80%]暗培养2 d后恢复正常光照,5 d 后收集苹果果皮用于RNA 提取和花青素含量测定。此外,为研究MbbZIP43 瞬时过表达影响苹果花青素积累的机制,参照Yu 等[36]的方法利用RT-qPCR 分析苹果叶片和果实中花青素合成结构基因的相对表达情况。
1.2.8 数据统计分析 运用IBM SPSS Statistics 25 对实验数据差异显著性进行单因素方差(ANOVA)分析,使用GraphPad Prism8 和Origin 软件进行数据统计分析及图形绘制。
2 结果
2.1 基因克隆和序列分析结果
以gDNA 和cDNA 为模板均克隆获得长度为522 bp 的目的片段(图1-A),说明该基因不含内含子。该基因与基因组参考序列(C1H46-028789)存在4 个碱基差异,相似度达99.23%(图1-B)。NCBI BLAST 比对结果显示,该基因与MdbZIP43(XP_008393381.1)的相似度最高(98.27%),故命名为MbbZIP43。

图1 MbbZIP43 基因PCR 产物电泳检测(A)及序列比对(B)结果Fig.1 Electrophoresis detection(A)and sequence alignment(B)results of PCR products for the MbbZIP43
MbbZIP43 预测可编码包含173 个氨基酸的蛋白质。蛋白理化性质分析结果显示,MbbZIP43 分子量为19.8 kD,等电点为7.93,脂肪系数为73.87,不稳定系数为56.37,总平均亲水性为-0.887,属于不稳定亲水蛋白。MbbZIP43 不含信号肽和跨膜结构,说明其属于非分泌和非跨膜蛋白。CDD 预测结果显示,MbbZIP43 含有bZIP_plant_GBF1 结构域。蛋白磷酸化位点预测结果显示,MbbZIP43 含有12 个丝氨酸、3 个苏氨酸和1 个酪氨酸磷酸化位点。蛋白二级结构预测结果显示,MbbZIP43 二级结构主要由α-螺旋(52.60%)、无规则卷曲(46.24%)、β-折叠和延伸链(各占0.58%)组成。三级结构预测结果显示,MbbZIP43 蛋白与桃环形结构域蛋白(A0A2N517U0.1.A)的三维结构最为接近,相似度为72.73%。
启动子顺式作用元件预测结果显示,MbbZIP43启动子区含有8 种14 个光响应相关元件(其中GT1-motif 元件有6 个,Box 4 元件有2 个,其余6种光响应相关元件各1 个)、2 种生长发育相关元件(分生组织表达和胚乳表达元件各1 个)、4 种激素相关元件(茉莉酸甲酯响应元件最多有4 个,其次是赤霉素响应元件3 个,脱落酸和水杨酸响应元件各1 个)和8 种20 个逆境响应相关元件(包括防御胁迫元件8 个,其中包含4 个MYB 元件、2 个W box 元件、各1 个DRE core 元件和TC-rich repeat元件,干旱和高温胁迫元件各4 个,伤害响应元件2 个以及低温和厌氧诱导元件各1 个)(表3)。

表3 MbbZIP43 启动子区顺式作用元件预测结果Table 3 Predicted cis-regulatory elements in the promoter region of MbbZIP43
利 用NCBI-blastp 对‘红满堂’MbbZIP43 同源蛋白进行了搜索发现,MbbZIP43 蛋白与苹果MdbZIP43、白梨PbbZIP43、沙梨PybZIP43、甜樱桃PabZIP43、扁桃PdbZIP43 和桃PpbZIP43 相似度较高,分别为98.27%、94.80%、93.06%、81.50%、80.92%和80.92%。将MbbZIP43 同源蛋白及已报道的花青素合成相关bZIP 蛋白进行多序列比对发现,这些bZIP 均具有典型的bZIP 保守结构(图2)。系统进化分析结果显示(图3),MbbZIP43 与MdbZIP43 亲缘关系最近,与其他物种bZIP43 蛋白聚为一支;MdbZIP44 单独一支,而已报道的花青素相关HY5蛋白聚为一支。

图2 不同植物bZIP43 以及已知花青素调控相关bZIP 蛋白多序列比对结果Fig.2 Multiple sequence alignment results for bZIP43 proteins and bZIP proteins related to known anthocyanin biosynthesis from different plant species

图3 不同植物bZIP 蛋白保守基序(A)及motif1 序列Logo 图(B)Fig.3 Conserved motifs in bZIP proteins from different plant species(A)and sequence Logo for the motif1(B)
保守基序分析结果显示(图3),所有成员均含有motif1。PFAM 预测结果显示,motif1 具有碱性区域和亮氨酸拉链区域,说明motif1 对应典型的bZIP保守结构域。除RcbZIP43、MdbZIP44 和GbHY5 外,所有蛋白均含有motif6。进化关系近的成员具有相似的保守基序,如所有bZIP43 蛋白均有motif1、motif2、motif3、motif4 和motif8,而所有的HY5 均含有motif1 和motif7,说明这些bZIP43 蛋白与HY5蛋白序列和保守基序存在较大差异。
2.2 MbbZIP43亚细胞定位分析
亚细胞定位预测结果(图4)显示,MbbZIP43定位于细胞核。进一步利用洋葱表皮细胞瞬时转化验证该蛋白亚细胞定位情况。结果显示,在瞬时表达35S∷MbbZIP43-GFP 融合蛋白的洋葱表皮细胞中,仅在细胞核检测到荧光信号;而瞬时表达35S∷GFP的洋葱表皮细胞各部位均有荧光信号分布。

图4 MbbZIP43 蛋白亚细胞定位分析结果Fig.4 Subcellular localization analysis results of Mbb-ZIP43 protein
2.3 MbbZIP43基因表达和相关性分析
利用RT-qPCR 研究MbbZIP43 在5 个发育时期‘红满堂’果实中的表达情况发现,随着果实的生长发育,该基因的相对表达量呈先升后降的趋势。在PS1 阶段表达量最低,在PS2 阶段表达量最高,其次为PS3 阶段,分别是PS1 阶段的7.11 和1.83 倍(图5-A)。
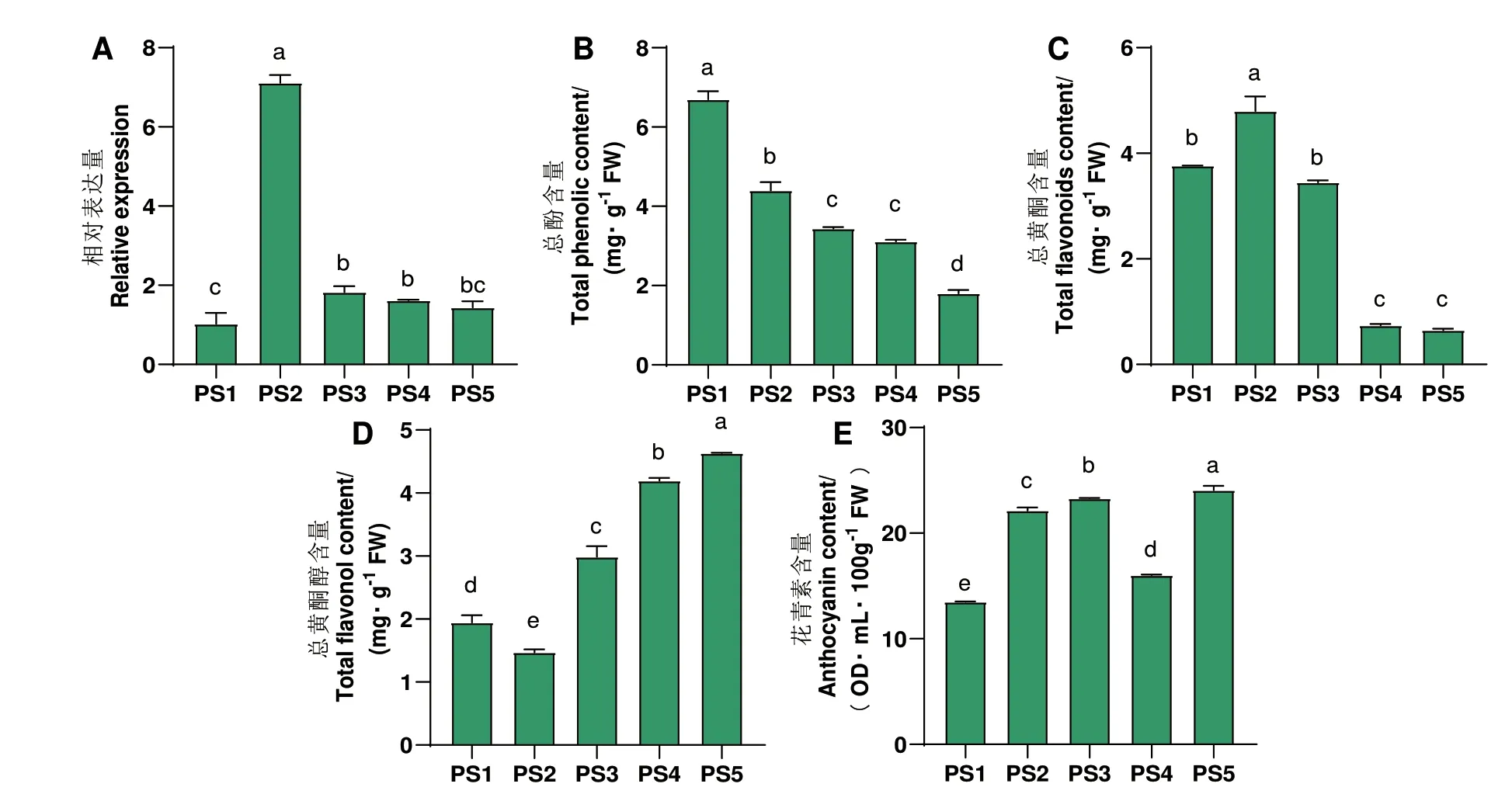
图5 不同发育时期‘红满堂’苹果MbbZIP43 相对表达量、总酚含量、总黄酮含量、总黄酮醇含量和花青素含量Fig.5 Relative expressions of MbbZIP43,total phenol content,total flavonoid content,total flavonol content and anthocyanin content in ‘Hongmantang’ apple fruits at different ripening stages
随着果实发育,‘红满堂’果实总酚含量呈下降趋势,在PS1 阶段含量最高(6.695 mg/g FW),PS5 含量最低(1.804 mg/g FW)(图5-B)。总黄酮含量先上升后下降,在PS2 阶段含量最高(4.800 mg/g FW),PS5 含量最低(0.644 mg/g FW)(图5-C)。总黄酮醇含量先下降后上升,在PS5 阶段含量最高(4.629 mg/g FW),PS2 最低(1.450 mg/g FW)(图5-D)。花青素含量呈“升-降-升”的趋势,在PS5 阶段含量最高(24.065 OD·mL/100 g FW),在PS1 含量最低(13.478 OD·mL/100 g FW)(图5-E)。
相关性分析结果(表4)显示,‘红满堂’果实总黄酮含量与总黄酮醇含量显著负相关(相关性系数为-0.97),与总酚含量正相关(0.69)。MbbZIP43表达量与总黄酮含量、花青素含量和总酚含量正相关,与总黄酮醇含量负相关,相关性均不显著。
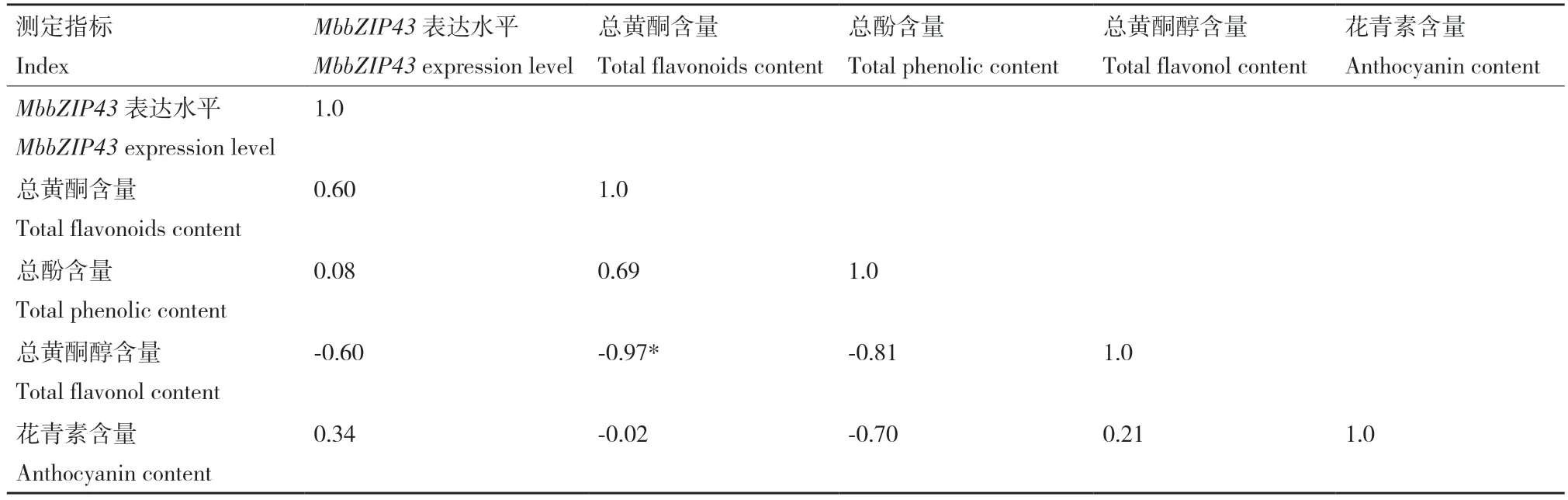
表4 MbbZIP43 基因表达水平与总黄酮、总酚、总黄酮醇和花青素含量相关性分析结果Table 4 Correlation analysis results among the MbbZIP43 expressions,total flavonoids content,total phenolic content,total flavonol content and anthocyanin content
2.4 MbbZIP43基因瞬时转化
为验证MbbZIP43 对花青素合成的调控作用,利用烟草叶片瞬时转化研究其过表达对花青素积累的影响,结果(图6-A)显示,瞬时过表达MbbZIP43基因的烟草叶片中花青素含量显著高于空载对照(EV),较EV 提高了17.42%。进一步利用‘八棱海棠’叶片瞬时转化研究其过表达对花青素积累的影响(图6-B)发现,瞬时过表达MbbZIP43 基因的苹果叶片中花青素含量显著高于空载对照(EV)(图6-D),较EV 提高了25.66%。利用‘嘎啦’苹果果实进行瞬时转化研究其过表达对花青素的积累(图6-C),结果(图6-F)显示,瞬时过表达MbbZIP43 基因的苹果果实花青素含量显著高于空载对照(EV),较EV 提高了48.99%。
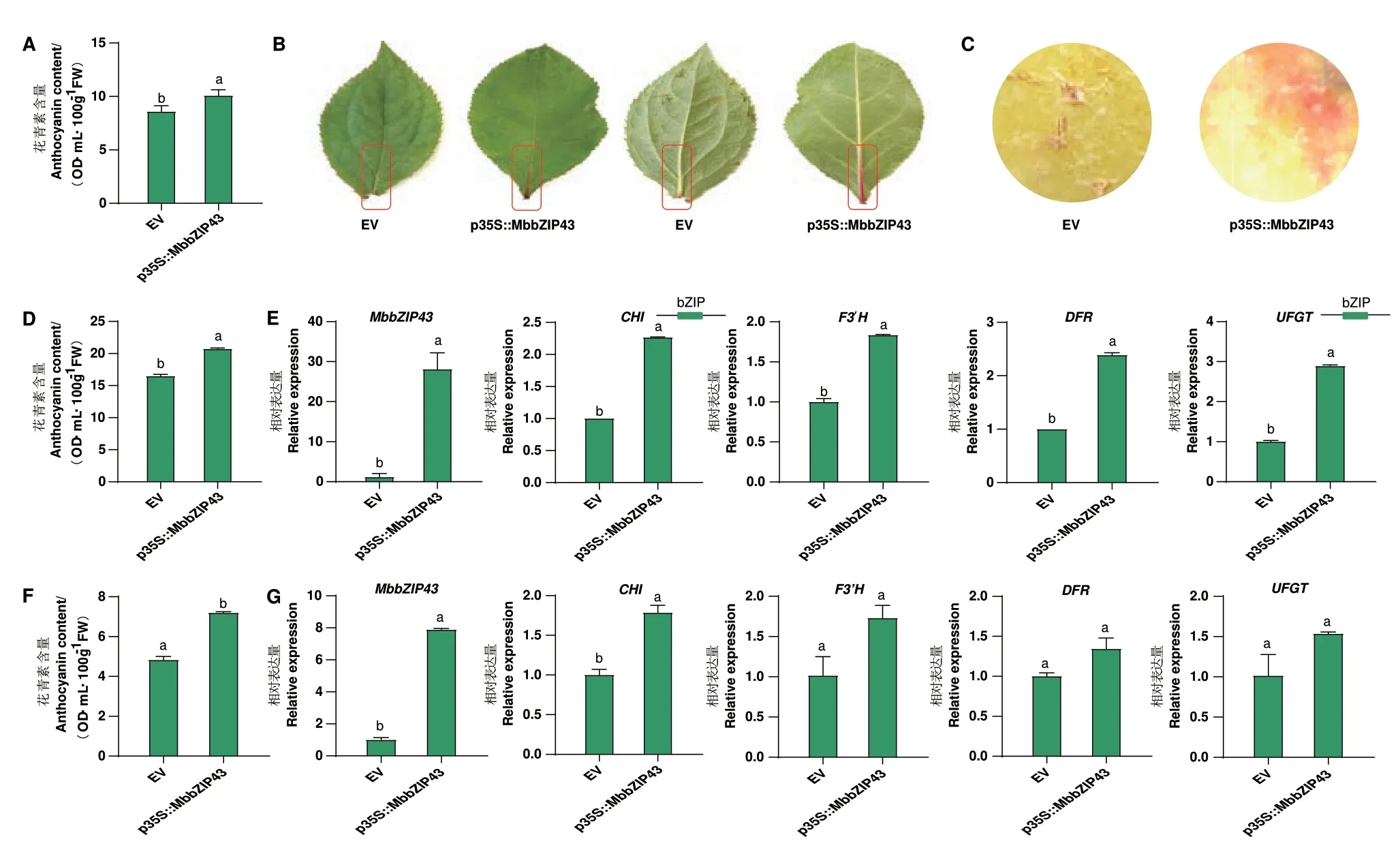
图6 MbbZIP43 瞬时过表达对花青素积累的影响Fig.6 Influences of transient overexpression of MbbZIP43 gene on anthocyanin accumulations
瞬时过表达MbbZIP43 的苹果叶脉及苹果果皮有较为明显的颜色变化(图6-B,C)。RT-qPCR 结果显示,瞬时过表达MbbZIP43 的‘八棱海棠’叶片和‘嘎啦’苹果果皮中MbbZIP43 基因的表达水平约为EV的28.12 倍和7.85 倍。利用RT-qPCR 进一步研究了瞬时过表达MbbZIP43 的‘八棱海棠’叶片和‘嘎啦’果皮中花青素合成相关结构基因(CHI、F3'H、DFR和UFGT)的表达情况发现,瞬时过表达MbbZIP43的‘八棱海棠’叶片和‘嘎啦’果皮中这些基因的表达量显著提高。其中,‘八棱海棠’叶片中CHI、F3'H、DFR 和UFGT 分别提高了2.27 倍、1.84 倍、2.39倍和2.89 倍;‘嘎啦’果皮中CHI、F3'H、DFR 和UFGT 分别提高了1.79 倍、1.70 倍、1.35 倍和1.51 倍。说明瞬时过表达MbbZIP43 对花青素积累的促进作用是通过诱导这些基因的表达实现的。通过预测这4 个花青素合成相关结构基因启动子上TFBS 分布情况发现,CHI 和UFGT 启动子区均含有bZIP 转录因子结合位点。过表达MbbZIP43 的‘八棱海棠’叶片和‘嘎啦’果皮中这两个基因的上调倍数均较高,推测MbbZIP43 主要通过诱导它们的表达促进花青素积累。
3 讨论
转录因子在花青素生物合成过程中扮演着重要调控作用[37]。其中,被研究最多的当属MYB、bHLH 和WD40 三类转录因子。这三类转录因子通过蛋白互作形成的MYB-bHLH-WD40(MBW)复合体被认为在调控植物花青素合成过程中发挥着关键作用[38]。栽培苹果MdMYB1[39]、MdMYB10[40]和MdMYBA[41]被证实可以通过上调花青素结构基因的表达促进果皮花青素的积累。An 等[42]发现过表达MdMYC2 的‘Orin’愈伤组织中花青素生物合成基因MdDFR、MdUF3GT、MdF3H 和MdCHS 的转录水平显著上调。WD40 蛋白对花青素的调控多需要同MYB 或bHLH 蛋白互作实现。如苹果WD40 蛋白MdTTG1 与bHLH 互作进而在调节花青素积累中发挥作用[43]。此外,MdHY5[44]和MdbZIP44[20]等bZIP 转录因子也被证实参与苹果花青素合成调控。
3.1 MbbZIP43与花青素合成调控相关HY5蛋白序列存在较大差异
Li 等[45]研究表明PsbZIP43 可能通过调节花青素生物合成结构基因的表达,参与‘黑宝石’李子果肉花青素的积累调控。本研究从‘红满堂’苹果中克隆获得一个CDS 长为522 bp 的MbbZIP43 基因。序列比对结果显示,该基因编码的蛋白与PsbZIP43和苹果、白梨、沙梨、甜樱桃和桃的bZIP43 序列相似度均高于80%,且这些蛋白含有相同的保守基序。系统进化分析结果显示,MbbZIP43 与苹果和梨等蔷薇科植物的bZIP43 聚为一类,说明它们在进化过程中高度保守且可能具有相似的功能。MbbZIP43 与已报道的调控花青素合成的bZIP 蛋白MdbZIP44 及HY5 均不聚在一支说明它们的功能和作用机制可能不同。
3.2 MbbZIP43的表达可能受光、逆境等多种因素影响
花青素的合成和积累受光照条件影响显著。光照条件下,MdHY5 可直接与MdMYB1 启动子结合促进花青素的积累[44]。UV-B 处理被证实可以显著促进苹果花青素积累。UV-B 处理后,受UV-B 诱导的MdWRKY72 基因的编码蛋白可以通过调节MdHY5和MdMYB1 的表达来促进花青素的积累[46];An等[47]发现UV-B 处理诱导MdBBX22 的表达,该基因编码的蛋白通过与MdHY5 互作增强MdHY5 与MdMYB10 和MdCHS 启动子的结合能力,从而导致花青素积累。本研究发现,MbbZIP43 启动子上存在大量光响应相关元件,暗示其可能参与光调控的苹果花青素积累。
MeJA 和ABA 处理都可以促进苹果花青素的积累[48-49]。MbbZIP43 启动子上存在4 个MeJA 响应相关元件和1 个ABA 响应元件,说明其可能参与这两种激素调节的花青素合成反应。
大量研究表明花青素的生物合成受环境因素影响显著[50]。Ubi 等[51]发现低温可以显著提高花青素生物合成结构基因CHS、ANS 和UFGT 的表达,进而促进苹果皮中花青素的积累;高温抑制MdMYB10 的表达,导致花青素在苹果皮中的生物合成和积累减少[52];在干旱条件下,MdERF38 的过表达可通过提高花青素合成结构基因(MdCHS、MdCHI、MdDFR 和MdUF3GT)的表达,促进了花青素生物合成[53]。An 等[54]的研究指出机械伤诱导的花青素积累与MdWRKY40-MdMYB1 相互作用有关。本研究发现,MbbZIP43 启动子上存在20 个逆境响应相关元件,其中包括干旱和高温胁迫元件各4 个,伤害响应元件2 个以及低温响应元件1 个,说明该基因的表达可能受温度、水分、机械伤等逆境环境影响。
3.3 MbbZIP43的表达水平与花青素含量正相关,瞬时过表达该基因可以促进烟草叶片、苹果叶片和苹果果实花青素积累
通过分析MbbZIP43 基因在不同发育时期‘红满堂’果实中的表达情况发现,该基因随着果实成熟呈先升后降的表达趋势,表达水平与花青素含量呈正相关。瞬时表达结果显示,瞬时过表达该基因的烟草、苹果叶片和果皮中花青素含量分别提高了17.42%、25.66% 和48.99%。CHS、CHI、F3'H、DFR、ANS 和UFGT 是花青素合成的关键结构基因[55-56]。An 等[20]发现MdbZIP44 通过上调花青素生物合成相关基因(MdDFR、MdUF3GT、MdF3H、MdCHI 和MdCHS)的表达来促进苹果果皮花青素积累。本研究通过利用RT-qPCR 研究瞬时过表达MbbZIP43 的苹果叶片和苹果果皮中花青素合成结构基因的表达情况发现,其过表达激活了CHI、F3'H、DFR 和UFGT 基因的表达,且对启动子区含有bZIP结合位点的CHI 和UFGT 基因的诱导效果显著,说明MbbZIP43 可能通过上调它们的表达促进苹果花青素积累。
4 结论
从‘红满堂’苹果中克隆获得一个CDS 长为522 bp 的bZIP 基因MbbZIP43。该基因的编码蛋白定位于细胞核,与多个植物bZIP43 蛋白高度同源但与已报道的花青素合成调控相关HY5 蛋白序列差异较大。MbbZIP43 瞬时过表达可以显著提高烟草叶片、苹果叶片和苹果果实花青素的积累,MbbZIP43瞬时过表达激活了花青素合成相关结构基因CHI 和UFGT 等的表达,进而促进花青素的积累。

