猕猴桃AcMYB88 的鉴定及功能研究
苑馨予 钟彩虹 张龙 郑浩 李吉涛 张琼
(1.生物资源保护与利用湖北省重点实验室(湖北民族大学),恩施 445000;2.中国科学院武汉植物园 中国科学院植物种质创新与特色农业重点实验室 中国科学院猕猴桃产业技术工程实验室,武汉 430074)
果肉色泽是影响果实品质的重要因素之一[1-3],多年来一直是果实品质研究的热门领域。其中,猕猴桃(Actinidia chinensis)因其果肉色泽不同,价格差异较大。优质红肉猕猴桃的零售价是传统绿肉猕猴桃的2-5 倍[4-5]。在过去几十年中,绿肉品种猕猴桃主导了全球商业市场。但近年来,消费者对富含花青苷的红心猕猴桃表现出较大兴趣[6]。在日常生活中,大多数消费者会根据猕猴桃的果肉颜色来选择购买[7-8]。红心猕猴桃因其果心横截面呈放射状红色条纹,形似太阳,日渐受到消费者的喜爱,其中‘东红’已成为中国红心猕猴桃的主栽品种[9]。
猕猴桃果肉颜色差异是由次生代谢物含量变化造成的,红肉猕猴桃是由花青苷积累导致的,如矢车菊素等[10]。研究表明,花青苷代谢由结构基因和转录因子共同调控[11]。转录因子在植物的各种生命活动中均发挥重要作用[12]。拟南芥中至少发现有1 533 个转录因子,约占整个基因组序列的5%,虽比重不高,但却能影响其整个生命进程[13]。猕猴桃中共发现58 类转录因子,其中,与红肉猕猴桃果肉色泽相关的转录因子有MYB、bHLH 等[14]。在猕猴桃中,Acc10232(AcMYB110)可以促进花青苷的积累,并且在猕猴桃各组织中组成性表达[15]。而Acc00493(AcMYB10)既可单独调控花青苷生物合成,也可与Acc19563(AcbHLH42)相互作用共同调控花青苷积累[16-17]。随着分子生物学的发展,越来越多的MYB 家族成员被挖掘鉴定,其生物学功能的研究也不断丰富。
花青素在着色过程中起着重要的作用,如植物的果实、叶子和花器等。已有研究人员注意到MYB转录因子家族参与调节植物花青素生物合成的作用,并确定MYB 的部分成员为主要调控因子,进行花青素生物合成。但是,调节花青素生物合成的因素很多,机理也比较复杂。在目前的研究中,关于猕猴桃花青素合成中MYB 转录因子的研究还相对较少。因此,对于这些猕猴桃MYB 转录因子成员在花青素生物合成中的确切功能和作用机制还存在着许多未知。
为了更好地理解猕猴桃花青素的合成过程,并挖掘出其他与猕猴桃果肉花青苷代谢调控相关的MYB 转录因子,研究果实不同发育时期的MYB 基因表达对果肉颜色的影响。本研究从plantTFDB 网站(https://planttfdb.gao-lab.org/index.php)下载97 个猕猴桃MYB 转录因子,选取12 个与AcMYB110 高度同源的MYB 转录因子,进行生物信息学分析,并研究它们在不同发育时期‘东红’猕猴桃果实中的表达情况。挖掘到一个花青苷代谢相关基因Ac-MYB88,并对其功能进行初步验证。为进一步解析MYB 转录因子参与猕猴桃果肉花青苷代谢的调控机制提供理论依据和参考。
1 材料与方法
1.1 材料
以国家猕猴桃资源圃内种植的‘东红’为材料,分别对花后20 d(20DAF)、50 d(50DAF)、80 d(80DAF)、110 d(110DAF)、140 d(140DAF)的‘东红’果实进行取样,液氮速冻后,置于-80℃超低温冰箱保存备用。每个样品选取3 个生物学重复。
1.2 方法
1.2.1 MYB 基因家族生物信息学分析 通过Plant-TFDB 在线网 站(https://planttfdb.gao-lab.org/index.php)下载猕猴桃MYB 蛋白序列[18];利用EXpasy在线工 具(https://web.expasy.org/protparam)分 析MYB 蛋白的分子量、氨基酸残基数、带负电荷残基数、带正电荷残基数、不稳定指数、脂肪指数、亲疏水性、等电点(pI)等基本属性[19];利用Protscale 在线工 具(https://web.expasy.org/protscale/)对猕猴桃MYB 转录因子进行氨基酸亲疏水性预测分析;通过CELLO 在线网站(https://cello.life.nctu.edu.tw)分析亚细胞定位情况[20]。采用SignalP4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)分 析MYB蛋白的信号肽。利用SOMPA 在线网站进行蛋白质二级结果预测。使用软件MEGA11.0,采用邻接法(neighbor-joining)构建猕猴桃MYB 蛋白进化树,并使用ITOL 在线网站(https://itol.embi.de)进行进化树修饰[21]。采用NetPhos3.1 在线软件(http://www.cbs.dtu.dk/services/NetPhos/)分析蛋白质磷酸化位点。利用MEME 在线网站(http://meme-suit.org/tools/meme)对猕猴桃MYB 蛋白家族进行motif 分析,将参数中的模体值设置成为10,其他均为默认值[22]。通过Plant CARE 在线网站对猕猴桃12 个MYB 转录因子进行启动子顺式元件预测[23]。
1.2.2 猕猴桃果实RNA 提取及cDNA 合成 用植物总RNA 小提试剂盒(Magen)提取猕猴桃果肉RNA,-80℃保存备用。用SYBR®Premix Ex TaqTMII(Tli RNaseH Plus)(TaKaRa)试剂盒将其反转录为cDNA,具体步骤参考说明书。
1.2.3 引物合成及RT-qPCR 分析 利用SnapGene软件设计RT-qPCR 引物,以猕猴桃Actin 为内参,进行RT-qPCR 分析,所用引物见表1。反应体系为TB Green Premix II 5 μL、cDNA 模板1 μL、正反向引物 各0.5 μL、ROX Reference Dye II 1 μL 和ddH2O 2 μL;PCR 程序为95℃ 30 s;95℃ 3 s,60℃ 30 s,共40 个循环;72℃ 20 s。每个基因设3 个技术重复,基因相对表达量计算采用2-△△Ct方法。

表1 试验用到的引物序列Table 1 Primer sequences used in the experiment
1.2.4 过表达载体构建 通过SnapGene 软件设计引物,使用高保真酶扩增Achn365361,将产物纯化,从而得到产物1。双酶切过表达载体pSAK277,同样将产物进行纯化,得到产物2。用pEASY-Uni Seamless Cloning and Assembly Kit 将产物1 与产物2进行同源重组,转化,进行菌液PCR 检测阳性克隆,并测序。将测序正确的质粒转化到农杆菌EHA105中,筛选阳性克隆,加入甘油-80℃保存备用。50 mL 离心管中加入20 mL LB+Kan+Rif 液体培养基,取上述菌液接种于50 mL 离心管,28℃、200 r/m 振荡培养1 d,用于后续农杆菌侵染烟草实验[17]。
1.2.5 农杆菌侵染烟草 选择长势良好的大叶烟草,将过表达载体pSAK-Achn365361(OE88)、pSAKAcMYB10(OE10)、pSAK-AcbHLH42(OE42)和空载(EV)分别转入EHA105,均匀涂布于LB+Kan +Rif 的固体平板上,28℃倒置培养2-3 d。用50 mL离心管进行扩大培养,离心收集菌体后重悬菌液至OD 值1.2-1.5,避光静置3 h 后,分别按表3 组合混合,将其注射烟草背面。避光处理24 h、培养7 d 后取样,用于花青苷含量测定和RT-qPCR 分析。
为验证AcMYB88 是否促进花青苷的积累,将AcMYB88 在大叶烟草叶片中进行瞬时过表达。将试验分成3 组(表2)。第1 组,将携带重组质粒的OE10 和OE88(试验组)分别注射到大叶烟草叶片右上侧和右下侧,左侧注射空载体(EV)(对照组);第2 组,将携带重组质粒的OE88+OE10+OE42(1∶1∶1)混合(试验组)注射到大叶烟草叶片右侧,左侧注射对照组,即EV+OE10+OE42(1∶1∶1);第3 组,将携带重组质粒的OE88+OE10(1∶1 )混合(试验组)注射到大叶烟草叶片右侧,将携带重组质粒的EV+OE10(1∶1)混合(对照组)注射到左侧。
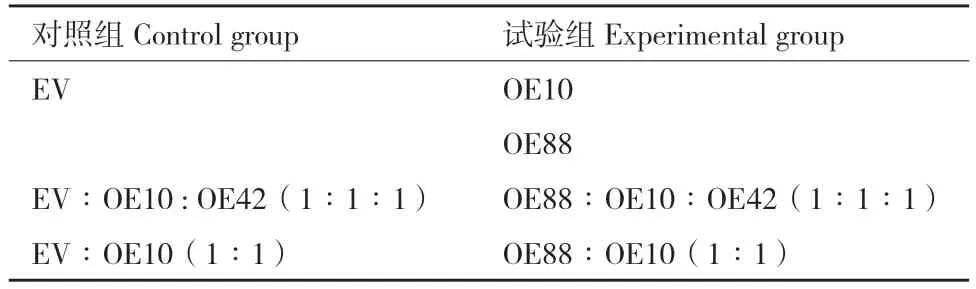
表2 农杆菌瞬时转化烟草组合Table 2 Agrobacterium combinations for tobacco transient transformation
1.2.6 花青苷含量测定 花青苷含量的测定采用pH示差法[24]。按照以下公式计算花青苷含量:
C=((A530-A620)-0.1(A650-A620))/ε×(V/m)×106×M×10-3
其中,C 表示花青苷浓度(μg/g);A 表示相应波长的吸光度;V 表示提取液体积(mL);m 表示样品重量(g);M 表示花青苷分子质量(287.24 g/mol);ε表示花青苷消光系数(4.62×106)。
1.2.7 烟草RT-qPCR 分析 利用NCBI 设计RTqPCR 引物,以烟草Actin 为内参进行RT-qPCR 分析,所用引物见表1;反应体系为TB Green Premix II 5 μL、cDNA 1 μL(cDNA 纯化方法同1.2.2)、引物各0.5 μL、ROX Reference Dye II 1 μL 和ddH2O 2 μL;PCR程序为95℃ 30 s;95℃ 3 s,60℃ 30 s,40 个循环;72℃ 20 s。每个基因设3 个技术重复,基因相对表达量计算采用2-△△Ct方法。
1.2.8 数据处理 采用SPSS、GraphPad 9、TBtools和Photoshop 软件进行数据处理和作图。
2 结果
2.1 猕猴桃MYB蛋白系统发育及理化性质分析
通过系统发育分析,筛选出12 条与AcMYB110高度同源的MYB 蛋白序列(图1)。理化性质分析结果表明,12 个猕猴桃MYB 转录因子编码的氨基酸数量为200(Achn207851)-423(Achn258201),平均284.58 个。分子量大小范围为22 325.81-45 538.79 Da,分子量最大的是Achn258201,最小的是Achn207851。等电点分布在5.84(Achn258201)-9.22(Achn218481),其中,Achn033551、Achn145-641、Achn207851、Achn258201、Achn365361 的等电点均小于7,它们可能编码弱酸性蛋白,在酸性亚细胞环境中发挥作用。不稳定指数介于42.43(Achn365361)-65.34(Achn172831)之 间,均大于40,为不稳定蛋白。脂肪指数在53.22(Achn218481)-71.18(Achn258201)范围内,蛋白成员间热稳定性差异较大。带负电荷的氨基酸残基数(Asp+Glu)介于26(Achn207851)-54(Achn258201)之间,带正电荷的氨基酸残基数(Arg+Lys)在22(Achn207851)-45(Achn258201)范围内,其中,Achn172831 的正电荷的氨基酸残基数等于负电荷氨基酸残基数,Achn036201、Achn141271、Achn154591、Achn212251、Achn218481、Achn371351 这6 个成员的正电荷氨基酸残基数大于负电荷氨基酸残基数,其余5 个成员的负电荷氨基酸残基数大于正电荷氨基酸残基数。12 个MYB 蛋白的亲水性质均为负值,表明它们是亲水性蛋白,平均亲水性为-0.71。亚细胞定位分析表明,12 个MYB 蛋白成员均定位于细胞核(表3)。

图1 猕猴桃MYB 蛋白家族系统进化分析Fig.1 Phylogenetic analysis of the MYB protein family in kiwifruit

表3 12 个猕猴桃MYB 转录因子理化性质分析Table 3 Analysis of the physicochemical properties of 12 kiwifruit MYB transcription factors
2.2 磷酸化位点预测分析
NetPhos 3.1 磷酸化位点分析表明,12 个MYB蛋白的磷酸化位点的总数:丝氨酸>苏氨酸>酪氨酸;丝氨酸磷酸化位点(Ser)最少为11 个(Achn365361),最多为38 个(Achn258201);苏氨酸磷酸化位点(Thr)最少为7 个(Achn033551、Achn145641 和Achn207851),最多为15 个(Achn036201);酪氨酸磷酸化位点(Tyr)最少为1 个(Achn033551、Achn036201、Achn141271、Achn145641、Achn154591 和Achn258201),最多为6 个(Achn218481)。Achn258201 有最多的丝氨酸和最少的酪氨酸磷酸化位点;Achn033551 潜在的苏氨酸和酪氨酸磷酸化位点最少,相应的激活酶活力最弱(表4)。

表4 猕猴桃MYB 蛋白的磷酸化位点Table 4 Phosphorylation sites of MYB proteins in kiwifruit
2.3 二级结构预测分析
SOPMA 分析结果显示,12 个MYB 蛋白中大部分成员的二级结构以无规则卷曲为主,其次为α-螺旋和延伸链,β-转角含量最少(表5)。其中,12 个MYB 蛋白的二级结构含量大小均为无规则卷曲>α-螺旋>延伸链>β-转角。α-螺旋占比为19.80%-27.19%,Achn145641 中α 螺旋占比最低,Achn258201α 螺旋占比最高;延伸链占比为10.88%(Achn036201)-15.17%(Achn172831);β-转角含量为2.15%(Achn371351)-5.19%(Achn365361);无规则卷曲占比介于54.37%(Achn258201)-63.80%(Achn371351),无规则卷曲占比最高,说明本研究中的12 个MYB 蛋白稳定性高(图2)。

图2 12 个MYB 蛋白二级结构预测Fig.2 Secondary structure prediction of 12 MYB proteins
2.4 猕猴桃MYB蛋白保守基序分析
对猕猴桃12 个MYB 基因进行motif 分析,共有10 个保守基序,motif 长度在11-50 个氨基酸不等(图3)。保守motif 数量5-9 个不等,平均含有7.08 个;12 个MYB 蛋白均含有motif 1、2、3、5、6;除Achn207851 外,均含有motif4;6 个蛋白含有motif7;4 个蛋白含有motif8;Achn036201 和Achn154591 含有motif9;Achn033551 和Achn145641含有motif10;

图3 12 个MYB 蛋白motif 分析和保守结构域分析Fig.3 Motif prediction and conserved domain analysis of 12 AcMYB proteins
12 个MYB 转录因子之间motif 的数目和结构差异不明显,表明这些蛋白进化上较为保守。motif1 和motif3 总是相连出现,在位置关系上motif1 在motif3之 前;motif6 和motif2、motif5 和motif1 也总是 相邻出现;motif8 出现在Achn036201、Achn154591、Achn172831 和Achn218481 这4 个AcMYB 蛋白中;motif9 出现在蛋白Achn036201 和Achn154591 中;motif10 出现在蛋白Achn033551 和Achn145641 中。不同MYB 蛋白的motif 数量与分布存在差异,多数motif 分布在N 端,而motif9 和motif10 出现在蛋白C 端。
2.5 猕猴桃MYB基因启动子顺式作用元件分析
12 个MYB 基因启动子中除了含有大量的CAAT-box 和TATA-box 等核心元件外,还具有较多的响应脱落酸、水杨酸、赤霉素、茉莉酸甲酯、赤霉素、生长素等植物激素的顺式元件;此外还有光响应元件和响应低温、干旱、厌氧等胁迫的元件(图4)。昼夜节律控制元件仅出现在Achn03351、Achn 212251 的启动子中。Achn03351、Achn036201、Achn172831、Achn207851、Achn218481、Achn258201和Achn371351 启动子中均含有干旱响应元件。除Achn141271、Achn207851 和Achn371351 外,其余9 个MYB 启动子中均存在厌氧诱导所必需的顺式作用调节元件。启动子序列中含有低温响应元件的转录因子包括Achn036201、Achn145641、Achn207851和Achn218481。Achn036201、Achn145641、Achn-172831、Achn207851、Achn258201 和Achn365361 的启动子序列中含有防御和胁迫响应元件。此外,还有一些转录因子含有分生组织、胚乳表达、玉米素代谢调节等相关的响应元件。其中光响应与激素反应相关顺式作用元件在12 个MYB 基因启动子中数量最多。

图4 12 AcMYBs 上游启动子元件的种类和数量Fig.4 Types and numbers of promoter elements in the upstream regions of 12 AcMYBs
2.6 ‘东红’果实不同发育时期MYB基因表达分析
对14 个MYB 基因进行RT-qPCR 定量分析(图5),通过聚类分析可将这14 个基因分为5 组。其中,第1 组包括Achn 141271;第2 组包括Achn371351、AcMYB10、Achn212251 和Achn 218481;第3 组包括Achn172831、Achn365361、Achn258201 和AcMYB-110;第4 组包括Achn145641、Achn033351 和Achn- 207851;第5 组包括Achn036201 和Achn154591。在‘东红’果实发育过程中,AcMYB110、Achn172831、Achn365361 的表达模式出现先增后降再增的趋势。其中,Achn365361 表达模式与AcMYB110 相似。因此,将Achn365361 作为候选基因,进一步探究其是否与果肉花青苷的积累有关。

图5 ‘东红’果实不同发育时期14 个MYB 基因表达聚类热图Fig.5 Expression heatmap of 14 MYB genes during different development stage of ‘Donghong’
2.7 Achn365361系统进化分析
系统进化分析结果表明(图6),Achn365361与AtMYB88 高度同源。因此,将Achn365361 命名为AcMYB88。然而,AtMYB88 是否促进拟南芥花青苷积累,目前尚未见相关报道。
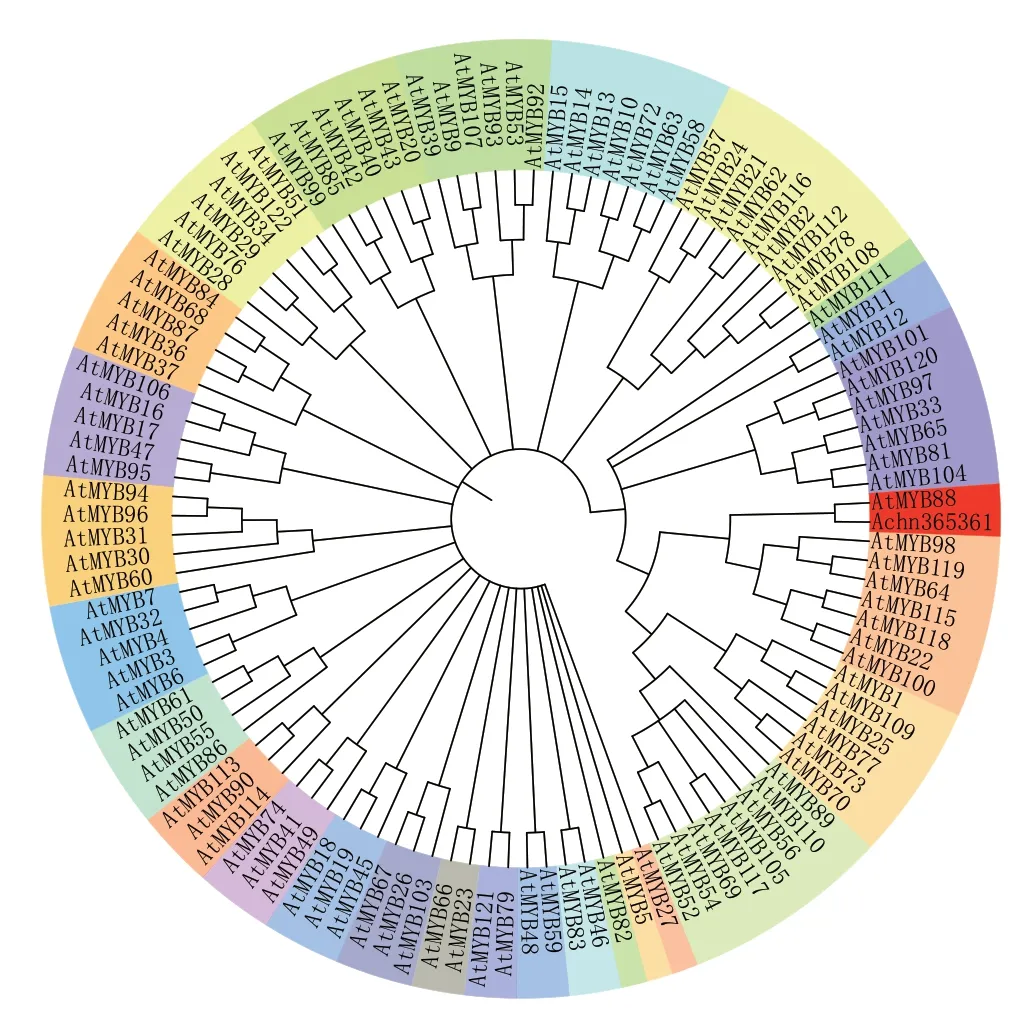
图6 Achn365361 转录因子的系统进化分析Fig.6 Phylogenetic analysis of Achn365361 transcription factor in Actinidia chinensis
2.8 烟草叶片瞬时表达
为进一步揭示AcMYB10 和AcMYB88 的功能,将重组载体pSAK-AcMYB88(OE88)、pSAKAcMYB10(OE10)和空载(EV)在大叶烟草叶片中进行瞬时过表达,结果如图7-A 所示,侵染6 d 后,对照组(EV)叶片的颜色没有明显变化,而试验组(OE10)和(OE88)的叶片颜色分别明显变红和变黄。叶片变黄可能由于大叶烟草叶绿素含量高,与花青苷的红色叠加从而显示出黄色。此外,试验组OE10、OE88 叶片花青苷含量分别为对照组的2.81倍和7.05 倍,差异显著(图7-B)。OE10 叶片中结构基因NtPAL、NtC4H、Nt4CL、NtCHS、NtF3H、NtLDOX、NtANR、NtANS 的表达量与对照相比,分别升 高99.89%、99.59%、85.55%、99.61%、99.92%、99.84%、99.63%和99.93%;试验组OE88叶片中结构基因NtPAL、NtC4H、Nt4CL、NtCHS、NtCHI、NtF3H、NtDFR、NtANR、NtANS 的表达量与对照相比,分别升高88.04%、99.19%、91.74%、92.65%、98.56%、91.64%、82.46%、96.13% 和99.63%,这与花青素含量一致(图7-C),表明AcMYB88、AcMYB10 能促进花青苷的积累。

图7 过表达AcMYB10 和AcMYB88 促进烟草花青苷积累及相关基因表达Fig.7 Overexpression of AcMYB10 and AcMYB88 promotes tobacco anthocyanin accumulation and related gene expression
如图8-A 所示,利用EV+OE10+OE42(1∶1∶1,对照组)及OE88+OE10+OE42(1∶1∶1,试验组)的农杆菌重悬液分别侵染大叶烟草。与对照组相比,试验组色素显著积累,花青苷含量升高2.64 倍(图8-B)。如图8-C 所示,试验组中与花青苷合成相关的结构基因表达量显著高于对照组。结果表明,AcMYB88 能与AcMYB10 和AcbHLH42 协同作用提高结构基因的表达量从而促进花青苷的积累。

图8 过表达EV+OE10+OE42 和OE88+OE10+OE42 促进烟草花青苷积累及相关基因表达Fig.8 Overexpression of EV+OE10+OE42 and OE88+OE10+OE42 promotes tobacco anthocyanin accumulation and related gene expression
将EV+OE10(1∶1,对照组)及OE88+OE10(1∶1,试验组)的农杆菌重悬液分别侵染大叶烟草(图9-A)。结果表明,与对照相比,试验组叶片色素显著积累,与花青苷含量的测定结果一致(图9-B)。同时与花青苷合成相关的结构基因的表达量也显著升高(图9-C)。其中,NtDFR 的表达量上升幅度最为明显,升高98.89%。结果表明,AcMYB88 也能与AcMYB10 协同作用,促进烟草叶片中花青苷的积累。

图9 过表达EV+10 和88+10 促进烟草花青苷积累及相关基因表达Fig.9 Overexpression of EV+10 and 88+10 promotes tobacco anthocyanin accumulation and related gene expression
3 讨论
3.1 AcMYB结构特征分析
MYB 基因广泛存在不同植物中,但家族成员数目差异很大。拟南芥[25]和辣椒[26]分别有192 和172 个MYB 家族成员,而在番茄[27]中鉴定到139个MYB 成员。在刺葡萄(Vitis davidii)[28]愈伤组织中仅鉴定到9 个MYB 成员。在本研究中,从转录因子网站中筛选到12 个与AcMYB110 高度同源MYB 基因。12 个MYB 基因所编码的氨基酸数目为200-423。通过对基因结构和保守基序分析发现,12个成员之间具有相似的基因结构和保守基序,表明这些成员在进化过程和功能上具有高度相似性。
蛋白质二级结构是蛋白质分子内部结构动态性的重要组成部分,影响蛋白质的生物功能和稳定性。蛋白质二级结构预测是研究蛋白质的重要内容,蛋白质二级结构的主要形式包括无规则卷曲、α-螺旋、β-折叠和β-转角。竹叶花椒MYB 家族的二级结构除ZaMYB21、ZaMYB24 和ZaMYB35 以α-螺旋为主外,其余36 个ZaMYBs 蛋白的无规则卷曲所占比例最高[14]。本研究中的12 个AcMYB 蛋白的二级结构均以无规则卷曲为主,其次为α-螺旋和延伸链,β-转角含量最少。
3.2 MYB基因参与花青苷生物合成
花青苷生物合成由结构基因和转录因子共同调控。这些转录因子通过调控花青苷生物合成途径中结构基因的表达,决定植物器官颜色的呈色部位和着色效果。研究表明,MYB 转录因子、bHLH转录因子和WD40 蛋白为花青苷生物合成途径中的主要调控因子,可直接参与调控结构基因的转录[29-30]。在苹果中已经分离得到很多MYB 基因,如MdMYB1、MdMYBA、MdMYB10 等,这些都属于R2R3 类MYB 基因,且能够调控花青苷的积累[31-32]。Cutanda-Perez 等[33]证 实VvMYBA1 和VvMYBA2 能调控葡萄花青苷合成途径中UFGT 的表达,从而调节果实的着色。研究表明,MYB10 能与bHLH3 协同作用,促进梨果皮花青素的合成[34]。烟草瞬时表达实验发现,与单独注射SmMYB1 相比,当SmMYB35与SmMYB1 共同侵染烟草后,叶片花青素含量明显增加[35]。本研究基于RT-qPCR 结果,从12 条MYB 基因中筛选出与AcMYB110 表达模式相似的基因AcMYB88,并通过瞬时转化烟草实验初步证实AcMYB88 参与花青苷的积累,且能与AcMYB10 和AcbHLH42 协同调控,进一步增加花青苷的积累,这为猕猴桃育种提供理论依据。
4 结论
从猕猴桃MYB 基因家族中筛选出与AcMYB110高度同源的12 个MYB 转录因子,筛选出与MYB110表达模式极为相似的候选基因AcMYB88,其表达可促进烟草叶片花青苷的积累,证明AcMYB88 为花青苷合成的正向调控因子。此外AcMYB88 能与AcMYB10 和AcbHLH42 协同作用进一步增加花青苷的积累。

