雨生红球藻钙依赖蛋白激酶(CDPK)家族鉴定与表达分析
李亚男 张豪杰 梁梦静 罗涛 李旺宁 张春辉 季春丽 李润植薛金爱 崔红利,2
(1.山西农业大学农学院 分子农业与生物能源研究所,太谷 030801;2.中国科学院烟台海岸带研究所 海岸带生物学与生物资源利用重点实验室,烟台 264003)
钙离子(Ca2+)是植物体内普遍存在的第二信使,通过瞬时改变植物生长发育过程中的Ca2+浓度,以及对外界环境刺激的反应,在信号转导途径中发挥重要作用[1-3]。在植物受到胁迫时,一些钙感受器或钙结合蛋白可以感知钙离子浓度的变化并识别钙信号,然后将其转导到一系列下游反应,以应对环境胁迫损伤,提高自身抗性[4-5]。迄今已在植物细胞内发现多种钙结合蛋白,如钙调素(calmodulin,CaM)、类钙调神经素B 亚基蛋白(calcineurin B-like proteins,CBLs)和钙依赖蛋白激酶(calcium-dependent protein kinases,CDPKs 或CPKs)等[6]。
CDPK 是独特的新型Ca2+传感器。与其他已知的Ca2+传感器相比,它具有一个催化功能的Ser/Thr激酶结构域和一个类钙调素结合域(能结合钙的EF-hand 基序)。因此,CDPK 同时具有Ca2+结合活性和激酶活性,能够直接结合Ca2+,将钙信号转化为下游的磷酸化信号[7-8]。典型的CDPK 蛋白结构主要由N 端可变区、Ser/Thr 激酶域、自抑制域(连接域)以及类钙调素结合域组成[6,9-10]。N 端可变区具有肉豆蔻酰化和棕榈酰化位点,对CDPK 的亚细胞定位及调控植物生长发育十分重要[11]。自抑制结构域与激酶域相邻,作为假底物与其结合,以使CDPK 失活[12]。目前已在莱茵衣藻(Chlamydomonas reinhardtii)[13]、拟南芥(Arabidopsis thaliana)[6]、烟 草(Nicotiana tabacum)[14]、水 稻(Oryza sativa)[15]、番茄(Solanum lycopersicum)[16]、玉米(Zea mays)[17]等中发现CDPK。
作为Ca2+的直接“传感器”,CDPK 在调节植物生长和各种胁迫的应答反应中发挥重要作用。拟南芥Atcpk1 突变体表现出对盐和干旱胁迫敏感,而其过表达株可显著增强对盐/干旱的抗性[18]。AtCDPK1 和AtCDPK2 基因在高盐胁迫下快速上调表达,但在低温下不受影响[19]。AtCDPK4/5/6/11 可以调节MAMP 或PAMP 触发的免疫反应,并磷酸化转录因子WRKY 以调节下游基因表达[20]。过表达OsCDPK7 可通过上调一些胁迫响应基因的表达,进而增强植物对盐碱或干旱的耐受性,但不参与冷胁迫响应。在莱茵衣藻中,大多数CDPK 基因在缺氮和盐胁迫下显著诱导,其中有6 个CrCDPK 基因在莱茵衣藻缺氮胁迫下的油脂积累中发挥积极作用[13]。大量研究表明,来自不同植物的CDPK 数量不同且具有功能多样性。目前,关于藻类CDPK 基因家族鉴定及其生物学功能研究较少,有待进一步解析。
雨生红球藻(Haematococcus pluvialis)是一种具有双鞭毛的单细胞淡水绿藻,是目前已知天然虾青素含量最高的生物,可在逆境条件下大量积累虾青素[21]。虾青素作为一种高价值的酮类胡萝卜素,具有很强的抗氧化能力,已广泛应用于食品、制药和化妆品等领域[22-23]。温度、光照和营养盐等非生物胁迫可促进雨生红球藻合成积累大量虾青素[24]。干旱、盐分和低温等非生物胁迫都会引起植物细胞内Ca2+浓度的变化,进而诱导下游信号的传递途径[25]。CDPK 可迅速感受瞬时Ca2+信号的变化,识别并磷酸化特异性底物后,引发各种生理反应,从而调控植物的生长发育及对多种胁迫的响应。而雨生红球藻在非生物胁迫下,CDPK 的转录水平如何?具有怎样的功能?是否参与虾青素等类胡萝卜素代谢的调控?回答这些问题有助于深入解析CDPK 基因参与雨生红球藻胁迫应答和虾青素的合成机制,以及建立优化的雨生红球藻培养体系,高效生产虾青素。
基于雨生红球藻转录组数据,本研究拟对雨生红球藻HpCDPK 基因家族进行鉴定和系统的生物信息学分析,进一步检测UV-B、高白光、高蓝光和α-酮戊二酸处理条件下HpCDPK 各成员的表达谱,以期为深入解析雨生红球藻HpCDPK 基因的生物学功能,尤其是介导雨生红球藻生长发育及虾青素生物合成积累的分子机制提供新的科学依据。
1 材料与方法
1.1 材料
本试验所用藻株为雨生红球藻[Haematococcus pluvialis(Flotow,1844)]藻株,现存于山西农业大学分子农业与生物能源研究所。
1.2 方法
1.2.1 雨生红球藻CDPK 基因家族成员鉴定及基本参数分析 雨生红球藻氨基酸序列来自本地转录组数据库。从Phytozome v13(https://phytozome-next.jgi.doe.gov/)下载拟南芥和莱茵衣藻CDPK 蛋白序列,与雨生红球藻转录组中对应的蛋白序列进行同源比对,筛选雨生红球藻中的CDPK 蛋白,其中同源比对E 值的阈值设置为1e-5。利用Interpro(http://www.ebi.ac.uk/interpro/)网站中 的search 命令检测雨生红球藻蛋白序列中同时包含Pkinase 结构域和EF-hand 基序的序列。对Interpro 序列比对的结果进行筛选。综合以上结果,使用SMART 数据库(http://smart.embl-heidelberg.de)对所含结构域进行验证。利用在线软件SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测蛋白的三级结 构。利 用ExPASy Proteomics Server(http://cn.expasy.org/tools)分析雨生红球藻CDPK 蛋白序列的长度、等电点、分子质量等参数。肉豆蔻酰化位点由ExPASy 中 的Myristoylator 程 序预测(http://web.expasy.org/myristoylator/)。棕榈酰化位点通过CSSPALM 4.0(http://csspalm.biocuckoo.org/)预 测。利用在线工具CELLO(http://cello.life.nctu.edu.tw/)和Softberry(http://linux1.softberry.com/berry.phtml)预测雨生红球藻HpCDPK 的亚细胞定位。
1.2.2 雨生红球藻CDPK 基因系统进化分析 利用MEGA7 软件中的 Clustal W 对鉴定所得雨生红球藻CDPK 蛋白序列与拟南芥、莱茵衣藻的CDPK 蛋白序列进行比对。基于序列比对结果,采用邻近法构建系统进化树,其中bootstrap 值设定为1 000。
1.2.3 雨生红球藻CDPK 蛋白的保守基序和功能结构域分析 利用在线网站MEME Suite v 5.5.0(https://meme-suite.org)预测雨生红球藻CDPK 基因家族成员蛋白序列中的保守基序(motif),其中motif 的最大数量设为15,最优的motif 宽度为10-100 个氨基酸,其余参数为默认数值。利用SMART 数据库(http://smart.emblheidelberg.de/)分析各CDPK 蛋白中的功能结构域。并利用TBtools(https://github.com/CJ-Chen/TBtools)将雨生红球藻 CDPK 基因的系统进化树和保守基序数据进行合并。
1.2.4 雨生红球藻CDPK 基因表达特性分析 高蓝光和高白光处理组:所用培养基为BG11,在光强25 μmol/(m2·s)(LED 白光)、温度(22.5±1)℃、光/暗周期(12 h/12 h)的条件下静置培养,每8 h 摇1 次。将对数期雨生红球藻在黑暗环境下处理24 h,经离心(5 000 r/min,4℃,5 min)收集,用新鲜培养基重悬细胞,分别于正常培养(N,25 μmol/(m2·s))、高白光(W,500 μmol/(m2·s))和高蓝光(B,500 μmol/(m2·s))条件下处理72 h。最后离心收藻,将样品于液氮速冻后存于-80℃,每个处理3 个重复,并进行转录组测序[26]。
UV-B 处理组:采用 MCM 培养基培养藻细胞,培养条件为:光强为25 μmol/(m2·s)、温度 25℃、光暗比为12 h/12 h,静置培养,每天手摇2-3 次。使用 Philips TL20W/01RS 窄带 UV-B 灯管(15 W)提供UV-B 光源,通过移动锥形瓶与紫外灯的距离调节强度,光强使用勒克斯计测量,在试验前连续照射24 h 使系统稳定[27]。离心收集正常光照组(L,25 μmol/(m2·s))、低UV-B 辐射组(LU200,200 W)、高UV-B 辐射组(LU400,400 W)以及对应的黑暗条件下处理组(D)、低UV-B 辐射组(DU200,200 W)、高UV-B 辐射组(DU400,400 W)培养的雨生红球藻藻株经液氮速冻后存于-80℃,每个样本3 个重复,用于转录组测序分析。
α-酮戊二酸(α-ketoglutaric acid,OG)处理组:将培养至对数生长期的雨生红球藻以5 000 r/min 离心5 min,收集藻细胞,然后重新悬浮在正常培养基和缺氮培养基中,缺氮(ND)培养基为不添加硝酸钠的BG11 培养基。对照为高光处理(CK),光照强度为270 μmol/(m2·s)。OG 浓度设置为10.0 mg/L。离心收集CK、OG、ND 和ND-OG 组培养的雨生红球藻藻株经液氮速冻后存于-80℃,每个样本3 个重复,用于转录组测序分析。
1.2.5 雨生红球藻HpCDPK 基因与类胡萝卜素合成基因的共表达分析 为预测HpCDPK2、HpCDPK3和HpCDPK5 的功能,使用从转录组中鉴定的类胡萝卜素合成相关基因,包括AACT、HMGS、MVD、IDI、DXS、DXR、CMT、CMK、MDS、HDS、HDR、GGPS、PSY、PDS、Z-ISO、ZDS、CRTISO、LYCB、LYCE、BKT、BCH、CYP97A、CYP97B、CYP97C、ZEP、VDE 和NCED/CCD。结合热图分析中使用的转录组数据,使用GraphPad Prism 9.0 中的ggcor 函数和默认的Pearson 相关系数计算HpCDPK 与类胡萝卜素合成相关基因表达的相关性。
2 结果
2.1 雨生红球藻CDPK基因及编码蛋白的基本信息
以拟南芥和莱茵衣藻CDPK 蛋白序列作为查询序列,通过BlastP 程序从雨生红球藻转录组中检索到候选CDPK 蛋白序列。通过SMART 和序列比对验证后,总共有7个非冗余的HpCDPK基因被鉴定,并命名为HpCDPK1-HpCDPK7(表1)。这些HpCDPK基因编码氨基酸长度主要集中在478-1 479 aa,所编码蛋白质分子质量大小在53 280.35-153 784.74 Da之间,等电点变化区间为5.71-7.29,其中除HpCDPK6 蛋白等电点大于7 显碱性,其余6 个蛋白等电点小于7 显酸性。三级结构预测结果表明,HpCDPK 蛋白主要由α 螺旋组成(图1)。在鉴定的7 个HpCDPK 中仅HpCDPK7 预测到在N 末端有肉豆蔻化基序。利用CELLO(http://cello.life.nctu.edu.tw/)和Softberry(http://linux1.softberry.com/berry.phtml)预测HpCDPK 蛋白亚细胞定位发现,HpCDPK1、3、4 均定位于细胞质,该定位更易识别Ca2+内流信号。
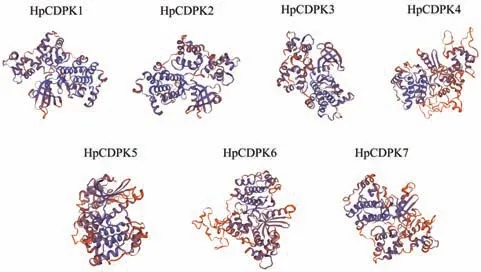
图1 雨生红球藻CDPK 蛋白三级结构预测Fig.1 Prediction of tertiary structures of CDPK proteins in H.pluvialis
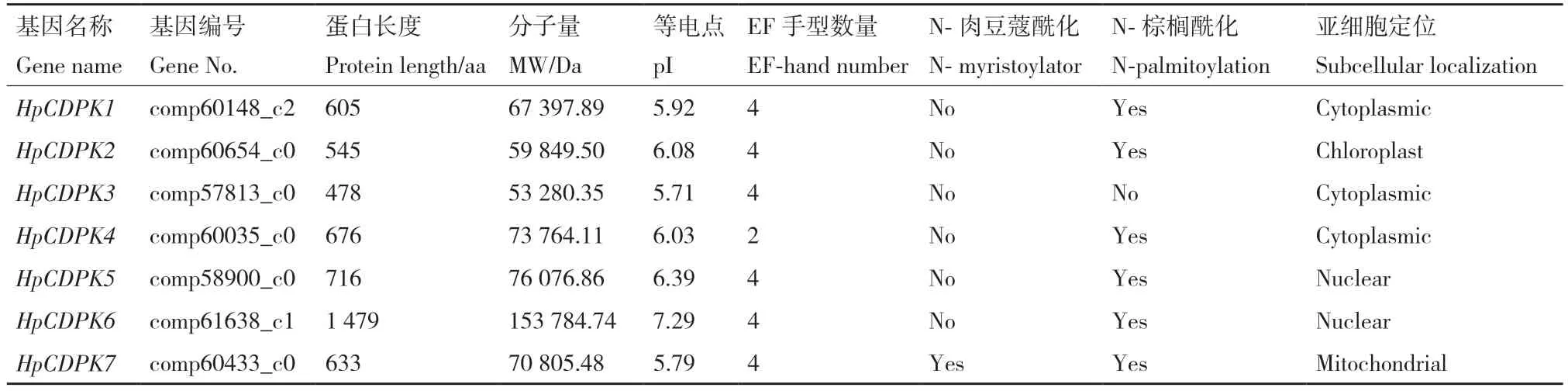
表1 雨生红球藻CDPK 基因家族成员信息Table 1 Members of CDPK gene family in H.pluvialis
2.2 雨生红球藻CDPK基因家族系统进化分析
为了剖析CDPK 基因家族成员的进化关系,我们使用双子叶模式植物拟南芥、单细胞模式生物莱茵衣藻和雨生红球藻CDPK 基因家族成员构建了系统发育树,这56 个成员可分为4 组(图2)。第1组成员最多,包含了31 个AtCDPK,皆为拟南芥成员。第2 组包括4 个CrCDPK 和2 个HpCDPK。第3组是由AtCDPK18、AtCDPK16和AtCDPK28聚集而成。第4 组则是由11 个CrCDPK 和5 个HpCDPK 组成。此外,雨生红球藻CDPK 基因家族成员与高等植物拟南芥的AtCDPK 基因家族成员进化关系相对较远,与同为低等植物的莱茵衣藻CrCDPK 基因家族成员亲缘关系较近。

图2 雨生红球藻、莱茵衣藻和拟南芥CDPK 基因系统发育树Fig.2 Phylogenetic tree of CDPK genes in H.pluvialis,C.reinhardtii and A.thaliana
2.3 雨生红球藻CDPK蛋白特征分析
保守基序(motif)是同源蛋白中的潜在功能区。为了研究HpCDPK 的蛋白结构和功能多样性,我们使用全长的HpCDPK 蛋白序列构建了一个单独的无根系统发育树,并将其与相应基因序列的保守基序和结构域组合进行了比较分析(表1 和图3)。利用在线MEME 工具分析获得HpCDPK 蛋白中最保守的9 个基序(图4),以此帮助我们研究它们的功能。无根系统发育树表明,HpCDPK 大致分为3 个主要亚组。motif7、motif2、motif3、motif1、motif4 为蛋白激酶结构域,该区域序列在不同物种间的同源性较高;motif5、motif8 和motif6 为EF-hand 基序,其可分为N 端和C 端两部分,且C 端的钙亲和力高于N 端(图3,5 和6)。基序分析结果表明,每个亚群内部保守的基序结构支持它们之间密切的进化关系,但不同亚群之间可能存在功能上的差异。此外,使用Interpro 和SMART 蛋白质数据库和序列比对预测了HpCDPK 的蛋白质结构(图3-6)。结果表明,本研究鉴定的所有CDPK 都具有4 个特征结构,即一个可变的N-末端结构域,一个催化Ser/Thr 蛋白激酶结构域,一个自抑制区和一个类钙调素结合域。此外,对HpCDPK 的保守结构域和重要位点分析发现,7 个HpCDPK 蛋白中,仅有HpCDPK1 具有C2 保守结构域。在激酶保守结构区域,所有HpCDPK 具有Ser/Thr 活性位点;除HpCDPK5 外,其余蛋白都含有激酶ATP 结合位点。此外,在EF 手型保守区域,7 个HpCDPK 都含有Ca2+结合位点,但各蛋白所含Ca2+结合位点的数量不同(图7)。

图3 雨生红球藻HpCDPK 家族成员的保守基序和功能结构域Fig.3 Conserved motif and functional domain of HpCDPK family members of H.pluvialis

图4 MEME 预测的雨生红球藻HpCDPK 保守基序Fig.4 Conserved motifs of HpCDPKs in H.pluvialis predicted by MEME
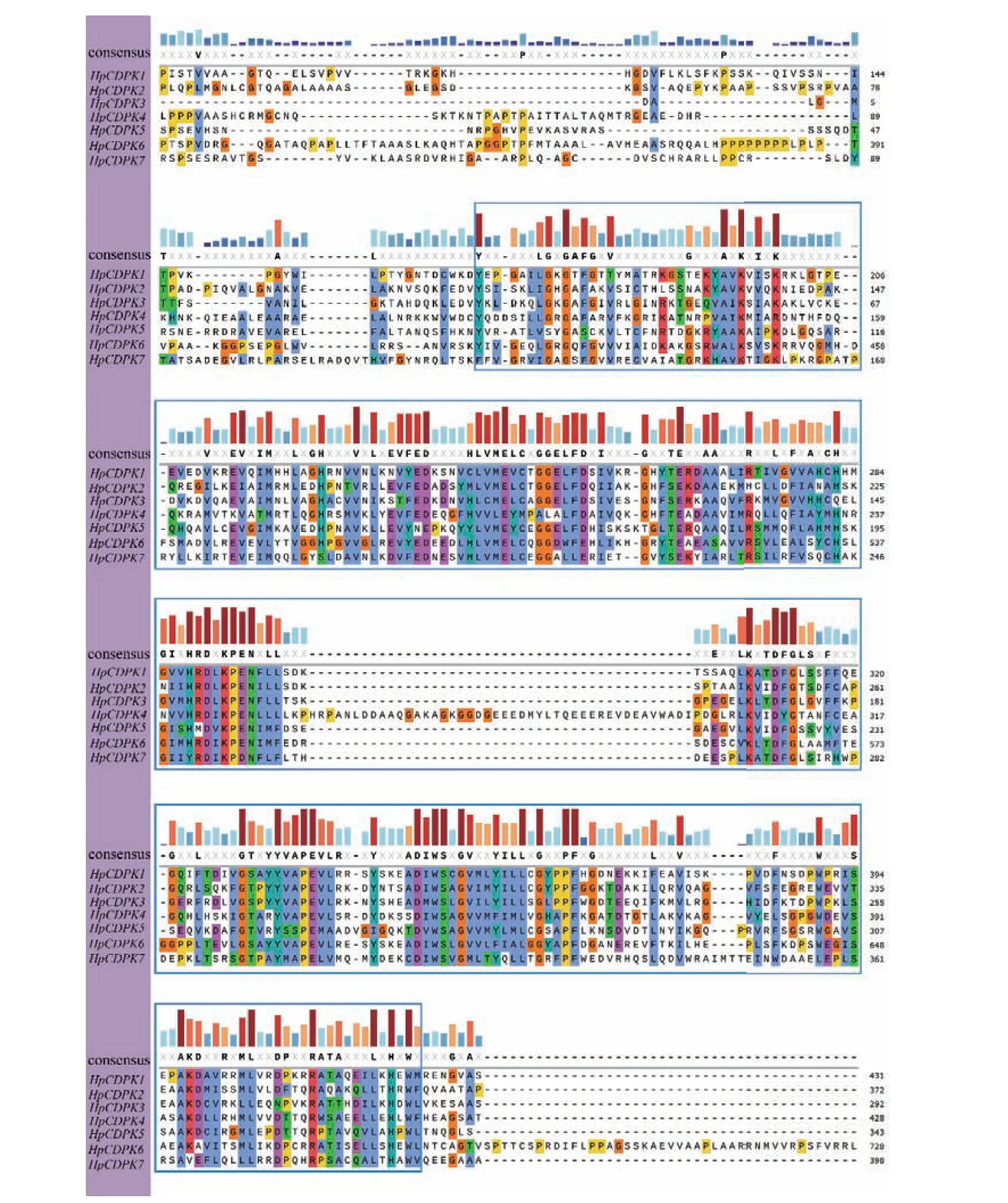
图5 雨生红球藻HpCDPK 蛋白保守PDK 结构域的多序列比对Fig.5 Multiple sequence alignments of conserved PDK domains of HpCDPK proteins in H.pluvialis
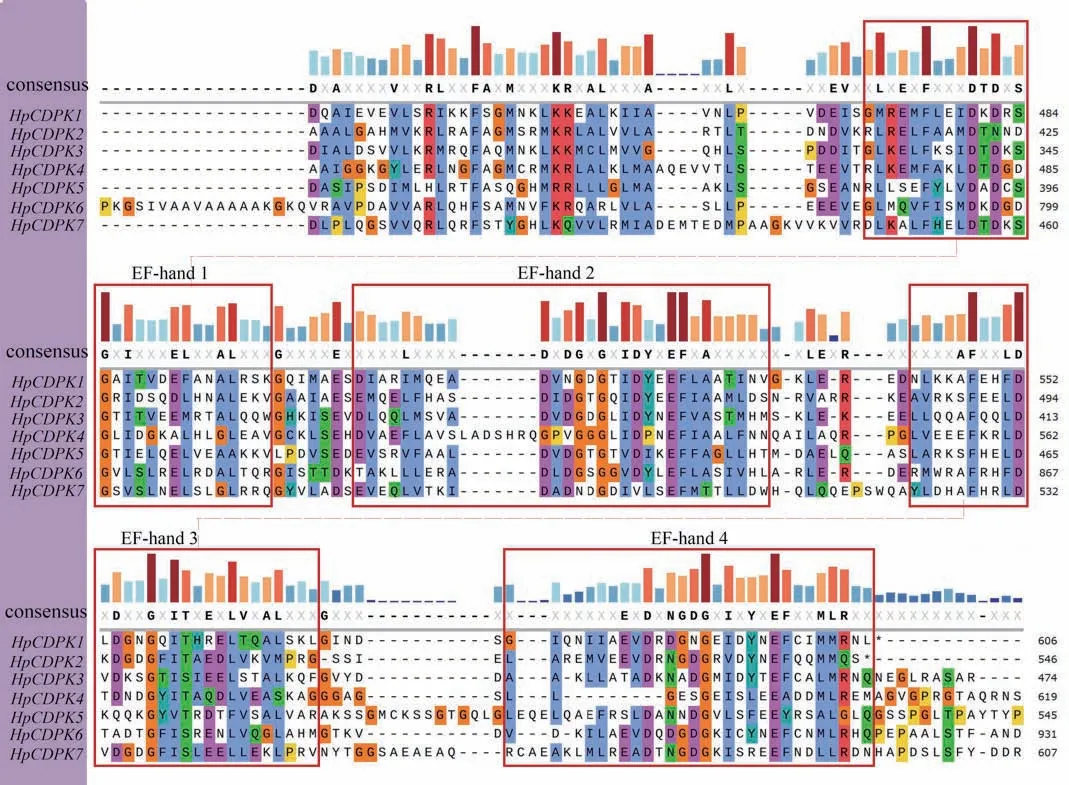
图6 雨生红球藻HpCDPK 蛋白保守EF 基序的多序列比对Fig.6 Multiple sequence alignments of conserved EF motifs of HpCDPK proteins in H.pluvialis

图7 雨生红球藻HpCDPK 的保守结构域和重要位点分析Fig.7 Conserved domain and important site analysis of HpCDPKs in H.pluvialis
2.4 雨生红球藻CDPK基因在非生物胁迫下的表达模式
为研究HpCDPK 基因是否在雨生红球藻胁迫响应过程中发挥功能,我们检测3 种不同胁迫下雨生红球藻HpCDPK 基因的表达模式。在正常培养条件(N)下(图8-A),雨生红球藻HpCDPK 基因均表达,且HpCDPK1 表达量最高。在高白光和高蓝光处理下,HpCDPK1 和HpCDPK6 表达量均显著降低,而且HpCDPK1 表达量减少幅度远低于HpCDPK6。

图8 雨生红球藻HpCDPK 基因在非生物胁迫下的表达模式Fig.8 Expression patterns of HpCDPK genes in H.pluvialis in response to abiotic stresses
在正常光照条件下(图8-B),UV-B(200 W 和400 W)处理的雨生红球藻HpCDPK2 和HpCDPK5基因的表达量均提高;HpCDPK3 在UV-B(200 W)辐射时上调,当UV-B 辐射增至400 W 时HpCDPK3的表达量下调。在黑暗条件进行UV-B(200 W和400 W)处理下,HpCDPK3 的表达 量下调,HpCDPK5 的表达量均上调;HpCDPK2 在UV-B(200 W)和UV-B(400 W)辐射时表达量均上调。
在高光条件(CK)下(图8-C),HpCDPK3 的基因表达量最高,HpCDPK5 的表达量最低。与CK相比,在OG、ND 和ND-OG 条件下,HpCDPK6 的表达量均下调;HpCDPK1、HpCDPK2、HpCDPK4、HpCDPK5 和HpCDPK7 的表达量均差异性上调,且在ND 和ND-OG 条件下的基因表达量高于OG 条件下的基因表达量,但其基因表达量在ND 和ND-OG条件下差异不显著。此外,在ND 和ND-OG 条件下,HpCDPK3、HpCDPK5 和HpCDPK6 的表达量差异同样不明显。
2.5 HpCDPK基因与类胡萝卜素及虾青素合成基因表达量的相关性分析
有研究表明,在UV-B 胁迫条件下可显著诱导雨生红球藻虾青素积累。为了探索HpCDPK 是否参与虾青素合成积累的调控,我们根据课题组已有的UV-B 诱导条件下雨生红球藻转录组数据,对不同强度UV-B 诱导处理下的雨生红球藻中HpCDPK2、HpCDPK3 和HpCDPK5 与虾青素合成及积累的关键基因转录水平进行相关性分析。结果表明,HpCDPK2、HpCDPK3 和HpCDPK5 与虾青素合成通路基因表达高度相关,暗示HpCDPK 可能介导雨生红球藻虾青素生物合成(图9)。进一步相关性分析(图10)显示,HpCDPK2 与虾青素合成关键基因PSY、BCH 和BKT 和类胡萝卜素合成关键基因Z-ISO(图10-A、C、D 和B)转录水平呈正相关(P<0.05)。HpCDPK3 与类胡萝卜素合成基因关键基因ZDS、CYP97B 和HMGS(图10-E、F 和H)转录水平呈正相关(P<0.05);而与其降解基因NCED/CCD(图10-G)转录水平呈负相关(P<0.05)。HpCDPK5 与类胡萝卜素合成关键基因DXS、DXR 和LYCB 以及其降解基因NCED/CCD(图10-I、J、L 和K)转录水平呈正相关(P<0.05)。由此推测HpCDPK 可能在UV-B 条件下参与虾青素生物合成的调控,亦可能在类胡萝卜素的积累中发挥类似功能,具体分子机制还需进一步试验验证。

图9 HpCDPK 基因与虾青素合成及积累基因的表达量相关性分析Fig.9 Correlation between HpCDPKs and gene expressions for astaxanthin synthesis and accumulation

图10 HpCDPK2、HpCDPK3 和HpCDPK5 基因与类胡萝卜素及虾青素合成及积累基因的表达量相关性Fig.10 Correlation between HpCDPK2,HpCDPK3,HpCDPK5 genes and gene expressions for the biosynthesis and accumulation of carotenoid and astaxanthin
3 讨论
CDPK 激酶在植物生长、发育和胁迫反应中发挥重要作用[10]。目前已在多种植物中阐明其生物学功能。雨生红球藻作为高效积累天然虾青素的优异种质,其CDPK 成员能否参与胁迫条件诱导虾青素合成的调控尚不清楚。本研究共鉴定7 个HpCDPK家族成员。通过与拟南芥和莱茵衣藻CDPK 成员比对与进化分析,分为4 组。其中HpCDPK 与来自莱茵衣藻的CDPK 聚为一类,与高等植物(拟南芥)来源的AtCDPK 明显分开,形成两个姐妹分枝,暗示在进化过程中具有种属特异性[13]。
N-肉豆蔻酰化修饰赋予蛋白灵活可变的膜结合能力,对蛋白的膜靶向尤为重要[28-29]。CDPK 具有N-肉豆蔻酰化基序,暗示定位在质膜,在胞膜结合和钙信号转导中发挥作用[1,30-32]。在本研究中,仅有HpCDPK7 预测含有N-肉豆蔻酰化基序,但亚细胞定位预测显示在线粒体。研究表明玉米ZmCK1 含有 N 末端肉豆蔻酰化基序,但ZmCK1:hGFP 融合蛋白定位于细胞质和细胞核[33]。CDPK 蛋白的亚细胞定位还可能受到其他因素影响,需要进一步的实验验证。
蛋白激酶结构域能将核苷三磷酸(ATP)的γ-磷酸转移到蛋白质侧链,导致构象变化进而影响其功能[34]。因此,含有ATP 结合位点的HpCDPK 成员可以利用ATP 作为磷酸基团的来源,以此来磷酸化靶底物[35]。尽管蛋白激酶结构域非常保守,但不同成员间的ATP 结合位点和Ser/Thr 蛋白激酶活性位点序列存在着大量的变异。例如,HpCDPK3 的激酶ATP 结合位点序列与其他成员此位点序列相比较短,HpCDPK5 不具有激酶ATP 结合位点序列。这可能是因为其保守性较低导致的,也可能是不同成员功能差异性所在。
为探究HpCDPK 是否参与雨生红球藻胁迫响应,我们检测了3 种不同胁迫下雨生红球藻HpCDPK 基因的表达模式。结果显示,HpCDPK1 和HpCDPK6基因表达受到光条件的影响,但HpCDPK1 对蓝光更敏感。UV-B 辐射对植物的生长发育具有重要的作用,高强度的UV-B 作为逆境胁迫因子,影响植物正常的生理功能;而低强度的UV-B 作为信号调控因子,促进植物光形态的建成[36-39]。已有研究表明,UV-B辐射显著影响长春花悬浮细胞培养中CDPK 蛋白激酶的活性[40]。HpCDPK5 无论在黑暗条件还是光照条件下UV-B(400 W)处理,其基因的表达量均上调,而HpCDPK3 表达则是下调。因此,HpCDPK3和HpCDPK5 在高强度UV-B(400 W)诱导下,其基因表达量具有相反模式。与之相似,OsCDPK2 的表达也与光诱导密切相关。暴露在光下的水稻绿叶中几乎检测不到OsCDPK2 蛋白,但当植株转移到黑暗中时,该蛋白水平急剧上升[41]。雨生红球藻在高光(HL)和缺氮(ND)双重胁迫,以及添加α-酮戊二酸(OG)处理的HpCDPK 基因表达模式结果显示,ND 和ND-OG 处理激活了更多差异表达的HpCDPK 基因,这与莱茵衣藻CDPK 在缺氮处理下的表达结果相一致[13]。其中HpCDPK7 基因转录水平在缺氮条件下上调最为明显。此外,结果还表明,HpCDPK 基因表达更易受到ND 影响,而OG 处理对其影响较小。
类胡萝卜素合成的前体物质是异戊烯焦磷酸(IPP),在雨生红球藻中,IPP 被认为只能由MEP途径合成[42]。已有研究表明,UV-B 辐射可提高雨生红球藻虾青素含量[43]。因此,我们对不同强度UV-B 辐射处理下的雨生红球藻中HpCDPK2、HpCDPK3 和HpCDPK5 与类胡萝卜素合成相关基因转录水平进行相关性分析,结果显示,HpCDPK5 和参与IPP 合成的酶基因DXS、DXR 和HDS 的转录水平呈正相关。IPP 在酶的作用下最终生成香叶基香叶基焦磷酸(GGPP),它是后续胡萝卜素合成的直接前提物质。GGPP 在经PSY、PDS、Z-ISO、ZDS 等酶的催化反应后生成全反式番茄红素,后者在两种不同类型的环化酶(LYCB 和LYCE)协同作用下形成不同的胡萝卜素[44-45]。其中,番茄红素在LYCB的催化下生成β-胡萝卜素,然后在BKT 和BCH 酶的参与反应下最终生成虾青素。结果显示,在GGPP合成全反式番茄红素阶段,HpCDPK2 与PSY 和Z-ISO基因的转录水平呈正相关,HpCDPK3 与ZDS 基因的转录水平呈正相关。在合成虾青素阶段,HpCDPK5与LYCB 基因的转录水平呈正相关,HpCDPK2 与虾青素合成关键基因BKT 和BCH 转录水平正相关。此外,我们发现NCED/CCD 与HpCDPK3 基因的转录水平负相关,与HpCDPK5 的转录水平呈正相关。类胡萝卜素裂解双加氧酶(CCD)家族包括CDD 和NCED,是双加氧酶酶促降解途径中的重要酶,可特异性识别不同底物和不同的双键位置进行断裂,从而形成自然界中多种多样的脱辅基类胡萝卜素[44]。因此,HpCDPK3 和HpCDPK5 基因的可能发挥相反的功能。
已有研究表明,CDPK 可通过磷酸化调节转录因子、离子通道、转运蛋白或一些其他信号通路相关的蛋白活性,从而调控基因的表达和维持ROS稳 态[46]。在本研究中,HpCDPK2、HpCDPK3 和HpCDPK5 基因的表达模式与类胡萝卜素合成相关基因的表达具有相关性。因此,我们推测上述基因可能通过磷酸化调节某种底物蛋白或转录因子的活性,进而调节雨生红球藻类胡萝卜素合成相关基因的表达,从而增加其含量。
4 结论
本研究在雨生红球藻转录组数据库中鉴定到7个HpCDPK 家族成员,HpCDPK 基因表达量受到多种胁迫条件的影响,其中HpCDPK7 基因转录水平在缺氮条件下上调最为明显。此外,HpCDPK2 与多个控制类胡萝卜素和虾青素合成的酶基因转录水平主要呈正相关,预示着HpCDPK2 可能在类胡萝卜素及虾青素合成积累中发挥积极调控作用。

