异基因造血干细胞移植患者T 淋巴细胞亚群与EB 病毒感染的相关性分析
陈希,金宏飞,吴青,刘静
淋巴瘤等恶性血液病严重威胁着人们的健康与生存,随着医疗技术的发展,异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)逐渐成为治疗恶性血液病的有效手段[1]。而移植后的免疫功能重建(immune reconstitution, IR)是影响allo-HSCT 疗效的主要因素之一[1-2],延迟的IR 会导致移植后感染、疾病复发和死亡率增加[3]。Berger 等[4]、Kim 等[5]均报道过allo-HSCT 3 个月后,CD4+T 淋巴细胞水平升高与患者总体生存率相关,CD4+T 淋巴细胞恢复正常水平的患者非复发死亡率降低,机会性感染发生概率下降,提示CD3+CD4+T 淋巴细胞计数是移植后IR 的重要指标。EB 病毒(Epstein-Barr virus, EBV)属γ疱疹病毒亚科,是唯一能引起人类感染的淋巴滤泡病毒,与多种肿瘤的发生、发展有密切的联系,被认为是免疫失调的触发点[6-8]。巨细胞病毒(cytomegalovirus, CMV)属β 疱疹病毒亚科,也是allo-HSCT患者发生并发症及死亡的主要原因[9]。EBV 和人巨细胞病毒(human cytomegalovirus, HCMV)都与机体的免疫功能相关,病毒感染阳性的allo-HSCT 患者大多存在淋巴细胞亚群分布不平衡,并且与患者的康复程度、生存率都密切相关[10]。最近有研究探讨了allo-HSCT 患者的IR 中T 淋巴细胞亚群的分布和γ 疱疹病毒的感染情况[11],然而allo-HSCT 患者的T 淋巴细胞亚群与病毒感染相关性的研究并不深入。本研究主要分析了allo-HSCT 患者T 淋巴细胞亚群和病毒感染的相关性,探讨T 淋巴细胞亚群的变化对预测allo-HSCT 后EBV 感染的价值。
1 对象与方法
1.1 研究对象
选择北部战区总医院2015 年5 月至2021 年12 月行allo-HSCT 的67 例患者作为研究组,同时选取54 例造血干细胞移植供者作为对照组,纳入标准:(1)诊断均符合《血液病诊断疗效与标准》[12];(2)EBV DNA>4.0×102copies/ml;(3)HCMV DNA>4.0×102copies/ml。排除标准:(1)合并心肌炎、肝炎等的危急病情;(2)合并自身免疫病等免疫系统疾病。研究组患者年龄(25.00 ± 7.00)岁,其中男性患者43 例,女性患者24 例,原发病包括急性髓系白血病(acute myelogenous leukemia, AML)28 例,急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)28 例,骨髓增生异常综合征(myelodysplastic syndromes, MDS)11 例。对照组患者年龄(30.00 ±10.00)岁,男性患者34 例,女性患者20 例,各项体检指标均无明显异常。2 组患者年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。本研究已通过北部战区总医院医学伦理委员会批准(伦理批号:Y2022215),并通过免除知情同意申请。
1.2 方法
1.2.1 外周血中性粒细胞(neutrophil, NEU)与淋巴细胞(lymphocyte, LYM)的检测 将DIFF 溶血剂与样本混合后,使用全自动血液细胞分析仪(BC-6900;迈瑞公司)进行检测。取患者EDTA-K2抗凝的全血,根据操作步骤,上机检测。
1.2.2 外周血中EBV-DNA 拷贝数的检测 采用圣湘生物科技股份有限公司提供的EBV 荧光定量检测试剂盒(PCR 荧光探针法),取患者EDTA-K2抗凝的全血800 μl,加入红细胞裂解液,震荡混匀至透明,12 000 r/min(离心半径为8 cm)离心3 min,加入生理盐水混匀,12 000 r/min 离心3 min,沉淀液中加入400 μl 核酸释放剂,75 ℃加热10 min 后备用扩增。另外,每批次标本同时扩增试剂盒中4 个病毒阳性定量参考品(4×104~4×107),以及阴性、弱阳性和强阳性质控品,根据其结果对扩增效率进行质控,并分析得出所测样品中病毒DNA 总含量(用基因copies/ml 表示)。
1.2.3 外周血中HCMV-DNA 拷贝数的检测 采用圣湘生物科技股份有限公司提供的HCMV 荧光定量检测试剂盒(PCR 荧光探针法),取患者生化采血管中血清100 μl,加入等体积浓缩液,12 000 r/min离心5 min,弃上清液,加入50 μl 核酸释放剂,与沉淀震荡或移液枪吹打混匀,室温静置10 min,作为待测样本备用扩增。另外,每批次标本同时扩增试剂盒中4 个病毒阳性定量参考品(4×104~4×107),以及阴性、弱阳性和强阳性质控品,根据其结果对扩增效率进行质控,并分析得出所测样品中病毒DNA 总含量(用基因copies/ml 表示)。
1.2.4 T 淋巴细胞亚群检测 取患者EDTA-K2抗凝的全血,T 淋巴细胞亚群应用免疫荧光单克隆抗体标记,采用流式细胞仪检测细胞百分比并进行数据分析。使用CD3+-FITC、CD4+-APC、CD8+-PE、CD16+-PE、CD56+-PE 荧光抗体,检测包括CD3+CD4+T 淋巴细胞、CD3+CD8+T 淋巴细胞和CD4+/CD8+比值及CD16+CD56+自然杀伤(natural killer, NK)细胞。CD3+CD4+T 淋巴细胞正常参考值范围为31%~60%,CD3+CD8+T 淋巴细胞正常参考值范围为13%~41%,CD4+/CD8+比值正常参考值范围为0.71~2.78,CD16+CD56+NK 细胞正常参考值范围为5%~27%。
1.2.5 检测试剂 CFX ConnectTMReal-Time PCR Detection System 购自Bio-Rad Laboratories, BD MultiTEST IMK Kit 购自美国Becton Dickinson 公司,FACS Calibur 购自美国Becton Dickinson 公司,溶血素购自美国Becton Dickinson 公司。
1.3 统计学处理
应用SPSS 23.0 统计软件进行数据分析。计数资料用例数和百分比(%)表示,组间比较采用χ2检验。计量资料用±s 表示,2 组间比较采用t检验。相关性分析采用Pearson 相关分析。P<0.05表示差异有统计学意义。
2 结果
2.1 外周血病毒载量的检测
54 例对照组EBV 感染率为12.96%(7/54),67 例研究组患者EBV 感染率为43.28%(29/67),2 组比较差异有统计学意义(P<0.001)。54 例对照组HCMV 感染率为1.85%(1/54),67 例研究组患者HCMV 感染率为11.94%(8/67),2 组比较差异有统计学意义(P=0.035)。研究组EBV-DNA 载量高于对照组,差异具有统计学意义(P=0.003)。研究组HCMV-DNA 载量与对照组比较差异无统计学意义(P>0.05)。见表1。

表1 研究组与对照组研究对象一般资料及外周血病毒载量比较
2.2 研究组EBV 感染者与非感染者的免疫激活功能比较
检测研究组合并EBV 感染者与非感染者的免疫激活功能的差异性。将研究组患者根据EBVDNA 检测结果分为EBV 阳性组和EBV 阴性组,比较其NEU、LYM 及T 淋巴细胞亚群水平。研究组EBV 阳性组和EBV 阴性组患者外周血NEU 与LYM 水平比较差异无统计学意义(P>0.05)。研究组EBV 阴性组与EBV 阳性组患者外周血CD3+CD4+T 淋巴细胞百分比、CD4+/CD8+比值比较,差异有统计学意义(t=2.440,P=0.010;t=3.070,P=0.005)。研究组EBV 阴性组与EBV 阳性组患者外周血CD3+CD8+T 淋巴细胞百分率与CD16+CD56+NK 细胞百分比比较差异无统计学意义(P>0.05)。见表2。
表2 研究组EBV 阳性组与EBV 阴性组患者NEU、LYM 及T 淋巴细胞亚群水平比较(±s)

表2 研究组EBV 阳性组与EBV 阴性组患者NEU、LYM 及T 淋巴细胞亚群水平比较(±s)
注:EBV 为EB 病毒,NEU 为中性粒细胞,LYM 为淋巴细胞,NK 细胞为自然杀伤细胞
组别EBV 阳性组EBV 阴性组t 值P 值CD16+CD56+ NK 细胞百分比(%)25.07 ± 5.90 18.30 ± 5.30 0.940 0.350例数29 38 NEU(%)47.92 ± 16.33 52.72 ± 16.95 1.080 0.351 LYM(%)39.91 ± 13.95 36.02 ± 18.30 0.790 0.627 CD3+CD4+ T 淋巴细胞百分比(%)16.67 ± 4.40 34.90 ± 5.20 2.440 0.010 CD3+CD8+ T 淋巴细胞百分比(%)33.33 ± 7.80 30.10 ± 3.60 0.450 0.650 CD4+/CD8+比值0.49 ± 0.29 0.93 ± 0.41 3.070 0.005
2.3 研究组EBV 阳性组与EBV 阴性组患者T 淋巴细胞亚群分布差异
研究组剔除明显免疫抑制数据后(EBV 阳性组8 例),分别将CD3+CD4+T 淋巴细胞百分比与CD3+CD8+T 淋巴细胞百分比、CD4+/CD8+比值按分布等比分群,再将患者按各分群数值计量。外周血CD3+CD4+T 淋巴细胞百分比分为0~<20%、20%~<40%和40%~65%,研究组EBV 阴性组与EBV 阳性组CD3+CD4+淋巴细胞百分比均主要分布在20%~<40%,2 组分布差异有统计学意义(χ2=9.269,P=0.010)。外周血CD3+CD8+T 淋巴细胞百分比分为0~<30%、30%~<60% 和60%~90%,研究组EBV阴性组与EBV 阳性组组间CD3+CD8+T 淋巴细胞百分比分布差异无统计学意义(χ2=0.279,P=0.870)。外周血CD4+/CD8+比值分为0~<0.6、0.6~<1.2 和1.2~1.8,EBV 阳性组CD4+/CD8+比值主要分布在0.6~<1.2,差异有统计学意义(χ2=10.367,P=0.006)。见表3。

表3 研究组EBV 阴性组与EBV 阳性组患者的T 淋巴细胞亚群分布情况[例(%)]
2.4 研究组感染EBV 的病毒载量与T 淋巴细胞亚群的相关性分析
研究组感染EBV 的病毒载量与CD3+CD4+T 淋巴细胞水平无相关性(r=0.065,P>0.05);研究组感染EBV 的病毒载量与CD3+CD8+T 淋巴细胞水平呈正相关(r=0.399,P<0.05);研究组感染EBV 的病毒载量与CD4+/CD8+呈负相关(r=-0.626,P<0.05)。见表4、图1。
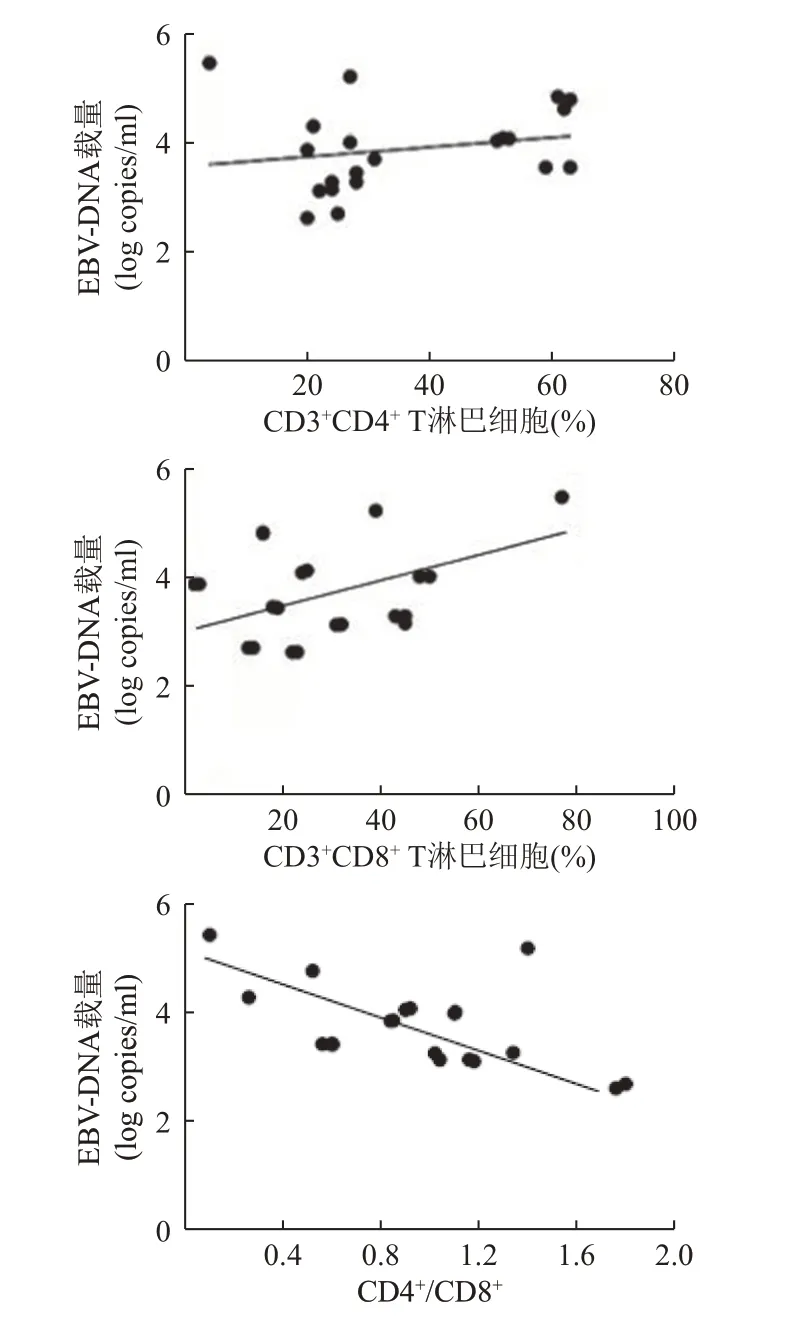
图1 EBV 病毒载量与T 淋巴细胞亚群的线性关系

表4 研究组EBV 阳性组患者EBV 病毒载量与T 淋巴细胞的相关性分析(n=21a)
3 讨论
Allo-HSCT 后的IR 是影响移植相关死亡率的重要因素。免疫功能失衡将会使患者的死亡率和复发率明显升高。据报道,一般固有免疫功能会最先恢复,而获得性免疫功能包括细胞免疫(T 淋巴细胞)、体液免疫(B 淋巴细胞)功能的恢复,需要l~2 年的时间[13]。一般认为,移植后T 淋巴细胞功能的重建主要分如下2 个作用机制:(1)供者成熟T 淋巴细胞的短期生存及扩增;(2)供者造血早期细胞经受者胸腺重新发育出来的T 淋巴细胞[14-15]。因此T 淋巴细胞重建的过程与其本身因素有关,而胸腺发育产生的T 淋巴细胞与移植后CD3+CD4+、CD3+CD8+T淋巴细胞的重建密切相关。
EBV 和HCMV 是2 种常见的人类疱疹病毒。EBV 属于γ 疱疹病毒科,病毒基因组的全部序列是一全长172 282 bp 的DNA[14]。人是EBV 的自然宿主,EBV 感染与宿主免疫状态密切相关。EBV 通常作为一种潜伏性和亚临床感染的状态存在于宿主细胞中,当宿主免疫功能受到抑制时,EBV 被激活并复制。EBV 感染可引起宿主免疫状态的一系列持续改变,直至出现严重的疾病[16-17],同样免疫受损的宿主EBV 激活风险比普通人更高。而值得注意的是,接受allo-HSCT 术后患者的免疫功能重建与EBV 的重新激活或原发感染均有密切的关系[11]。HCMV 属β 疱疹病毒科亚科的双股线性DNA 病毒,是免疫受损患者的重要病原体,其感染是血液病患者的常见并发症,也是导致患者死亡的主要原因之一[18-20]。
T 淋巴细胞亚群是预测移植后IR 程度的一个重要指标,同时大量allo-HSCT 相关报道证实[21-22],其与人类免疫缺陷病毒感染患者相似,CD3+CD4+T淋巴细胞数目与移植后人类疱疹病毒感染率明显相关[23-25]。本研究发现,allo-HSCT 患者感染EBV与HCMV 的阳性率高于对照组,且allo-HSCT 患者感染后EBV-DNA 的拷贝数更高,说明allo-HSCT 患者更容易感染或重新激活HCMV 和EBV。随后对比allo-HSCT 患者中EBV 阳性与EBV 阴性的NEU和LYM 水平,差异无统计学意义,可能与allo-HSCT患者IR 过程相关。随后对T 淋巴细胞亚群与EBV感染的相关性进行分析,发现CD3+CD4+T 淋巴细胞与CD4+/CD8+比值在allo-HSCT 的EBV 阳性患者中更低。模拟免疫功能恢复过程,研究组EBV 阴性组与EBV 阳性组CD3+CD4+淋巴细胞百分比均主要分布在20%~<40%,差异有统计学意义(χ2=9.269,P=0.010)。EBV 阳性组CD4+/CD8+主要分布在0.6~<1.2,差异有统计学意义(χ2=10.367,P=0.006)。恶性血液病allo-HSCT 患者感染EBV 的风险与CD3+CD4+T 淋巴细胞含量与CD4+/CD8+比值具有相关性。随后,EBV-DNA 的载量分析发现,CD3+CD8+T 淋巴细胞与EBV-DNA 载量呈正相关,CD4+/CD8+比值与EBV-DNA 载量呈负相关,原因可能是EBV 的感染导致了CD3+CD8+T 淋巴细胞的水平升高,也是allo-HSCT 患者病毒感染后免疫失衡的表现。
本研究分析了T 淋巴细胞亚群变化来反映免疫功能的变化,探讨了T 淋巴细胞亚群变化与allo-HSCT 患者EBV 感染的相关性,CD3+CD4+T 淋巴细胞为allo-HSCT 患者EBV 感染的一个重要危险因素,而allo-HSCT EBV 感染患者CD3+CD8+T 淋巴细胞含量的增多影响了allo-HSCT 患者免疫系统的重建,进一步加重病毒感染的allo-HSCT 患者免疫功能失衡。同时CD4+/CD8+比值在预测EBV 感染和病毒载量中起着关键的作用。因此,建议allo-HSCT 患者在免疫功能恢复过程中,需要同时监测病毒感染状态和免疫功能的变化。本研究仍有一些不确定因素的存在。检测外周血单个核细胞中的EBV-DNA 比EBV 抗体的检测更有助于诊断EBV 的感染,但部分EBV 携带者的外周血单个核细胞可以检测到低拷贝数的EBV-DNA,因很难区分EBV 的感染状态,所以低拷贝数的EBV-DNA 并没有加入到EBV 阳性的分组中。此外,受本研究样本量的限制,统计分析的偏差可能较大。且未进一步对HCMV 感染allo-HSCT 患者的T 淋巴细胞亚群进行分析,后续会对这一部分进行研究。

