当归芍药散对血管性痴呆模型大鼠炎症反应、神经凋亡、Aβ 转运相关细胞因子的影响
曲美洁 唐咏春 臧运华 于 淼 王潇慧 周喜燕
(1.山东中医药大学第一临床医学院,山东济南 250199;2.青岛大学附属海慈医院,山东青岛 266033)
随着我国老龄人口的增加,血管性痴呆(vascular dementia,VaD)的发病率与日俱增,我国VaD患者占据全球VaD患者总数的四分之一。本病作为血管性认知障碍,是由脑血管疾病引起脑区低灌注引起,以语言、情感功能、认知功能的障碍及记忆力下降为主要临床表现[1]。当前VaD发病机制尚不明确,主要集中在炎症反应、神经元凋亡、氧化应激、神经元细胞钙超负荷等方面[2]。作为仅次于阿尔茨海默病的第二大痴呆类型,也是目前唯一可以预防治疗的痴呆类型[3],本病目前主要的治疗方法是采用多种药物联合,控制炎症反应、保护脑神经[4],但尚未取得理想的治疗效果。因此,临床针对VaD的研究重点主要以早期防治为主,延缓病情进展,减轻VaD患者痛苦。相关研究表明,炎症反应、神经元凋亡等机制是VaD形成的关键[5]。脑组织缺血缺氧,导致局部内皮细胞、神经元等被激活,释放肿瘤坏死因子-α(TNF-α)、核因子κB(NF-κB)等炎性因子,促进脑组织β-淀粉样蛋白(Aβ)产生,引发炎症级联反应,促进细胞凋亡,损伤脑组织,从而引起认知障碍[6-7]。因此,减少炎性因子释放和Aβ产生、抑制神经细胞凋亡、改善神经损伤是防治血管性痴呆发生、发展的关键分子机制。
当归芍药散出自《金匮要略》,具有养血柔肝、健脾祛湿等功效。现代药理学研究证实,当归芍药散中含有抗炎、调节免疫、保护神经等多种有效成分[8],可以起到明显的扩张末梢血管、改善微循环、促进脑代谢活化功效[9],对VaD患者的症状具有较好的改善作用。因此本实验研究基于炎症因子释放、神经元凋亡等因素,通过永久性结扎双侧颈总动脉建立VaD动物模型,观察当归芍药散对VaD模型大鼠空间学习和记忆能力、海马组织细胞凋亡的影响,及其对TNF-α/NF-κB信号通路,以及B淋巴细胞瘤-2基因(Bcl-2)、兔抗人单克隆抗体(Bax)蛋白和低密度脂蛋白受体(LRP1)、糖基化终末产物受体(RAGE)基因的调控作用,探索其可能的作用机制。
1 实验材料
1.1 实验动物 封闭群纯种SPF级SD雄性健康大鼠,体重180~220 g,由青岛市实验动物中心提供,动物饲养及实验过程遵循实验动物3R原则。本研究经青岛大学附属海慈医院伦理委员会审批通过(伦理审批编号:2022HC05LS013)。大鼠在安静环境下分笼饲养,自由饮水、摄食,室温(23±1)℃,相对湿度60%,光线自动控制,每12 h明暗交替,统一使用符合规定的大鼠饲料和水喂养。
1.2 实验药物 当归芍药散,药物组成:当归9 g、白芍48 g、川芎24 g、茯苓12 g、泽泻24 g、白术12 g,所有药品均购自青岛市中医院中药房,且均为道地药材。药液制备方法:药物使用超纯水浸泡1 h后,大火煮沸,转文火再煮沸30 min,收集药液,剩余药材重复上述步骤再次煎煮,收集并混合2次药液,60 ℃浓缩,分装,置于-20 ℃冰箱中保存备用,使用前加热并用超纯水稀释成浓度分别为72 mg/mL(高剂量)、18 mg/mL(低剂量)的药液。
尼莫地平片,拜耳医药保健有限公司生产,批号:H20003010,规格20 mg,研磨成粉,用超纯水配置成浓度16.8 mg/mL的溶液,置于-20 ℃冰箱备用。
1.3 主要试剂 二甲苯、无水乙醇、碳酸锂、冰醋酸、30%H2O2(批 号:10023418、10009218、20022818、10000218、10011218),购自国药集团化学试剂有限公司;苏木素伊红(批号:G1004),购自武汉塞维尔生物科技有限公司;Bax兔抗人单克隆抗体(1∶1000,批号:PAB46088)、兔Bcl-2 单克隆抗体(1∶1000,批号:A00040-1),购自武汉博士德生物工程有限公司;兔抗大鼠TNF-α抗体、兔抗大鼠NF-κB抗体,购自英国abcam公司;TNF-α酶联免疫吸附(ELISA)试剂盒、NF-κB ELISA试剂盒、蛋白Marker、DAB显色液、2×Tap聚合酶链式 反 应(PCR)master Mix(批 号:QYH-12018、P12103、G1022、G3302-01),购自武汉塞维尔生物科技有限公司;PVDF转移膜、化学发光试剂(批号:IPVH00010、WBKLS0500),购自上海未熹生物科技有限公司;DAB浓缩试剂盒、封闭山羊血清、终止液(批号:DA1010、SL038、C1058),购自北京索莱宝科技有限公司;20×Tris-EDTA修复液、TBE电泳缓冲液(批号:G1203、G3002),购自武汉塞维尔生物科技公司;PBS缓冲液,购自山东西亚化学有限公司;枸橼酸缓冲液(批号:BL604A),购自福州奥研实验器材责任公司;溴酚蓝指示剂(批号:115-39-9),购自湖北兴琰新材料科技有限公司。
1.4 主要仪器 正置显微镜、石蜡切片机(型号:DM1000、RM2235),购自徕卡纤维系统有限公司;移液器(型号:P100、P200),购自吉尔森P型移液器公司;恒温烘箱(型号:DHG-9023A),购自上海一恒科学仪器有限公司;摊片烤片机、自动组织脱水机(型号:TKD-TK、TKD-TSF),购自湖北康强医疗器械有限公司;稳压DNA电泳仪(型号:mini protean 3 cell),购自伯乐生命医学产品有限公司;恒温烘箱(型号:TY-HX),购自台裕科技公司;水迷宫(型号:BW-MWM101),购自上海软隆科技发展有限公司;实时免疫荧光PCR仪(型号:MiniAmp),购自美国ABI公司;全自动化学发光仪(型号:HISCL-5000),购自上海继圣医疗器械有限公司;离心机(批号:SMP-2),购自武汉塞维尔生物科技有限公司。
2 实验方法
2.1 造模与分组 SD大鼠适应性饲养2周后,行Morris水迷宫测试,剔除120 s内找不到平台者。测试结束3 d后采用双侧颈总动脉永久性结扎法建立VaD动物模型[10]:造模前禁食12 h,注射1%戊巴比妥钠40 mg/kg腹腔麻醉,确保手术期间大鼠有自主呼吸;保持仰卧姿势,固定头部,去毛备皮,消毒后沿颈正中切开,分离出双侧颈总动脉后选用0号慕丝线结扎,缝合伤口。另取12只SD大鼠作为假手术组,假手术组大鼠不结扎颈总动脉,只做皮肤切口和组织分离处理后缝合皮肤。手术后各组大鼠均予青霉素10万单位肌注3 d防感染,观察大鼠待活动正常后放回实验室继续喂养。术后3 d,所有造模大鼠再次行水迷宫测试,逃避潜伏期>55 s,跨越平台频率<1 次/60 s,且出现精神较差、反应迟钝、活动减少、舌质暗红等表现者,表明造模成功。将造模成功的大鼠随机分为模型组、阳性对照组和当归芍药散低、高剂量组,每组12只。
2.2 给药 造模完成1 周后开始灌胃给药。阳性对照组灌胃给予尼莫地平片1.68 g/(kg·d),当归芍药散低、高剂量组分别灌胃给予中药溶液1.8、7.2 g/(kg·d),假手术组、模型组每日灌胃给予等体积蒸馏水。各组均每日灌胃1次,灌胃体积为1 mL/10 g,连续4周。
2.3 取材 末次灌胃后次日,每组随机取8只大鼠进行Morris水迷宫测试;测试结束后次日,每组大鼠再随机取8只,腹腔注射1%戊巴比妥钠40 mg/kg麻醉,于腹主动脉处取血,离心分离血清,于-20 ℃冰箱中保存拟用于ELISA法检测;随后迅速断头处死大鼠,取部分海马组织,4%多聚甲醛固定,石蜡包埋,用于免疫组化、苏木素-伊红(HE)染色;另取部分海马组织放入冻存管,立即转移到-80 ℃冰箱中冻存,用于实时荧光定量PCR法检测。
2.4 指标检测
2.4.1 Morris水迷宫测试行为能力 末次灌胃结束后,各组大鼠禁食禁水24 h,每组随机选取8只,采用Morris水迷宫测试检测各组大鼠的学习记忆能力。测试包括两项:(1)定位巡航试验检测逃避潜伏期:每只大鼠连续训练4 d,按照设计好的顺序将其面向池壁,从各入水口放入水中,记录60 s内找到平台的实际时间(即逃避潜伏期),如果大鼠在60 s内找不到平台,则由实验者引导找到平台,记录逃避潜伏期为60 s。每次找到平台后,均使其于平台停留20 s。(2)空间探索试验检测穿越平台数:定位巡航试验结束后次日,使大鼠面向池壁,轻轻放入水中,入水口选在平台对角处,测试时间60 s,记录其穿越平台位置的次数,判断大鼠记忆存储和再现能力。
2.4.2 HE染色检测海马神经元组织病理形态变化 取浸泡于4%多聚甲醛中固定的各组大鼠海马组织,按常规步骤脱水浸蜡包埋,沿矢状面切片,厚度约4 μm,严格参照试剂盒说明进行HE染色,中性树脂胶封片,光镜下观察海马组织病理形态,评价神经元损伤程度。
2.4.3 免疫组化法检测海马组织Bcl-2、Bax蛋白表达 取每组8只大鼠海马组织按常规步骤脱水、浸蜡、包埋后切片,厚度4 μm,65 ℃烤片1 h后脱蜡水化;用枸橼酸缓冲液进行抗原修复;3%H2O2湿盒孵育10 min,PBS缓冲液冲洗,阻断后置于封闭山羊血清中室温封闭,分别滴加Bax(稀释比为1∶200)、Bcl-2抗体(稀释比为1∶100),4 ℃冰箱孵育过夜,复温45 min后滴加二抗,DAB显色后,经苏木精复染、脱水、透明、中性树胶封片。于光学显微镜下拍照观察,并采用Image J软件分析OD值。
2.4.4 ELISA法 检 测 大 鼠 血 清TNF-α、NF-κB含量 取每组8只大鼠血清,按ELISA试剂盒说明书上的操作步骤进行检测,于多功能酶标仪450 nm波长处读取OD值并进行分析,根据标准曲线计算大鼠血清TNF-α、NF-κB含量。
2.4.5 实时荧光定量PCR法检测海马组织LRP1 mRNA、RAGE mRNA表达 取冻存的各组大鼠海马组织约100 mg,使用Trizol法提取细胞总RNA,电泳确定RNA完整性,并检测RNA纯度及浓度,将RNA逆转录合成cDNA,进行实时定量PCR,严格按照试剂盒说明书操作,以适量cDNA进行PCR扩增反应,反应条件为:95 ℃预变性持续1 min,95 ℃变性持续5 s,60 ℃退火持续10 s,72 ℃延伸30 s,连续循环40次。系列反应结束后得到Ct值,采用2-△△Ct计算mRNA相对表达量。引物序列见表1。
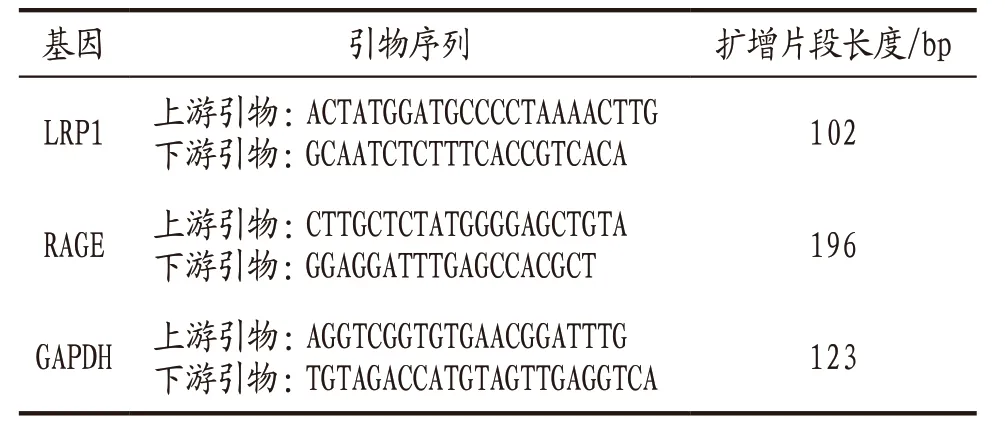
表1 大鼠海马组织LRP1、RAGE mRNA引物序列
2.5 统计学方法 采用SPSS 26.0软件对数据进行统计学分析。本研究所有计量资料均满足正态分布,采用均值±标准差(±s)表示,经检验(检验水准为0.05),资料均满足方差齐性,采用单因素方差分析,组间比较采用LSD法。以P<0.05表示差异具有统计学意义。
3 实验结果
3.1 各组大鼠行为能力比较 定位巡航试验结果显示:模型组大鼠每日逃避潜伏期均明显长于假手术组(P<0.01);各给药组大鼠每日逃避潜伏期均明显短于模型组(P<0.01),其中当归芍药散高剂量组每日逃避潜伏期均明显短于低剂量组和阳性对照组(P<0.05,P<0.01),当归芍药散低剂量组第4天逃避潜伏期与阳性对照组比较差异无统计学意义(P>0.05)。空间探索试验结果显示:模型组大鼠穿越平台次数明显少于假手术组(P<0.01);各给药组大鼠穿越平台次数均明显多于模型组(P<0.05,P<0.01),其中当归芍药散高剂量组穿越平台次数明显多于低剂量组和阳性对照组(P<0.01),当归芍药散低剂量组穿越平台次数与阳性对照组比较差异无统计学意义(P>0.05)。详见表2。
表2 各组大鼠Morris水迷宫测试行为能力比较(±s)

表2 各组大鼠Morris水迷宫测试行为能力比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与阳性对照组比较,#P<0.05,##P<0.01;与当归芍药散低剂量组比较,☆☆P<0.01。
逃避潜伏期/s穿越平台数/次第1天 第2天 第3天 第4天假手术组 8 22.36±1.00 13.39±0.84 10.93±0.37 9.63±0.75 2.72±0.46模型组 8 56.43±3.09** 48.20±3.59** 42.18±3.58** 39.17±2.68** 1.35±0.09**阳性对照组 8 29.44±2.15△△ 27.43±1.62△△ 20.52±1.24△△ 12.08±1.08△△ 1.51±0.11△△当归芍药散低剂量组 8 42.44±2.10△△## 37.03±1.88△△## 28.08±1.30△△## 12.03±0.68△△ 1.40±0.05△当归芍药散高剂量组 8 25.71±2.07△△##☆☆ 19.08±2.60△△##☆☆ 13.61±1.58△△##☆☆ 9.94±0.94△△#☆☆ 2.89±0.32△△##☆☆组别 动物数/只
3.2 各组大鼠海马组织病理形态比较 假手术组大鼠海马组织CA1区细胞数量多,体积大,排列整齐,结构正常,边界清晰,胞膜、核膜清晰,胞核明显。模型组大鼠海马组织CA1区细胞数量明显减少,排列稀疏,部分细胞肿胀,结构不齐,胞核变小、固缩、凋亡,细胞膜、核膜界限不清。与模型组比较,各给药组大鼠神经元病理改变均较轻,其中当归芍药散高剂量组大鼠海马组织CA1区细胞数量显著多于模型组,排列分布相对齐整,结构形态基本正常。详见图1。

图1 各组大鼠海马组织病理形态(HE染色,×100)
3.3 各组大鼠海马组织Bax、Bcl-2蛋白表达比较 模型组大鼠海马组织Bcl-2 蛋白相对表达量、Bcl-2/Bax值均明显高于假手术组(P<0.01),Bax蛋白相对表达量明显低于假手术组(P<0.05)。各给药组大鼠海马组织Bcl-2 蛋白相对表达量、Bcl-2/Bax值均明显低于模型组(P<0.01),Bax蛋白相对表达量明显高于模型组(P<0.01)。当归芍药散高剂量对上述指标的改善作用显著优于低剂量和阳性药物(P<0.01),当归芍药散低剂量组Bcl-2 蛋白相对表达 量、Bcl-2/Bax值 与 阳 性 对照组比较差异均无统计学意义(P>0.05)。详见图2、表3。
表3 各组大鼠海马组织Bax、Bcl-2 蛋白相对表达量及Bcl-2/Bax值比较(±s)
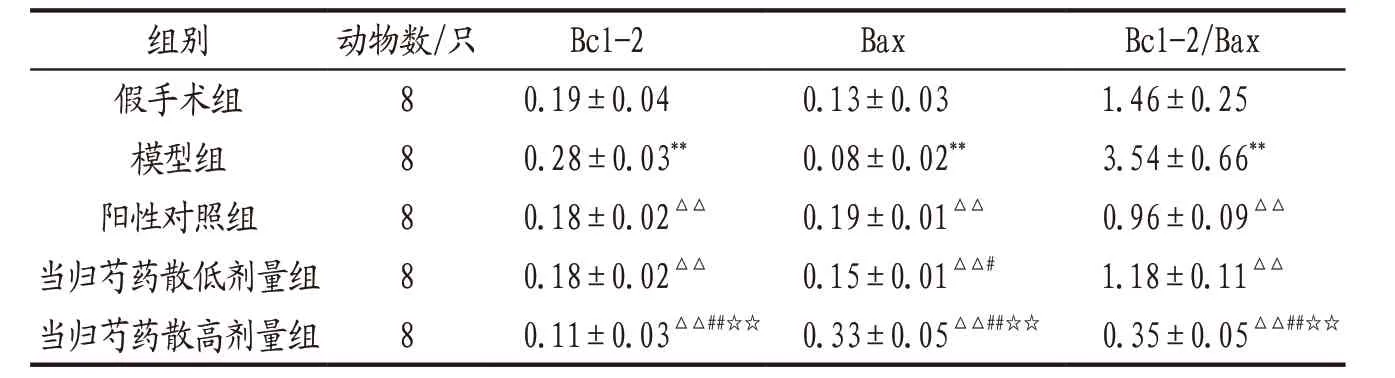
表3 各组大鼠海马组织Bax、Bcl-2 蛋白相对表达量及Bcl-2/Bax值比较(±s)
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,△△P<0.01;与阳性对照组比较,#P<0.05,##P<0.01;与当归芍药散低剂量组比较,☆☆P<0.01。
组别 动物数/只 Bcl-2 Bax Bcl-2/Bax假手术组 8 0.19±0.04 0.13±0.03 1.46±0.25模型组 8 0.28±0.03** 0.08±0.02** 3.54±0.66**阳性对照组 8 0.18±0.02△△ 0.19±0.01△△ 0.96±0.09△△当归芍药散低剂量组 8 0.18±0.02△△ 0.15±0.01△△# 1.18±0.11△△当归芍药散高剂量组 8 0.11±0.03△△##☆☆ 0.33±0.05△△##☆☆ 0.35±0.05△△##☆☆
3.4 各组大鼠血清TNF-α、NF-κB含量比较 模型组大鼠血清TNF-α、NF-κB含量均显著高于假手术组(P<0.01);各给药组大鼠血清上述指标含量均显著低于模型组(P<0.01),其中当归芍药散高剂量组大鼠上述指标水平均显著低于低剂量组和阳性对照组(P<0.01)。详见表4。
表4 各组大鼠血清TNF-α、NF-κB含量比较(±s)

表4 各组大鼠血清TNF-α、NF-κB含量比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,△△P<0.01;与阳性对照组比较,##P<0.01;与当归芍药散低剂量组比较,☆☆P<0.01。
组别 动物数/只 TNF-α/(pg/mL) NF-κB/(pg/mL)假手术组 8 50.16±10.10 26.81±4.11模型组 8 339.05±36.32** 180.13±11.64**阳性对照组 8 176.08±11.14△△ 90.97±5.32△△当归芍药散低剂量组 8 236.96±14.9△△## 118.58±7.70△△##当归芍药散高剂量组 8 117.90±19.34△△##☆☆ 59.94±6.76△△##☆☆
3.5 各组大鼠海马组织LRP1、RAGE mRNA相对表达量比较 模型组大鼠海马组织LRP1 mRNA相对表达量显著低于假手术组(P<0.01),RAGE mRNA相对表达量显著高于假手术组(P<0.01)。各给药组大鼠海马组织LRP1 mRNA相对表达量显著高于模型组(P<0.01),RAGE mRNA相对表达量显著低于模型组(P<0.01)。当归芍药散高剂量对大鼠海马组织上述基因表达的改善作用显著优于低剂量和阳性药物(P<0.05,P<0.01),当归芍药散低剂量对大鼠海马组织LRP1 mRNA表达的提升作用显著优于阳性药物(P<0.01)。详见表5。
表5 各组大鼠海马组织LRP1 mRNA、RAGE mRNA相对表达量比较(±s)

表5 各组大鼠海马组织LRP1 mRNA、RAGE mRNA相对表达量比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,△△P<0.01;与阳性对照组比较,#P<0.05,##P<0.01;与当归芍药散低剂量组比较,☆☆P<0.01。
组别 动物数/只 LRP1 mRNA RAGE mRNA假手术组 8 8.55±0.24 0.20±0.02模型组 8 0.85±0.07** 13.18±1.50**阳性对照组 8 1.66±0.31△△ 1.00±0.07△△当归芍药散低剂量组 8 2.10±0.12△△## 7.92±0.52△△##当归芍药散高剂量组 8 9.79±0.53△△##☆☆ 0.30±0.03△△#☆☆
4 讨论
研究表明,VaD疾病进程与NF-κB、TNF-α等炎性因子激活炎症反应,Bax、Bcl-2等凋亡因子加速神经凋亡,LRP1、RAGE等转运因子调控Aβ沉积等密切相关,治疗本病则应基于改善Aβ诱导的胆碱能神经元凋亡,调节Aβ沉积,抑制炎症信号传递,增强血流灌注,在一定程度上减少脑组织损伤。
血管性痴呆属于中医学“痴呆”范畴,《杂病源流犀烛·中风源流》中提及“中风后善忘”。本病病机复杂,可因五脏失和、脑窍失养、神失所养、神机失用而发病。现代医家基于前人经验提出本病病因病机为髓海不足、脾肾不足、肝气郁结、痰浊蒙窍等,以补髓益智、补益脾肾、行气化郁等为治则,祛邪扶正,改善患者症状。当归芍药散由当归、白芍、茯苓、白术、泽泻、川芎六味药物组成。方中川芎、当归、白芍补益气血,茯苓、泽泻、白术祛水化湿,其中白芍兼疏肝化瘀[11]。诸药合用,开敛结合,走守并进,以肝脾两脏入手,健脾益气、养血柔肝,增强患者正气,祛除积留体内湿瘀之邪[12]。VaD患者多因肝脾不足、痰瘀阻滞而脑窍不通、神机失养,故以当归芍药散补益肝脾、化痰祛瘀。现代药理学研究发现,当归芍药散可通过调控凋亡因子、抑制炎症反应和减少Aβ沉积等途径,调控炎症介质分泌,发挥抗炎作用,延缓细胞凋亡,调节免疫[13-15],与现代医学药物治疗VaD方向一致。
细胞凋亡受Bcl-2、Bax等凋亡因子影响[16],控制线粒体膜的通透性,调节凋亡激活物的释放,激活通道,Bax与Bcl-2形成易聚体,两者协作调控细胞凋亡,因此逆转两种蛋白表达,可减轻脑损伤,一定程度上起到修复脑神经的作用[17-18]。Aβ对神经系统的毒性作用导致血管壁淀粉样变,进而导致血管硬化、弹性变差,增加血管壁破裂以及血栓形成风险,甚至诱使神经元过早凋亡。相关实验研究发现,Aβ沉积抑制突触生长,导致神经变性,降低神经元存活率,进而推动VaD病情进展[19]。LRP1作为大脑中参与代谢的主要受体,广泛存在于神经元细胞中,不仅参与脂质代谢,而且是清除Aβ的重要转运体,其功能水平降低与认知性障碍加重密切相关[20];RAGE作为膜蛋白,则是通过介导多种激酶,激活炎症信号通路,引起细胞凋亡坏死[21]。LRP1与RAGE均为Aβ重要转运蛋白,参与调节Aβ沉积[22],抑制神经胶质细胞激活、神经炎症发生、神经细胞凋亡过程[23]。NF-κB作为缺血损伤反应最早的关键因子,同时又是起关键作用的核转录因子[24],在机体炎症反应和细胞的分裂分化和成熟等方面发挥重要作用[25],脑缺血组织损伤激活NF-κB[26],促进TNF-α表达[27],若抑制NF-κB信号通路发挥作用,减少神经炎症反应和内质网应激,保护神经元功能,则能延缓VaD疾病进程[28]。
本研究结果表明,模型组大鼠学习记忆能力明显异常,海马组织神经元损伤,血清TNF-α、NF-κB表达增加,海马组织Bcl-2蛋白表达增加,Bax蛋白表达降低,Bcl-2/Bax值增加,LRP1 mRNA表达降低,RAGE mRNA表达增加,炎症、凋亡及Aβ转运相关细胞因子均出现异常表现。经当归芍药散、尼莫地平治疗后,VaD模型大鼠学习记忆能力显著提高,海马组织神经元细胞数量、形态明显恢复,上述细胞因子得到显著改善,其中当归芍药散高剂量效果更为明显,显著优于低剂量和阳性药物尼莫地平。
综上,当归芍药散对VaD模型大鼠有一定的治疗作用,且可显著改善VaD模型大鼠海马组织细胞形态,其可能的作用机制:通过抑制TNF-α、NF-κB表达缓解大鼠海马组织炎症反应,一定程度上减少脑组织损伤,提高认知水平;通过调节Bcl-2、Bax凋亡因子延缓细胞凋亡,改善VaD神经损伤,起到脑保护作用;通过激活LRP1、抑制RAGE两种转运蛋白,促进Aβ清除,减少Aβ沉积,促进海马突触长时程增强,进而保护神经元,促进神经重塑。且当归芍药散上述作用表现出一定的剂量依赖性。由于本研究实验动物样本数较少,药物浓度梯度不足,下一步将增加样本量,丰富中药浓度梯度,并进一步分析当归芍药散有效成分,探索其他作用靶点,深入研究其作用机制,从而更好地指导临床运用。

