角膜缘干细胞缺乏动物模型建立方法研究进展
郭笑霄 综述 李新宇 审校
华中科技大学同济医学院附属同济医院眼科,武汉 430030
角膜缘干细胞缺乏(limbal stem cell deficiency,LSCD)是由于角膜缘干细胞(limbal stem cell,LSC)数量减少和/或功能异常导致的角膜上皮稳态失衡,临床上表现为角膜上皮细胞结膜化、持续或反复的角膜上皮缺损,可伴有角膜新生血管、眼表炎症反应或角膜瘢痕的形成,最终可导致角膜盲[1]。根据病因,LSCD分为获得性LSCD和遗传性LSCD两大类,目前在我国眼表化学烧伤和热烧伤是LSCD的首要病因。根据角膜上皮结膜化的受累范围是否为全周累及,LSCD可分为部分性和完全性两大类。根据临床检查发现的角膜和角膜缘受累程度,LSCD国际共识进行了临床分期,其中病变未累及视轴或角膜中央直径5 mm区域为LSCD Ⅰ期,累及角膜中央直径5 mm区域为LSCD Ⅱ期,累及全角膜为LSCD Ⅲ期。LSCD的分类及分期对于选择治疗方式和设计手术方案至关重要[1]。目前,LSCD的治疗主要是通过手术行角膜缘干细胞移植(limbal stem cell transplantation,LSCT),由于LSCT需要切取健康的角膜缘组织进行移植,该治疗方式本身会对供给处角膜缘造成创伤;此外,对于单次LSCT未能治愈的LSCD,需多次重复手术,而健康的角膜缘组织来源比较受限。因此,利用培养的LSC进行移植也被推荐用于LSCD的治疗[2-4],但远期效果并不明确,依然面临着诸多挑战[5]。因此,需要进行更为全面的基础研究,对LSCD的发生机制及发展演变过程进行更为深入的探索。而建立理想的动物疾病模型是对LSCD进行细胞水平和分子水平研究以及评价新的治疗措施必不可少的方法和手段。近年来,国内外许多研究对LSCD的造模方法进行了报道,涉及了不同动物种类、不同干预方式。本文综述了近年来LSCD研究常用的动物模型,总结分析动物模型的建立方法、优缺点以及用于研究LSCD的动物和类型选择,以期为后续研究人员构建合适模型提供参考。
1 LSCD动物模型的建立方法
1.1 机械法造模
1.1.1手术刀等工具刮削造模 1971年,Davanger等[6]首次提出LSC位于角膜缘组织Vogt栅栏内,早期研究LSCD的方法主要通过机械方法去除角膜缘组织。手术切除角膜缘上皮,钝刀片、钝铲或新月形刀去除角膜缘组织都曾被用于制作LSCD模型[7-10]。
Gipson等[8]最早开始利用钝刀片刮除角膜上皮及角膜缘组织,用于研究角膜上皮的迁移愈合情况。刘先宁等[11]用机械法进行新西兰白兔LSCD造模,研究者提出了2种造模方法:(1)单纯去除角膜缘内外宽约2 mm、深100~150 μm的角膜缘浅板层组织;(2)在上述方法的基础上去除中央角膜深100~150 μm的浅板层组织。该研究显示,单纯去除角膜缘浅板层组织的动物模型成功率为40%,造模成功需耗时(29.5±1.3)d;而角膜缘联合角膜中央浅板层组织共同去除的造模成功率为100%,造模成功需耗时(15.8±0.8)d;因此,2种方法都证实了机械法进行兔LSCD造模的可行性,此外角膜缘联合中央角膜浅板层组织去除既可提高造模成功率,又可缩短造模时间。随后,柯红琴等[12]也采用角膜缘联合中央角膜浅板层组织的方法对日本大耳白兔进行造模,该团队切除了厚100~150 μm的角膜缘内1 mm、外2 mm的角膜缘浅板层以及厚约100 μm的中央角膜浅板层组织,在手术2周时造模成功率为12.5%,但在5周时可提高到87.5%。
以上2个研究团队使用了相同的方法造模,但是造模成功率和成模时间有明显差异。分析产生差异的可能原因为:(1)不同的研究团队、不同的操作者在造模过程中操作细节有差异;(2)2个团队使用的动物品种不同,而不同物种的角膜厚度可能存在一定差异。据报道,日本大耳白兔的中央角膜厚度为(382.0±25.1)μm[13],而新西兰白兔中央角膜厚度为(356.8±25.6)μm[14]。故在切除相同厚度的浅板层角膜缘组织的情况下,新西兰白兔损失的角膜组织更多,可能对模型的成功有一定影响。
为了对角膜缘及中央角膜进行规则地切削并保证切削后角膜表面的平整性,蔺琪等[15]先借助9 mm环钻标记并去除新西兰白兔中央角膜上皮,然后再向周边薄板层剖切至角膜缘外1 mm,深度达浅基质层,为0.1~0.2 mm,并环形剪除,该研究造模成功率为84.2%,较刘先宁等[11]研究的造模成功率稍低,这可能与中央角膜切削深度不同有关。
此造模法应用的时间较久,建模方法成熟,可靠性高;对基质的损伤小,角膜基质微环境保存良好。该系列方法缺点包括:(1)钝刮刀等机械去除角膜上皮的方法易导致损伤不均匀,尤其近角膜缘处。该方法的改良可以参考蔺琪等[15]提出的环钻划界加板层切除法,以期得到更平整的角膜。(2)手术中不可避免地残留有LSC和角膜上皮细胞,残留细胞借助于基底层重建了完整的角膜上皮层,致使一部分动物模型制作失败[9,16]。(3)对术者的技巧要求高,增加了可重复性难度。在进行角膜缘切除术时,可能导致基质损伤、前房穿孔,造成严重的机械损伤。
1.1.2旋转毛刺工具造模 使用旋转毛刺工具(AlgerBrush Ⅱ)是目前制作角膜损伤的首选方法[17-19]。Li等[20]将AlgerBrush Ⅱ旋转毛刺作为诱导新西兰白兔LSCD的造模工具,同时与手术和化学法进行了比较,结果发现旋转毛刺工具造模更安全、更有效。其具体方法:每次清创前在距角膜缘约1.5 mm处进行全周结膜切开,使用1 mm尖头钻的AlgerBrush Ⅱ进行360°角膜缘切除,然后使用2.5 mm圆头钻去除剩余的角膜上皮,或直接用2.5 mm圆形钻头360°去除浅层角膜缘及整个角膜上皮;最后用生理盐水冲洗眼表,使用润湿的棉签去除眼表的碎屑。但是,Afsharkhamseh等[21]利用毛刺旋转工具制作小鼠LSCD模型时,发现必须经过多次重复清创,才能彻底地去除角膜缘细胞。
此造模法的优点是操作相对简单、一致性较好、稳定时间较长[16]。相比机械刮削工具损伤更均匀,同时可以去除基底膜;相比化学造模法,对角膜基质层或其他眼内结构的损伤小,术后出现炎症和瘢痕的可能性小,更有利于结果的判读及评估[22]。其缺点是有细胞残留可能,需反复多次清创;同时,毛刺的速度、放置的角度、施加在角膜上的压力以及停留的时间等因素对于实验结果影响较大,这也可能是不同研究结果之间存在差异性的潜在原因之一[23]。
1.2 灼烧法造模
通过灼烧破坏角膜缘组织是建立热损伤诱导LSCD的一种方法。Majo等[24]为了模拟小鼠的LSCD,对野生型小鼠的角膜缘组织进行灼烧,由于灼烧的不可控性,导致角膜缘上皮及基质层完全受损,甚至伤及睫状体。随后,Afsharkhamseh等[16]将灼烧法进一步改进并与AlgerBrush Ⅱ工具相结合,建立C57BL/6J小鼠LSCD模型。该研究利用AlgerBrush Ⅱ去除角膜缘和中央角膜上皮后,使用一种可调节的电烧灼器对角膜缘进行受控热损伤,并通过研究得出致角膜损伤但又不穿孔的最佳温度为(50±1)℃。其具体操作方法是把一根弯曲的长约1.5 cm的实心铜线一端绑在灼烧器上,形成一个细且钝的尖端,使其加热150 ml的水,通过测量水温来间接测量尖端的温度,然后作用于角膜缘2~3 s来诱发角膜缘损伤。
此造模方法较为复杂,操作难度较大;并且由于灼烧导致的热损伤可加重角膜混浊的程度,模型的损伤也更严重,故此模型更适合用于模拟基质损伤及愈合反应等研究。
1.3 化学法造模
1.3.1碱烧伤法造模 化学性烧伤角膜组织是制作LSCD实验模型的常用方法之一,尤其是使用碱性试剂[25-26]。其主要原理是破坏角膜缘和角膜上皮及其基底层,使残留的LSC不能再次建立完整的角膜上皮层。
NaOH是化学造模法中常用的一种试剂,目前常用于眼表灼伤的NaOH浓度主要为1 mol/L和0.5 mol/L,处理时间为20、30、45和60 s,浓度和时间根据模型动物角膜厚度会有一定区别[27]。卢建民等[28]利用圆形滤纸片对新西兰白兔进行角膜缘干细胞缺损模型的制备。具体方法:全身麻醉后,将直径8 mm圆形滤纸片用1 mol/L NaOH浸湿,沥干后覆盖于角膜中央1 min,生理盐水冲洗角膜表面和结膜囊3 min,再用无菌干棉球吸干,虹膜复位器刮拭角膜表面,去除全部角膜上皮层。出现角膜深实质层水肿、混浊呈瓷白色,虹膜纹理窥不清及角膜缘缺血视为造模成功。郭滨等[29]将18只新西兰白兔随机分为3个组,分别用外径为16 mm、内径为8 mm的1 mol/L NaOH溶液浸泡的环形滤纸在角膜缘贴附60 s并结膜囊内滴入30 s、角膜缘贴附30 s并结膜囊内滴入30 s、仅角膜缘贴附30 s,结果发现结膜囊滴入NaOH溶液的组均不同程度地出现了角膜穿孔、眼球萎缩、睑球粘连等并发症;而仅进行角膜缘碱烧伤的兔在第4周行激光扫描共聚焦显微镜检查发现角膜缘栅栏结构消失、角膜结膜化,角膜上皮中出现杯状细胞。研究证明了环形滤纸浸润NaOH溶液烧伤角膜缘组织,可以成功构建LSCD动物模型,同时也表明联合结膜囊滴入NaOH溶液可导致广泛的组织损伤及坏死。不同物种之间对碱烧伤造模引起的LSCD特征中存在一定差异。Kethiri等[30]通过单眼滴入1 mol/L NaOH溶液进行碱烧伤30 s,然后用生理盐水冲洗,并将C57BL/6小鼠和新西兰白兔的LSCD碱烧伤模型与化学烧伤诱导的人LSCD角膜进行比较,结果显示小鼠和兔角膜新生血管发生率分别为50%和67%,而人角膜全部出现新生血管;小鼠和兔角膜均有67%可能出现基质炎症反应,而人角膜则全部出现炎症表现;三者分别有50%、50%和83%的角膜中存在杯状细胞。研究数据表明,小鼠、兔和人在碱烧伤造模引起的角膜血管化程度、炎症和杯状细胞形成等结果中存在显著差异。因此,在利用动物模型获取LSCD结果类推到人眼时,要注意这些差异的影响。
Zhang等[27]利用NaOH烧伤法造模,同时与机械法切除角膜缘及角膜上皮制作的完全性兔LSCD模型进行了比较,结果表明碱烧伤组的角膜混浊、新生血管化程度较机械切除组严重,适合用于与新生血管相关的研究;而角膜缘机械切除联合上皮刮除对角膜基质的损伤较小,角膜基质的微环境保存良好,更适合于研究干细胞的分化、转化、干细胞相互作用、微环境及干细胞替代疗法。
KOH溶液与NaOH同为强碱性物质,也是常被用于造模的化学试剂品之一。Li等[3]采用1 mol/L KOH溶液浸泡后的直径4 mm的圆形滤纸灼烧颞上方角膜30 s,随后立即用100 ml生理盐水冲洗,建立兔部分性LSCD模型;高晴琴等[31]也用了同样的方法建立新西兰白兔部分性LSCD模型,除麻醉意外死亡的实验兔外,所有实验动物均造模成功,且在观察的2个月时间内,未出现角膜穿孔情况。该研究团队还将此方法用于建立C57小鼠的LSCD模型,将直径为3 mm的圆形滤纸片用1 mol/L KOH溶液浸润后,作用于中央角膜表面30 s,用20 ml生理盐水充分冲洗,麻醉后顺利苏醒的24只小鼠,仅2只分别在第7天和第14天出现了角膜穿孔,其余22只发生不同程度完全性LSCD,诱导成功率为92%[31]。
碱烧伤法造模的优点是操作简单,易实施,病因与临床病例的吻合度较高;但此方法的一个重要缺点是结果的不可预测性,因为难以控制化学损伤的深度及程度,存在对深层基质或周围组织造成溶解、穿孔或损伤的风险,难以保证模型的统一以及避免碱烧伤的后续影响。
1.3.2苯扎氯铵造模 化学灼伤和机械去除角膜缘组织诱导动物获得的LSCD模型,均属于急性角膜破坏,对局部组织损伤过重,伴随较重的炎症反应。然而,对于需要研究眼表慢性及长期损伤形成LSCD的模型并不合适,可考虑采用目前研究较多的苯扎氯铵溶液造模。
苯扎氯铵是滴眼液中常用的防腐剂,由于存在细胞毒性,长期使用含防腐剂的外用药物是多种眼表疾病的潜在风险,往往导致角膜上皮、内皮、结膜以及支配神经出现不同程度的损伤[32]。Pauly等[33]系统地研究了长期给予不同剂量的苯扎氯铵溶液对大鼠眼表的毒性作用,观察到了角膜上皮侵蚀、炎症反应以及新生血管的形成。Lin等[34]将苯扎氯铵配置成不同浓度的滴眼液点眼,分别为0.1%、0.25%、0.5%,每天4次,持续28 d,结果显示使用0.5%的苯扎氯铵溶液成功诱导BALB/c小鼠出现了LSCD的典型表现,包括角膜新生血管、基质炎症反应和弥漫的上皮缺损等,证实了长期给予防腐剂苯扎氯铵可以诱导BALB/c小鼠LSCD。
此造模法虽然操作简单,但造模周期较长,时间和经济成本较高,比较适合于需要探索LSCD慢性发展及机制演变过程的研究。此外,该造模方法所造成的病变部位难以完全集中在角膜缘及角膜,可能造成整个眼表结构的损伤。
1.3.3硫芥子气造模 硫芥子气是一种能对人体皮肤、呼吸道及眼等器官产生损害的烷化剂,可以液滴态、雾态、蒸气态长期储存,损伤眼部时可导致角膜上皮反复糜烂、延迟不愈,故也被用于LSCD的研究[35-36]。Kadar等[36]将新西兰白兔眼暴露于10 μl纯度超过95%的硫芥子气蒸气中4 min,在暴露后的4 h~4周的不同时间点对眼进行组织学和分子生物学评估,结果发现与角膜中央上皮的损伤不同,LSC在硫芥子气暴露后的急性期并未受到损伤,而是在暴露2周后,干细胞逐渐丢失,表现出LSCD的典型症状,这表明与硫芥子气眼部毒性相关的LSCD并非源自直接的细胞毒性,而是由于角膜缘基质的病变致使微环境异常,从而导致细胞损伤。此造模方法目前实际应用较少,主要用于再现士兵在战争中眼部损伤情况的相关研究。
1.4 化学+手术切除法造模
手术切除角膜缘可以与正庚醇、甲醇等有机溶剂相结合,首先利用有机溶剂去除角膜上皮,再通过手术去除角膜缘[37]。Chen等[7]使用正庚醇联合机械方法进行全角膜上皮清除,发现不同持续时间的正庚醇处理方法可导致不同程度的角膜结膜化及血管化。Avila等[38]用此方法建立了新西兰白兔的LSCD模型,具体操作是先用正庚醇去除角膜上皮,然后全周板层切除角膜缘上皮;为确保完全破坏角膜和角膜缘上皮,3周后重复上述步骤。术后1个月所有眼均出现中至重度角膜新生血管,伴表面不规则及角膜混浊,造模成功率为100%。随后,Sitalakshmi等[39]用同样的方法建立兔完全性LSCD模型,术后2~3周,角膜表面逐渐不规则、基质混浊,角膜结膜化导致上皮屏障不良,荧光素染色呈阳性;印迹细胞检查示结膜杯状细胞存在于角膜表面。
此造模法的优点是使用正庚醇去除角膜上皮是一种简单、易行、有效的方法,正庚醇处理后的角膜无上皮细胞残留,基质面光滑,细胞结构完整规则,适于干细胞贴附、移植等相关研究;缺点是角膜缘环形切除的厚度可能与正庚醇去除上皮的厚度不一致,导致中央出现一个较高的角膜浅基质岛,使新生血管难以长入角膜中央,多沿周边环形生长,故可能对模型的评分和确立产生一定影响[15]。
1.5 基因敲减法造模
除了上述方法造模外,还可以将携带Pax6敲低基因的小鼠模型用于研究角膜上皮伤口愈合及其对无虹膜相关LSCD的潜在影响[40];也有研究者研究斑马鱼模型中与角膜营养不良有关的其他基因[41]。由于LSCD的遗传病因较少,由突变引起的LSCD表型可能不那么严重;并且转基因动物难以生产和饲养,故遗传模型的使用率较低。
LSCD动物模型不同造模方法、优缺点、适用范围、具体方法、动物种类等信息详见表1。
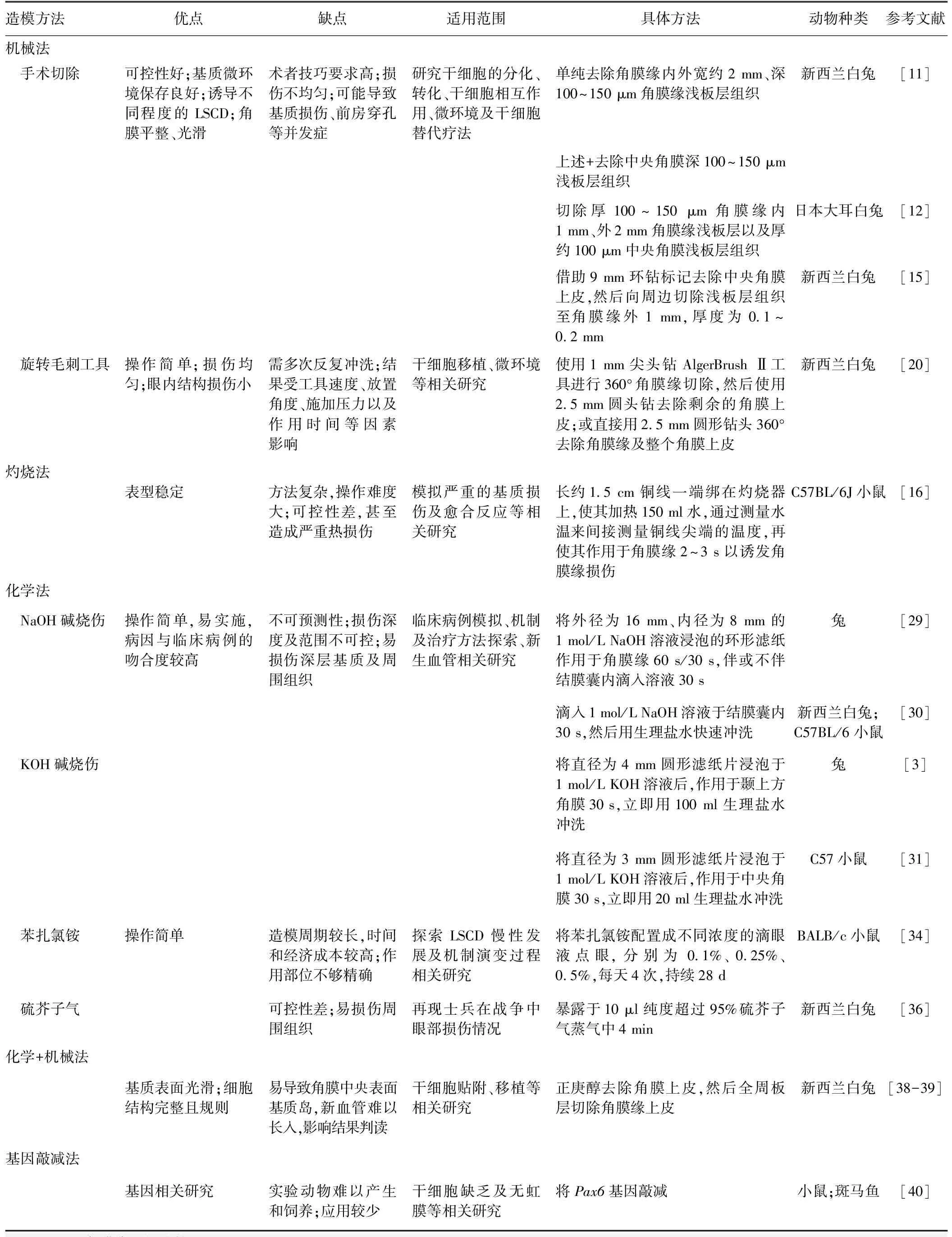
表1 LSCD动物模型
2 LSCD模型的动物选择
关于LSCD模型动物的选择要求包括:(1)所选的动物应尽量与人体的生理学、解剖学、基因学等特点相近;(2)要考虑实验动物的伦理、来源、经济成本、饲养难度以及造模操作难度等问题;(3)动物的建模周期、重复性、成功率、死亡率等因素应控制在最佳水平;(4)在建立动物模型后,能够比较全面地模拟人类疾病发生和发展过程以及病理生理变化是要考虑的重要因素。
目前,研究LSCD的动物模型主要限于少数哺乳动物,如小鼠、大鼠、兔和山羊等。其中,兔是常选动物之一,并且也常用于研究其他眼表疾病,如泪膜、结膜、角膜疾病等[12,16,21,31,39]。分析其原因:(1)兔的角膜大小与人类相似,因此有利于成功造模和手术操作。(2)兔性情温顺,极少伤人,在制作LSCD模型时更易操作和观察,拍摄照片时也更加清晰。因此,兔是建立角膜疾病动物模型的首选动物[16]。但是,Ti等[42]在建立完全性LSCD兔模型时,发现鼻侧的新生血管多于其他方向,考虑与兔眼存在瞬膜有关;因此在用兔眼造模时,建议去除瞬膜,避免影响操作及观察记录。
其次,小鼠也是制作LSCD模型的常选动物之一[17,22,25,34]。小鼠经济且容易获得,既能模拟人类的表型,又能持续足够长的时间,适合用于研究疾病的病理生理学以及新疗法的评估;同时,小鼠可供选择的抗体较兔齐全,有利于在同类研究中的比较。缺点是小鼠眼球较小,进行操作、测量新生血管面积及照相的难度较大;尤其在使用化学试剂诱导LSCD造模时,碱液可能会累及小鼠结膜,导致睑球粘连等病变,故利用化学法造模时不适合选取小鼠作为动物模型。另外,值得注意的是,小鼠角膜缘缺乏栅栏状结构,并且角膜缘起始处前弹力层的位置与人类不同,因此在类推到人类时要注意这些差异的影响[43-44]。
另外,山羊也被用于建立LSCD模型,但山羊造模价格昂贵,体型较大,活动度大,麻醉时可能导致效果不理想,必须在全身麻醉联合球周麻醉下进行,给实验操作带来一定难度,因此使用山羊做此类研究较少[45-46]。
除了哺乳动物模型外,水生动物斑马鱼和两栖动物非洲爪蟾也用于LSCD的相关研究。其中,非洲爪蟾的角膜形态和发育在很大程度上与人类相似[47-48],这使其成为研究角膜上皮、干细胞等角膜疾病病理学的合适模型,主要用于发育机制、再生、细胞重编程及细胞克隆等方面的研究[49-50]。
3 LSCD模型的类型选择
根据LSCD角膜上皮结膜化的受累范围,可将LSCD分为部分性及完全性两大类。部分性LSCD的特征是角膜上皮部分结膜化,留有部分功能正常的角膜缘以产生正常的角膜上皮细胞;完全性LSCD是指角膜缘360°干细胞丢失,角膜表面完全被结膜上皮覆盖。
根据目前的研究报道,完全性LSCD模型的研究要多于部分性[17,51-54]。但是制作完全性LSCD模型在控制病变部位、观察实验结果以及检验治疗效果时,因其较重的眼表损伤,往往具有一定的局限性,尤其在利用角膜化学伤诱导LSCD时,往往角膜损伤范围较大合并严重的角膜基质混浊,甚至出现角膜溃疡、穿孔等导致造模失败。例如,郭滨等[29]应用不同碱烧伤方法制作兔完全性LSCD模型时,由于NaOH在角膜缘停留时间过长,6眼全部出现角膜穿孔、眼球萎缩而造模失败;Ma等[55]在研究骨髓间充质干细胞重建大鼠化学烧伤眼表模型时发现,36%的大鼠因出现了严重的前房积脓、前房积血或角膜穿孔而造模失败。
而建立的部分性LSCD模型,角膜容易暴露便于观察,眼前节照相时动物配合情况相对较好,操作时易精确控制部位和时间,成功率高。其中,化学法是制作部分性LSCD模型的常用方法之一。例如,高晴琴等[31]在制作兔部分性LSCD模型时,采用碱烧伤造模方法,作用于颞上方角膜。造模后2个月时,2只新西兰白兔角膜新生血管累及2个象限,其余10只均累及1个象限,平均累及(1.17±0.39)个象限。同时,动物模型的损伤比较局限,相比于完全性LSCD,能更早地进入无充血、角膜上皮化的炎症稳定阶段,便于获取眼表改善、视觉改善等阳性指标,有利于客观定量评价治疗效果。在研究LSCD微环境重建,如角膜缘微环境细胞的移植时,更适合采用仍存有部分自体LSC的部分性LSCD模型[31]。
4 结语
LSC位于角膜缘上皮基底层的特殊结构“Vogt栅栏”处,属于成体单能干细胞,是正常角膜上皮细胞增生和分化的来源[56-57]。临床上,角膜直接损伤或角膜干细胞微环境破坏均有可能导致LSCD的发生。建立理想的LSCD动物模型是研究LSC的生理、病理以及观察体外构建的角膜组织移植效果的基础。
文中系统阐述给予不同的方法(机械法、灼烧法、化学法、化学+手术法、基因敲减等)建立的LSCD动物模型,以及LSCD动物种类的选择及制作类型的选择。机械法应用时间较久,建模方法成熟,可靠性高,但具有侵入性,可能会导致基质损伤、前房穿孔等严重并发症,对操作者个人技巧要求较高。其中,使用旋转毛刺工具造模是目前推荐制作角膜损伤的首选方法,损伤均匀创伤小,结果可控性强,但对于工具的使用需要一定的经验。灼烧法造模表型稳定,但操作复杂,热损伤的可控性差。化学方法破坏角膜组织是一种快速、操作简单的方法,且病因与临床病例的吻合度较高,但损伤的深度及范围控制困难,难以保证模型的统一,需在操作精确度方面进一步改进。化学+手术法在上述造模手段的基础上进一步改进,研究结果也证明其可行,此方法造模基质表面光滑,细胞结构完整,但易形成角膜中央基质岛,影响新生血管生长。基因敲减法由于操作较为复杂,造模动物难以产生和饲养而相对应用较少。
综上所述,LSCD动物模型用于相关研究多年,提升了临床及科研人员对LSCD的理解、研究和治疗。但是,目前造模方法众多,许多研究在进行LSCD诊断时对角膜印迹细胞学检查应用不足,导致各研究造模质量参差不齐。因此,仍需要进一步深入探索,建立更理想、更完善的动物模型为LSCD的基础及临床研究提供更有价值的帮助。
利益冲突所有作者均声明不存在利益冲突

