具有抑菌活性乳酸菌的分离、鉴定及其生长特性研究
张 甜,丁真真,刘艳全,徐明宜,王继莲*
(1.喀什大学 生命与地理科学学院,新疆 喀什 844000;2.新疆帕米尔高原生物资源与生态重点实验室,新疆 喀什 844000)
浆水、酸奶、馕均为中国传统发酵食品,极具地方特色,广受大众喜爱。传统发酵食品中含有多种微生物,包括乳酸菌[1]。乳酸菌作为一类通过发酵碳水化合物产生大量乳酸的细菌,是一种无孢子革兰氏阳性细菌[2-3],其具有促进机体生长发育,调节消化道内菌群平衡,进而改善胃肠道功能、提高食物消化率和生物效价、降低血清胆固醇、控制内毒素、抑制肠道内腐败菌生长、加强机体免疫力等功能[4]。
乳酸菌发酵产生的代谢产物有有机酸、细菌素和其他具有抗菌活性的物质[5],TODOROV S D等[6-8]从糖蜜中分离的植物乳杆菌(Lactobacillus plantarum)可产生抗革兰氏阴性菌的细菌素,对腐败菌和食源性病原体的生长和繁殖有强烈的抑制作用。细菌素具有高效、无毒、无残留、无耐药性等特点,可以抑制多种细菌、真菌,食品药品监督管理局(food and drug administration,FDA)批准商用的细菌素有乳酸链球菌素(Nisin)和片球菌素(Pediocin)等[9]。目前,已有乳酸菌及其代谢产物在乳及乳制品、肉及肉制品、果蔬制品、水产品、蛋制品中的应用报道,其在食品保鲜中起到一定效果,可作为新型生物防腐剂被开发利用[10-14]。
食品来源的乳酸菌具有安全、无害等特点,本研究旨在从陕西及喀什地区传统发酵食品中分离筛选具有良好抑菌作用的乳酸菌,对其发酵上清液的稳定性及其生长特性进行研究,并通过分子生物学技术对筛选菌株进行鉴定,为具有抑菌活性乳酸菌的研究和天然生物防腐剂的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
陕西西安农家浆水、喀什地区传统发酵酸奶和发酵馕面团,无菌袋取样后置于4 ℃冰箱备用。
指示菌菌种包括枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、普通变形杆菌(Proteus vulgaris):由喀什大学生命与地理科学学院提供。
1.1.2 试剂
氯化钠、草酸、氢氧化钠(均为分析纯):天津市圣奥化学有限责任公司;核酸染料、聚合酶链式反应(polymerase chain reaction,PCR)裂解液:日本TaKaRa公司。
1.1.3 培养基
MRS肉汤培养基、MRS琼脂培养基、LB培养基和营养琼脂培养基:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
ZWY-2102C全温振荡器:上海智城分析仪器制造有限公司;SHELLABG112电热恒温培养箱:宁波市科技园区新江南仪器有限公司;SW-CJ-1FD超净工作台:苏州净化设备有限公司;LDZF-751-2立式压力蒸汽灭菌锅:上海博讯实业有限公司;5910R高速冷冻离心机:深圳市科时达电子科技有限公司;HH-S6恒温水浴锅:江苏金怡仪器科技有限公司;TU-1950紫外-可见分光光度计:北京普析通用仪器有限责任公司;E221生物显微镜:麦克奥迪实业集团有限公司;Mastercycler nexus PCR仪:德国Eppendorf公司;DYY-6C型电泳仪:北京六一生物科技有限公司;ZF-20D暗箱式紫外分析仪:河南省百年仪器有限公司。
1.3 方法
1.3.1 乳酸菌的分离纯化
参照黄慧福等[15]的方法,分别称量10 g浆水、酸奶、面团溶于90 mL无菌水中,旋涡振荡混匀,梯度稀释,每个样品均稀释10个梯度(10-1~10-10)。分别吸取3种样品的7个稀释梯度(10-4~10-10)的样液200 μL,涂布于MRS固体培养基上,37 ℃恒温培养箱中培养24 h[16]。随机选取单菌落于MRS固体培养基进行平板交叉划线,37 ℃培养24 h,重复5次得到纯化菌株。将纯化后的菌株接种于MRS液体培养基,甘油保藏备用。
1.3.2 抑菌试验
(1)指示菌菌悬液的制备
以枯草芽孢杆菌、大肠杆菌、普通变形杆菌3种微生物作为指示菌,将斜面保藏的菌株接种到营养琼脂培养基中,37 ℃条件下活化培养两次。挑取单菌落接种到LB液体培养基中,37 ℃、150 r/min培养24 h,用0.85%的灭菌生理盐水将指示菌浓度稀释至108CFU/mL,得到指示菌菌悬液[17]。
(2)发酵上清液制备
将筛选纯化的单菌落接种于MRS肉汤培养基中,37 ℃、120 r/min培养24 h,得到发酵液。发酵液于4 ℃、14 000 r/min离心10 min,得发酵上清液,置于4 ℃冰箱备用[18]。
(3)发酵产物抑菌活性的测定[19-22]
抑菌乳酸菌的筛选:吸取100 μL 3种指示菌菌悬液,分别涂布于营养琼脂培养基上。将涂布好的培养皿划分为四个区域,分区域放入灭菌牛津杯,再吸取200 μL各菌株的发酵上清液滴入牛津杯,37 ℃培养24 h,观察是否产生抑菌圈。测量抑菌圈的直径,筛选出抑菌圈较大的菌株。
发酵产物酸碱处理后的抑菌试验:用1 mol/L的草酸溶液和1 mol/L的氢氧化钠溶液调节发酵上清液的pH至2.0和9.0,其中一组保持2 h后再调回其初始pH,另一组保持pH至2.0和9.0,测量抑菌圈的直径。
发酵产物热处理后的抑菌试验:分别将发酵上清液经60 ℃和100 ℃处理15 min,测量抑菌圈直径。
1.3.3 筛选菌株的生长特性
生长曲线和产酸能力测定[19,23]:按2%的接种量将筛选乳酸菌菌株的菌液接种于100 mL MRS肉汤培养基,37 ℃振荡培养24 h,每隔2 h取样,测定发酵液在波长600 nm处的吸光度值(OD600nm值)和pH,绘制生长曲线和pH变化曲线。
抑菌动力学试验[19]:按2%的接种量将筛选乳酸菌菌株的菌液接种于100 mL MRS肉汤培养基中,37 ℃振荡培养24 h,每隔2 h取样,测定其发酵上清液对指示菌的抑菌圈直径,并绘制抑菌动力学曲线。
耐酸碱试验[24-25]:用1 mol/L的草酸溶液和1 mol/L的氢氧化钠溶液调节MRS液体培养基的pH至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0,按2%的接种量将筛选乳酸菌菌株的菌液接种于100 mL MRS肉汤培养基,37 ℃振荡培养24 h后测定发酵液的OD600nm值。
耐渗透压试验[25]:按2%的接种量将筛选乳酸菌菌株的菌液接种于100 mL MRS肉汤培养基中,分别添加氯化钠含量至0%、2%、4%、6%、8%、10%、12%、14%,37 ℃振荡培养24 h,测定发酵液的OD600nm值。
1.3.4 筛选菌株的分子生物学鉴定
用灭菌牙签挑取乳酸菌单菌落于50 μL裂解液中,充分混匀,90 ℃水浴裂解15 min得到脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,利用通用引物27F(5'-AGAGTTTGATCCTGGCTCA-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对16S rDNA基因序列进行PCR扩增。PCR扩增体系:DNA模板2μL、引物各2μL、2×PowerTaqPCR MasterMix 25 μL、补充双蒸水(ddH2O)至50 μL。PCR扩增条件:94 ℃预变性10 min;94 ℃变性30 s,54 ℃退火60 s,72 ℃延伸90 s,35个循环;72 ℃再延伸10 min,4 ℃保存[26]。将PCR扩增产物送至杨凌天润奥科生物科技有限公司进行测序,返回的基因序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)网站的GenBank数据库中与已知序列进行同源比对,利用MEGA 11.0软件中的邻接法(neighbor joining,NJ)绘制系统发育树[27]。
1.3.5 数据处理
每一组实验平行测定3次,结果用“平均值±标准差”表示,采用SPSS Statistics 26.0对数据进行处理,采用单因素方差分析和Duncan多范围检验确定数据之间的显著性差异(P<0.05),采用Origin 2021绘图。
2 结果与分析
2.1 乳酸菌的分离纯化
稀释涂布后和交叉纯化的菌落见图1。由图1可知,各菌落间形态差异较小,乳酸菌单菌落均呈乳白色圆球状,其质地圆润光滑,具有光泽。

图1 部分乳酸菌的分离纯化结果Fig.1 Isolation and purification results of some lactic acid bacteria
2.2 抑菌试验结果
2.2.1 具有抑菌活性乳酸菌的筛选
采用牛津杯法共筛选出15株具有抑菌能力的菌株,编号为Y1~Y15,结果见表1。由表1可知,所有菌株对大肠杆菌、普通变形杆菌和枯草芽孢杆菌这三种指示菌中的一种或多种具有抑菌能力,从中挑选出抑菌圈直径>13 mm且能够同时抑制3种指示菌的4株菌株Y1、Y4、Y14和Y15进行进一步研究。
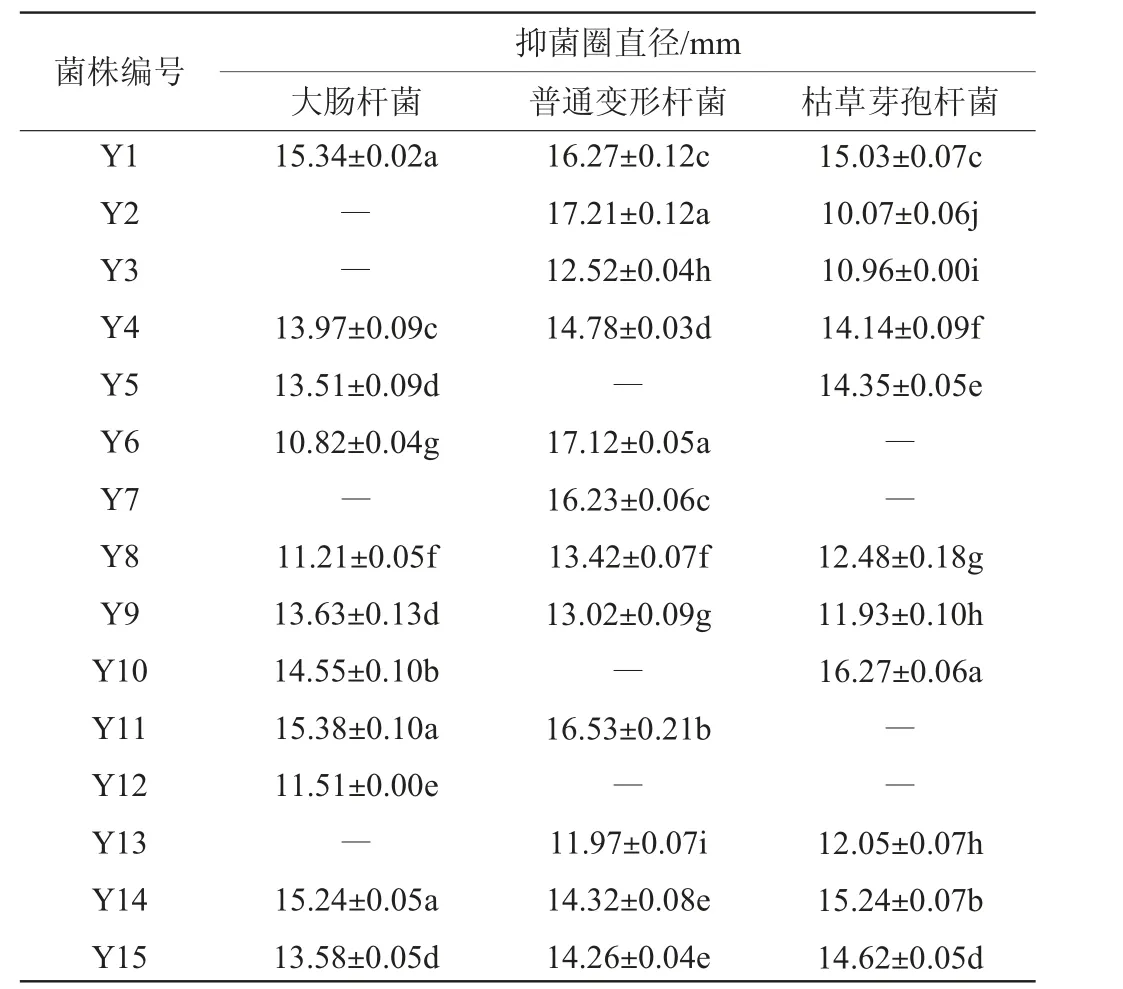
表1 筛选乳酸菌菌株发酵上清液的抑菌效果Table 1 Antibacterial effect of screened lactic acid bacteria supernatant
2.2.2 发酵产物经酸碱及高温处理后的抑菌效果
发酵产物经酸碱、高温处理后的抑菌效果见表2~表4。由表2~表4可知,4株菌株经高温处理后抑菌圈直径明显减小,抑菌效果降低,且温度越高,抑菌效果越弱。菌株Y1在60 ℃、100 ℃处理后对大肠杆菌、普通变形杆菌、枯草芽孢杆菌的抑菌活力保持在69%以上,但菌株Y4、Y14、Y15经100℃处理后对大肠杆菌的抑菌能力均消失,菌株Y4、Y14对普通变形杆菌和枯草芽孢杆菌的抑菌活力保持在69%以上。

表2 不同条件下乳酸菌发酵上清液对大肠杆菌的抑菌效果Table 2 Antibacterial effect of lactic acid bacteria supernatant on Escherichia coli under different conditions

表3 不同条件下乳酸菌发酵上清液对普通变形杆菌的抑菌效果Table 3 Antibacterial effect of lactic acid bacteria supernatant on Proteus vulgaris under different conditions

表4 不同条件下乳酸菌发酵上清液对枯草芽孢杆菌的抑菌效果Table 3 Antibacterial effect of lactic acid bacteria supernatant on Bacillus subtilis under different conditions
大部分菌株发酵上清液经酸碱处理再调回原始pH后的抑菌效果明显减弱,菌株Y1、Y14、Y15发酵上清液经酸碱处理后抑菌活力仍保持在67%以上,且除菌株Y15外,酸处理再调回后的抑菌效果小于碱处理再调回后的抑菌效果,尤其是菌株Y4,其经酸处理调回后对普通变形杆菌的抑菌活力消失,表明酸处理条件下会降低发酵液的抑菌活性。部分菌株经碱处理再调回后抑菌圈略有增大,可能是因为处理2 h后调回原始pH时添加的无机酸起到了抑菌效果。4株菌株发酵上清液pH调至2时抑菌圈明显增大,表明调酸后添加的无机酸增加了抑菌效果,pH调至9时抑菌活性均较少甚至消失,可能是碱中和了发酵液中的有机酸,残留部分细菌素起到的抑菌效果。
2.3 筛选菌株的生长特性
2.3.1 生长曲线和产酸能力
观察筛选乳酸菌菌株在MRS肉汤培养基中培养24 h内的生长趋势和产酸能力,结果见图2。由图2可知,4株菌株的生长曲线均呈“S”型,0~8 h为生长延滞期,菌体浓度不增长或增长缓慢;8~16 h为对数生长期,尤其8~12 h生长快速,此时细胞代谢非常活跃;18 h后生长趋于稳定,OD600nm值稳定在2.4左右。随着培养时间的延长,发酵液pH逐渐下降,培养20~24 h,菌株Y1的pH趋于3.5,菌株Y4、Y14、Y15的pH趋于2.5,说明4株菌株发酵后均能产酸,且菌株Y4、Y14、Y15的产酸能力高于菌株Y1。
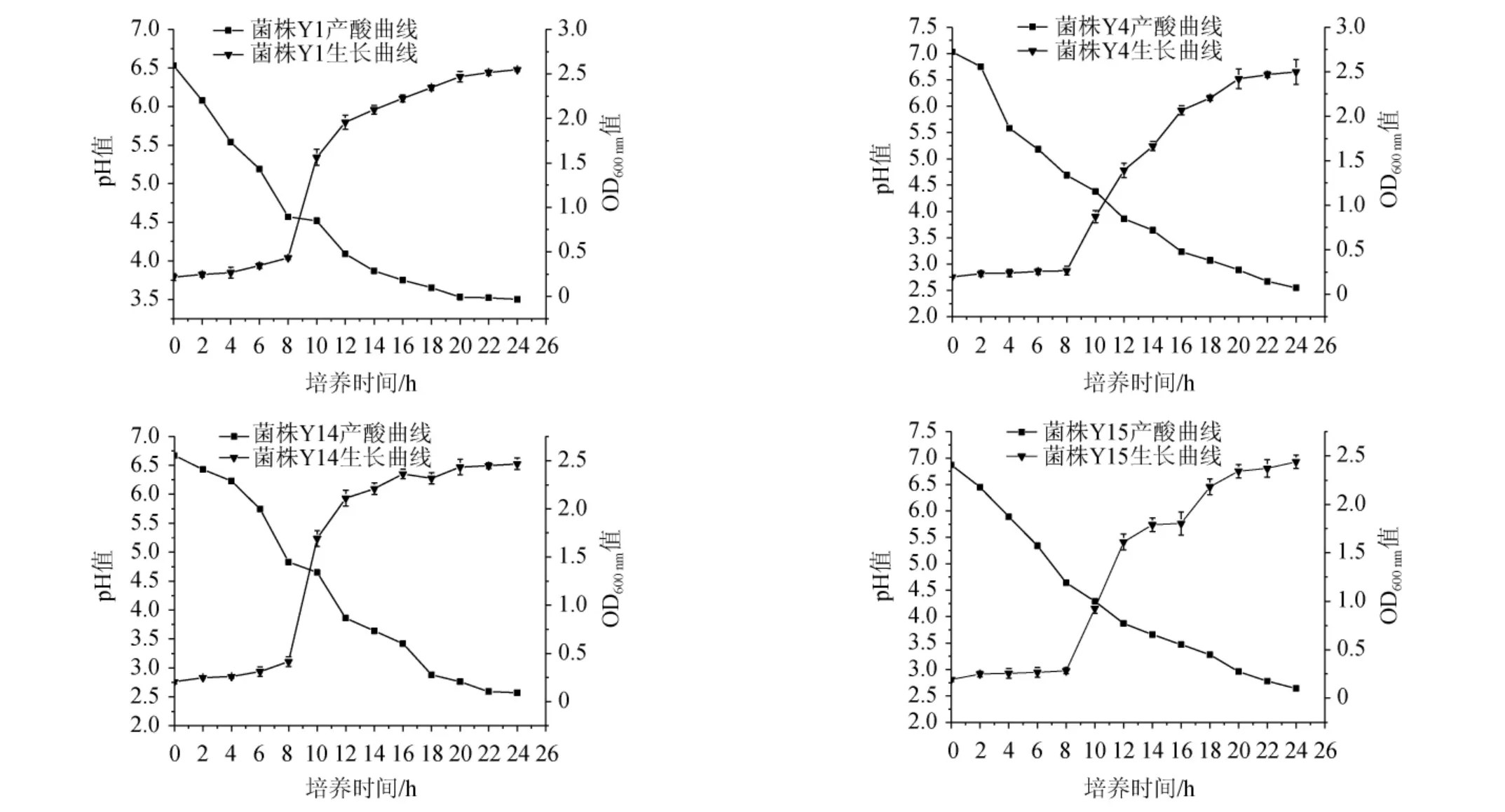
图2 4株筛选菌株的生长曲线和产酸曲线Fig.2 Growth and acid production curves of 4 screened strains
2.3.2 抑菌动力学曲线
对菌株Y1、Y4、Y14、Y15进行抑菌动力学试验,结果见图3。由图3可知,发酵上清液在培养4 h时开始具有抑菌活性,在生长延滞期抑菌活性增加缓慢;在生长对数期时,抑菌活性增加较快;进入生长稳定期后抑菌活性基本稳定。根据Gaden的分批发酵产物动力学学说[28],产物生成与菌体生长相关,即抑菌曲线和生长曲线呈现伴随式生长,为生长偶联型。

图3 4株筛选菌株对大肠杆菌(A)、普通变形杆菌(B)及枯草芽孢杆菌(C)的抑菌动力学曲线Fig.3 Antibacterial kinetics curves of 4 screened strains against Escherichia coli (A), Proteus vulgaris (B) and Bacillus subtilis (C)
2.3.3 耐酸碱能力
对菌株Y1、Y4、Y14、Y15进行耐酸碱试验,结果见图4。由图4可知,4株菌株的最适生长pH值为6.0。菌株Y1在pH 5.0~8.0时生长良好,在pH<5.0和pH>8.0时生长受到抑制。菌株Y4、Y14在pH 5.0~7.0、菌株Y15在pH 4.0~7.0时生长良好,菌株Y14和Y15在pH 4.0时的OD600nm值分别为0.800、1.802,高于菌株Y1(0.231)和Y4(0.190),菌株Y1和Y15在pH 8.0时的OD600nm值分别为1.387、0.769,高于菌株Y4(0.185)和Y14(0.148),说明菌株Y15、Y14的耐酸能力高于菌株Y1和Y4,菌株Y1、Y15的耐碱能力高于Y4和Y14。综上,菌株Y15的耐酸较好,菌株Y1的耐碱性较好。

图4 4株筛选菌株的耐酸碱能力Fig.4 Acid and alkali tolerance of 4 screened strains
2.3.4 耐渗透压能力
对菌株Y1、Y4、Y14、Y15进行耐渗透压试验,结果见图5。由图5可知,菌株Y1、Y4、Y15在不添加NaCl时生长最好。随着NaCl含量的增加,菌株的生长均受到不同程度的抑制。当NaCl含量为2%时,菌株Y14和Y15生长较好,OD600nm值分别为2.355、2.383;当NaCl含量为4%时,菌株Y14和Y15能生长,且菌株Y15的OD600nm值(1.430)高于菌株Y14(0.560),而菌株Y1和Y4几乎不生长;当NaCl含量≥6%时,所有菌株几乎不生长。综上,菌株Y15的耐渗透压能力最好。

图5 4株筛选菌株的耐渗透压能力Fig.5 Osmotic pressure tolerance of 4 screened strains
2.4 筛选菌株的鉴定
基于16S rDNA基因序列构建4株筛选菌株的系统发育树,结果见图6。由图6可知,菌株Y1和Y4与发酵乳杆菌(Lactobacillus fermentum)聚于一支,亲缘关系最近;菌株Y14和Y15与植物乳杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系最近。因此,鉴定菌株Y1和Y4为发酵乳杆菌(Lactobacillus fermentum),鉴定菌株Y14和Y15为植物乳杆菌(Lactiplantibacillus plantarum)。

图6 基于16S rDNA基因序列4株筛选菌株的系统发育树Fig.6 Phylogenetic tree of 4 screened strains based on 16S rDNA gene sequences
3 结论
本研究以枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、普通变形杆菌(Proteus vulgaris)为指示菌,采用传统培养分离法结合牛津杯法从传统发酵食品中筛选得到4株具有良好抑菌活性的乳酸菌菌株,分别为Y1、Y4、Y14和Y15。4株菌株的发酵上清液均能抑制3种指示菌的生长,其中,菌株Y1抑菌活性较好,对3种指示菌的抑菌圈直径均达>13 mm,其发酵上清液在60 ℃、100 ℃处理后的抑菌活力保持在69%以上;菌株Y1、Y14、Y15发酵上清液经酸碱处理后在调回抑菌活力仍保持在67%以上。4株菌株的生长曲线与产酸特性和抑菌活性存在生长偶联相关性,进入稳定期后,抑菌圈直径趋于稳定,可在发酵12~18 h时终止发酵。4株菌株均在pH 5.0~7.0时生长良好,最适生长pH均为6.0,其中菌株Y15耐酸性及耐渗透性较好,菌株Y1耐碱性较好。经分子生物学鉴定,菌株Y1和Y4为发酵乳杆菌(Lactobacillus fermentum),菌株Y14和Y15为植物乳杆菌(Lactiplantibacillus plantarum)。

