PCID2在胃癌组织中高表达并通过调控细胞周期进程和增殖影响患者预后
张 诺,张 震,张雨路,宋 雪,张小凤,李 静,左芦根,3,胡建国
蚌埠医科大学第一附属医院1检验科,2胃肠外科,3炎症相关性疾病基础与转化研究安徽省重点实验室,4中心实验室,安徽 蚌埠 233000;5蚌埠医科大学临床医学院,安徽 蚌埠233000
胃癌(GC)是消化系统最常见的恶性肿瘤之一,其发病率和死亡率分别居全球第5位和第4位,造成了严重的社会危害[1,2]。当前,若单纯依靠手术、放化疗等常规治疗手段,对于患者术后5年生存率的改善效果欠佳[3-5]。癌细胞增殖等生物学行为是导致肿瘤恶性进展的重要因素,深入这一领域的研究有望为胃癌的靶向治疗及预后评估提供重要参考[6-9]。PCI结构域2(PCID2)作为三素修复核酸外切酶2(TREX-2)mRNA复合物的组分之一,在核质运输中扮演重要角色,同时还是细胞周期调节因子[10,11]。新近的研究表明,PCID2在结肠癌中的表达异常升高,并通过促进肿瘤细胞增殖和周期进程影响患者预后[12]。然而,PCID2在胃癌中的作用和机制尚未见报道。本研究尝试通过分析本机构纳入胃癌患者的临床数据和开展体内外实验,旨在探究PCID2在胃癌组织中的表达水平及其对胃癌患者远期预后的评估价值,并探讨其对胃癌细胞增殖和周期的影响及可能机制,以期为胃癌临床诊疗水平提升提供新的参考。
1 材料和方法
1.1 资料采集
收集2012 年1 月~2016 年12 月接受胃癌根治术(医疗机构:蚌埠医科大学第一附属医院)的患者资料。纳入标准:经临床和病理组织学检测确诊为原发性胃癌;具有完整的病历资料。排除标准:合并其他组织起源的恶性肿瘤;患有严重的心血管、肝或肾疾病;术前接受过放疗或化疗。按照以上标准,本研究共纳入100例胃癌患者,并获取以下信息:(1)基本资料:性别、年龄、术前糖类抗原19-9(Carbohydrate antigen 19-9,CA19-9)、术前癌胚抗原(Carcinoembryonic antigen,CEA)、肿瘤直径、肿瘤组织类型、病理分级、T分期、N分期等资料于本院病例系统获取;(2)生存资料:通过多种渠道获取胃癌患者术后生存情况,包括电话随访、门诊复查等方式,明确术后5年是否发生肿瘤相关性死亡及时间;(3)组织蜡块:于本院病理科收集所纳入患者胃癌组织和癌旁组织蜡块,以用于后续的免疫组织化学染色实验;(4)冰冻标本:于本院《消化系统肿瘤生物标本库系统》中调取30例胃癌患者(属于上述已纳入研究的100例患者)癌组织和癌旁组织冰冻标本(液氮保存),以用于后续的RT-qPCR实验和Western blot实验(随机调取其中3例胃癌患者的癌组织和癌旁组织冰冻标本)。本研究已通过蚌埠医学院伦理委员会批准(批准号:伦科批字[2023]第396号)。
1.2 实验动物
选择BALB/c-Nude裸鼠9只(雄性,6周龄,体质量20±2 g),在无特定病原体(SPF)环境下饲养,购自江苏集萃药康生物科技股份有限公司。本研究已通过蚌埠医学院动物研究伦理委员会批准(批准号:伦动科批字[2023]第430号)。
1.3 主要试剂
人胃癌细胞系(MGC-803)购自国家生物医学实验细胞资源库,兔抗PCID2多克隆抗体、兔抗p27多克隆抗体、兔抗p16多克隆抗体(武汉三鹰生物技术有限公司),HRP标记抗兔二抗(北京中杉金桥生物技术有限公司),逆转录及RT-qPCR两步法试剂盒(Takara),胎牛血清、RPMI 1640培养基、胰酶、PBS缓冲液均(Gibco),兔抗β-actin单克隆抗体(Abcam),CCK-8实验试剂盒(北京索莱宝科技有限公司),RIPA裂解液、BCA蛋白浓度检测试剂盒、ECL化学发光检测试剂盒及细胞周期检测试剂盒均(上海碧云天生物技术有限公司),小鼠单克隆抗p27抗体及抗p16抗体均(Santa-cruz)。
1.4 方法
1.4.1 免疫组织化学法检测PCID2、p27及p16在胃癌和癌旁组织中的表达情况 将胃癌患者手术标本蜡块制成5 μm厚度的切片,经脱蜡水化、抗原修复后除去内源性过氧化物酶,再经封闭、孵育一抗:PCID2(1∶100);p27(1∶400);p16(1∶2000)和二抗、DAB显色、复染细胞核及脱水透明后进行封片扫描。相对积分光密度(IOD)值采用Image-J软件计算。以胃癌组织中PCID2相对表达量(IOD值)的中位数为界,将患者分为PCID2低表达组(n=50)和PCID2高表达组(n=50)。
1.4.2 RT-qPCR 检测PCID2 在胃癌和癌旁组织中mRNA 表达水平 首先使用Trizol 试剂提取组织总RNA,然后进行反转录,最后于RT-qPCR仪上进行扩增。扩增程序为:95 ℃变性30 s,55 ℃退火60 s,72 ℃延伸20 s,重复40个循环。本实验以GAPDH为内参基因,并通过计算2-ΔΔCT值评估PCID2 mRNA 的表达水平。实验所用引物为上海生工公司合成,序列如下:PCID2:上游5'-CTCCAGAGGAGAAGTGTCAACA-3',下游5'-GCTCGCAAGAATGATTGGACT-3';GAPDH:上游5'-GGAGCGAGATCCCTCCAAAAT-3',下游5'-GGCTGTTGTCATACTTCTCATGG-3'。
1.4.3 GO功能富集分析预测PCID2可能的生物学功能通过cBioPortal 数据库(https://www.cbioportal.org)获取PCID2在胃癌中的共表达基因(Ρ<0.01),进而通过DAVID 数据库(https://david.ncifcrf.gov/)进行基因本体注释(Gene Ontology,GO)富集分析(Ρ<0.05),以预测PCID2可能参与的生物学功能。
1.4.4 细胞转染及分组 将MGC-803培养于含有10%胎牛血清的RPMI-1640培养基中(37 ℃、5%CO2条件下)。待细胞密度达70%~80%时,分别用对照空载体、特异性敲低和过表达PCID2 慢病毒载体转染MGC-803,并筛选稳定表达的细胞株用于后续实验检测。细胞实验分组依次为对照组(NC组)、PCID2敲低组(Si-PCID2组)及PCID2过表达组(LV-PCID2组)。
1.4.5 CCK-8 法检测PCID2 对胃癌细胞增殖的影响以2×103/孔的密度将转染成功的MGC-803细胞接种到96孔板内,分别于培养24、48、72、96 h时,以10 μL/孔的体积添加CCK-8试剂。孵育4 h后,检测450 nm处吸光度值(A450nm)。
1.4.6 流式细胞术检测PCID2对胃癌细胞周期的影响收集转染成功MGC-803 细胞,用磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗后,于4 ℃的70%冰乙醇中固定1 h。PBS洗涤并离心2次,然后将细胞重悬于含225 μL 碘化丙啶和90 μL 核糖核酸酶A(Ribonuclease A,RNase A)的PBS溶液中,混匀后于室温下孵育30 min。最后采用流式细胞仪检测并计算细胞周期分布情况。
1.4.7 Western blot检测PCID2对细胞周期相关蛋白及p27和p16蛋白表达的影响 收集转染成功MGC-803细胞、裸鼠移植瘤、胃癌组织及癌旁组织,并利用蛋白裂解液提取总蛋白。在测定蛋白浓度后,加入上样缓冲液,并对蛋白进行变性处理。然后经SDS-PAGE凝胶电泳分离目的蛋白,再依次进行转膜、封闭、孵育一抗及二抗,最后利用凝胶成像系统采集图片。以β-actin为内参,利用Image-J软件对目的蛋白进行定量分析。
1.4.8 裸鼠移植瘤实验 转染成功的MGC-803细胞经胰蛋白酶消化、离心后重悬成单细胞悬液(1×108个/mL),并以100 μL/只鼠的剂量接种于裸鼠背部皮下(NC组、Si-PCID2组及LV-PCID2组,3只/组)。14 d后,处死裸鼠,取出移植瘤,拍照并测量移植瘤体积和重量(肿瘤体积=1/2×长×宽2)[13]。
1.5 统计学分析
采用SPSS 26.0软件和GraphPad prism 9.0软件进行统计学分析和制图。计量资料表示为均数±标准差,每项实验均独立重复不少于3次。通过χ2检验进行率的比较;两组间均数比较采用t检验;3组间均数比较采用单因素方差分析(one-way ANOVA)。通过Spearman进行相关性分析;通过Kaplan-Meier(K-M)曲线进行生存分析;分析影响胃癌患者术后5年生存率的独立危险因素采用Cox比例风险回归模型;分析PCID2预测胃癌患者术后5年生存率的评估价值采用受试者工作曲线(ROC)。以Ρ<0.05为差异具有统计学意义。
2 结果
2.1 PCID2在胃癌组织中呈现高表达
免疫组织化学和RT-qPCR检测结果表明,PCID2在胃癌组织中的蛋白和mRNA表达水平较癌旁组织均明显增加,且主要表达于癌细胞胞质(Ρ<0.01,图1A~C)。
2.2 胃癌组织中PCID2表达水平与肿瘤恶性进展相关
以PCID2相对表达水平的中位数(3.085)为界,将纳入研究的100例患者分为PCID2低表达组(n=50)和PCID2高表达组(n=50)。通过对纳入患者的临床资料进行分析发现,PCID2高表达组患者CA19-9≥37 kU/L、CEA≥5 μg/L、T分期(T3~T4)及N分期(N2~N3)的比例显著高于PCID2低表达组(Ρ<0.01,表1)。进一步相关性分析结果显示,PCID2在胃癌组织中的表达水平与患者外周血中CA19-9(r=0.504,Ρ<0.001)及CEA(r=0.535,Ρ<0.001)水平呈正相关(图2A、B)。
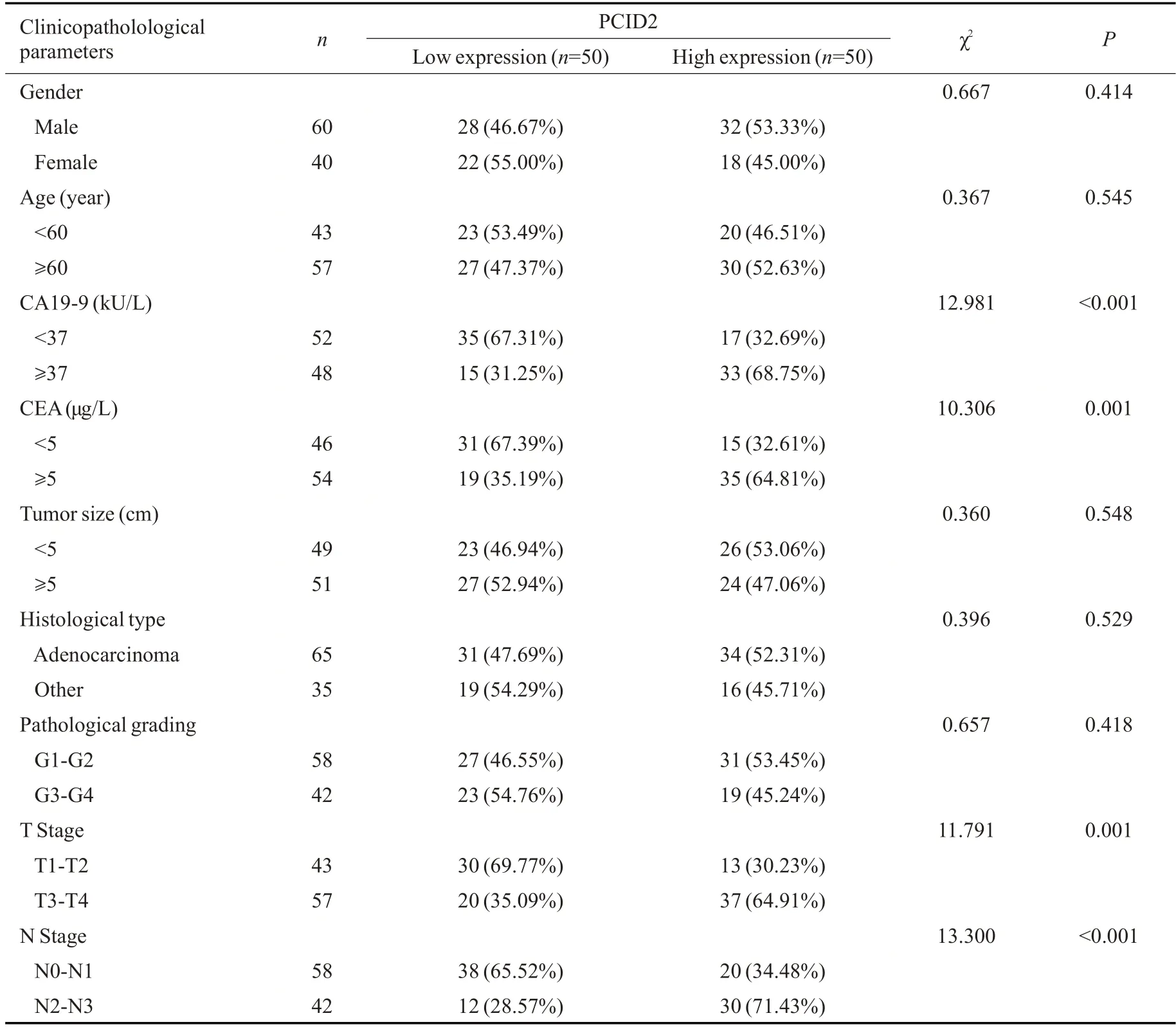
表1 胃癌组织中PCID2表达水平与胃癌患者临床病理参数间的关系Tab.3 Relationship between the expression level of PCID2 in GC tissues and clinicopathological parameters of the patients
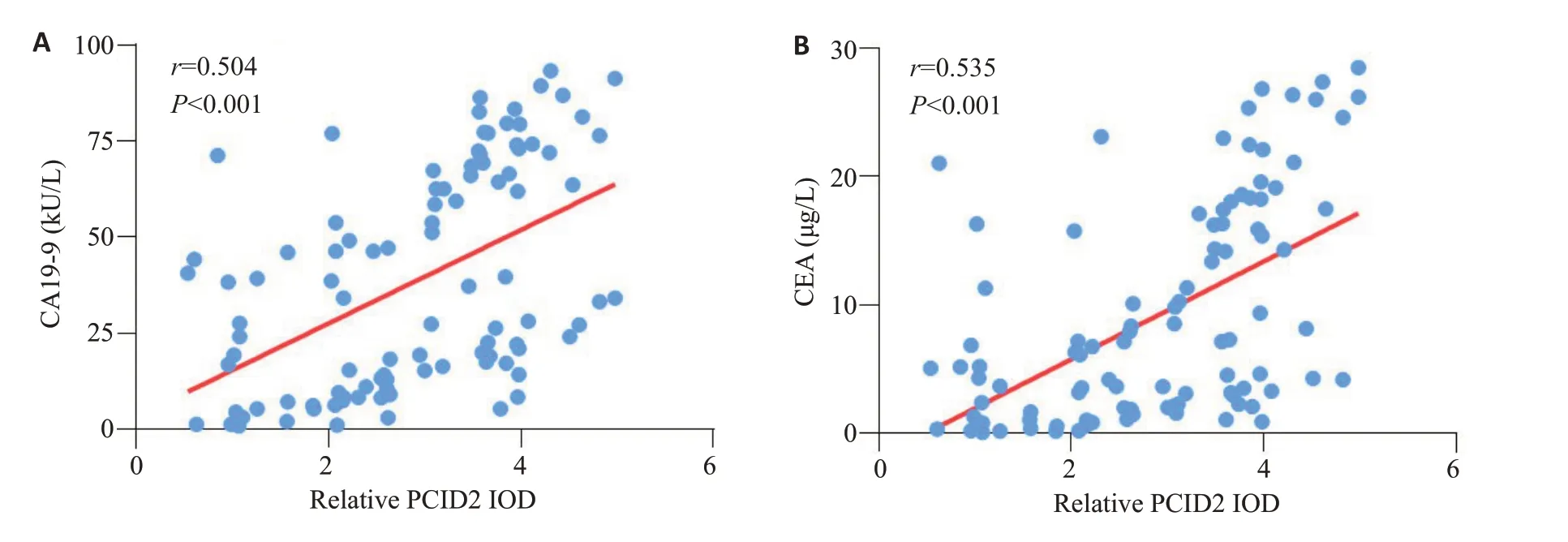
图2 胃癌组织中PCID2表达水平与CA19-9及CEA水平的相关性分析Fig.2 Correlation analysis between the expression level of PCID2 in GC and the levels of CA19-9 and CEA in peripheral blood.A:Correlation analysis between PCID2 and CA19-9.B:Correlation analysis between PCID2 and CEA.
2.3 PCID2高表达提示胃癌患者术后预后不良
采用K-M生存曲线比较PCID2高表达与低表达对胃癌患者术后5年生存率的影响,结果显示PCID2高表达组患者术后5年生存率显著低于PCID2低表达组患者(Log-rank χ2=38.248,Ρ<0.001,图3)。

图3 PCID2 表达水平与患者胃癌根治术后5 年生存率的关系Fig.3 Relationship between PCID2 expression level and 5-year survival rate of GC patients after radical operation.
2.4 PCID2高表达是影响患者胃癌根治术后5年生存率的独立危险因素
单因素结合Cox 多因素分析表明,胃癌组织中PCID2高表达、外周血CA19-9≥37 kU/L和CEA≥5μg/L、临床T分期(T3~T4)及N分期(N2~N3)是影响胃癌患者术后5年生存率的独立危险因素(Ρ<0.05,表2)。

表2 影响胃癌根治术后5年生存率的单因素结合Cox多因素分析Tab.3 Univariate and Cox multivariate analyses of the factors affecting the 5-year survival rate of GC patients after radical gastrectomy
2.5 PCID2表达水平对胃癌患者根治术后5年生存率具有一定评估价值
ROC 曲线分析显示:以PCID2 相对表达水平(3.035)为截点值,预测胃癌患者术后5年生存率的敏感性、特异性、曲线下面积分别为76.74%、75.44%、0.755(Ρ<0.001,图4)。

图4 PCID2表达水平对胃癌患者根治术后5年生存率的评估价值Fig.4 Evaluation of the predictive value of PCID2 expression level for 5-year survival rate of GC patients after radical operation.
2.6 PCID2促进胃癌细胞周期进程及增殖
GO功能富集分析结果显示PCID2可能参与胃癌细胞细胞周期G1/S期转变(Ρ<0.01,图5A)。采用慢病毒转染方式分别构建敲低与过表达PCID2基因的胃癌细胞系,并通过Western blot验证转染效率(Ρ<0.05,图5B、C)。CCK-8实验证明:PCID2过表达促进胃癌细胞增殖,敲低则反之(Ρ<0.01,图5D)。流式细胞术分析表明:PCID2过表达促进胃癌细胞G1/S期转变,敲低则抑制(Ρ<0.05,图5E、F)。Western blot实验证实:PCID2过表达显著促进CyclinD1和CDK6的表达,敲低则反之(Ρ<0.05,图5G、H)。
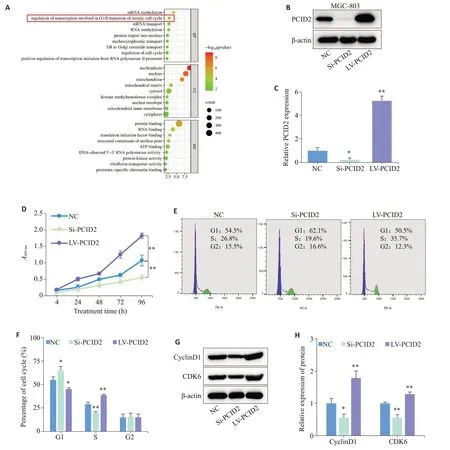
图5 PCID2对胃癌细胞周期进程及增殖的影响Fig.5 Effect of PCID2 expression level on cell cycle progression and proliferation of GC cells.A:GO function enrichment analysis of PCID2 in GC. B,C:Western blotting for verifying efficiency of PCID2 knock-down and overexpression. D:CCK-8 assay for assessing the proliferation of GC cells. E,F:Flow cytometry for analyzing cell cycle distribution of GC cells. G,H:Western blotting for detecting expressions of cell cycle-related proteins in GC cells.NC: Normal control.Si:SiRNA.LV:Overexpression.*P<0.05 vs NC,**P<0.01 vs NC.
2.7 PCID2在体促进裸鼠成瘤
使用慢病毒转染成功后的胃癌细胞建立裸鼠皮下成瘤模型,通过对裸鼠移植瘤体积和重量进行组间比较发现:PCID2过表达可明显增加肿瘤的体积和质量,敲低则相反(Ρ<0.05,图6A~C)。Western blot检测表明:PCID2过表达促进裸鼠移植瘤中CyclinD1和CDK6的表达,敲低则反之(Ρ<0.05,图6D、E)。
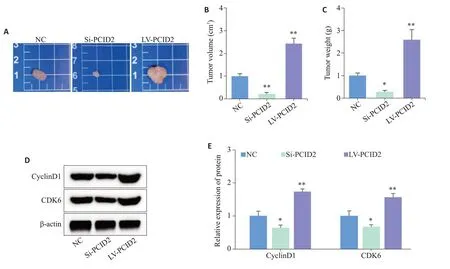
图6 PCID2对裸鼠皮下成瘤能力的影响Fig.6 Effect of PCID2 expression level on subcutaneous tumor growth in nude mice.A:Representative pictures of the tumors from the nude mice in each group. B:Comparison of tumor volume in each group.C:Comparison of tumor weight in each group.D,E:Western blotting for detecting expressions of cell cycle-related proteins in tumors of the nude mice.*P<0.05 vs NC,**P<0.01 vs NC.
2.8 p27蛋白、p16蛋白在胃癌组织中低表达且受PCID2调控
免疫组织化学染色和Western blot分析显示:胃癌组织中的p27蛋白和p16蛋白表达水平较癌旁组织均明显降低(Ρ<0.05,图7A~F)。此外,在胃癌细胞(图7G、H)和裸鼠移植瘤(图7I、J)中,PCID2过表达可抑制p27蛋白和p16蛋白表达,敲低则促进二者表达(Ρ<0.05)。
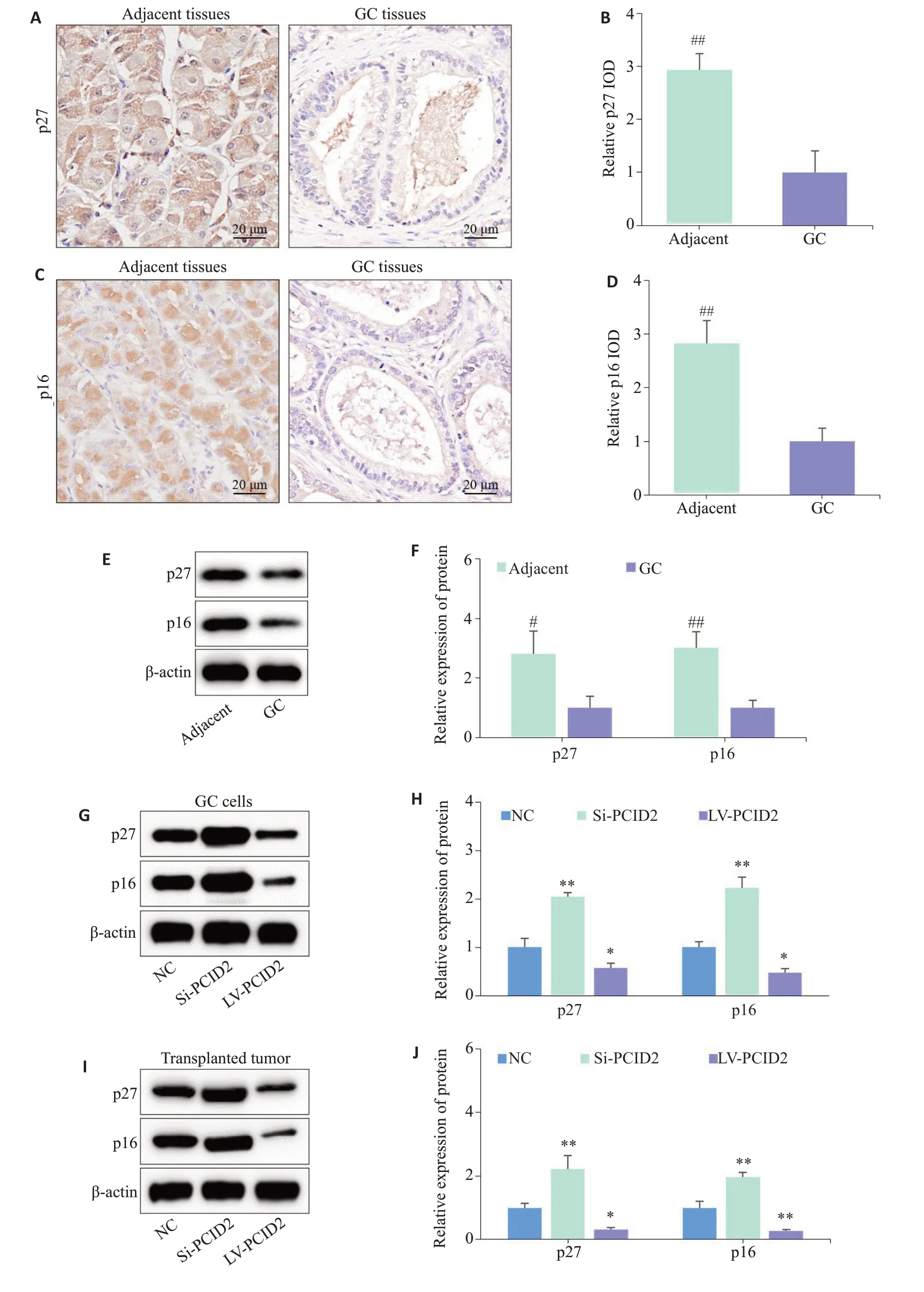
图7 p27蛋白、p16蛋白在胃癌组织和癌旁组织中的表达情况及PCID2对其表达的影响Fig.7 Expressions of p27 and p16 proteins in GC and adjacent tissues and the influence of PCID2 on their expression.A,B:Immunohistochemical staining for detecting expression levels of p27 protein in GC tissues and adjacent tissues. C,D:Immunohistochemical staining for detecting expression levels of p16 protein in GC tissues and adjacent tissues.E,F:Western blotting for detecting expression levels of p27 and p16 protein in GC tissues and adjacent tissues. G,H:Western blotting for detecting expression levels of p27 and p16 proteins in GC cells with PCID2 overexpression and knockdown. I,J:Western blotting for detecting expression levels of p27 and p16 proteins in tumors of the nude mice.#P<0.05 vs GC,##P<0.01 vs GC;*P<0.05 vs NC,**P<0.01 vs NC.
3 讨论
癌细胞通过异常增殖等生物学行为参与肿瘤的恶性进展,而这一过程受多种蛋白分子的调控[14-16],深入这一领域的探索对胃癌进展机制的揭示、临床诊疗水平的提高及患者预后评估具有重要的临床意义[17-19]。本研究通过分析胃癌患者临床数据,证实PCID2在胃癌组织中高表达且影响患者术后5年生存率。并且通过组织样本分析结合体内外实验,发现p27蛋白、p16蛋白在胃癌组织中低表达并可能通过PCID2调控进而促进胃癌细胞增殖和细胞周期进程。
我们首先对胃癌患者组织标本进行实验分析,发现PCID2在胃癌组织中显著高表达。T分期与N分期可反映肿瘤的浸润程度以及淋巴结受累情况,其分期越高代表肿瘤恶性程度越高,而CA19-9和CEA是临床上筛查胃肠道肿瘤常用的血清学标志物[20,21]。通过进一步分析PCID2表达水平与胃癌患者临床病理参数之间的关系,发现PCID2 高表达组患者CA19-9≥37 kU/L、CEA≥5 μg/L、T分期(T3~T4)及N分期(N2~N3)的比例显著高于PCID2低表达组患者,且胃癌组织中PCID2水平与外周血CA19-9、CEA浓度呈正相关。以上结果提示,PCID2可能在胃癌的发生发展中扮演重要角色[7,22]。接下来,我们尝试分析PCID2表达对胃癌患者预后的影响,结果证实PCID2高表达是胃癌患者预后不良的独立危险因素,提示PCID2与胃癌患者预后密切相关。另外,本研究通过ROC曲线分析表明PCID2对评估胃癌患者术后5年内是否死亡具有较高的预测价值,提示PCID2有望成为评估胃癌患者预后的良好指标。以上研究结果表明PCID2在胃癌组织中高表达并影响患者预后。
基于以上发现,我们尝试进一步探究PCID2影响患者预后的可能途径。首先通过GO功能富集分析发现,PCID2的生物学功能可能与细胞周期G1/S期转变有关。为进一步探究PCID2对胃癌细胞周期的调控作用,我们采用慢病毒转染的方式分别构建敲低和过表达PCID2的胃癌细胞系。CCK-8实验显示PCID2过表达能够促进胃癌细胞增殖。同时,流式细胞术分析发现PCID2过表达能够促进胃癌细胞G1/S期转变,并可促进细胞周期关键蛋白CyclinD1和CDK6表达,而敲低PCID2则会产生相反的效果。最后,PCID2对胃癌细胞增殖及周期进程的调控作用也进一步在裸鼠成瘤实验中得到验证,但具体的分子机制仍有待进一步探究。
已有研究表明,细胞周期紊乱引起的肿瘤增殖失控是导致癌变的重要原因,其中G1/S期的转变是调控细胞周期的关键因素[23-25]。既往报道显示,p27和p16属于细胞周期蛋白依赖性激酶抑制蛋白(CDKIs)家族[26]。其中,p27基因主要负向调节Cyclin E和CDK2的活性,抑制G1期细胞进入S期,进而阻碍细胞的增殖和分裂[27-29];而p16基因可直接与Cyclin D竞争性结合CDK4,降低Cyclin D/CDK4复合物活性,抑制G1/S期的转变,影响细胞周期的进展[30,31]。既往研究发现,p27和p16曾作为抑癌基因,通过调节癌细胞生长周期参与多种恶性肿瘤的发生发展[32-34]。基于此,我们检测了胃癌组织及癌旁组织中p27和p16蛋白的表达情况,发现它们在胃癌组织中低表达。此外,进一步利用体内外实验发现,过表达PCID2可抑制p27和p16蛋白表达,敲低则促进p27和p16蛋白表达。以上实验结果提示,PCID2促进胃癌细胞增殖和周期进程可能与抑制p27和p16表达有关。
本研究同时也存在以下不足:我们的研究对象数量有限,仍需进一步扩大样本量来证明现有结论;此外,虽然本研究证实了PCID2可能通过抑制p27、p16表达促进胃癌细胞增殖及周期进程,但不能排除PCID2通过其他机制影响胃癌恶性进程的可能。
综上所述,本研究证实PCID2在胃癌组织中高表达,并可能通过抑制p27和p16表达促进胃癌细胞增殖和周期进程,进而影响患者预后。本研究不仅拓展了对PCID2生物学功能的认识,还有望为胃癌靶向治疗及患者预后评估提供新的分子参考。

