聚乳酸/羟基磷灰石/磷钙锌石复合支架促进大鼠骨质疏松性骨缺损愈合
罗彩珠,陈金香,张 群,于学钊,张书勤
南方医科大学1第三附属医院//广东省骨与关节退行性疾病重点实验室,广东 广州 510630;2药学院//国家药监局药物代谢研究与评价重点实验室,广东 广州510515
随着我国人口老龄化,骨质疏松问题日益突显,逐渐成为公共卫生挑战[1]。骨质疏松的特点是骨量减少和骨微结构破坏,增加骨折风险同时伴随严重并发症,给患者和社会带来了严重的负担[2]。骨质疏松患者的骨再生细胞缺陷,包括数量减少和功能降低,导致骨组织的再生过程受限;此外,骨质疏松患者体内骨髓间充质干细胞向脂肪细胞方向分化增多,而向成骨细胞方向分化减弱,使得骨组织的修复受到影响[3,4]。因此针对骨质疏松性骨缺损骨骼微环境开发更适合的骨移植物很有必要。
Zn2+与人体骨骼密切相关,Zn2+能够有效地刺激人类骨骼形成[5],在健康成年人中,循环中的Zn2+浓度与骨钙素呈正相关,与骨再吸收标志物呈负相关[6];同时研究表明,Zn2+在骨质疏松性骨折的发生发展中也起着重要作用,并且随着衰老和骨骼流失,绝经后女性骨骼中的Zn2+含量下降[7]。因此,在OP患者在骨缺损后,如果能实现Zn2+在损伤部位的持续释放,可能会更好地治疗骨质疏松性骨缺损。
将具有生物可降解性质、良好机械强度的聚合物与生物活性陶瓷混合,制备出与天然细胞外基质相同的生物复合材料。本文选取聚乳酸(PLA)和羟基磷灰石(Ca5(PO4)3OH),HA作为生物复合材料,已有研究证实通过静电纺丝[8]、冷冻干燥[9]和溶剂浇铸法[10]制备的多孔PLA/HA复合材料具有优秀的力学性能和更高的促细胞增殖性能。迄今为止,研究人员通过3D打印制备了各种多孔PLA/HA支架,在提高力学性能的同时,实现了精确复杂的骨结构[11],具有很大的应用前景。在PLA/HA复合材料中载入Zn多将Zn2+掺入到HA中制备Zn-HA中,再与PLA复合,但已有研究表明,Zn2+的掺入降低了HA的溶解度和机械强度[12]。对Zn-HA已进行了大量的体外和体内研究,但Zn取代对HA骨传导特性的作用仍存在争议[13]。纳米磷钙锌石(nano size-scholzite CaZn2(PO4)2·2H2O,nZCP)可将Zn2+持续释放到骨微环境中,其在细胞水平的促成骨作用已被证实[14,15],但其在体内的活性尚未得到验证。通过湿化学方法可以很容易地获得nZCP,其还可以作为形成骨无机质主要成分HA的成核材料[14]。
本研究为了不影响HA的骨传导特性,利用所合成的粒径为10 nm的nZCP替代Zn-HA作为Zn2+的缓释平台,并将其与多孔PLA/HA支架进行复合。将不同剂量的nZCP 分别加入到PLA/HA 中,形成一组PLA/HA/nZCP(PHZ)复合支架。不受控制的Zn2+快速释放会破坏体内的Zn稳态,导致其他微量金属离子如Ca2+、Fe2+和Cu2+的缺乏,并与亲和位点结合导致蛋白质功能障碍[12]。因此,控制其在安全的范围内持续释放至关重要,为此探究了Zn2+的释放行为,设立含量梯度,找到PLA/HA具有较好成骨活性的nZCP含量。数据表明不同Zn含量的PHZ(分别为PHZ-1、PHZ-2、PHZ-3)支架具有连通的孔结构,粒径20~40 μm,具有良好的Zn2+缓释性能。PHZ-2、PHZ-3 两组即nZCP 质量百分比为4.5%~7.5%的PHZ支架在体外和体内表现出更佳的成骨活性。
1 材料和方法
1.1 药品及试剂
聚乙烯吡咯烷酮(相对分子质量40 000,Aladdin),Ca(OH)2、十二烷基硫酸钠、ZnO、H3PO4、1,4-二氧六环、二氯甲烷、PLA(相对分子质量80 000)、HA(Mcklin China),胎牛血清(Gibco),青霉素/链霉素(Procell),α-基础培养基、胰蛋白酶(Gibco),钙黄绿素/碘化丙啶细胞活力测定试剂盒(Beyotime),抗坏血酸、β-甘油磷酸(Mcklin),地塞米松(Pythonbio),4%多聚甲醛(Biosharp),PBS(Procell),ALP染色试剂盒(Beyotime),RIPA缓冲液(Aladdin),蛋白酶抑制剂(Solarbio),ALP检测试剂盒(NJJCBIO),0.2%茜素红(Solarbio),BCA蛋白测定试剂盒(Beyotime),抗RUNX2、抗ALP、抗-βactin等一抗(Abcam),二抗(Beyotime),苏木素-伊红染色试剂盒、亚甲基蓝酸性品红染色试剂盒(Solarbio)。
1.2 nZCP的制备
在聚乙烯吡咯烷酮(3.0 g)的超纯水溶液(100 mL)中依次加入Ca(OH)2(74 mg)、十二烷基硫酸钠(SDS 1.0 g)、ZnO(162 mg)。30 min内,滴加H3PO4(136 μL,用30 mL超纯水稀释),将混合溶液倒入厚壁试管中,80℃搅拌12 h,离心后,形成的nZCP沉淀物用超纯水冲洗3次,烘干备用。
1.3 复合支架的制备
1,4-二氧六环和二氯甲烷混合溶液(5 mL,v/v=85∶15)完全溶解PLA(0.85 g),接着加入HA和3种不同质量的nZCP(表1)。搅拌直到粉末完全在PLA均匀分散。将混合液体倒入模具,冷冻干燥3 d,去除溶剂,产物分别记为PLA/HA、PHZ-1、PHZ-2、PHZ-3。

表1 不同组别中每种组分的含量Tab.3 Content of each component in different scaffolds
1.4 表征
通过Zeta-sizer对nZCP的粒径大小进行测定。采用D8AA25 X衍射仪、SEM、FTIR光谱仪分别对不同支架和nZCP的粉末X射线衍射(PXRD)图谱、形貌、FTIR图谱进行了表征。此外用EDS不同支架进行了元素分析。为了观察Zn2+和Ca2+元素的释放,将支架浸泡在磷酸盐缓冲盐水(PBS pH=7.4)中,收集上清液,用电感耦合等离子体原子发射光谱法测定Zn2+和Ca2+的浓度。
1.5 复合支架压缩模量
在进行力学分析之前,将复合支架制备为圆柱体(直径6 mm,高12 mm)。之后,在万能力学试验机上进行压缩性测试。以1.0 mm/min的横向头速度向支架施加轴向压缩载荷,直到支架破裂。在加载过程中,记录载荷-位移数据并用于生成曲线,其中破坏载荷定义为抗压强度。
1.6 体外细胞试验
1.6.1 分离培养大鼠骨髓间充质干细胞(rBMSCs)采用全骨髓贴壁法从SD大鼠(4周龄)股骨和胫骨分离rBMSCs。分离的rBMSCs在含10%(v/v)胎牛血清和1%(v/v)青霉素/链霉素的α-基础培养基中,浓度为5%CO2,37 ℃培养,2 d后更换培养基。在细胞融合前,用0.25%胰蛋白酶收集细胞,将细胞重悬于新鲜培养基中,1.6.2 复合支架浸提液的制备 支架浸提液按照国际标准化方法(ISO 10993-12)制备[16]。简单地说,支架(3 cm2/mL)在37℃的成骨诱导培养基中37 ℃浸泡72 h。离心后,用带有0.22 μm过滤膜的注射器过滤上清液,得到支架浸提液。
1.6.3 复合支架的细胞相容性分析 细胞粘附后,将支架放到细胞板上共培养1、3、5 d,然后加入10 μL的2-(2-氧基-4-硝基苯)-3-(4-硝基苯)-5-(2,4-二硫苯)-2 h-四氮唑单钠盐(WST-8),37 ℃孵育30 min。使用酶标仪在570 nm处测定rBMSCs的A值。细胞接种至96孔,在37 ℃和5%CO2培养箱中培养。1、3和5 d后,按照制造商的说明,使用钙黄绿素/碘化丙啶细胞活力测定试剂盒对细胞进行染色。然后在激光扫描共聚焦显微镜下观察细胞(LSCM,NikonA1,Japan)。
1.6.4 ALP染色试验 rBMSCs接种于12孔板中,密度为4×105/孔。用不同支架浸提液制备成骨培养基(正常α-MEM培养基、50 μg/mL抗坏血酸、10 mmol/L β-甘油磷酸、100 nmol/L 地塞米松,分别与细胞作用7 d 和14 d。去除培养基,用4%多聚甲醛固定细胞20 min。PBS洗涤2次后,将ALP染色试剂盒制备的染色液加入每孔,在室温下黑暗孵育30 min。然后将液体取出,扫描全板,记录并观察ALP的表达。
1.6.5 ALP 活性测定 使用一定体积的RIPA 缓冲液和蛋白酶抑制剂。细胞在冰上溶解30 min,然后以15 000 r/min离心5 min,随后收集上清液。最后,使用ALP检测试剂盒通过记录微板检测器在520 nm处的吸光度值来测定上清液中的酶活性。将酶活性(IU/L)归一化为总蛋白(mg/dL)。
1.6.6 茜素红染色(ARS)采用ARS法测定细胞外基质矿化(ECM)。rBMSCs 接种于12 孔板中,密度为4×105/孔。14 d后,加入0.2%茜素红,室温孵育1 h。吸去染色液,扫描拍照。
1.6.7 qPCR定量检测 为了确定骨形成标记物的转录水平,用含有支架浸提液的成骨培养基在6孔板中处理rBMSCs 7 d 和14 d。原始细胞密度为1×106/孔。用Trizol 提取总RNA,然后反转录成cDNA,然后采用SYBR 法进行定量PCR 检测,反应过程如下∶95 ℃下30 s,95℃下5 s,60℃下34 s,循环40 次,95℃下15 s,60℃下1 min,95℃下15 s。引物序列见表2。
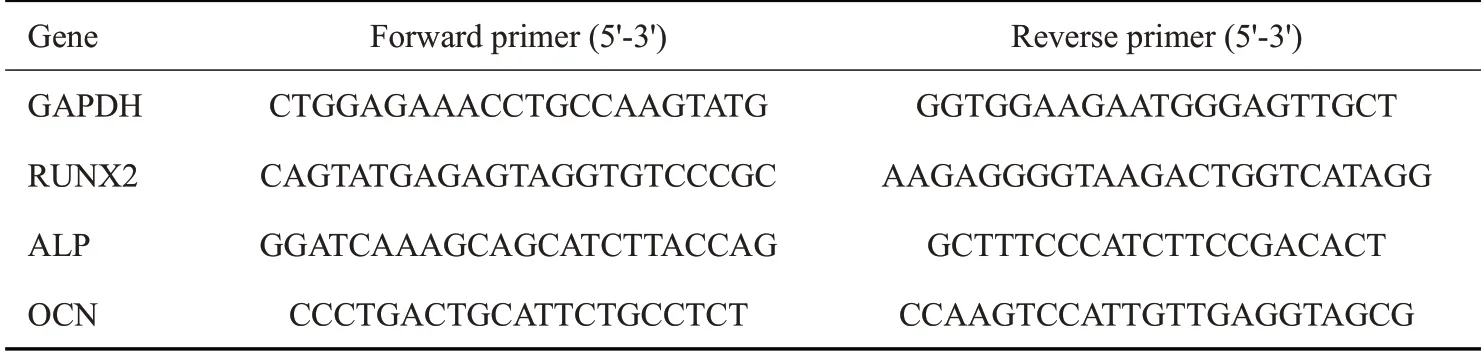
表2 引物序列表Tab.3 Primer sequences for RT-qPCR
1.6.8 Western blot检测 培养后第4天和第7天,从6孔板中收集细胞,用RIPA缓冲液裂解。用BCA蛋白测定试剂盒测定总提取蛋白浓度。随后,使用SDS-聚丙烯酰胺凝胶电泳从不同样品中分离出等量的蛋白质,并转移到聚偏二氟乙烯膜中。将膜与抗RUNX2、抗ALP、抗-β-actin等一抗在4℃孵育过夜,然后在室温下与二抗孵育1 h。最后,利用增强型化学发光检测试剂盒,捕获蛋白条带。
1.7 体内试验
1.7.1 动物造模 SD大鼠(雌性,8周龄)购自南方医科大学动物实验中心。所有实验程序均经南方医科大学动物伦理委员会批准(NO.44002100029647)。采用OVX模型诱导骨质流失(12周,体质量210±10 g)。OVX手术后8周,进行骨缺损手术。术前将体质量350±20 g的SD大鼠随机分为4组(PLA/HA、PHZ-1、PHZ-2、PHZ-3)。用电钻在股骨远端制造一个直径3.5 mm,深度4 mm的缺损,并在闭合前立即将复合支架放入骨缺损中。植入6周和12周后处死大鼠,取出股骨,用4%多聚甲醛固定,以备后续分析。
1.7.2 μCT成像评价 各组大鼠股骨用4%多聚甲醛固定,置于75%乙醇中待进一步分析。μCT 用于评价其微观结构和量化骨结构参数。扫描仪的设置电压为70 kV,电流为110 mA,分辨率为10.8 μm/像素[17]。整个股骨固定在一个长75 mm、直径20 mm的扫描支架中。X射线设置为55 kVp,145 μA,8 W。因构建的是股骨髁骨缺损模型故将感兴趣体积(VOI)定义为股骨远端股骨髁[18]。随后通过内置软件计算VOI的骨结构参数:骨矿物质密度(BMD,mg/cm3)、骨体积分数(BV/TV,%)、骨小梁厚度(Tb.Th,mm),骨小梁分离(Tb.Sp,mm),骨小梁数(Tb.N,1/mm)。股骨远端三维显微结构由MIMICS Medical 21.0 重建。
1.7.3 组织学评价 固定后的股骨样本用浓度从75%增加到100%的乙醇脱水,然后石蜡包埋。组织切片(厚度为4 μm)采用德国Leica 公司SP1600 型锯切片机制作。随后,用苏木素-伊红染色试剂盒和亚甲基蓝酸性品红染色试剂盒对缺损部分切片进行组织学观察。
1.8 统计分析
使用GraphPad Prism进行统计分析。数据分析采用Kolmogorov Smirnov方法检验正态性,然后进行单向方差分析(ANOVA)和t检验。当Ρ<0.05时认为差异有统计学意义。本研究中所述的所有数据都是基于每个实验重复3次的结果。
2 结果
2.1 nZCP和PHZ支架的表征
PXRD 谱中的所有峰10.3°、13.0°、19.4°、21.4°、26.1°、28.3°、31.9°、32.2°、34.6°、39.8°、47.6°、50.3°、55.3°均与标准ZCP(JCPDS No.35-0495)一致,证实了高纯度nZCP的成功合成(图1A)。SEM图像显示合成的nZCP呈球形,平均尺寸约为10 nm(图1B),与DLS结果一致(图1C)。

图1 nZCP及各组支架的表征Fig.1 Characterization of the synthesized nZCP and scaffolds.A:PXRD patterns of the synthesized nZCP and simulated ZCP.B:SEM of nZCP(scale bar:100 nm).C:Particle size distribution of nZCP.D,E:PXRD patterns and FTIR spectra of different scaffolds and their subcomponents.F,G:Typical stress-strain curves and compressive strength data of PLA/HA and PHZ.H,I:Zn2+and Ca2+release profiles of the scaffolds in PBS(pH=7.4).Data are shown as Mean±SD.**P<0.005,***P<0.0005,****P<0.0001.
在PXRD结果中,PLA/HA、PHZ-1、PHZ-2和PHZ-3的强2θ峰在16.8°和19.2°左右,表明这些支架主要成份是PLA,在10.3°和31.8°的衍射2θ峰分别属于nZCP和HA。PHZ中的特征峰与单组分相一致(图1D)。
在PLA 的红外光谱中,C=O 拉伸振动峰出现在1720 cm-1处,1110~1220 cm-1和1150 cm-1为酯类的C-O拉伸峰,2960 cm-1和2860 cm-1处的能带是-CH3的C-H不对称和对称拉伸,甲基的不对称和对称弯曲模式在1490 cm-1到1300 cm-1。HA谱中1160 cm-1~950 cm-1处的峰可视为磷酸盐γ1 和γ3 两种振动模式的特征峰,569 cm-1和604 cm-1处的峰可视为磷酸盐γ4振动模式的特征峰,HA谱中3430 cm-1处的峰属于羟基的特征峰(图1E)。
从支架的典型应力-应变曲线可以看出,PHZ-2和PHZ-3 的抗压强度高于PLA/HA 和PHZ-1(图1F)。PHZ-2 的抗压强度(2.63±0.23 MPa)与PHZ-3(2.42±0.16 MPa)相当,但显著高于PLA/HA(1.47±0.16 MPa,Ρ<0.0005)和PHZ-1(1.81±0.09 MPa,Ρ<0.005,图1G)。用ICP-MS 分析了支架中Ca2+和Zn2+的释放行为,前10 d两种离子的释放速度较快,随后逐渐减缓,达到稳定释放(图2H~I)。
扫描电镜显示,所有支架中均存在多孔结构(图2A、B)。随着nZCP含量的增加支架内部的粗糙度升高(图2C、表3)。
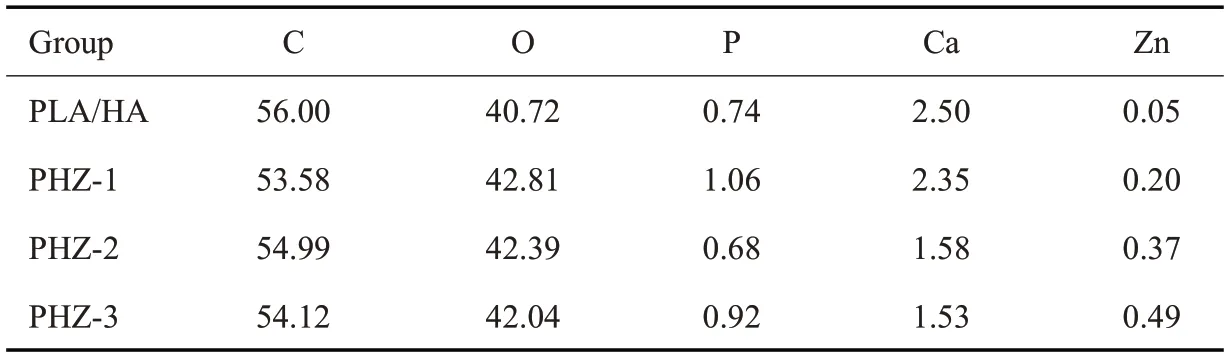
表3 通过EDS测定的不同组别原子百分含量Tab.3 Element atomic percentage of different samples determined by EDS(%)
2.2 复合支架作用下rBMSCs细胞增殖及成骨分化
CCK-8结果所示,各组与rBMSCs共培养1、3、5 d后增殖良好。含nZCP的支架A值与PLA/HA的支架A值差异无统计学意义(Ρ>0.05,图3A)。细胞死活染色结果,所有rBMSCs均附着在细胞培养板上分布良好,无细胞死亡(视野呈绿色荧光,几乎没有红色荧光,图3B)。

图3 支架具有良好的生物相容性,PHZ促进rBMSCsALP活性和胞外基质矿化Fig.3 Evaluation of biocompatibility of the scaffolds in rBMSCs and their effects on ALP activity and extracellular matrix mineralization of the cells.A:Viability of rBMSCs cultured with aqueous extracts of different scaffolds at 1,3,and 5 days.B:Livedead staining of the rBMSCs (green and red colors indicate living and dead cells,respectively;scale bar:250 μm).C,D:ALP staining of rBMSCs at 7 days of incubation with the scaffold extracts.E,F:at 14 days.G:ARS staining of rBMSCs at 14 days of incubation(scale bar:250 μm).Data are shown as Mean±SD.*P<0.05,**P<0.005,***P<0.0005,****P<0.0001.
ALP染色结果所示,随着体系中nZCP含量的增加,第7天ALP染色程度加深(图3C),第7天的ALP活性定量进一步证实了染色结果(图3D)。PHZ-3组的ALP 活性显著高于PLA/HA 组(Ρ<0.0001)、PHZ-1 组(Ρ<0.0005)、PHZ-2组(Ρ<0.005)。第14天,趋势与第7天的结果相同(图3E、F)。ARS结果显示,与其他组相比,PHZ-2和PHZ-3的钙结节数量明显升高(图3G)。
PHZ-3培养7 d后RUNX2(Ρ<0.0005)和OCN(Ρ<0.005)表达水平明显高于PLA/HA组,而PHZ-2的ALP表达水平最高(Ρ<0.0001,图4A1~A3)。培养14 d后,与PLA/HA 相比,PHZ-2 中OCN(Ρ<0.0001)和ALP(Ρ<0.0005)的表达上调最明显,而RUNX2在PHZ-3中最高(Ρ<0.05,图4B1~B3),这与第7天的结果不一致。Western blot结果显示,与其他各组相比,PHZ-2在第4天(Ρ<0.05)和第7 天(Ρ<0.05)RUNX2 蛋白表达量最高,第4天ALP蛋白表达无显著差异,但第7天PHZ-2(Ρ<0.05)和PHZ-3(Ρ<0.05)的ALP蛋白表达略有增加(图5A~D)。
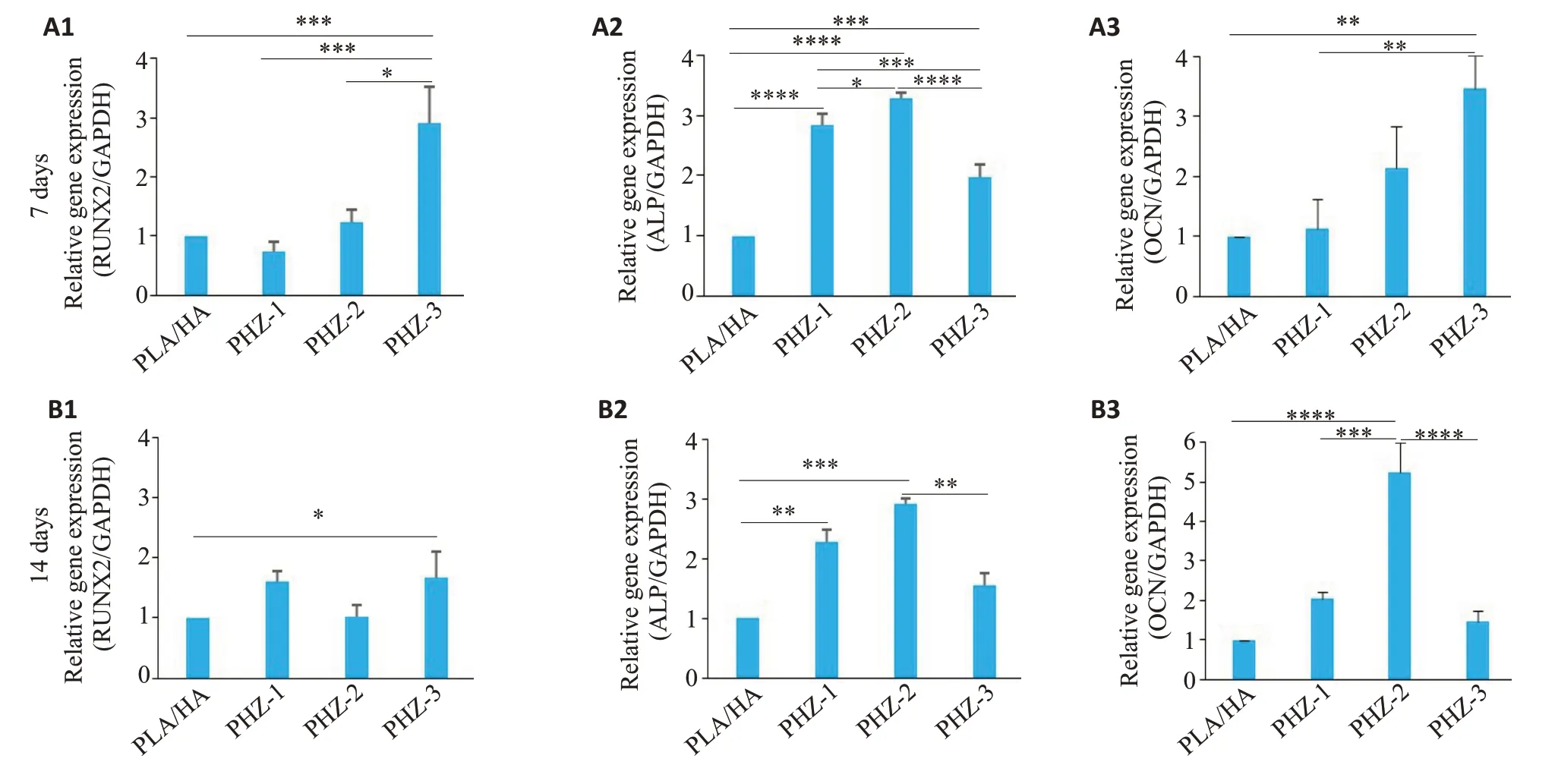
图4 PHZ在7 d和14 d促进成骨相关基因RUNX2、ALP、OCN转录Fig.4 PHZ promotes transcription of osteogenic genes RUNX2,ALP and OCN in rBMSCs at 7 and 14 days.A:Expression levels of RUNX2 (A1),ALP (A2),and OCN (A3) mRNA in rBMSCs treated with the scaffold extracts for 7 days.B:Expression levels of RUNX2(B1),ALP(B2),and OCN(B3)in rBMSCs treated with the scaffold extracts for 14 days.Data are shown as Mean±SD.*P<0.05,**P<0.005,***P<0.0005,****P<0.0001.

图5 PHZ在4 d和7 d促进成骨相关基因RUNX2、ALP表达;OVX术后8周骨质疏松模型成功构建Fig.5 PHZ promotes expressions of RUNX2 and ALP proteins in in rBMSCs and establishment of a osteoporotic rat model 8 weeks after OVX surgery. A: Western blots of RUNX2 and ALP proteins in rBMSCs treated with the scaffold extracts for 4 days. B1, B2:Quantification of RUNX2 and ALP protein at 4 days.C:Western blots of RUNX2 and ALP in rBMSCs incubated with different extracts for 7 days.D1,D2:Quantification of RUNX2 and ALP protein at 7 days.E1,E2:Three-dimensional reconstruction of femoral condyle trabecular bone at 8 weeks after OVX(E1)and sham operation(E2).F:Bone parameters in femoral condyle at 8 weeks after OVX.Data were shown as Mean±SD,*P<0.05,**P<0.005,***P<0.0005.
2.3 PHZ在体内刺激成骨
OVX手术8周后,假手术组与OVX组与的骨参数BV/TV(Ρ<0.05)、Tb.Th(Ρ<0.05)、骨形态有显著差异,说明骨质疏松模型构建成功(图5E、F)。股骨髁缺损造模6周和12周后采集股骨,μCT图像显示缺损部位的冠状面、矢状面和水平面上新形成的骨(图6A~C)。在6周的样本中,4组材料没有明显降解(图6A~C),但支架周围有新的骨骼生长。术后12周骨缺损内新骨长入支架的三维重建图像(图6D),与PLA/HA和PHZ-1相比,PHZ-2和PHZ-3中发现了更多的新骨。定量分析显示,PHZ-3组的BMD(Ρ<0.05)和BV/TV(Ρ<0.05)参数相较于PLA/HA显著增加,PHZ-2和PHZ-3组Tb.Sp值低于PLA/HA组(Ρ<0.05),但4组的Tb.N 和Tb.Th 参数无统计学差异(图6E)。在手术6周时,在PHZ-3支架内部和表面内均观察到新形成的组织,而其他组仅在表面出现少量新生组织(图7A1)。手术12 周时,PHZ-2 和PHZ-3的新生组织多于其余两组(图7A2)。亚甲基蓝酸性品红染色时,新成熟骨组织和骨类似物分别被染色为暗红色和紫灰色(图7B)。
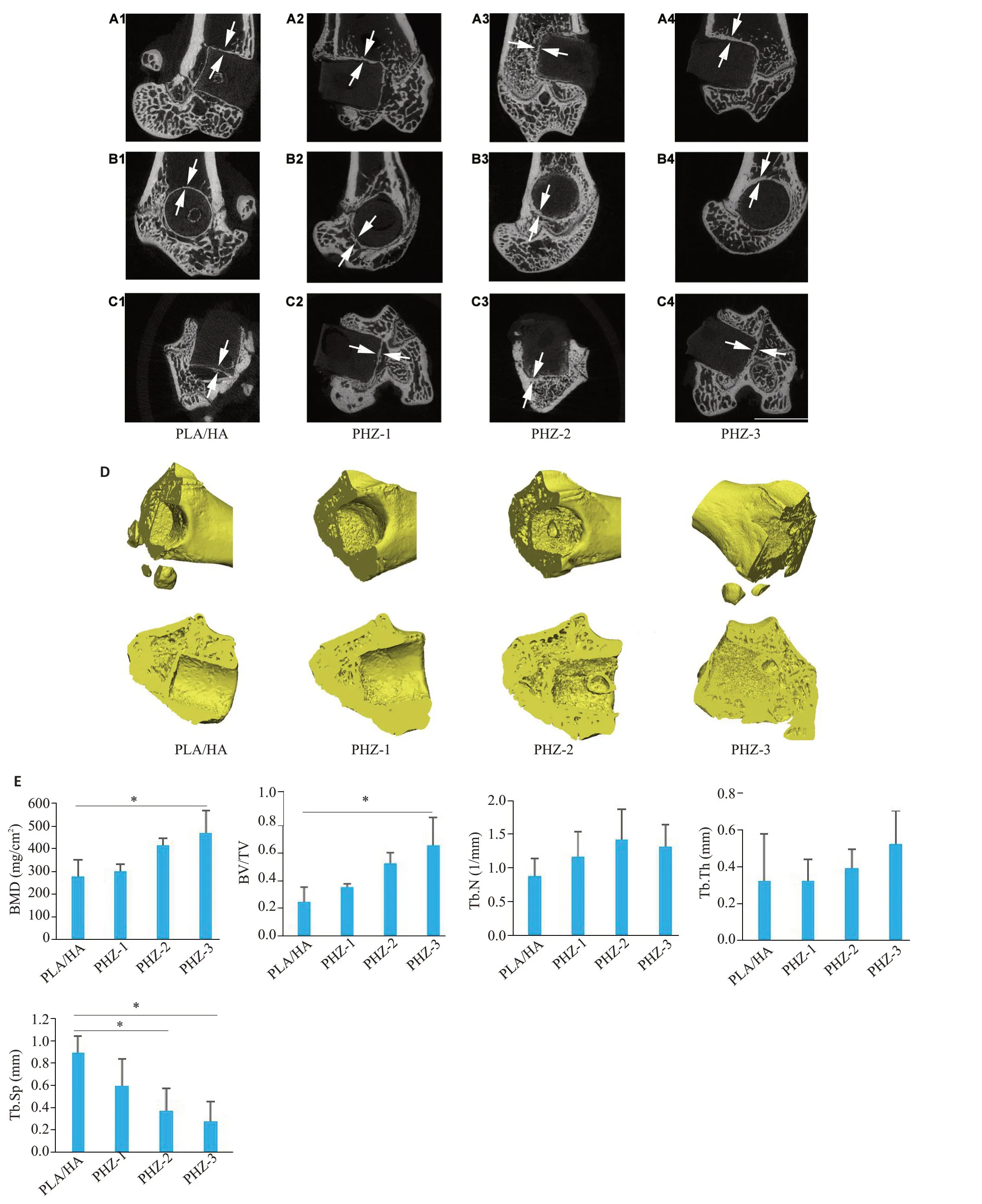
图6 PHZ在骨缺损术后6周,12周促进骨整合和骨修复Fig.6 PHZ promote bone graft integration and bone repair at 6 weeks and 12 weeks after scaffold implantation.A-C:MicroCT images of bone defects in the coronal plane(A1-A4),sagittal plane(B1-B4),and horizontal plane(C1-C4)at 6 weeks after implantation(scale bar:5 mm).D:Threedimensional reconstruction of bone defects observed from different angles at 12 weeks.E:Bone parameters of the bone defects at 12 weeks.Data are shown as Mean±SD,*P<0.05.
3 讨论
已有研究证实PLA/nHA支架在动物体内具有良好的生物相容性,当nHA在PLA的质量分数为15%时对细胞的增殖效果最好,因此在此项研究中PLA中掺入HA和nZCP质量百分数为15%[19]。支架结构方面,内部孔隙连通,大孔径约40 μm,有利于成骨[20,21]。在组成方面,PHZ 支架中含有Ca、P 和Zn 元素,同时HA、ZCP二者在PHZ支架中均匀分散。经nZCP掺杂后,HA的XRD谱峰未发生变化,表明HA的晶格参数未受影响[20]。从FTIR 结果可以看出,PHZ 与PLA、HA、nZCP有相似的FTIR峰值,说明PLA、HA、nZCP只是简单的混合,不涉及化学键变化[22]。nZCP在PHZ中的分散分布促进了降解过程中支架中Zn2+的连续稳定释放,从而实现了长时间有效的成骨。PLA/nHA、PHZ支架抗压强度接近松质骨(抗压强度:0.1~16 MPa)[23],PHZ-3与PHZ-2两组的抗压强度高于PLA/nHA、PHZ-1,可能是因为nZCP填充了nHA颗粒之间的空隙并且nZCP加入后支架内的无机组分有一定的团聚,提高了支架的抗压强度。这有利于其未来在骨科治疗中的应用,但PHZ的力学性能还不能完全满足骨缺损再生的需要,今后还需进一步改进。
高剂量的Zn2+(600~900 μmol/L)被发现具有细胞毒性且对真核细胞往往是致命的[24-26]。因此,需调整生物材料中Zn2+的含量保证其对真核细胞的无毒,同时,PHZ支架在30天内持续释放Zn2+,从3种不同Zn含量的支架PHZ-1、PHZ-2、PHZ-3所释放的Zn2+浓度均在1~50 μmol/L的有效成骨细胞活性范围内[24]。这种控制Zn2+的释放可以使Zn2+保持在低浓度,降低毒性,这对未来PHZ支架在人体上的安全应用至关重要。
接下来,验证PHZ支架促进rBMSCs的增殖和成骨分化。添加nZCP对rBMSCs的增殖无不利影响,为后续rBMSCs的成骨分化提供了基础。随后,我们研究了支架对rBMSCs成骨分化的影响,有研究结果表明,Zn2+能够在增殖分化期通过刺激ALP活性和胶原合成来增加成骨作用[27],发现添加nZCP增强了rBMSCs的ALP 活性和矿化过程。已有研究指出,Zn2+通过RUNX2的表达影响成骨活性,RUNX2是一种关键的成骨特异性转录因子,被认为是成骨分化的早期标志,OCN被认为是成骨分化的晚期标志物[28],RUNX2是ALP、OCN的主要调控因子[29]。nZCP的加入对RUNX2、ALP、OCN基因和蛋白的表达均有上调作用,但不同的nZCP加入量在成骨分化不同时期4、7、14 d表现出不同上调程度,这可能与其他由支架释放的离子如Ca2+和PO43-离子的共同作用有关[30]。nZCP的加入可加速成骨分化过程,PHZ-2、PHZ-3两组的促成骨活性较好。
最后,体内实验再次证实nZCP的加入提高了支架的成骨性能。由于支架的孔连通性和大孔结构,新生骨可从支架的外围向内部生长。新骨在支架内部的生长证明了支架具有良好的骨传导性。Zn2+的早期释放可促进rBMSCs的粘附,粘连性能的改善有利于成骨早期的骨整合[31],为后续rBMSCs的成骨分化提供了基础。与PLA/nHA 相比,添加了nZCP 的PHZ-1、PHZ-2、PHZ-3形成了更多的新骨,说明nZCP内Zn2+的释放增强了支架的成骨能力;PHZ-2、PHZ-3促成骨效果好于PHZ-1,说明PHZ-2、PHZ-3内的nZCP含量更有利于骨再生。
综上所述,本研究通过水热法合成了粒径均匀(10 nm)的nZCP 并将其与多孔PLA/HA 支架进行复合。同时探究了在PHZ复合支架内Zn2+的释放行为以及其细胞毒性,验证了PHZ支架的生物相容性,通过体内外实验找到PLA/HA内具有较好成骨活性的nZCP含量。但是因为PHZ同时可释放Ca2+和PO43-离子,其在体内外表现出的促成骨活性可能是多种离子共同作用的结果,所以在PLA/HA掺入最佳的锌含量仍需进一步实验,但可以得出结论PHZ-2、PHZ-3是应用于骨质疏松性骨缺损有前景的复合材料。

