离子液体1-乙基-3-甲基咪唑亚磷酸甲酯盐与1-乙基-3-甲基咪唑亚磷酸乙酯盐的热物性
刘泽鹏,曾纪珺,廖袁淏,唐晓博,赵波,韩升,张伟
(西安近代化学研究所,氟氮化工资源高效开发与利用国家重点实验室,陕西 西安 710065)
离子液体(ionic liquids)是一种熔融温度在近室温范围内(一般小于100℃)的有机盐,通常由大体积有机阳离子(如咪唑、吡咯、吡啶和季铵)和有机或无机阴离子(如[BF4]-、[PF6]-、[N(SO2CF3)2]-和[N(SO2F)2]-等)组成[1]。符合条件的阴阳离子可以组合成多种离子液体,这些离子液体具有许多特性,如极低的蒸气压、高电导率、高热稳定性、宽电化学稳定电位窗口和宽液态温度范围等[2]。相关研究表明,离子液体中阴离子结构对离子液体的性质具有决定性作用[3-5],而改变阳离子结构可以对离子液体相关性质进行一定程度上的调控[6-7]。因此,了解离子液体阴离子结构与其热物性之间的构效关系是设计开发出新型离子液体的关键[8]。目前,大部分关于离子液体热物性的研究主要集中在含氟阴离子([BF4]-、[PF6]-和[N(SO2CF3)2]-)[9-11]、磺酸/硫酸酯类阴离子([CH3SO3]-、[CF3SO3]-和[EtSO4]-)、羧酸类阴离子([CH3COO]-、[CF3COO]-)和卤素类阴离子(Cl-、Br-、[AlCl4]-)等,但是对于新型磷酸酯类和亚磷酸酯类离子液体的热物性研究较少,限制了该类离子液体的应用进程[12-14]。
亚磷酸酯阴离子类([RO(H)PO2]-)离子液体相比于大部分含氟离子液体具有毒性低、合成过程简单、原料价廉、耐腐蚀等优点,因此在金属材料润滑、纤维素溶解、萃取精馏等方面得到较广泛的应用研究[15-17]。而对亚磷酸酯离子液体开展设计合成和应用研究的前提是了解其热物性质。通过测试分解温度、固液相变温度、密度、黏度、电导率和表面张力等数据,并对数据进行分析处理是准确描述离子液体热物性质的主要手段。然而,目前关于亚磷酸酯类离子液体热物性数据的报道较少,仅有少量关于1-乙基-3-甲基咪唑亚磷酸甲酯盐([Emim][OMP])的热物性报道。Hiraga 等[18]报道了[Emim][OMP]在293.15~373.15K 范围内的密度,并以此计算得到了离子液体的热膨胀系数和压缩系数;Hasse等[19]报道了[Emim][OMP]在273.15~333.15K 范围内的黏度;Almeida 等[20]报道了298.2~343.1K 范围内的表面张力,并通过线性方程拟合计算得到了表面熵、表面焓和临界温度。
本文选择[Emim][OMP]和1-乙基-3-甲基咪唑亚磷酸乙酯盐([Emim][OEP])为研究对象,合成了这两种离子液体,并对其结构进行了表征。测定了两种离子液体的热稳定性、相行为、293.15~353.15K 范围内的密度和黏度,以及293.15~343.15K 范围内的电导率和表面张力,将实验值与数学模型关联,根据实验值和模型方程计算了离子液体的体积性质和表面性质,包括离子液体的热膨胀系数、分子体积、标准熵、晶格能、表面熵和表面焓,并讨论了两种离子液体的离子性。
1 实验部分
1.1 实验试剂与仪器
1-甲基咪唑(≥99%)、1-乙基咪唑(≥98%)、亚磷酸二甲酯(≥98%)、亚磷酸二乙酯(≥99%)和乙醚(≥99.7%),上海麦克林生化科技有限公司。
Advance 500 核磁共振波谱仪,德国Bruker 公司;Vario EL Cube 型元素分析仪,德国Elementar公司;DL31 型卡尔费休水分仪,瑞士METTLER TOLEDO公司;STA 449 F5型同步热分析仪,德国Netzsch 公司;DSC 214 Polyma 型差示扫描量热仪测定,德国Netzsch公司;SVM 3000型密度黏度仪,奥地利Anton Paar公司;FE30型电导率仪(配LE703电极),瑞士METTLER TOLEDO 公司;LS800S 型手套箱,成都德力斯公司;标准型DSA25S接触角测量仪,德国KRUSS公司。
1.2 离子液体[Emim][OMP]与[Emim][OEP]的合成及结构表征
1.2.1 离子液体[Emim][OMP]的合成
将14.42g (0.15mol) 1-乙 基 咪 唑 和16.51g(0.15mol)亚磷酸二甲酯加入干燥的烧瓶中,并将混合物在氮气气氛中130℃搅拌24h。冷却后,将混合物用乙醚洗涤4 次,通过旋转蒸发除去乙醚。将产物在80℃、1Pa 下干燥24h,得到26.29g 无色液体,产物收率85%,含水量为243mg/kg。
1.2.2 离子液体[Emim][OEP]的合成
将12.32g (0.15mol) 1-甲 基 咪 唑 和20.72g(0.15mol)亚磷酸二乙酯加入干燥的烧瓶中,并将混合物在氮气气氛中130℃搅拌24h。冷却后,将混合物用乙醚洗涤4 次,通过旋转蒸发除去乙醚。将产物在80℃、1Pa 下干燥24h,得到27.22g 无色液体,产物收率82%,含水量为265mg/kg。
1.2.3 结构表征
离子液体的结构通过核磁共振光谱和元素分析得到证实。使用核磁共振波谱仪进行核磁共振分析,以氘代乙腈为内标溶剂。使用元素分析仪CHN模式测定离子液体中碳、氢和氮三种元素的含量。
1.3 热物性测定
1.3.1 热稳定性
采用同步热分析仪测量离子液体的热分解温度。每个样品取样5~10mg 置于铂盘上,将盛有样品的铂盘在氮气(20mL/min)氛围中从308.15K加热至973.15K,升温速率为10K/min。标准不确定度为u(T)=±1K。Tstart是样品开始失重或发生热分解的温度。Tonset是样品开始发生显著质量损失或反应的温度点,标志着样品在该温度附近发生热性质变化,本文取实验开始时基线与分解时质量分数-温度曲线切线的交点为Tonset。
1.3.2 相行为
离子液体的固液相变过程使用差示扫描量热仪测试。使用铝盘称量样品,并在密封条件下,氮气气氛中从293.15K 加热至333.15K,然后冷却至123.15K 并再次加热至333.15K。在加热循环过程中记录玻璃化转变温度(Tg,热容变化的开始)、结晶温度(Tc,放热峰的开始)、固-固转变温度(Ts-s,吸热峰的开始)和熔点(Tm,吸热峰的开始)。
1.3.3 密度和黏度
使用密度黏度仪同时测量273.15~353.15K范围内离子液体的密度ρ(g/cm3)和黏度η(Pa·s)。该仪器使用矿物质标准油在273.15~363.15K的温度范围进行了校准。测量标准不确定度为u(ρ)=±0.0005g/cm3,u(η)=±0.35%Pa·s,u(T)=±0.02K。所有测量重复三次,取其平均值。
1.3.4 电导率
采用电导率仪测量离子液体的电导率σ(mS/cm),测试前用氯化钾溶液(0.1mol/L)校准。在手套箱中进行测试,使用外部油浴控制温度,每个温度点的平衡稳定时间为1h。测量标准不确定度为u(σ)=±0.5%mS/cm,u(T)=±0.3K。所有测量重复三次,取其平均值。
1.3.5 表面张力
使用标准型接触角测量仪测定表面张力γ(mN/m),并使用注射器产生液滴。使用Advance软件评估液滴的形状。测量记录在293.15~343.15K的温度范围内,并在开放环境条件下进行。标准不确定度为u(T)=±0.1K 和u(γ)=±1mN/m。所有测量重复三次,取其平均值。
2 结果与讨论
2.1 结构表征
通过1H 和13C 核磁数据和元素分析结果确定所合成的离子液体为目标结构,见图1、图2。

图1 1-乙基-3-甲基咪唑亚磷酸甲酯盐的核磁共振氢谱图和碳谱图

图2 1-乙基-3-甲基咪唑亚磷酸乙酯盐的核磁共振氢谱图和碳谱图
(1) 1-乙基-3-甲基咪唑亚磷酸甲酯盐([Emim][OMP])
淡黄色液体。1H NMR(500MHz,CD3CN)化学位移δ:1.47(t,3H),3.38(d,3H),3.91(s,3H),4.25(q,2H),6.66(d,1H),7.53(q,1H),7.59(q,1H),9.95(s,1H)。13C NMR(125MHz, CD3CN)化学 位 移δ:14.73,35.54,44.51,49.24,49.27,121.87,123.45,137.89。C7H15N2O3P元素分析:计算值,C 40.78%、H 7.33%、N 13.59%;实验值,C 40.46%、H 7.36%、N 13.49%。
(2) 1-乙基-3-甲基咪唑亚磷酸乙酯盐([Emim][OEP])
淡黄色液体。1H NMR(500MHz,CD3CN)化学位移δ:1.13(t,3H),1.44(t,3H),3.71(t,2H),3.90(s,3H),4.25(q,2H),6.71(d,1H),7.67 (t,1H),7.75(t,1H),10.15(s,1H)。13C NMR(125MHz,CD3CN)化学位移δ:14.85,16.30,16.36,35.50,44.40, 58.00, 58.03, 122.04, 123.56, 138.10。C8H17N2O3P元素分析:计算值,C 43.63%、H 7.78%、N 12.72%;实验值,C 43.25%、H 7.82%、N 12.59%。
2.2 热稳定性和相行为
热重分析曲线如图3所示,根据热重分析曲线得到离子液体的Tstart和Tonset,如表1 所示。[Emim][OMP]与[Emim][OEP]的热稳定性相近,分解温度分别为271.0℃和259.2℃。对比常见的含氟阴离子类离子液体,四氟硼酸盐([Cnmim][BF4])的Tonset在395~420℃范围内,六氟磷酸盐([Cnmim][PF6])的Tonset在400~430℃范围内,三氟甲磺酰亚胺盐([Cnmim][Tf2N])的Tonset在390~440℃范围内。因此,[Emim][OMP]与[Emim][OEP]的热稳定性,相比含氟阴离子类离子液体要更差。但与烷基咪唑卤盐(Tonset= 255~280℃) 和烷基咪唑硝酸盐(Tonset=280~290℃)相当,强于烷基咪唑醋酸盐(Tonset=220~230℃)[21]。

表1 [Emim][OMP]与[Emim][OEP]的Tstart和Tonset

图3 [Emim][OMP]与[Emim][OEP]的热重分析曲线图
使用差示扫描量热法对离子液体的固液相变进行了研究(图4),结果表明[Emim][OMP]与[Emim][OEP]不存在熔点或凝固点,只有玻璃化转变。[Emim][OMP]和[Emim][OEP]的Tg分别为-84.87℃和 -85.00℃,即[Emim][OMP]与[Emim][OEP]并不存在真正意义上的固液相变,而只有冷却或加热过程中产生的无定形玻璃态与液态之间的转变。

图4 [Emim][OMP]与[Emim][OEP]的DSC图
2.3 密度和体积性质
密度是离子液体应用研究中最重要的物理性质之一,并且密度受温度、纯度等因素影响较小,离子 液 体[Emim] [OMP] 与[Emim] [OEP] 在293.15~353.15K范围内的密度及[Emim][OMP]密度的文献值见表2,[Emim][OMP]与[Emim][OEP]的密度随温度变化曲线如图5所示。

表2 [Emim][OMP]与[Emim][OEP]在293.15~353.15K范围内的密度实验值及[Emim][OMP]密度的文献值

图5 [Emim][OMP]与[Emim][OEP]的密度随温度变化曲线
对比文献值可以发现实验测定的[Emim][OMP]的密度值与文献值相对误差不超过0.2%,实验值与文献值吻合较好。离子液体的密度主要与分子量和阴阳离子间相互作用力有关。[Emim][OEP]的密度略小于[Emim][OMP]的密度,考虑[Emim][OEP]的分子量大于[Emim][OMP],因而可以推断,由于阴离子碳链的延长,阴阳离子间相互作用力减弱,因而导致[Emim][OEP]的密度减小。
依据测得的密度实验值,计算了离子液体相关的体积性质,包括热膨胀系数、分子体积、标准熵和晶格能。
2.3.1 热膨胀系数
离子液体的恒压热膨胀系数αp的定义式为式(1)[22]。
由式(1)可知,通过对lnρ与T作直线拟合,拟合方程为式(2),所得线性拟合方程的斜率负值即为离子液体的热膨胀系数αp。离子液体[Emim][OMP]和[Emim][OEP]的lnρ对T的线性方程拟合的参数、相关系数及平均相对误差见表3,其中平均相对误差Δ采用式(3)计算[23]。拟合的相关系数均大于0.9999,Δ 均小于0.01%,由此可知,密度的自然对数方程预测值与实验值一致。

表3 [Emim][OMP]与[Emim][OEP]的lnρ对T的线性方程拟合参数
式中,ρ为密度,g/cm3;ρ0为拟合参数,g/cm3;α为热膨胀系数,K-1;T为热力学温度,K;Zexp和Zcal分别为实验值和计算值;n为数据点数。
由 表3 可 知, 离 子 液 体[Emim] [OMP] 和[Emim][OEP]的热膨胀系数与[Emim][BF4] (α=5.90×10-4K-1)[24]、[Emim][CH3SO3] (α=5.4458×10-4K-1)[25]等常规离子液体的热膨胀系数相当。
2.3.2 分子体积
离子液体的分子体积(Vm)定义为阴阳两个离子的体积加和,由式(4)计算而得。
式中,M是离子液体的相对分子质量,g/mol;NA为阿伏伽德罗常数,取值6.02×1023mol-1;ρ是298.15K 下离子液体的密度,g/cm3;Vm是298.15K下离子液体的分子体积,nm3。
离子液体[Emim][OMP]和[Emim][OEP]的分子体积见表4,[Emim][OMP]分子体积小于[Emim][OEP],这表明随着阴离子碳链的增长,离子液体分子量增大,相应分子体积也增大。

表4 [Emim][OMP]与[Emim][OEP]在298.15K下的分子体积、标准熵及晶格能
2.3.3 标准熵和晶格能
根据Glasser[22]经验方程,可以得到标准熵S⊖和晶格能UPOT关于分子体积Vm的表达式如式(5)、式(6)。
由表4可知,离子液体的标准熵随离子液体分子体积的增大而增大,即较大分子体积的离子液体阴阳离子间的相互作用更弱,更容易形成较高的无序状态,使得离子液体的标准熵更大。与之相反,离子液体的晶格能随着分子体积的增大而减小,UPOT([Emim][OMP])=459.54kJ/mol,UPOT([Emim][OEP])=447.97kJ/mol。这两种离子液体的晶格能比起传统的熔融盐要低很多,例如,碱金属卤化物中晶格能最低的是CsI,其晶格能为602.5kJ/mol,较低的晶格能是保证该类离子液体在室温下为液态的一个重要原因。
2.4 黏度
黏度是离子液体的一个关键特性参数,相较于常规有机溶剂,在室温下大多数离子液体的黏度要大得多,一般在0.01~1Pa·s 之间。离子液体[Emim][OMP]和[Emim][OEP]的黏度实验值如表5 所示,离子液体的黏度随温度变化曲线如图6所示。

表5 [Emim][OMP]与[Emim][OEP]在293.15~353.15K范围内的黏度

图6 [Emim][OMP]与[Emim][OEP]的黏度随温度变化曲线
离子液体的黏度主要由阴阳离子间的范德华力、氢键和库仑力等作用力共同决定[26],阴阳离子间的作用力越大,离子液体的黏度越大。对于结构相同的[Emim][OMP]和[Emim][OEP]离子液体,阴离子碳链增长会使阴离子的体积增大,从而增大离子间的范德华力,降低库仑力。根据图4曲线可知在相同温度下[Emim][OMP]的黏度小于[Emim][OEP],这表明[Emim][OEP]离子液体黏度增大主要来自范德华力变化的贡献[27-28]。
根据图6可知,离子液体的黏度随温度的升高呈减小趋势,采用VFT方程[29]拟合黏度与温度的关系,如式(7)。
式中,η为黏度,Pa·s;η0、Bη、T0,η为拟合参数;T为热力学温度,K。式(7)中的拟合参数、拟合相关系数和平均相对误差见表6,拟合相关系数R2均大于0.99999,平均相对误差Δ 均小于0.1%,因此黏度的VFT方程预测值与实验值一致。

表6 [Emim][OMP]与[Emim][OEP]黏度的VFT方程拟合参数、相关系数及平均相对误差
2.5 电导率
良好的电导率是离子液体能够用作电极材料的一个非常重要的性质,离子液体的电导率大多明显高于有机溶剂(最高可达20mS/cm)。[Emim][OMP]和[Emim][OEP]的电导率实验值见表7和图7。离子液体的电导率主要与黏度和离子尺寸有关,其中电导率与黏度成反比,而在黏度相当时,离子尺寸越小,电导率越大。由图7 可知,[Emim][OMP]的电导率明显大于[Emim][OEP],即[Emim][OMP]具有更低的黏度、更小的离子尺寸,因而具有更高的电导率。

表7 [Emim][OMP]与[Emim][OEP]在293.15~343.15K范围内的电导率

图7 [Emim][OMP]与[Emim][OEP]的电导率随温度变化曲线
由图7可知,离子液体的电导率随着温度的升高呈显著增大的趋势。采用VFT方程[30]拟合电导率与温度的关系,如式(8)。
式中,σ为电导率,mS/cm;σ0、Bσ、T0,σ为拟合参数;T为热力学温度,K。式(8)中的拟合参数、拟合相关系数和平均相对误差见表8,拟合相关系数R2均大于0.9999,平均相对误差Δ 均小于1%,因此,电导率的VFT方程预测值与实验值一致。
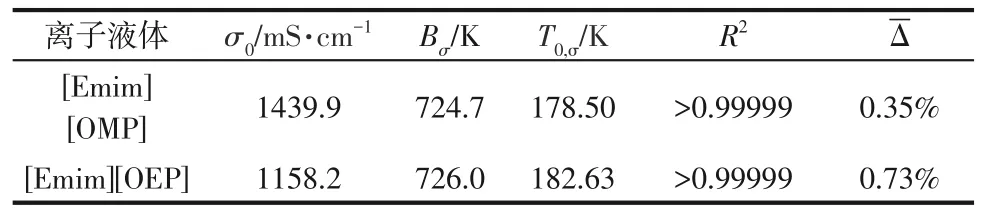
表8 [Emim][OMP]与[Emim][OEP]电导率的VFT方程拟合参数、相关系数及平均相对误差
2.6 离子性
离子液体的离子化程度通常使用离子性这一性质进行描述。基于密度和电导率实验值可以计算得到离子液体的摩尔电导率,计算公式如式(9)。根据Walden 规则表达式[(式(10)][31]可知离子液体的摩尔电导率与黏度呈反比例关系,其乘积称为Walden乘积,以此可以描述离子液体的离子性。
通过Walden 规则可以对离子液体的离子性简单定性,假定稀的KCl水溶液中的溶质完全离子化,由该溶液测量获得的摩尔电导率和黏度作的Walden线作为参考线。若离子液体的Walden 线位于参考线上部,则可认为是“super ionic liquid”;若离子液体的Walden线位于参考线下部,并在参考线的10%线的上部,可将该离子液体归类为“good ionic liquid”;若离子液体的Walden线位于参考线的10%线的下部,则可归类为“poor ionic liquid”[32-33]。
式中,Λ表示摩尔电导率,S·cm2/mol。
式中,W表示Walden乘积;η表示黏度,Poise,1Poise=0.1Pa·s。
[Emim][OMP]与[Emim][OEP]在温度为293.15~343.15K范围内的Walden图见图8。由图8可知,不同温度的实验点呈线性关系,这表明[Emim][OMP]与[Emim][OEP]均遵循Walden 规则。[Emim][OMP]与[Emim][OEP]的实验点均接近理想KCl 溶液线,依此可以将[Emim][OMP]与[Emim][OEP]归类为“good ionic liquid”。

图8 [Emim][OMP]与[Emim][OEP]的Walden图
2.7 表面张力
表面张力是一个对自由表面的物理和化学研究非常重要的性质,大部分离子液体的表面张力在30~60mN/m 之间[34]。[Emim][OMP]和[Emim][OEP]的表面张力实验值如表9和图9所示。对于亚磷酸酯离子液体,[Emim][OMP]在某论文中报道的其表面张力数据与本文最大偏差值达到了1.96mN/m。分析原因在于不同的课题组使用不同的测量方法测量表面张力,从而使测量实验值产生较大的偏差。因此,对于表面张力的测定,要达到准确可靠且具有复现性存在一定难度[35]。

表9 [Emim][OMP]和[Emim][OEP]在293.15~343.15K范围内的表面张力
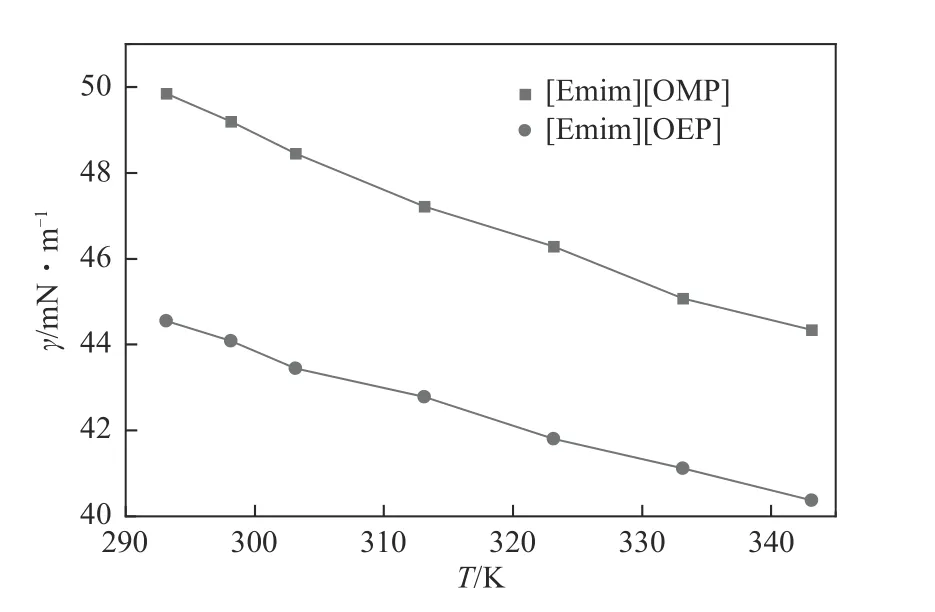
图9 [Emim][OMP]和[Emim][OEP]表面张力随温度变化曲线
[Emim][OMP]的表面张力大于[Emim][OMP],分析认为离子液体的表面张力随阴离子体积的增大而减小。表面张力与温度线性相关,根据式(13)可以计算离子液体的表面焓和表面熵[36]。
式中,γ为表面张力,mN/m;Hγ为表面焓,mJ/m2;Sγ为 表 面 熵,mJ/(m2·K);T为 热 力 学 温度,K。
表面焓Hγ、表面熵Sγ、拟合相关系数R2和平均相对偏差Δ 如表10 所示,拟合相关系数R2均大于0.99,平均相对误差Δ 均小于1%,因此,表面张力线性拟合方程预测值与实验值一致。根据拟合结果可以发现,[Emim][OMP]相比[Emim][OEP]具有更大的表面焓和表面熵,这归因于离子液体阴离子体积增大使得表面张力减小。

表10 [Emim][OMP]和[Emim][OEP]表面张力的线性拟合结果
3 结论
本文合成了两种烷基咪唑亚磷酸酯离子液体,即[Emim][OMP]和[Emim][OEP],使用核磁共振氢谱、碳谱和元素分析对产物进行了表征。在一定温度下测定了产物的热稳定性、相行为、密度、黏度、电导率和表面张力,通过数学模型关联了实验数据,并得到了以下结论。
(1)[Emim][OMP]和[Emim][OEP]只表现出玻璃化转变而无凝固点和熔点,热稳定性相比常见的烷基咪唑离子液体要略差。
(2)基于密度实验值计算了离子液体的体积性质,包括热膨胀系数、分子体积、标准熵和晶格能;基于表面张力实验值计算了离子液体自由表面的热力学性质,包括表面熵和表面焓。离子液体[Emim][OMP]和[Emim][OEP]的体积性质和表面热力学性质变化与离子液体的分子量变化具有较强关联性,其中分子量的增大来源于阴离子侧链烷基的增长,离子液体的阴离子体积也会随之增大,使得离子液体分子体积增大和表面张力减小,从而导致离子液体标准熵增大以及晶格能、表面熵和表面焓的减小。
(3)分别使用数学模型和经验方程关联离子液体的密度、黏度和电导率、表面张力。密度、黏度和电导率拟合相关系数均大于0.9999,表面张力拟合相关系数大于0.99,平均相对误差均小于1%,结果表明所用的数学模型和经验方程对离子液体的密度、黏度和电导率、表面张力均有较好的预测。这归因于实验仪器的精度较高,使得实验数据偏差较小,而所选择的数学模型能更好地拟合相关的实验数据。
(4)离子液体[Emim][OMP]和[Emim][OEP]均遵循Walden规则,且均属于“good ionic liquids”。

