左侧星状神经节吗啡后处理在心肌梗死后重塑中的调节作用
毛 遂,陶 辉,张 野
(安徽医科大学第二附属医院麻醉与围术期医学科;安徽医科大学麻醉与围术期医学安徽普通高校重点实验室,安徽 合肥 230601)
心室重塑是心肌梗死(myocardial infarction,MI)后心力衰竭的主要病理生理机制,其中交感神经的异常激活是引发心室不良重塑的强力驱动因素[1],星状神经节(stellate ganglion,SG)是颈交感神经系统的一部分,包含支配头部和颈部的交感神经节前纤维和支配心脏的交感神经节后神经纤维。研究表明急性MI可以诱导SG的神经重塑,另有报道称超声引导下注射A型肉毒杆菌毒素可阻断心脏交感神经节,以改善慢性MI大型动物模型中的心脏重塑[2-3]。这表明SG在交感神经调节心脏活动过程中发挥重要作用,其中左心室的神经调节主要由左侧星状神经节(left stellate ganglion,LSG)调控[4-5]。
吗啡属于阿片类镇痛药物,因其良好的镇痛和镇静作用,在临床麻醉中被广泛应用于心血管手术麻醉和术后镇痛。研究表明,吗啡预处理可以明显减轻大鼠冠状动脉结扎诱导的局部心肌缺血/再灌注损伤[6];并且在MI吗啡后处理中改善了大鼠左心室重构和功能障碍[7]。本课题组前期研究发现表明外周和中枢阿片预处理介导了鞘内吗啡的心肌保护作用[8-9],其机制涉及到SG中交感神经元的兴奋性。在此基础上,本研究拟进一步探讨LSG吗啡后处理在MI后重塑中的调控作用,以期为阿片类药物心肌保护机制研究提供新的思路和靶点。
1 材料与方法
1.1 实验动物健康雄性SD大鼠购于河南斯克贝斯生物科技股份有限公司,体质量(220~250)g,实验动物合格证号为:SYXK(皖)2020-001。大鼠被饲养在安徽医科大学第二附属医院的清洁级动物房中,房间昼夜周期为12/12 h,湿度设置为(40±15)%,环境温度设置为(22±1) ℃,大鼠可以自由的获取干净食物和水,垫料每两天更换一次。本实验所有操作符合安徽医科大学实验动物伦理委员会要求(编号:LLSC20221128)。
1.2 主要试剂和仪器盐酸吗啡注射液(批号:201206,沈阳第一制药厂);组织裂解液(P0013B)、蛋白酶磷酸酶抑制剂混合物(P1046)、BCA蛋白浓度测定试剂盒(P0010)和抗荧光淬灭封片液(P0131)等均购自上海碧云天生物技术有限公司;GAPDH(60004-1-Ig)抗体购自武汉三鹰生物技术有限公司;CollagenⅠ(ab260043)、Collagen Ⅲ(ab184993)和MOR(ab10275)抗体购自Abcam公司;Western blot兔二抗(31460)、Western blot鼠二抗(31430)、荧光兔二抗(A-11011)、反转录试剂盒(K1622)和总 RNA提取试剂TRIzol购自Thermo公司;ELISA试剂盒(JYM0295Ra)购自武汉基因美公司;SYBR-Green-qPCR标准混合液(RR820A)购自TaKaRa公司。小动物呼吸机(ALC-V8S)购自上海奥尔科特生物科技有限公司;蛋白电泳和转移设备(1658033)购自Bio-RAD公司;全自动化学发光图像分析仪(5200)购自上海天能科技有限公司;倒置显微镜(Vert.A1)购自蔡司公司;实时荧光定量PCR仪(CFX Connect)购自上海伯乐生命医学产品有限公司;小动物超声仪(VINNO 6)购自飞依诺科技股份有限公司。
1.3 方法
1.3.1模型的建立 大鼠腹腔注射3%戊巴比妥钠50 mg·kg-1,5 min后待大鼠充分麻醉后,将其固定在手术台面。胸部剃毛,并用75%酒精消毒3遍,对大鼠进行插管后,使用小动物呼吸机辅助呼吸,呼吸频率约为70~80次/min,潮气量约为25~30 mL·kg-1,呼吸比为1 ∶1。随后在左侧胸部平腋下肋间开胸暴露心脏,用6-0带针线在左心耳下缘2 mm穿过冠状动脉左前降支,随后结扎引起冠状动脉左前降支闭塞,肉眼可见结扎线到心尖部的心肌变白,并且心电图的Ⅱ导联显示ST段抬高。Sham组仅穿线但不结扎。MI+Morphine组在MI手术完成后按照经皮后入路SG阻滞的方式将0.15 g·kg-1吗啡注入大鼠LSG周围[10]。具体方法如下,首先触诊大鼠C7棘突作为定位标志点,然后使用1 mL注射器沿C7锥体左侧面垂直缓慢刺入,当针尖和锥体失去接触时,将其撤回约0.5 mm后缓慢注射吗啡。当大鼠从麻醉中恢复后观察大鼠有无上睑下垂等霍纳综合征表现来判断是否给药成功[11],在MI后3 d、6 d和9 d按照同样的方法注射相同剂量的吗啡。Control组按照同样方法注射生理盐水。
1.3.2超声心动图 4周后使用飞依诺兽用彩超仪对大鼠心功能进行检测。首先在B型模式下寻找大鼠心脏,然后切换至M型模式,随后测量各组大鼠左心室舒张末期内径( left ventricular internal diameter at end-diastole,LVIDd)、左心室收缩末期内径( left ventricular internal diameter at end-systole,LVIDs)、左心室射血分数( left ventricular ejection fraction,LVEF)、左心室缩短分数( left ventricular ejection fractional shortening,LVFS)。
1.3.3Masson染色 检测完超声后取大鼠心脏组织,使用PBS灌流后放入4%的多聚甲醛中固定,随后由武汉塞维尔公司专业技术人员进行切片,Masson染色和扫描。使用CaseViewer软件分析染色结果,ImageJ软件计算胶原容积分数(collagen volume fraction,CVF ) 。
1.3.4Western blot 取部分MI周围区组织,加入PIPA裂解液,研磨,离心后得到组织总蛋白。使用BCA试剂盒测定浓度后加入上样缓冲液,100 ℃金属浴10 min后自然冷却10 min,-20 ℃保存待测。取20 ug蛋白进行凝胶电泳,然后转移到PVDF膜上进行转膜,把膜放入快速封闭液中封闭30 min。按照蛋白分子量裁出相应蛋白条带,然后分别放入GAPDH(1 ∶10 000),CollagenⅠ(1 ∶1 000),Collagen Ⅲ(1 ∶1 000)的一抗稀释液中,4 ℃摇床过夜。TBST洗膜后加入二抗稀释液,室温孵育1 h。再次洗膜后滴加显影液反应1 min,随后在成像系统上显出蛋白条带。
1.3.5实时荧光定量PCR 采用TRIzol法提取部分MI周围区组织中的总RNA,并逆转录成cDNA。使用的引物由上海生工生物工程公司合成,其中ANP上下游引物序列:5′-CGAGAGTCAGGAAACGGAAAG-3′,5′-CTCAGACACACACACACATACA-3′;BNP上下游引物序列: 5′-CACCTCTCAAGTGATCCTGTTT-3′,5′-GCAAGTTTGTGCTGGAAGATAAG-3′;GAPDH上下游引物序列:5′-ACTCCCATTCTTCCACCTTTG-3′,5′-CCCTGTTGCTGTAGCCATATT-3′。在实时荧光定量PCR仪上进行PCR反应,反应条件:95 ℃预变性10 min,95 ℃变性30 s,55 ℃复性30 s,72 ℃延申2 min,总共40个循环。用2-ΔΔCT值法定量目的基因ANP和BNP表达水平。
1.3.6免疫荧光检测 MI手术后28 d取大鼠LSG组织,4%多聚甲醛4 ℃过夜。0.3 g·L-1的蔗糖对组织脱水24 h,每12 h换液,4 ℃过夜。冰冻切片机将组织切成10 μm厚,放置-20 ℃冰箱保存。取切片,置内源性过氧化氢酶阻断剂作用15 min,3 mL·L-1Triton X-100作用15 min,胎牛血清37 ℃孵育1 h,一抗4 ℃ 孵育过夜。次日,经PBS冲洗3次,避光加入荧光二抗,37 ℃孵育1 h,PBS冲洗3次,抗荧光淬灭剂封片。显微镜下拍照,分析结果。
1.3.7ELISA 在MI后1、3、6、9、28 d尾静脉取血0.5 mL,冷冻高速离心机3 000 r·min-1离心20 min,取上清,-20 ℃保存待测;超声检测后取部分MI周围区组织,即围绕病理梗死区域的2 mm区域[12],加入适量PBS,使用研磨仪充分研磨,冷冻高速离心机12 000 r·min-1离心15 min,取上清。按照ELISA试剂盒步骤,首先进行标准品的稀释和加样,随后设置空白孔,接着进行样品的加样:首先加入样品稀释液40 μL,然后加入待测样品10 μL。用封板膜封板后37 ℃孵育30 min,重复洗涤5遍,加入显色剂,37 ℃避光反应10 min,加入终止液,等待15 min后反应终止,随后立即在酶标仪上450 nm处,检测各孔A值。

2 结果
2.1 心功能测量大鼠的心脏超声提示MI后4周,与Sham组相比,MI组大鼠LVIDd和LVIDs均明显增加(P<0.01);与Control组相比,MI+Morphine组LVIDd(P<0.05)和LVIDs(P<0.01)明显下降(Fig 1A-C)。与Sham组相比,MI组大鼠LVEF和LVFS明显下降(P<0.01);与Control组相比,MI+Morphine组LVEF和LVFS明显增加(P<0.01)(Fig 1D,E)。表明吗啡后处理对心衰大鼠的心功能有保护作用。
2.2 心肌病理变化取大鼠心脏进行Masson染色来明确大鼠心肌的病理变化。Masson染色结果表明Sham组左心室结构完整,心肌无纤维化改变;MI和Control组心肌纤维化改变明显,纤维化的程度占整个心室壁约40%,心室壁厚度明显变薄,并且心室腔扩大明显;而MI+Morphine组心肌纤维化沉积明显减少,心室壁厚度增加,心室腔扩大程度减弱(Fig 2A,B)。与Sham组相比,MI组CVF明显增加(P<0.01);与Control组相比,MI+Morphine组CVF明显降低(P<0.01)(Fig 2C)。表明吗啡后处理可以改善MI后心肌的病理变化。
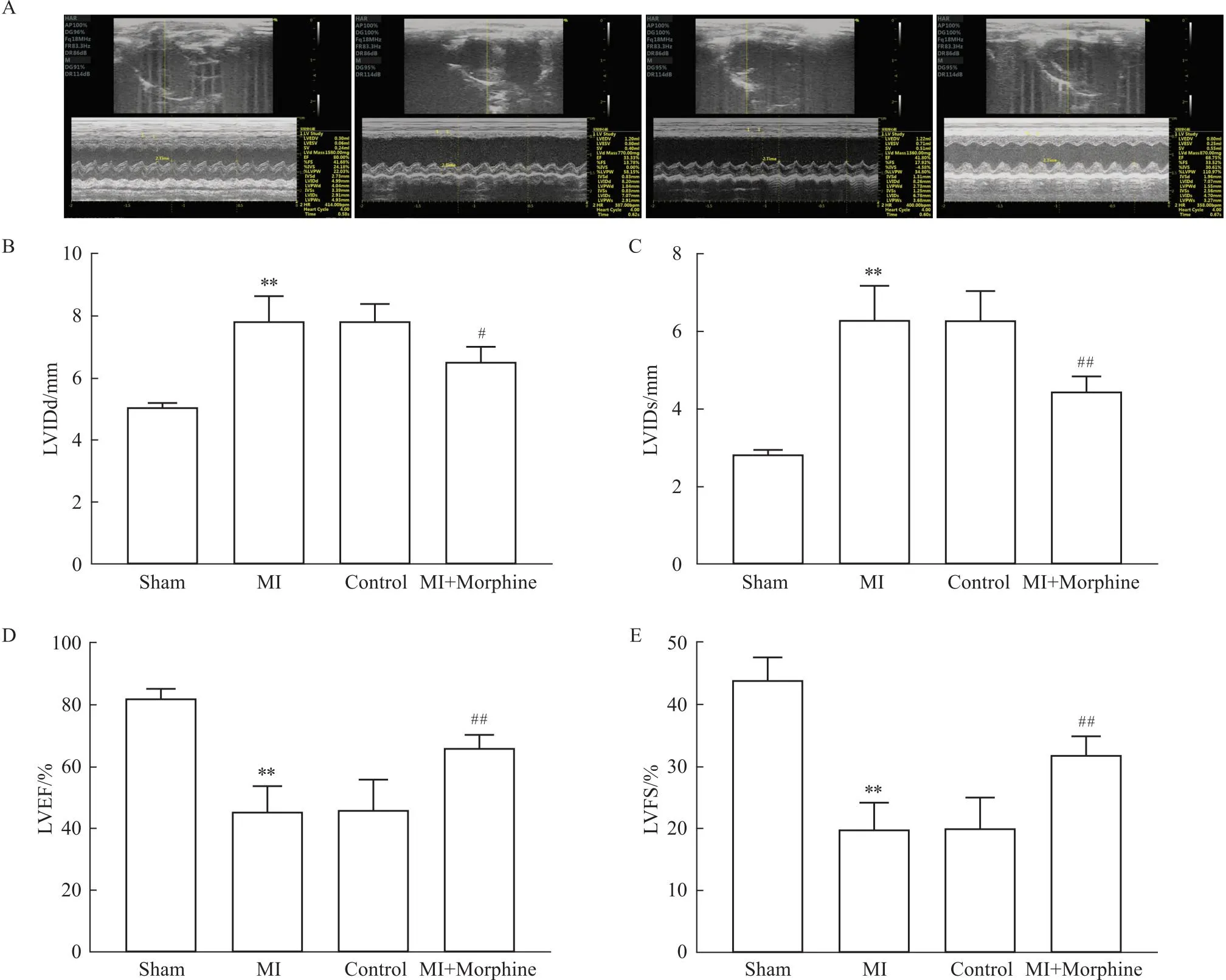
Fig 1 Results of cardiac function in each

Fig 2 Effects of morphine postconditioning on myocardial pathological
2.3 Collagen Ⅰ、Ⅲ以及ANP mNRA和BNP mRNA的表达Western blot结果显示:与Sham组相比,MI组左心室组织中纤维化蛋白CollagenⅠ、CollagenⅢ的表达明显增高(P<0.01);与Control组相比,MI+Morphine组左心室组织中纤维化蛋白CollagenⅠ,CollagenⅢ的表达明显下降(P<0.01)(Fig 3A、3B)。随后测量心脏组织中心房钠尿肽(atrial natriuretic peptide,ANP)和脑钠肽(brain natriuretic peptide,BNP)的表达变化,二者是衡量心肌肥厚的重要指标。实时荧光定量PCR结果显示:与Sham组相比,MI组左心室组织中ANP mNRA和BNP mRNA表达量均明显上调(P<0.01);与Control组相比,MI+Morphine组左心室组织中ANP mNRA和BNP mRNA表达量均明显降低(P<0.01)(Fig 3C,D)。表明吗啡后处理可能通过减少心肌纤维化和心肌肥大发挥心肌保护作用。

Fig 3 Effects of morphine postconditioning on myocardial fibrosis protein, ANP mNRA and BNP
2.4 μ阿片受体的表达情况吗啡作为阿片受体的非特异性激动剂,主要激动μ阿片受体。为探究LSG吗啡后处理是否通过激动μ阿片受体发挥MI后重塑中的调控作用,本研究采用免疫荧光实验检测μ阿片受体在SG中的表达情况。结果显示μ阿片受体在MI 4周后表达增加(P<0.01);并且在吗啡后处理后的表达进一步增加(P<0.01)(Fig 4A,B)。

Fig 4 Expression of μ opioid receptor in stellate ganglion detected by
2.5 血浆和心肌中儿茶酚胺浓度阿片类药物激动阿片受体后可以通过抑制钙通道内流进而抑制神经元兴奋。因此,我们推测LSG吗啡后处理可能会减少交感神经末梢儿茶酚胺的释放。本研究使用ELISA试剂盒检测心衰大鼠血浆和心肌中儿茶酚胺浓度。ELISA结果显示:在吗啡后处理的各个时间点,与Sham组相比,MI组血浆中儿茶酚胺浓度明显增高,并且一直处于相对较高的水平(P<0.01);与Control组相比,MI+Morphine组血浆中儿茶酚胺的浓度明显降低,并且一直处于相对较低的水平(P<0.01)(Tab 1)。与Sham组相比,MI组4周后梗周区中儿茶酚胺的含量明显增高(P<0.01);与Control组相比,MI+Morphine组梗周区中儿茶酚胺的含量明显降低(P<0.01)(Fig 5)。表明吗啡后处理降低了血浆中和心肌中儿茶酚胺浓度。

Tab 1 Concentration of catecholamine (ng·L-1) in plasma in different

Fig 5 Content of catecholamine in myocardial tissue 28 days
3 讨论
MI后心室重塑的发病过程是一个极其复杂的病理生理过程,一直是国内外心脏疾病研究的核心领域。其中有文献报道,交感神经的异常激活是诱发MI后心肌重塑和室性心律失常的核心效应因素[1]。当MI导致神经损伤时,交感神经异常萌发,并发生区域性(不均匀性)心肌神经支配过度。异常的交感神经激活与电重构心肌之间的耦合导致室性心动过速、室颤和心源性猝死,最终给心脏带来一系列不可逆的损伤。SG作为调节心脏交感神经活性的通路已经被证明在其中发挥重要作用,但是具体的机制尚不清楚[3]。
本课题组前期研究发现表明外周和中枢阿片预处理介导了鞘内吗啡的心肌保护作用[8-9],其机制涉及到SG中交感神经元的兴奋性。左右SG支配着心脏不同区域的交感神经。目前观点认为,LSG发出的神经纤维主要支配左心室[4]。在缺血/再灌注损伤的犬模型中,LSG神经活动在MI后立即增加,并且在接下来的8周内继续增加[5]。临床手术中LSG切除术已经被证明可以降低MI患者心房颤动的发生[13]。这表明对LSG进行某种干预可能会影响梗死心脏的神经活动。故本实验采用经皮后入路SG阻滞的方式,将吗啡注射到MI后大鼠的LSG周围,观察LSG吗啡后处理在MI后重塑中的调控作用。
本研究发现,通过LAD构建MI后心力衰竭的大鼠的心功能水平与Sham组相比出现了明显的下降;心梗面积显著增大同时便随着心肌组织呈现纤维化改变;纤维化蛋白CollagenⅠ和CollagenⅢ的表达明显增高;心肌组织中ANP mNRA和BNP mRNA表达量均明显上调。与Control组相比,吗啡后处理明显改善了大鼠的心功能,心脏心梗面积减小,心肌组织纤维化沉积减轻,纤维化蛋白CollagenⅠ和CollagenⅢ,ANP mNRA和BNP mRNA表达量也随之下降。表明吗啡后处理在MI后心室重塑的过程中有心肌保护作用。
阿片受体是一组以阿片肽为配体的抑制性G蛋白偶联受体,阿片受体对心血管,呼吸和交感神经等系统具有明显的调节作用[14]。阿片受体有三种不同的经典受体类型,分别是μ、δ和κ受体。其中吗啡主要激动μ阿片受体,并且通过激活MOR-1型受体和Nef介导的细胞信号级联反应调节阿片受体基因转录,从而影响μ阿片受体的mRNA剪接,最终影响μ阿片受体的表达[15]。为了进一步探究吗啡后处理对MI后重塑的心肌保护作用机制,本实验探究了LSG吗啡后处理后μ阿片受体的表达变化情况。免疫荧光结果显示μ阿片受体在MI 4周后SG中表达增加,并且在吗啡后处理后表达进一步增加,表明吗啡可能通过激动μ阿片受体发挥心肌保护作用。
交感神经过度激活至少可以导致四种类型的交感神经重塑:MI区交感神经密度减少、梗死周围区交感神经密度增加、神经递质或神经肽产生改变以及神经元兴奋性增加[16]。其中交感神经主要释放儿茶酚胺激活心脏上β肾上腺素能受体(β-AR)调节心肌细胞复极化和收缩性,心脏β-AR的激活通过改变跨膜电流和Ca2+稳态调节心肌细胞复极[17]。已有研究表明在突触前神经末梢,内源性阿片肽或阿片类药物激动阿片受体后可以有效抑制N型(Cav2.2)和R型(Cav2.3)钙通道内流,从而抑制神经元兴奋[18]。据此,我们推测LSG吗啡后处理可能会降低交感神经末梢儿茶酚胺的释放。本研究使用ELISA试剂盒检测了大鼠血浆和心脏中儿茶酚胺的浓度。实验结果提示LSG吗啡后处理减少了交感神经末梢儿茶酚胺的释放。
综上所述,LSG吗啡后处理可以改善MI后心室重塑,其发挥作用的机制可能与吗啡激动LSG中μ阿片受体,减少交感神经末梢儿茶酚胺释放有关。

