芒柄花黄素通过DRP1-NLRP3信号通路缓解过敏性哮喘的作用机制
陈 牧,白巧云,宋艺兰,陈 娇,金永德,延光海
(1.吉林省过敏性常见疾病免疫与靶向研究重点实验室,2.延边大学附属医院耳鼻咽喉科,3.延边大学医学院解剖学教研室,吉林 延吉 133002)
哮喘是一种以气道高反应性和慢性气道炎症为特征的常见慢性疾病,全球有3.58亿患者。哮喘的病理特征包括黏液产生过多、气道阻塞和炎性细胞浸润增加[1]。氧化应激和炎症反应与哮喘密切相关,线粒体功能障碍和ROS过量产生导致的氧化应激是关键因素。因此,我们认为维持线粒体功能和体内平衡以及下调炎症反应是改善哮喘的有效措施。
线粒体功能障碍影响活性氧的释放,引起炎症。过量的ROS会导致氧化应激损害细胞和组织,导致呼吸道不良。颗粒物(particulate matter, PM)暴露导致哮喘疾病中线粒体抗氧化酶Mn-SOD和OPA-1降低、炎症标志物NLRP3和IL-1β升高,及线粒体裂变蛋白DRP1增加[2]。众所周知,过多ROS的产生最终将导致线粒体生物能量失衡[3]。研究表明,LPS刺激增强 DRP1 依赖的线粒体 ROS 的产生,促进了 mtDNA 渗漏到细胞质中,激活Kupffer 细胞中STING信号[4]。在蟑螂变应原诱导的哮喘中,芳香烃受体通过抑制ROS触发的NLRP3炎症小体来保护气道Muc5ac生成[5]。TNF-α诱导的气道平滑肌(ASM)活性增加后,ROS产生增加,激活多种应答途径,包括pIRE1α/XBP1s信号通路和相关的细胞因子表达改变,导致线粒体功能失调[6]。已知卵清蛋白在呼吸系统疾病中可激活NLRP3炎症小体,诱发caspase-1激活及促炎因子释放[7]。因此,ROS的清除与DRP1介导的线粒体裂变的抑制,对改善哮喘气道炎症极为重要。
芒柄花黄素(formononetin, FN)是黄芪中提取的生物活性异黄酮,具有抗炎抗氧化作用[8]。研究表明,FN可以通过降低 ROS 的水平和抑制细胞凋亡来减轻 H2O2诱导的细胞死亡[8]。FN 抑制肥大细胞脱颗粒以缓解化合物48/80诱导的假过敏反应[9]。报告指出,FN可减缓皮层神经元炎症,保护大鼠脑损伤后的神经功能[10]。
然而,FN在哮喘中能否维持线粒体稳态仍然不清楚。在此,本研究旨在阐明FN是否通过DRP1-NLRP3途径缓解哮喘气道炎症,为临床靶向用药提供基础研究。
1 材料与方法
1.1 动物无特定病原体(SPF)级雌性BALB/c小鼠50只,20~22 g,8周龄,购自延边大学健康科学中心饲养部(中国延吉动物许可证[JI]2020-00093)。所有小鼠均在无特定病原体、温度(22±2)℃、相对湿度50%~60%、提供严格灭菌的水和食物及12 h光照和夜间循环条件下饲养。实验中所有操作规程均符合《实验动物管理条例》,并经延边大学医学院伦理委员会批准,批准文号(SYXK(JI)2020-0009)。
1.2 哮喘小鼠模型的建立及分组雌性BALB/c小鼠共50只,每组10只共5组:分别为对照(Control)、OVA(Model)、FN(剂量为20 mg·kg-1、40 mg·kg-1)和地塞米松(Dex,剂量为5 mg·kg-1)组(n=10)。哮喘模型的建立,在第0、7和14天将溶于在300 μL生理盐水中的25 μg OVA和2 mg氢氧化铝佐剂通过腹膜内(ip)注射使小鼠致敏。对照组小鼠注射等剂量的生理盐水。最后一次OVA致敏一周后(第21天),OVA组小鼠每天接受含100 μg OVA的20 μL PBS溶液雾化激发,FN组和Dex组激发前30 min分别经口灌胃FN溶液或注射Dex。FN(THT011-20 mg),分子量268.26,纯度 ≥ 98%,购自上海融禾医药科技发展有限公司。FN溶液的制备,将FN溶于生理盐水中,并用盐水稀释。Control组给予等量生理盐水。
1.3 样本采集和处理小鼠最后一次激发(4周)后,收集眼眶后静脉丛血液并离心(1 000×g,10 min)获得血清。然后采集支气管肺泡灌洗液(BALF),将BALF细胞在4 ℃下以400×g离心10 min。在-80 ℃储存上清液以待下一步的细胞因子测定。收集左肺组织固定,用于之后病理及组织学分析,其他右肺组织储存于-80 ℃,以待进一步的蛋白分析。
1.4 组织学分析肺组织切片(n=6)用苏木精和伊红 (HE, # G1120, Solarbio) 染色,用于炎性细胞分析。进行Masson染色(# G1340,Solarbio)以评价气道周围胶原沉积。扫描蓝色的胶原纤维所占面积,并统计胶原沉积所占百分比。分别测量支气管平滑肌层厚度(Md)、支气管基底膜周径(Pbm)、支气管管壁厚度(Wd)和平滑肌层面积(WAm)以及管壁总面积(WAt)。其结果将各标本组织基底膜周径(Pbm)进行统一标准化。对于DRP1的免疫组织化学分析,首先将石蜡包埋的肺组织脱蜡水化,用柠檬酸盐抗原修复,然后用3%的H2O2在室温下孵育10 min,再用5%的山羊血清封闭在室温下孵育15 min,冲洗后,用兔DRP1 (# DF7037, 1 ∶200, Affinity) 抗体孵育肺切片,然后用山羊抗兔IgG H&L(HRP) (# 6721, 1 ∶2 000; Abcam) 孵育。再使用光学显微镜 (Eclipse Ni-U, Nikon)采集图像。
1.5 酶联免疫吸附试验(ELISA)BALF上清液中细胞因子,血清IgE采用ELISA(R&D Systems, Minneapolis)法进行,IL-4、IL-13、IL-5和IgE的灵敏度为2.0 ng·L-1。SOD、CAT活性和MDA的含量也采用ELISA法,按照使用说明书进行检测。
1.6 ROS检测为了检测细胞中的总ROS,BEAS-2B细胞与DCFH-DA (10 μm·L-1, # S0033S,碧云天) 在37 ℃孵育30 min。最后,通过 Cytation 5 (BioTek) 观察荧光,并使用 ImageJ 软件 (National Institutes of Health, Bethesda, MD, USA) 进行分析。
1.7 Western blot检测按常规方法提取蛋白,BCA定量检测蛋白浓度,蛋白变性处理,配制SDS-PAGE分离电泳胶,上样20 μg蛋白,样品转到PVDF膜,5%脱脂奶粉封闭1 h,与一抗4 ℃过夜。p-DRP1(# DF2980)、DRP1(# DF7037),MFN1(# DF7543)、MFN2(# DF8106)购自Affinity; NLRP3(A126974),Caspase-1(# A0964)购自ABclonal;IL-1β(12242s),GAPDH(#2118S)购自CST。使用二抗为山羊抗兔抗体(# 5151,CST)并与它在室温下(25 ℃)孵育2 h。PVDF膜用显影液显影。通过Quantity One (BioRad, Hercules, CA, USA)计算蛋白水平。
1.8 细胞培养和处理人支气管上皮(BEAS-2B)细胞购自中国科学院上海生命科学研究院细胞资源中心(中国上海)。细胞在添加10%胎牛血清(Gibco)、100 kg·L-1链霉素和100 kU·L-1青霉素的DMEM(Gibco)中于37 ℃、5% CO2条件下培养。对于刺激,给予10 μg·L-1IL-13预处理30 min,然后与FN(1、10 μmol·L-1)或Dex(5 μmol·L-1)处理BEAS-2B细胞24 h。
1.9 免疫荧光染色对于DRP1和IL-1β的免疫荧光染色,BEAS-2B细胞和肺组织切片固定,室温下在含0.25% Triton X-100的PBS中透化10 min,并用PBS清洗3次。随后,用1%牛血清白蛋白 (BSA; Sigma-Aldrich) 的PBS中孵育1 h。然后与抗DRP1和IL-1β抗体在4 ℃下孵育过夜。缓慢冲洗后,与Alexa Fluor 488(绿色)标记的驴抗山羊IgG(Invitrogen)在1% BSA中在室温下避光孵育2 h。清洗后,使用4′-6-二脒基-2-苯基吲哚(DAPI; Invitrogen)对细胞核染色。在Cytation 5下进行观察并采集图像。
2 结果
2.1 FN能显著减轻OVA诱导哮喘小鼠气道炎症,上皮下胶原沉积与纤维化为了检测FN对哮喘小鼠气道周围炎性细胞浸润和上皮下胶原沉积和纤维化的影响,我们通过肺组织HE染色(Fig 1A,C)和Masson染色(Fig 1B,D)测定气道周围炎性细胞与胶原沉积。与Control组相比,OVA组气道周围炎症细胞浸润增加。然而,与OVA组相比,FN高剂量治疗小鼠气道周围炎症细胞与胶原沉积和纤维化减少明显。结果表明,FN可能通过抑制气道炎症和上皮下胶原沉积和纤维化来减轻OVA诱导的哮喘。

Fig 1 Effect of FN on airway inflammation and subepithelial collagen deposition and
2.2 FN减轻OVA诱导哮喘小鼠Th2细胞因子及血清中IgE水平我们通过ELISA法检测了BALF中的Th2细胞因子(Fig 2A)。与Control组相比,OVA组IL-4、IL-5和IL-13的表达水平明显增加(P<0.05)。与OVA组相比较,FN高剂量治疗的Th2细胞因子水平明显减少(P<0.05)。此外,ELISA法检测了血清总的和特异性IgE水平(Fig 2B)。与Control组相比,OVA组血清IgE水平增加明显(P<0.05)。与OVA组相比,FN高剂量治疗后IgE水平减少明显(P<0.05)。以上结果表明,FN可能通过减少Th2和IgE水平来减轻OVA诱导的哮喘。

Fig 2 Effect of FN on BALF inflammatory cell infiltration and serum ige in asthmatic
2.3 FN对氧化应激的影响ROS产生过多可导致线粒体损伤。我们用ELISA法测定了BALF中SOD、CAT和MDA表达(Fig 3A-C)。与Control组相比,OVA组SOD和CAT活性明显降低,但MDA表达水平明显增加(P<0.05)。与OVA组相比,FN高剂量治疗后则可以逆转该作用(P<0.05)。此外,我们还分析了BEAS-2B中ROS水平(Fig 3D)。与Control组细胞相比,IL-13诱导的BEAS-2B细胞ROS表达明显增加。与IL-13诱导的BEAS-2B细胞相比,FN高剂量治疗后的ROS生成明显降低。由此可见,FN可能通过增加SOD、CAT,降低MDA,减少ROS积累来防止线粒体损伤。
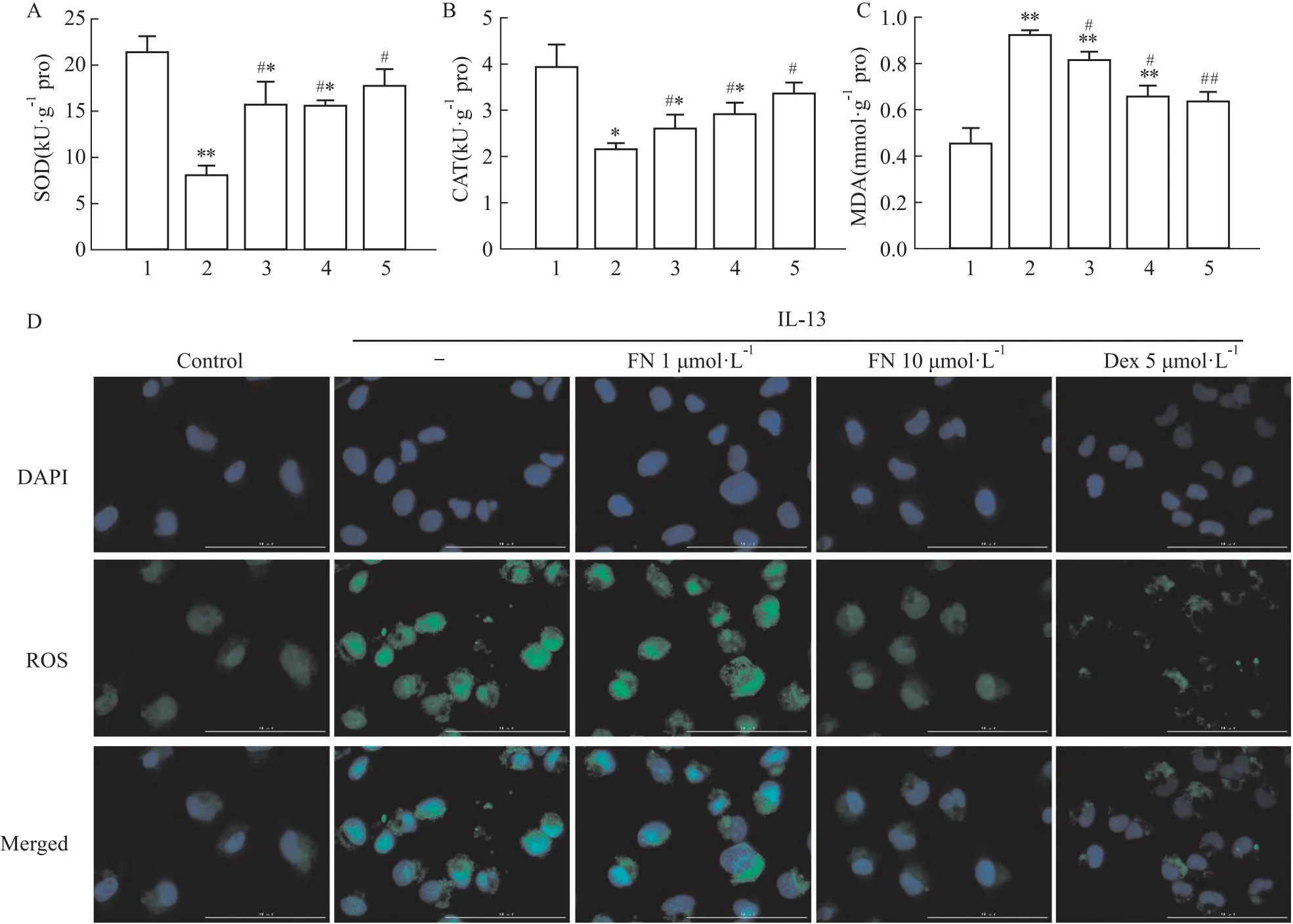
Fig 3 Effect of FN on oxidative stress in asthmatic mice
2.4 FN对 p-DRP1、DRP1、MFN1、MFN2蛋白的影响我们通过Western blot测定了p-DRP1、DRP1、MFN1、MFN2(Fig 4A,B)。与Control组相比,OVA组p-DRP1水平增加,MFN1的表达明显减少(P<0.05),而总DRP1与MFN2的表达无明显变化。与OVA组相比,FN高剂量治疗可明显增加DRP1的减少,MFN1的表达增加(P<0.05),而总DRP1与MFN2的表达无明显变化。此外,DRP1的免疫组织化学结果也显示,FN治疗后可以减少DRP1蛋白的表达水平(Fig 4C)。与此同时,免疫荧光检测BEAS-2B细胞中DRP1的表达水平,与Control组相比,IL-13诱导的BEAS-2B细胞中DRP1的表达明显上升(Fig 4D)。与IL-13诱导的BEAS-2B细胞相比,FN高剂量治疗后可明显减少DRP1的表达。上述结果表明,FN可能通过DRP1-NLRP3通路的影响,减少线粒体裂变,从而减轻哮喘气道炎症。
2.5 FN对DRP1介导的NLRP3的影响为了解FN对哮喘小鼠体内NLRP3炎症小体的影响,我们通过Western blot 分析了NLRP3、Caspase-1、IL-1β蛋白表达水平(Fig 5A,B),与Control组相比,OVA组NLRP3、Caspase-1、IL-1β蛋白表达明显增加(P<0.05),与OVA组相比,FN高剂量治疗后可有效抑制NLRP3、Caspase-1、IL-1β表达(P<0.05)。此外,免疫组织荧光染色IL-1β(Fig 5C),结果表明OVA组NLRP3表达明显增加,而FN高剂量治疗后显著减少该表达。以上结果表明FN能有效减少哮喘小鼠体内NLRP3炎症反应。

Fig 5 Effect of FN on DRP1-Mediated NLRP3
3 讨论
本研究探讨FN通过调节ROS抑制DRP1介导的线粒体裂变在过敏性气道炎症中的作用及潜在机制。本研究证明,FN可以抑制OVA诱导的气道周围嗜酸性粒细胞浸润和胶原沉积、BALF中炎症细胞以及血清IgE水平。此外,FN可增加哮喘小鼠BALF中SOD和CAT活性,同时减少MDA表达以及BEAS-2B细胞中总ROS水平。而且,FN还可以增加OVA诱导哮喘小鼠MFN1的表达,同时减少DRP1的磷酸化与NLRP3炎症小体活化。我们的发现表明FN在减轻 OVA 诱导的哮喘小鼠气道炎症方面发挥了很有前景的药理作用,可能是通过抑制DRP1-NLRP3信号通路实现。
众所周知,ROS的产生过多和氧化应激与OVA诱导的支气管上皮细胞损伤和哮喘的发生发展有关[11]。FN具有多种药理作用,如抗癌、抗凋亡、抗炎、抗氧化、抗高血压和抗糖尿病等。研究证实,FN有效地提高了创伤性脑损伤大鼠脑组织谷胱甘肽过氧化物酶(GSH-Px)和SOD的活性,同时降低了MDA、肿瘤坏死因子-α(TNF-α)白细胞介素-6(IL-6)浓度。同时,核因子E2相关因子2(Nrf2)的蛋白表达有效上调[12]。一致地,我们发现FN上调OVA诱导的哮喘中SOD和CAT,且降低MDA。由此可见,FN可通过诱导抗氧化酶抑制哮喘炎症,从而抑制氧化应激和组织损伤。众所周知,ROS水平的减少是抑制气道炎症的有效策略。我们的数据表明FN能减弱IL-13诱导BEAS-2B细胞中总ROS的水平。基于上述发现,我们推测FN可能通过抑制氧化应激和ROS减轻气道炎症。
ROS调控的线粒体功能障碍可引发线粒体裂变。据报道,百草枯(paraquat, PQ)诱导的凋亡和线粒体裂变中,DRP1与ROS在小鼠肺泡II型(AT-II)细胞中具有相互作用[13]。由此可见,炎症引起的ROS与线粒体裂变密不可分。研究证实,DRP1(Ser616)磷酸化可使DRP1失活导致线粒体裂变。此外,分泌型卷曲相关蛋白5(Sfrp5)可以通过增加p-AMPK和线粒体融合蛋白的同时降低p-DRP1(Ser616)改善心肌梗死后重塑[14]。此外,在链脲佐菌素(streptozotocin, STZ)诱导的糖尿病大鼠中,FN减弱肾小管细胞凋亡、线粒体断裂并恢复线粒体动力学相关蛋白,如DRP1、Fis1和MFN2,以及凋亡相关蛋白,如Bax、Bcl-2和 cleaved caspase-3的表达。我们的研究结果也揭示了OVA与IL-13诱导的气道炎症中ROS大量产生、DRP1被募集到线粒体膜并促进线粒体分裂,从而导致线粒体功能障碍。同时,我们的研究结果也证实FN通过减少DRP1的磷酸化和线粒体融合蛋白的增加,维持正常的线粒体形态。说明,FN是通过减少DRP1介导的线粒体裂变,改善线粒体功能,抑制气道炎症。
氧化应激和线粒体功能障碍已被证明能触发炎症的激活,如NLRP3炎症小体[15]。当ROS产生增加时,细胞接收相关信号来刺激NLRP3炎症小体[15]。激活的NLRP3刺激Caspase-1并介导IL-1β成熟,从而扩大炎症反应。表明NLRP3的激活与线粒体损伤具有广泛而紧密的联系[16]。研究发现, DRP1介导的线粒体裂变可诱导视网膜细胞产生ROS和NLRP3炎症小体的形成[15],从而引发一系列炎症级联反应。NLRP3驱动的炎症反应是哮喘发病的关键驱动因素[17]。研究证实,FN有抗炎,抗氧化作用。在动物模型中,FN通过阻断NF-κB和 AP-1 活化途径显著抑制炎症相关基因表达[18]。有报道称,FN治疗显著改善了小鼠肺功能,减轻了肺部炎症,包括炎症细胞浸润、白细胞介素IL-4、IL-5和IL-13、免疫球蛋白IgE、C-C基序趋化因子配体5(CCL5,也称为趋化因子)、CCL11(也称为嗜酸细胞活化趋化因子-1)和 IL-17A 水平升高。此外,FN处理显著减弱了杯状细胞增生和胶原沉积,并显著降低氧化应激。进一步的,我们的结果也证实了线粒体功能障碍与哮喘小鼠中NLRP3炎症小体的相关性。由此可见,ROS的抑制与线粒体功能的维持有助于抑制NLRP3,caspase-1和IL-β蛋白的表达。这些结果揭示了FN可能通过抑制DRP1-NLRP3信号通路缓解哮喘气道炎症。
总之,基于体内外实验,我们推测FN可能通过DRP1-NLRP3信号通路部分发挥其生物学效应。综上所述,本研究结果表明FN可能通过抑制ROS相关的线粒体裂变减轻过敏性气道炎症。但其潜在机制仍需进一步验证。我们的发现可能有助于了解FN在支气管哮喘中的作用并且为阐明哮喘发病机制提供研究基础。

