基于网络药理学方法与分子对接技术探究左西孟旦治疗低氧肺动脉高压的作用机制
张晓丹,谢玉良,高梦丹,袁奥雪,李涵飞,祝田田
(1. 新乡医学院药学院,2. 河南省心血管重构与药物干预国际联合实验室,3. 新乡市心血管重构干预与分子靶向治疗药物研发重点实验室,河南 新乡 453003)
低氧肺动脉高压(hypoxic pulmonary hypertension,HPH)是高原地区普遍的心血管疾病,主要指长期低氧条件下,肺动脉压异常持续性升高,心肺功能代偿性增加,肺动脉发生异常重塑的进行性疾病[1]。高海拔地区居民因长期暴露于低氧环境,右心室压力负荷增大,常发生右心衰竭和过早死亡[2]。此类疾病目前仍不可完全治愈,且预后较差,HPH的早期诊疗对控制疾病发展进程至关重要。目前HPH的治疗方法有氧疗法和药物疗法等。传统治疗药物包括前列腺素受体激动剂、磷酸二酯酶5抑制剂、内皮素受体拮抗剂等,虽有一定疗效但普遍作用不佳[3]。因此,寻找更好的治疗药物对控制HPH患者的病程发展及提升生活质量意义重大。
左西孟旦(levosimendan,LEVO)于2000年在欧洲上市应用,是一类新型钙增敏作用的正性肌力药,在心血管类疾病的治疗中具有多效性。其作用主要包括选择性收缩期钙增敏的正性肌力作用、开放三磷酸腺苷依赖性钾通道的舒血管作用,以及抗炎、抗氧化、抗细胞凋亡作用等[4]。因其独特的作用机制,近年来,LEVO临床应用广泛,包括晚期心力衰竭、心源性休克、心脏手术、肺动脉高压等[5],但说明书中主要适应症为心力衰竭,其他超说明书用法仍需各种研究验证。本研究旨在通过动物实验、网络药理学方法与分子对接技术,探讨LEVO对HPH的治疗作用及潜在机制,为进一步开拓LEVO的应用范围及寻找HPH的更佳治疗方法奠定基础。
1 材料与方法
1.1 动物实验探究LEVO对HPH的治疗作用
1.1.1HPH模型的构建 清洁级SD大鼠,♂,体质量180~220 g,购自河南斯克贝斯生物科技股份有限公司[生产许可证号:SCXK(豫)2020-0005]。实验动物在相对湿度45%~65%、温度(23±1)℃、通风良好和氧气充足的条件下饲养。24只SD大鼠随机分为常氧组(control)、常氧+LEVO组(LEVO)、低氧组(hypoxia)、低氧+LEVO组(hypoxia+LEVO)。常氧的两组大鼠正常饲养,低氧的两组大鼠于同室的常压低氧培养仓内饲养,连续饲养4周。期间给予LEVO的两组大鼠按照24 μg·kg-1的剂量每周腹腔注射1次(LEVO购自山东齐鲁制药有限公司),另外两组大鼠同时注射等量生理盐水。实验期间每天观察大鼠状态,定时更换饲料、垫料、饮用水等。
1.1.2检测大鼠右心指标 造模结束后,称量并记录所有大鼠体质量。使用右心导管法测定大鼠的右心室收缩压(right ventricular systolic pressure,RVSP),判断造模是否成功。之后处死大鼠,分离左右心室及室间隔,并称重,测量胫骨长度,计算右心肥厚指数并做统计图。
1.1.3肺组织切片及形态学染色分析 采集所有大鼠肺组织进行石蜡包埋与切片。进行HE、Masson和VG染色,使用光学显微镜观察大鼠肺组织病理学变化。拍照保存后进行数据分析,并绘制统计图。

1.2 LEVO治疗HPH的网络药理学分析
1.2.1建立LEVO药物靶点库 LEVO作为一种新兴的化学药物,在许多常用的数据库中并未收录或预测靶标较少。使用检索词“levosimendan”在Swiss Target Prediction、DrugBank Online、BatMan、Targetnet、SEA、PharmMapper数据库中检索(Tab 1)。部分检索结果需要使用UniProt数据库匹配基因名称,将所得结果合并,删除重复项后得到药物靶点库。

Tab 1 Network pharmacology involved database information
1.2.2建立HPH疾病靶点库 HPH是第三类肺动脉高压,在GeneCards、OMIM数据库中检索“hypoxic pulmonary hypertension”,对检索结果进行相应筛选,整合后删除重复项即得。
1.2.3确定共同靶点并构建“药物-靶点-疾病”关系网络 分别导入药物与疾病对应靶点,使用Venny2.1.0在线工具对二者进行取交,得到共同靶点,并保存供后续筛选使用。将药物、疾病和交集靶点制成脚本后导入Cytoscape3.9.0软件,合理调整位置后,制成“药物-靶点-疾病”关系网络图。
1.2.4构建蛋白互作(PPI)网络并筛选核心靶点 将上述得到的共同靶点导入STRING数据库,对参数进行设置:限制物种为“homo sapiens”,要求最低相互作用分数为“high confidence >0.9”,将不互动的单一靶点隐藏,其他默认设置,即得到构建好的PPI网络图。导出图片,将生成的TSV文件转移至Cytoscape3.9.0软件中进行可视化处理,并利用Degree值进行筛选分析,得到核心靶点。
1.2.5进行GO生物学功能和KEGG通路富集分析 将经PPI筛选后的靶点导入DAVID数据库进行GO生物学功能和KEGG通路富集分析,限制物种同上。数据处理标准为P<0.01,按照Count值进行降序排列,用微生信网站进行可视化,获得LEVO治疗HPH的生物过程、细胞组成、分子功能及相关信号通路关系图。
1.2.6对核心靶点进行分子对接 选取Degree值前5的蛋白与LEVO进行分子对接。首先获取LEVO小分子文件:在PubChem数据库中查找“levosimendan”,下载其3D结构文件,并通过Open Bable 2.4.1将文件转化为mol2格式。其次获取蛋白结构文件:在Uniprot数据库分别筛选Degree值前5的蛋白,选择分辨率高、结构完整的蛋白结构,并进入PDB数据库下载对应的pdb文件。然后对小分子和蛋白进行预处理:使用PYMOL软件去除受体蛋白的水分子和配体等,之后将小分子文件和受体蛋白文件分别置于AutoDockTools1.5.7中加氢并平衡电荷。最后在AutoDockTools1.5.7中分别进行LEVO与5个受体蛋白的分子对接,记录各自结合能,并将对接结果转入PYMOL进行可视化处理。
2 结果
2.1 LEVO对HPH的治疗作用
2.1.1LEVO对右心收缩压及右心重构指数的影响 Fig 1结果显示,造模结束后,低氧组大鼠相较于常氧组体质量明显下降,RVSP、右心室与左心室加室间隔重量比值(weight ratio of right ventricle to left ventricle plus ventricular septum,RV/LV+S)及右心室重量与胫骨长度的比值(ratio of right ventricular weight to tibial length,RV/TL)明显升高(P<0.01),说明持续低氧使大鼠的心肺功能异常改变,出现了肺血管重构和右心肥厚。给予LEVO后,与低氧组相比,低氧+LEVO组大鼠体质量增加(P<0.05),RVSP、RV/(LV+S)和RV/TL明显降低(P<0.01),而与常氧组相比,各项指标差异均无显著性(P>0.05)。以上结果表明,LEVO能明显改善HPH大鼠的肺血管重构,使肺动脉压趋于正常。

Fig 1 Results of body weight (A), RVSP (B), RV/(LV+S) (C) and RV/TL (D) in n=6)
2.1.2LEVO对肺组织的影响 肺部组织的异常病理学改变可通过染色的方法从显微镜下观察得到。HE染色结果发现(Fig 2A,2B),对比常氧组,低氧组大鼠的肺血管壁出现明显增厚,管腔内空隙明显减少,肺动脉壁厚度与血管外径的比值明显增加(P<0.01)。LEVO治疗后,对比低氧组,低氧+LEVO组的肺血管壁肥厚情况受到抑制,肺动脉壁厚度与血管外径的比值明显减小(P<0.01),可见病理损伤相对改善。
Masson和VG染色结果均表明(Fig 2C-F),低氧组大鼠肺组织内胶原纤维沉积明显,肺部纤维化严重,与常氧组相比肺纤维化相对面积明显增大(P<0.01)。给予LEVO后,低氧+LEVO组的肺纤维化相对面积比低氧组明显减小(P<0.01),肺部纤维化程度受到有效抑制。综合上述染色结果可知,LEVO可以在不影响常氧组大鼠正常肺组织形态的情况下,明显改善HPH大鼠的肺血管重构,使其异常病理改变程度减轻并趋于正常。

Fig 2 Rat lung tissue determined by HE, Masson and VG n=6)
2.2 网络药理学和分子对接结果分析
2.2.1LEVO靶点预测 通过检索多个数据库:Swiss Target Prediction、DrugBank Online、BatMan、Targetnet、SEA、PharmMapper,分别得到LEVO对应靶点基因6、4、29、80、5、272个,去重后整合,最终得到357个药物靶点。
2.2.2HPH靶点预测 在GeneCards、OMIM数据库中分别检索到HPH对应靶点3 730、256个,对其进行简单筛选,保留相关性评分≥2的靶点,整合去重后最终获得2 451个疾病靶点。
2.2.3LEVO与HPH交集靶点网络 将357个药物靶点与2 451个疾病靶点导入Venny2.1.0中,对二者进行互相映射,得到交集靶点174个,整理并保存(Fig 3)。将LEVO、HPH以及174个共同靶点整理成脚本文件,并导入Cytoscape3.9.0软件中进行可视化操作,绘制“LEVO-交集靶点-HPH”网络图(Fig 4)。

Fig 3 Venn diagram of intersection of LEVOtargets and HPH targets

Fig 4 Network diagram of “LEVO-intersection target-HPH”
2.2.4PPI网络与关键靶点 在STRING数据库中输入上述174个交集靶点,物种设置为“homo sapiens”,最低置信度要求为0.9,并隐藏无联系的单一靶点,得到PPI网络图(Fig 5)。把PPI网络对应的TSV文件导入Cytoscape3.9.0进行可视化,得到139个点和525条边。选择“Analyze Network”对其进行分析,得到每个节点对应的Degree值。根据Degree值将139个关键靶点进行降序排列,按照大小调整位置,绘制成关键靶点图(Fig 6),并把排名前5的靶点(SRC、HSP90AA1、MAPK1、PIK3R1、AKT1)作为LEVO治疗HPH的核心靶点。

Fig 5 PPI network map of LEVO action on HPH
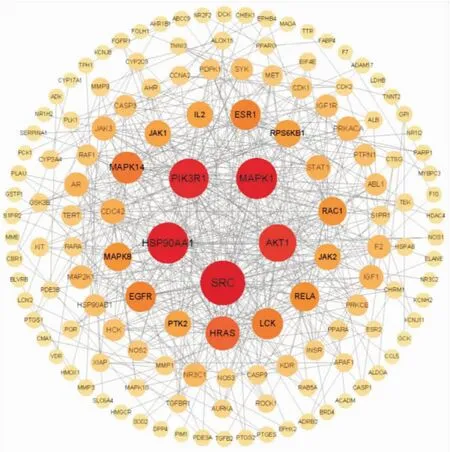
Fig 6 Key targets for LEVO treatment of HPH
2.2.5GO生物学功能富集分析 为进一步探索LEVO治疗HPH的潜在作用机制,将上述筛选后的139个关键靶点导入DAVID数据库进行GO生物学功能富集分析。共得到GO富集结果381条,分别为生物过程(biological process,BP)267条、细胞组成(cellular component,CC)40条及分子功能(molecular function,MF)74条,并对各项中排名前10的数据进行可视化(Fig 7)。其中BP主要涉及信号转导、蛋白质磷酸化、RNA聚合酶II启动子转录的正向调控、细胞凋亡过程的负调控等。

Fig 7 GO biological function enrichment analysis
2.2.6KEGG通路富集分析 KEGG通路富集分析同样在DAVID数据库中进行,共得到136条富集通路,将Count值≥19的前23条通路在微生信平台上进行可视化(Fig 8)。其中主要包括癌症通路、前列腺癌、FoxO信号通路、乙型肝炎、癌症中的蛋白多糖、脂质和动脉粥样硬化、PI3K-Akt信号通路、MAPK信号通路、Ras信号通路等。

Fig 8 Top 23 for KEGG pathway enrichment analysis
2.2.7分子对接 将LEVO与上述Degree值排名前5的核心靶点进行分子对接,从而预测其结合模式与结合性能。核心靶点的蛋白结构从PDB数据库中获取,分别为:SRC(PDB:2SRC)、HSP90AA1(PDB:5XRD)、MAPK1(PDB:8AOJ)、PIK3R1(PDB:7CIO)、AKT1(PDB:1UNQ)。由LEVO与受体蛋白的对接结合能(Tab 2)可知,数值均小于-5 kcal·mol-1,表明5个核心靶点与LEVO均有较好的结合性,其中结合能最低的是Degree值最高的核心靶点SRC。分子对接可视化结果(Fig 9)表明,小分子LEVO能够通过氢键与受体蛋白SRC的氨基酸残基LEU-89、TYR-90、LYS-249、PRO-250、THR-252和TYR-326结合,从而形成稳定构象。

Fig 9 Plot of molecular docking pattern of LEVO to core target site
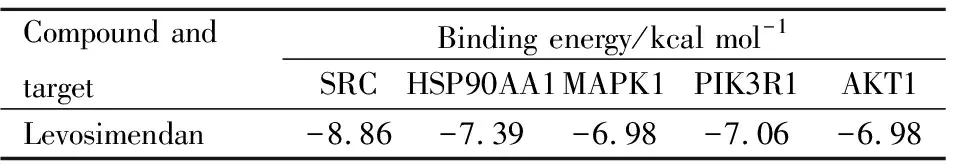
Tab 2 Binding energy of levosimendan to core targets
3 讨论
本研究构建HPH大鼠模型,通过检测各项特征性指标及HE、Masson、VG染色,探究了LEVO对HPH的治疗作用。实验结果表明,LEVO能够明显增加HPH大鼠的体质量,明显降低其RVSP、RV/(LV+S)和RV/TL,同时能使HPH大鼠肺部的异常病理改变恢复至相对正常。因此,动物实验结果很好地证明了LEVO对HPH具有治疗作用。
HPH病因复杂,有着较高的发病率和死亡率,有研究发现无论是高海拔地区还是平原区域,HPH的患病率呈现逐年上升趋势,且平原地区患者的心肺功能较高原地区患者更差[6]。当前对于HPH的具体发病机制仍未完全阐明。LEVO在上市以来的20多年间,除了主要治疗心力衰竭以外,也被尝试性用于许多其他临床疾病,包括肺动脉高压。有非临床研究表明,LEVO可减轻猪的缺氧性肺血管收缩,并改善持续缺氧导致的心脏抑制[7]。此外,有临床研究选取了126例肺动脉高压老年患者进行试验,结果对比常规氧疗组发现,加用LEVO治疗的试验组改善患者临床症状的效果更好,且能明显提高患者的生活质量[8]。目前LEVO与HPH的研究相对较少,且多聚焦于合并用药时的疗效探究。虽然有研究认为LEVO改善肺血管重构的作用可能与细胞超极化介导的抗炎与抗增殖作用有关[9],但是其具体机制还需通过实验进行深入探究。
网络药理学的结果表明,经PPI分析后,LEVO作用于HPH的关键靶点有139个,包括SRC、HSP90AA1、MAPK1、PIK3R1、AKT1、HRAS、MAPK14、LCK、EGFR、ESR1等。GO富集分析发现,信号转导、蛋白质磷酸化和细胞凋亡过程在其中发挥着重要作用,KEGG分析主要富集在癌症通路、PI3K-AKT信号通路、MAPK信号通路、Ras信号通路等。有研究发现,LEVO可抑制抑癌蛋白PTEN的活性,负反馈激活PI3K/AKT信号通路,发挥抗细胞凋亡的作用[10-12]。此外,Ras与MAPK信号通路之间的串话可能参与肺血管重构,从而影响HPH的发生发展[13]。
将分析后Degree值排名前5的关键靶点作为LEVO治疗HPH的核心靶点,并分别与LEVO进行分子对接。结果显示均具有良好的结合性能,表明这些受体蛋白可能是LEVO对HPH发挥治疗作用的潜在位点,其中SRC的结合效果尤为显著。有研究发现,抑制蛋白酪氨酸激酶SRC磷酸化可抑制缺氧诱导因子1α的表达,进而抑制肺动脉高压中肺动脉平滑肌细胞的迁移与增殖,且该研究认为靶向SRC激活的抑制剂可能使肺动脉高压发生逆转[14]。此外,SRC家族酪氨酸激酶被认为可能参与肺动脉平滑肌细胞钾离子通道的调控[15],且SRC抑制剂可抑制LEVO诱导的AKT磷酸化[16]。但是SRC如何在LEVO治疗HPH的过程中发挥作用,仍需进一步探索。
综上,本研究将动物实验、网络药理学方法及分子对接技术相结合,验证了LEVO对HPH大鼠确有治疗作用,能够减轻HPH的肺血管重构,并且发现LEVO可通过结合多靶点和调控多通路发挥此作用,但其中具体作用机制还需进一步探究,这也为我们后续的实验提供了研究方向。

