自体富血小板血浆通过Notch1调节骨质疏松大鼠骨折愈合
沈灵杰 秦超 刘合飞
南通市海门区人民医院手足外科,江苏 南通 226100
骨质疏松症(osteoporosis,OP)患者的骨骼脆弱,具有较高的骨折风险[1]。OP性骨折患者的生活质量降低、病死率较高,给家庭及医疗保健系统带来了沉重负担[2]。开发新的治疗方法来加快OP骨折患者骨组织修复及愈合,是骨科研究的重要任务之一。
富血小板血浆(platelet-rich plasma,PRP)是一种超生理浓度的血小板浓缩物,可通过释放多种高浓度的生长因子、转化生长因子,来促进创伤区快速止血、栓塞血管再通,炎症反应快速应答、肉芽组织修复生长[3-4]。近来研究发现,PRP也可为骨折愈合提供富含生长因子及衍生蛋白的有利微环境,来加速成骨细胞、破骨细胞的增殖和迁移,并快速有效的促进骨折修复与重建,而受到骨科研究的重视[5]。但PRP加速骨质生长、促进骨折愈合的具体分子生物学机制还不甚明确。
Notch通路可调控骨形成蛋白(BMP)表达,抑制成骨细胞、骨原细胞分化等来参与OP性骨折愈合过程,而逐渐受到骨科研究学者的重视[6]。PRP能否调控Notch活化,来发挥促骨质生长及骨愈合作用,还未见报道。本研究拟建立大鼠OP性骨折模型,制备自体PRP并进行干预,从Notch通路方面探究PRP促OP性骨折愈合的可能机制,以期为PRP的开发应用及在OP方面的治疗提供可靠资料。
1 材料与方法
1.1 实验材料
1.1.1动物:SPF级SD雄性大鼠60只,6~8月龄,体重250~300 g,购自北京百奥赛图基因生物技术有限公司,生产许可证号为SCXK(京)2020-0007;所有大鼠于动物实验中心房中常规饲养。本试验动物符合3R原则,试验经南通市海门区人民医院伦理委员会批准。
1.1.2主要试剂及仪器:维甲酸(货号:1674004,上海玉博生物科技有限公司);Notch通路抑制剂(γ-分泌酶抑制剂,DAPT)(货号:M00762,北京百奥莱博科技有限公司);骨钙素(OCN)ELISA试剂盒(货号:YK-08750,北京伊塔生物科技有限公司)、骨性碱性磷酸酶(BAP)ELISA试剂盒(货号:RX301001R,泉州市睿信生物科技有限公司)、血小板源生长因子(PDGF)ELISA试剂盒(货号:F16541,上海西唐生物科技有限公司)、转化生长因子-β(TGF-β)ELISA试剂盒(货号:SND-R746,滁州仕诺达生物科技有限公司)、胰岛素样生长因子1受体(GF-1R)ELISA试剂盒(货号:CD-108844,武汉纯度生物科技有限公司);碱性磷酸酶钙-钴法染色试剂盒(货号:YM-S1519,上海远慕生物科技公司);抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(货号:SY6328,北京伊塔生物科技有限公司);兔抗大鼠Notch1、骨形态发生蛋白(BMP)、骨保护素(OPG)、核因子κB受体活化因子配体(RANKL)等抗体(美国abcam公司,货号:ab184742、ab214821、ab203061、ab62516);SkyScan1276小动物显微CT(Micro-CT)影像系统购自布鲁克(北京)科技有限公司。
1.2 方法
1.2.1大鼠OP性骨折模型建立及分组给药:取SD雄性大鼠,参照文献[7]灌胃给予70 mg/kg维甲酸,1次/d,14 d后用小动物显微CT(Micro-CT)检测骨密度。确认为OP后,将大鼠麻醉,用右侧股骨干骨折髓内固定术建立OP性骨折模型,并分为模型组、PRP组、DAPT组(Notch通路抑制剂DAPT)、PRP+DAPT组,每组12只,另取12只正常雄性大鼠,用闭合骨折制备法造成大鼠右侧股骨中段骨折,设为正常骨折组,来作为对照。PRP组参照文献[8]在大鼠造模前,经眼眶采血3 mL制备PRP凝胶溶液[(血小板平均浓度为(12.05±0.29)×1012/L、白细胞平均浓度为(3.81±0.26)×109/L],取PRP凝胶溶液注射至骨折断之间,1次/d;DAPT组尾静脉注射1 mg/kg的DAPT溶液[9],1次/d;PRP+DAPT组给予PRP凝胶溶液的同时,尾静脉注射给予DAPT溶液;模型组及正常骨折组于骨折断端注射给予不含PRP的凝胶溶液0.3 mL。各组连续给药6周,末次给药结束后12 h,取大鼠进行后续试验。
1.2.2X线观察大鼠骨折愈合情况:各组大鼠末次给药结束后,用X线检测骨折愈合情况,骨折愈合评价采用盲法进行,由不知实验分组的本院骨科医师完成。
1.2.3ELISA法测大鼠血清OCN、BAP、PDGF、TGF-β、IGF-1R水平变化:将大鼠麻醉,取腹主动脉血,按ELISA试剂盒说明书方法检测血清OCN、BAP、PDGF、TGF-β、IGF-1R水平。
1.2.4Micro-CT法检骨痂组织结构变化:处死大鼠6只,取右侧股骨组织,按照文献[7]方法对大鼠股骨进行Micro-CT扫描,并计算骨小梁数量、骨小梁厚度、骨体积/总体积、骨密度等指标变化。取骨痂组织进行螯合剂乙烯二胺四乙酸(EDTA)脱钙、透明、石蜡包埋后,切成厚度为5 μm切片,备用。
1.2.5碱性磷酸酶钙-钴法染色及抗酒石酸酸性磷酸酶(TRAP)染色法分别检测成骨细胞及破骨细胞数目:取1.2.4项下的骨痂组织切片,按分别按碱性磷酸酶钙-钴及抗酒石酸酸性磷酸酶(TRAP)染色试剂盒说明书方法染色、孵育、封片后,置于显微镜下观察拍照,用Image Pro Plus 5.0图像分析系统计算单位面积内阳性染色的细胞数目。
1.2.6免疫组化染色法检测骨痂组织Notch1阳性表达水平:取1.2.4项下的剩余骨痂石蜡切片,二甲苯脱蜡,梯度乙醇水化,微波法修复抗原后,3%过氧化氢孵育10 min,并用10%山羊血清封闭10 min;加入一抗(Notch1,1∶500)4 ℃孵育过夜,洗去一抗,加入羊抗兔二抗(1∶800)室温孵育1.5 h,DAB显色、苏木精复染封片后,于光镜下观察Notch1阳性表达(细胞呈棕黄色)并拍照,用Image Pro Plus 5.0图像分析系统分析单位面积内阳性染色区域的积分光密度值。每张切片随机选取5个视野,取均值。
1.2.7Western Blot法测骨痂组织BMP、OPG、RANKL蛋白表达水平:将剩余大鼠处死,取骨痂组织,液氮中冻存后,研磨、加匀浆液匀浆后提取蛋白,BCA法测定蛋白浓度,取20 μg蛋白上样、电泳、转膜反应后,加入一抗BMP、OPG、RANKL(1∶800)、β-actin(1∶500)4 ℃孵育过夜,加入羊抗兔二抗(1∶800)37 ℃孵育2.5 h后,增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image-J软件分析各组蛋白相对表达水平。
1.3 统计学分析
2 结果
2.1 PRP对OP性骨折大鼠骨折愈合变化的影响
正常骨折组大鼠骨折线模糊不清,骨折断端骨痂形成明显,骨折愈合较好。模型组及PRP+DAPT组大鼠骨折线清晰,有少量骨痂形成,但未连接,骨折愈合不佳。与模型组相比,PRP组大鼠骨折线模糊或消失,骨折断端有大量骨痂形成,且骨痂在骨折断端呈连续性包绕贯穿,骨折处髓腔再通。DAPT组大鼠骨折线清晰,骨折断端几乎未见骨痂形成,骨折愈合欠佳,见图1。
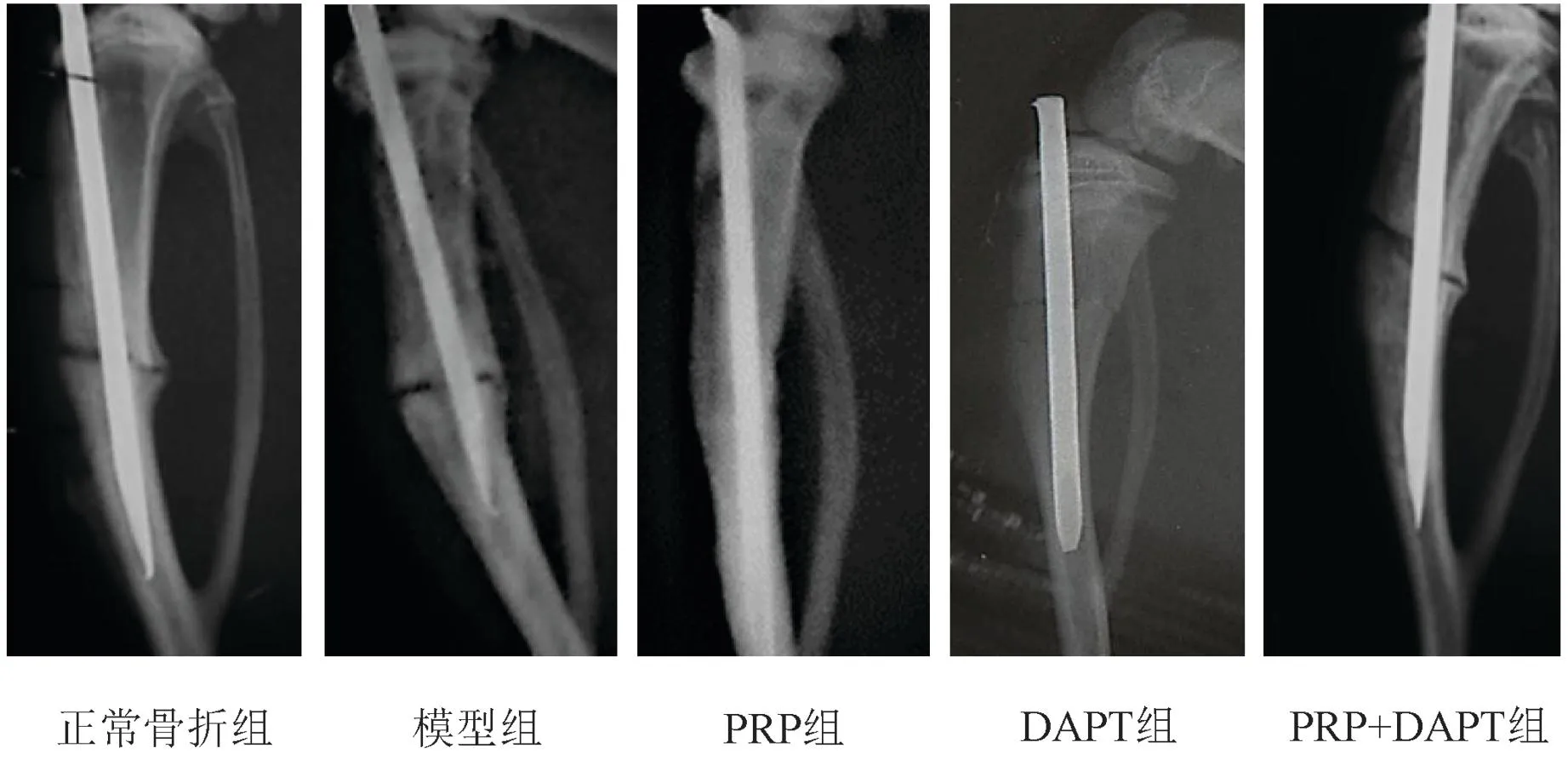
图1 各组大鼠骨折部位X线扫描图Fig.1 X-ray scan of fracture site of rats in each group
2.2 PRP对OP性骨折大鼠股骨骨密度、骨痂体积/总体积、骨小梁数量、骨小梁分离度的影响
与正常骨折组相比,模型组大鼠骨密度、骨痂体积/总体积、骨小梁数量、骨小梁厚度均降低(P<0.05)。与模型组相比,PRP组大鼠骨密度、骨痂体积/总体积、骨小梁数量、骨小梁厚度均升高(P<0.05);DAPT组大鼠骨密度、骨痂体积/总体积、骨小梁数量、骨小梁厚度进一步降低(P<0.05)。PRP+DAPT组大鼠上述指标变化与PRP组相反(P<0.05),见图2、表1。
表1 各组大鼠股骨骨密度、骨体积/总体积、骨小梁数量、骨小梁厚度比较
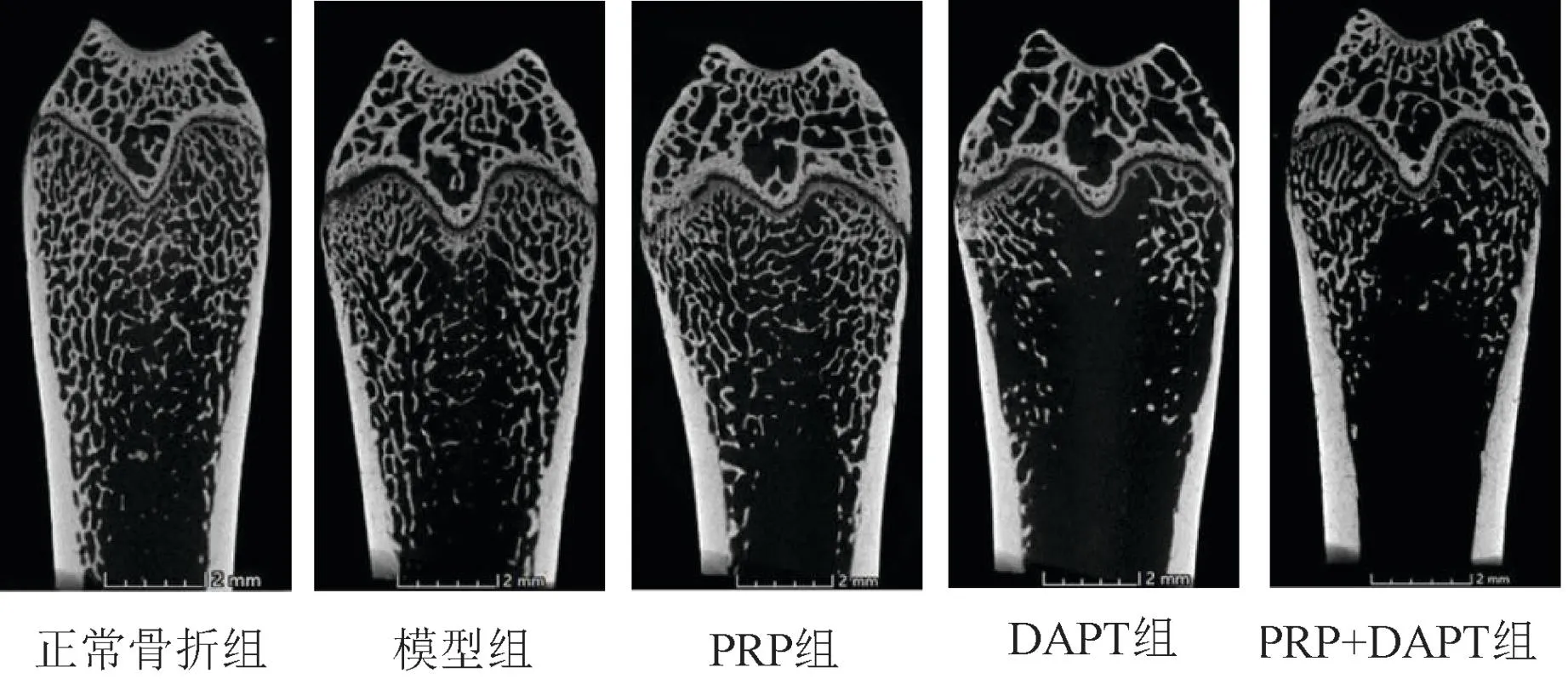
图2 Micro-CT检测各组大鼠骨微结构变化Fig.2 Micro-CT detected the changes of bone microstructure in each group
2.3 PRP对OP性骨折大鼠骨痂组织成骨细胞数目及破骨细胞数目表达的影响
碱性磷酸酶钙-钴法染色显示,成骨细胞胞核呈圆形,细胞质染色呈黑色,其表面有细小凸起,主要靠近骨小梁边缘,紧密排列成立方体或矮柱状,抗酒石酸酸性磷酸酶(TRAP)染色显示,破骨细胞呈红色或暗红色,由多核巨细胞组成,分布于骨髓腔边缘。与正常骨折组相比,模型组大鼠成骨细胞数目降低(P<0.05),破骨细胞数目升高(P<0.05)。与模型组相比,PRP组大鼠成骨细胞数目升高(P<0.05),破骨细胞数目降低(P<0.05)。DAPT组大鼠成骨细胞数目进一步降低(P<0.05),破骨细胞数目进一步升高(P<0.05)。PRP+DAPT组大鼠上述指标变化与PRP组相反(P<0.05),见图3、表2。
表2 各组大鼠骨痂组织成骨细胞数目及破骨细胞数目比较个/mm2)

图3 各组大鼠骨痂组织成骨细胞(碱性磷酸酶钙-钴法染色,400×)及破骨细胞(抗酒石酸酸性磷酸酶法染色,200×)比较Fig.3 Osteoblasts (Calcium Cobalt alkaline phosphatase staining, 400×) and osteoclasts (tartrate-resistant acid phosphatase staining, 200×) were compared in each group
2.4 PRP对OP性骨折大鼠骨痂组织中Notch1阳性表达的影响
免疫组化显示Notch1在正常骨折组大鼠骨痂组织中呈强阳性表达。与正常骨折组相比,模型组大鼠Notch1阳性表达降低[(6.19±0.64)平均光密度/mm2比(21.13±2.11)平均光密度/mm2,P<0.05]。与模型组相比,PRP组大鼠Notch1阳性表达升高[(20.71±0.69)平均光密度/mm2比(6.19±0.64)平均光密度/mm2,P<0.05]。DAPT组大鼠Notch1阳性表达进一步降低[(1.11±0.22)平均光密度/mm2比(6.19±0.64)平均光密度/mm2,P<0.05]。与PRP组相比,PRP+DAPT组大鼠Notch1阳性表达降低[(6.28±0.61)平均光密度/mm2比(20.71±0.69)平均光密度/mm2,P<0.05],见图4。

图4 大鼠骨痂组织Notch1免疫组化染色图(400×)Fig.4 Notch1 immunohistochemical staining of rat callus tissue (400×)
2.5 PRP对OP性骨折大鼠血清OCN、BAP、PDGF、TGF-β、IGF-1R水平的影响
与正常骨折组相比,模型组大鼠血清OCN、BAP、PDGF、TGF-β、IGF-1R等水平降低(P<0.05)。与模型组相比,PRP组大鼠OCN、BAP、PDGF、TGF-β、IGF-1R等水平升高(P<0.05)。DAPT组大鼠OCN、BAP、PDGF、TGF-β、IGF-1R等水平进一步降低(P<0.05)。PRP+DAPT组大鼠上述指标变化与PRP组相反(P<0.05),见表3。
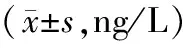
表3 各组大鼠血清OCN、BAP、PDGF、TGF-β、IGF-1R水平比较Table 3 Comparison of serum levels of OCN, BAP, PDGF, TGF-β and IGF-1R in each group
2.6 PRP对OP性骨折大鼠骨痂组织BMP、OPG、RANKL蛋白表达的影响
与正常骨折组相比,模型组大鼠骨痂组织BMP、OPG蛋白表达降低(P<0.05),RANKL蛋白表达升高(P<0.05)。与模型组相比,PRP组大鼠骨痂组织BMP、OPG蛋白表达升高(P<0.05),RANKL蛋白表达降低(P<0.05)。DAPT组大鼠骨痂组织BMP、OPG蛋白表达进一步降低(P<0.05),RANKL蛋白表达进一步升高(P<0.05)。PRP+DAPT组大鼠上述指标变化与PRP组相反(P<0.05),见图5、表4。

表4 各组大鼠骨痂组织BMP、OPG、RANKL蛋白表达比较Table 4 Comparison of BMP, OPG and RANKL protein expression in callus tissue of rats in each group
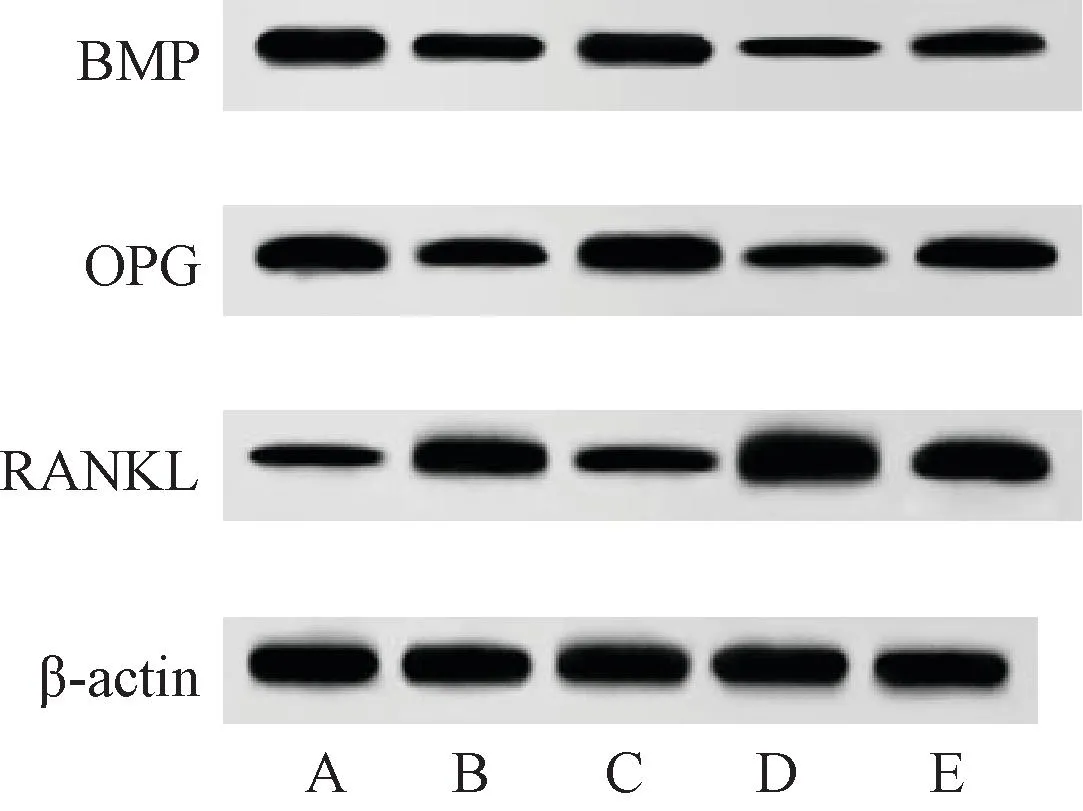
图5 各组大鼠骨痂组织BMP、OPG、RANKL蛋白表达免疫印迹图Fig.5 Western Blot of BMP, OPG and RANKL protein expression in callus tissue of rats in each group
3 讨论
OP患者骨量减少、骨结构异常、骨脆性增加,是导致骨折发生率升高的重要原因之一[10]。维甲酸又叫维A酸,可影响骨的正常生长、发育及代谢,引起OP形成[11]。本研究用维甲酸诱导建立大鼠模型后发现,大鼠股骨骨密度降低,预示大鼠OP模型建立成功。本研究结果显示,与正常骨折组相比,OP性大鼠骨折线清晰、骨痂体积减少、骨小梁密度及厚度降低、骨细胞指数降低、骨愈合时间延长,与骨形成有关的血清骨钙素、骨性碱性磷酸酶(BAP)含量明显减少,提示OP性骨折组大鼠出现骨密度降低、骨痂形成减少及骨愈合延迟的现象,表明造模成功。
骨折时,骨折断端聚集的大量血小板,可释放大量的PDGF、TGF-β、IGF等来促进成骨增殖、调节骨细胞功能和代谢等,而参与骨修复与再生过程[12-13]。PRP中含有大量的PDGF、TGF-β、IGF等生长因子,且自体提取制备的PRP,具有制备简单、可行性高、价格低廉、生物安全性高及并发症少等优点,被证实具有加速骨细胞活化、促进骨缺损修复、骨诱导再生等作用,而在骨折治疗中有广阔的应用前景[14-15]。冀少林等[8]建立大鼠OP性骨折模型,证实PRP可促进OP性骨折大鼠骨痂形成。本研究发现,PRP组大鼠干预治疗后,大鼠血清中DGF、TGF-β、IGF水平异常升高,骨痂体积、骨小梁形成及骨愈合水平均高于OP性骨折模型组,证实PRP具有较好的促进OP性骨折愈合作用。但其具体分子生物学机制还有待进一步验证。
Notch信号通路是骨代谢过程中的重要通路[16]。大量文献研究发现,当Notch信号出现异常时,会引起骨发育失调、骨质疏松、骨软化等[17]。周灵通等[18]发现,Notch可表达于成骨细胞中,可通过抑制破骨细胞分化和成熟来促进骨矿物质沉积。Ballhause等[19]发现,Notch活化可通过促进BMP、OPG等促成骨活化因子表达,抑制破骨细胞活化来影响骨代谢及骨重建过程。本研究发现,OP性骨折组大鼠骨密度降低、骨愈合延迟的同时,骨痂组织中Notch1表达显著降低,BMP、OPG等促成骨活化因子表达降低,RANKL等骨吸收反应相关因子表达增加,进一步抑制大鼠Notch1表达,大鼠骨密度进一步降低,骨折愈合更加缓慢。本研究发现,PRP促进大鼠骨密度升高、加快骨折愈合的同时,Notch1及BMP、OPG表达也升高,提示PRP促进OP性骨折大鼠骨量增加及骨折愈合的作用,也可能与促进Notch1通路激活有关。Notch通路抑制剂-DAPT可逆转PRP的上述作用。
综上所述,PRP促进OP性骨折大鼠骨量增加及骨折愈合的作用,也可能与促进Notch1通路激活有关。这可能为阐明PRP改善OP性骨折的分子生物学机制,提供一定参考。但OP性骨折骨密度降低及骨折愈合的调控机制复杂,涉及多条通路多个细胞因子共同调节,Notch可能只是其中的一条途径。PRP促进OP性骨折愈合的其他分子机制,仍需继续深入研究。

