基于植物甾醇与γ-谷维素的牡丹/葵花籽油凝胶的制备及其物理特性研究
赵晶晶,徐宝成,2,3,4*,丁玥,2,3*,刘茜茜,王永超,余慧,刘丽莉,2,3
1(河南科技大学 食品与生物工程学院,河南 洛阳,471000)2(食品加工与安全国家级实验教学示范中心,河南 洛阳,471000) 3(河南省食品绿色加工与质量安全控制国际联合实验室,河南 洛阳,471000)4(农业农村部油料作物生物学与 遗传育种重点实验室,湖北 武汉,430062)
固体脂肪在食品工业中发挥着重要的作用[1],广泛应用于烘焙、糖果、膨化、人造奶油[2]和肉制品[3]等食品加工中。目前使用的固体脂肪多为氢化植物油和动物油脂,除了含有大量的饱和脂肪酸外,还含有反式脂肪酸,过多摄入会增加冠心病、糖尿病和癌症的患病几率[4-5]。随着生活水平的提高,消费者对食品安全和营养健康的要求越来越高,因此迫切需要开发一种新型塑性油脂来替代传统固体脂肪。
油凝胶是由液态油和凝胶剂形成的一种热可逆的塑性脂肪,其中的凝胶剂通过自组装或结晶的方式形成三维网络结构,液态油被包裹在三维网络结构中而失去流动性,使整个体系呈现为具有黏弹性的固态或半固态[6]。目前常用的凝胶剂主要有生物蜡[7]、脂肪酸类[8]、乙基纤维素[9]、卵磷脂、植物甾醇和γ-谷维素[10]等。与其他凝胶剂相比,植物甾醇和γ-谷维素具有更明显的优势,一方面植物甾醇和γ-谷维素的溶解温度低,可以减少制备过程中油脂的氧化劣变;除此之外,植物甾醇和γ-谷维素还具有降低心血管疾病的患病风险[11]、抗衰老[12]和调节免疫力等生理功能,是目前最安全和最具潜力的植物油凝胶剂。
根据油凝胶的形成机理可知,植物甾醇与谷维素的比例不仅会影响油凝胶的硬度[13]、黏度、微观结构[14]、流变和热力学性质等物性指标,还会影响其在油中的自组装行为和结晶方式[15]。这些物性参数的细微变化对其后续在冰激凌、巧克力、人造黄油、人造奶油中的应用至关重要。但目前关于植物甾醇与谷维素的比例对这些参数具体影响的研究报道还不够全面。此外,油相的脂肪酸组成、分子质量和酰基链长度等也会影响凝胶剂的凝胶能力。殷俊俊等[16]研究发现不同植物油对植物甾醇/γ-谷维素油凝胶(植物甾醇∶谷维素=3∶2,质量比)的凝胶时间有显著影响。但有关不同植物油(尤其是α-亚麻酸含量较高的油脂)对油凝胶硬度、黏度、熔点、晶体生长方式和微观形貌等物理特性的影响还未见报道。
鉴于此,本研究选用植物甾醇和γ-谷维素为天然的凝胶剂,探讨植物甾醇和γ-谷维素的比例以及甘油三酯脂肪酸模式对油凝胶形成速度、外观、硬度、黏度、热力学和流变特性以及微观结构的影响,为制备营养型(高α-亚麻酸/亚油酸、高植物甾醇/γ-谷维素)油凝胶提供技术支撑,也为后续进一步探讨该类凝胶在功能营养奶油、黄油、冰激凌和巧克力等食品中的应用提供依据和参考。
1 材料与方法
1.1 材料与试剂
一级压榨葵花籽油,中粮集团有限公司,其中葵花籽油的主要脂肪酸为棕榈酸6.29%、硬脂酸4.12%、油酸24.59%、亚油酸61.52%、α-亚麻酸0.28%;牡丹籽油,洛阳国花坊牡丹生物科技有限公司提供,其中牡丹籽油的主要脂肪酸为棕榈酸5.59%、硬脂酸1.91%、油酸22.83%、亚油酸27.50%、α-亚麻酸40.67%;植物甾醇(β-谷甾醇41.8%、豆甾醇31.2%、菜油甾醇23.4%、菜籽甾醇0.2%、总植物甾醇96.6%),西安天宝生物科技有限公司;γ-谷维素(纯度≥99%),济宁市安康制药有限责任公司,以上均为质量分数。
1.2 仪器与设备
HJ-6A多头磁力搅拌器,江苏常州新瑞仪器厂;TA DHR-2型食品流变仪,美国沃特斯公司;TA.XT质构仪,美国Stable Micro Systems公司;差示扫描量热仪,瑞士METTLER-TOLEDO公司;XPV-203型偏振光显微镜,上海长方光学仪器有限公司。
1.3 实验方法
1.3.1 油凝胶样品的制备
分别向牡丹籽油和葵花籽油中添加8%(质量分数)的混合甾醇凝胶剂(植物甾醇∶γ-谷维素=20∶80、40∶60、60∶40、80∶20,质量比),在90 ℃下搅拌至完全溶解,冷却至室温并转移至4 ℃环境下形成凝胶。
1.3.2 油凝胶外观形态观察及凝胶时间
将热的油凝胶样品装到10 mL的透明玻璃瓶中,冷却至室温并转移至4 ℃储藏,观察油凝胶的外观形态,并记录样品的凝胶时间,样品倒置后不发生流动的时间即为凝胶形成的时间。
1.3.3 油凝胶的质构特性
将热的油凝胶样品装到10 mL的透明玻璃瓶中,样品表面保持均匀平整,样品高度为2.5 cm,在4 ℃下储藏24 h。使用质构仪对油凝胶样品的硬度和黏聚性进行测定,探针型号P5,测前速度5 mm/s,测中速度1 mm/s,测后速度5 mm/s,下压深度10 mm,每组样品测定3次,取平均值。
1.3.4 油凝胶的流变学测定
油凝胶样品的流变学特性采用流变仪进行测定,使用40 mm平板夹具,测量平板间距1 mm,测量时取适量热的油凝胶样品置于流变仪控温底盘上。首先以10 ℃/min的速率加热至90 ℃,清除样品的结晶记忆,然后以10 ℃/min的冷却速率从90 ℃降至40 ℃,固定频率1 Hz,应变1%。最后通过动态时间扫描测定油凝胶的弹性模量(G′)和黏性模量(G″)随时间变化的曲线,测定温度4 ℃,固定频率0.1 Hz,应变0.1%,时间3 600 s。
1.3.5 油凝胶热力学性质
采用差示扫描量热仪测定油凝胶样品的热力学性质,称取10~15 mg油凝胶样品置于铝盘中并用铝盖密封,在恒定氮气流100 mL/min的条件下,以10 ℃/min的速率从室温加热至120 ℃,采集样品的熔化曲线数据并记录样品的初始熔化温度。
1.3.6 油凝胶微观结构观察
将适量热的油凝胶液体滴到载玻片上,盖上盖玻片,将样品压平使其均匀分布,在4 ℃下放置48 h,使用偏振光显微镜对样品的微观结构进行观察,放大倍数为10倍和40倍。
1.4 数据处理与分析
样品均平行测定3次,结果以平均值±标准偏差表示。应用Excel 2016和Origin Pro 9.0软件对数据进行处理和分析。
2 结果与分析
2.1 油凝胶外观形态观察及凝胶时间分析
经1.3.1节方法制备的油凝胶样品置于4 ℃下储存,不同比例的凝胶剂对牡丹/葵花籽油凝胶形成时间的影响如图1所示。
由图1可知,凝胶剂的添加量为8%时,植物甾醇与γ-谷维素比例的差异对2种植物油形成凝胶的时间产生显著的影响,其中m(植物甾醇)∶m(γ-谷维素)=40∶60时,牡丹籽油和葵花籽油形成凝胶的时间最短,分别为30和37 min,然后依次是添加比例为60∶40、20∶80、80∶20的样品。相比而言,同等条件下牡丹籽油形成凝胶的速度要比葵花籽油快。

图1 不同凝胶剂质量比例对牡丹/葵花籽油 形成凝胶时间的影响Fig.1 Effect of mass ratio of gelling agent on the oleogel formation time of peony/sunflower seed oil
由图2和图3外观形态可知,葵花籽油凝胶整体呈现淡黄色,透明的状态,而同等条件下牡丹籽油凝胶的透明度则有所下降,并且当植物甾醇与γ-谷维素质量比为80∶20,在4 ℃放置3.5 h(图3-a-4号样品)时,牡丹籽油凝胶中会出现部分小颗粒结晶,在4 ℃放置24 h(图3-b-4号样品),牡丹籽油凝胶整体呈现乳白色、不透明的状态。通过分析2种植物油的脂肪酸组成,发现牡丹籽油含有丰富的α-亚麻酸、亚油酸、油酸等不饱和脂肪酸,其中α-亚麻酸含量高达40.67%,而葵花籽油中油酸、亚油酸含量较多,α-亚麻酸含量仅为0.28%,因此,推测可能是由于牡丹籽油特殊的脂肪酸组成模式使得其在植物甾醇与γ-谷维素构成的三维网络空间倾向于以β型(三斜排列)的方式进行堆积,形成的结晶更加致密,影响光的透射,从而呈现出浑浊不透明的凝胶状态。相比而言,葵花籽油在凝胶剂形成的三维网络空间更倾向于形成β′型(正交堆积)结晶,致密性不如β型结晶,易于光的透过,因此形成的凝胶透明度较高。此外,有研究发现油凝胶的透明度还会随着γ-谷维素的增加而提高[14],通常植物甾醇与γ-谷维素质量比为40∶60时,可获得最坚硬的透明凝胶[15],这与本研究的结果一致。与之相反随植物甾醇比例的增加,油凝胶的透明度会有所下降[17],这种现象在牡丹籽油凝胶中表现得尤为明显,这可能是由于牡丹籽油凝胶体系中过量的植物甾醇导致储藏期间甾醇结晶的生长,破坏了原来均匀的空间网络结构,使其变得浑浊[15](图3-b-4号样品)。

图2 葵花籽油凝胶Fig.2 Sunflower seed oil oleogel

a-储存3.5 h;b-储存24 h
2.2 凝胶剂的比例对油凝胶质构特性的影响
由图4可知,4 ℃放置24 h后,同一植物油基质所制备的油凝胶的硬度存在显著差异,当植物甾醇与γ-谷维素质量比为40∶60时,油凝胶的硬度最大,然后依次是添加比例为60∶40、20∶80、80∶20的样品。然而,当植物甾醇/γ-谷维素的添加比例一样时,牡丹籽油凝胶的硬度整体上要大于葵花籽油,结合二者的凝胶时间发现,凝胶所需时间越短的样品,其硬度越大。出现此现象的原因可能是:牡丹籽油特殊的脂肪酸组成模式使得其在植物甾醇与γ-谷维素构成的三维网络空间倾向于以β型(三斜排列)的方式进行堆积,而葵花籽油则倾向于以β′型(正交堆积)的方式进行堆积。由于β型堆积更加致密,因此牡丹籽油凝胶的硬度也相对更高[18]。
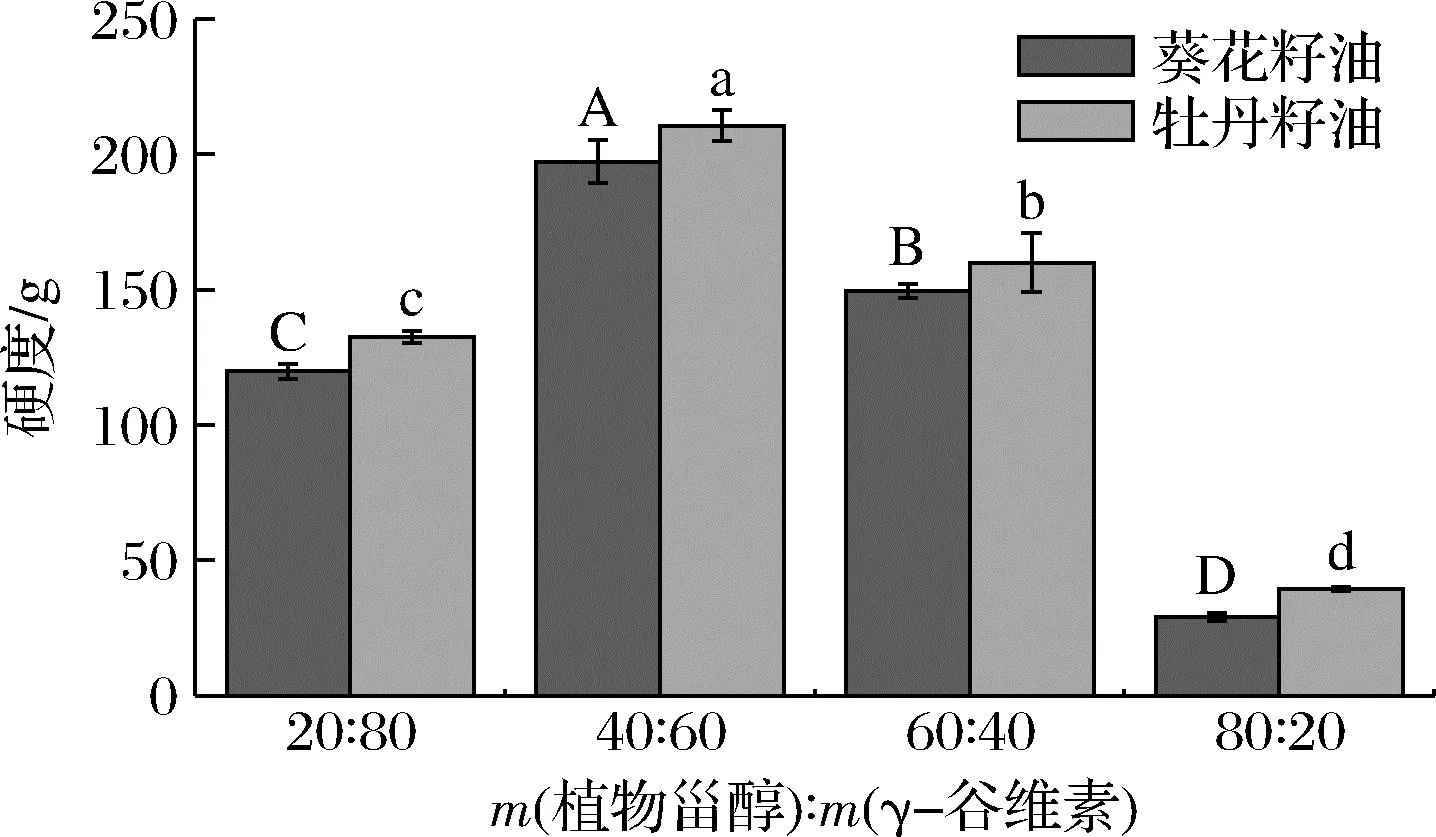
图4 植物甾醇与γ-谷维素的质量比对油凝胶硬度的影响Fig.4 Change in hardness of oleogels with different mass ratio of phytosterol and γ-oryzanol
测试时探针提取的阻力可以反映样品的黏度,如图5所示,当植物甾醇与γ-谷维素质量比为40∶60时,油凝胶的黏度最大,比例为60∶40和20∶80的次之,80∶20时黏度最小,这与硬度的变化趋势是一样的,这可能与油凝胶体系中形成的三维网络空间结构的形态和晶格分子间作用力的大小有关。菜籽甾醇、豆甾醇和β-谷甾醇的分子质量分别为400.68、412.69、414.71 Da,均含有一个羟基,而γ-谷维素的分子质量为602.89 Da,含有一个羟基、一个酯键和一个甲氧基,也就是说添加量同为8%的情况下,甾醇比例越多可用于形成凝胶网络的分子数就越多,但相比而言,γ-谷维素分子中除了羟基以外还含有一个酯键和一个甲氧基,即γ-谷维素形成凝胶网络时分子间作用力更大,结构更稳定[19]。本研究中当凝胶剂添加量为8%,植物甾醇与γ-谷维素质量比为40∶60时,用于形成油凝胶网络结构的分子数和分子间作用力达到最佳平衡,形成的凝胶网络致密且分子间作用力最大,因此凝胶的硬度和黏度也最大。

图5 植物甾醇与γ-谷维素的质量比对 油凝胶黏聚性的影响Fig.5 Change in cohesiveness of oleogels with different mass ratio of phytosterol and γ-oryzanol
2.3 油凝胶的流变学分析
本研究考察了植物甾醇与γ-谷维素质量比对牡丹/葵花籽油凝胶结晶过程中贮存模量G′、损耗模量G″的影响。测试过程中,为使样品凝胶,流变仪底盘的温度始终保持在4 ℃,频率固定在0.1%,应变为0.1%。为方便分析,本研究将凝胶过程分为平衡前期、对数期和平衡后期[20]。如图6所示,在平衡前期,样品的G′和G″值接近于0 Pa,且G″>G′,此时的油凝胶样品仍然处于液体状态;与牡丹籽油样品相比,葵花籽油样品的平衡前期较长,样品的G′和G″值较低。在对数期样品的G′和G″值开始急剧增加,且样品的G′逐渐大于G″,一般认为G″和G′的交点为样品开始形成凝胶的点,此时样品中三维网络晶格开始形成。在平衡后期,样品的G′和G″值趋于稳定,当样品的G′值接近或者大于106Pa时,即表明样品中致密且相互交联的空间网络结构已形成,油凝胶样品表现出特有的黏弹性和硬度(图6)。
如图6可知,牡丹籽油样品开始凝胶的时间要早于葵花籽油,且其对数期明显要短于葵花籽油,这表明牡丹籽油体系中凝胶空间网络结构的形成速度和甘油三酯在晶格间的堆积速度更快。对于葵花籽油样品,植物甾醇与γ-谷维素质量比为40∶60和60∶40时,其平衡后期的G′>106Pa,说明样品已形成油凝胶(图6-a);在相同条件下,植物甾醇与γ-谷维素质量比为40∶60、60∶40和20∶80的牡丹籽油样品均已形成凝胶(图6-b)。另一方面,葵花籽油和牡丹籽油凝胶最终的G′值均与甾醇与γ-谷维素添加比例有关,其值由大到小排序为:40∶60添加组>60∶40添加组>20∶80添加组>80∶20添加组;当G′值越大时,样品最终的硬度也越大,这与2.2节的结果相一致。

a-葵花籽油;b-牡丹籽油
2.4 油凝胶的热力学分析
如图7所示,葵花/牡丹籽油凝胶在进行加热时均可观察到明显的熔化峰。在同一升温速率下,当植物甾醇与γ-谷维素质量比为40∶60时,油凝胶的熔点最高,其次为60∶40,20∶80,80∶20添加比例的样品。结合凝胶时间和硬度可发现,凝胶时间越短,其硬度越大,开始融化的温度也越高,融化峰也相对明显。有研究指出,油凝胶的熔点与其自身的三维网络结构有关,网络结构越多、越密集,油凝胶的熔点也越高[19]。除上述原因以外,我们认为油凝胶的熔点还与凝胶剂的分子结构(所带的活性官能团)、油脂的脂肪酸组成模式等因素有关,如植物甾醇与γ-谷维素的质量比例为40∶60时,用于形成油凝胶网络结构的分子数和分子间作用力可达到最佳平衡,形成的凝胶网络致密且分子间作用力最大,因此熔点也越高。另一方面,在相同的植物甾醇与γ-谷维素质量比例下,牡丹籽油凝胶的熔化温度整体上要高于葵花籽油,这可能是牡丹籽油在植物甾醇与γ-谷维素构成的三维网络空间倾向于以β型的方式进行堆积,而葵花籽油则倾向于以β′型的方式进行堆积。由于β型堆积更加致密,因此牡丹籽油凝胶的融化温度也相对较高。
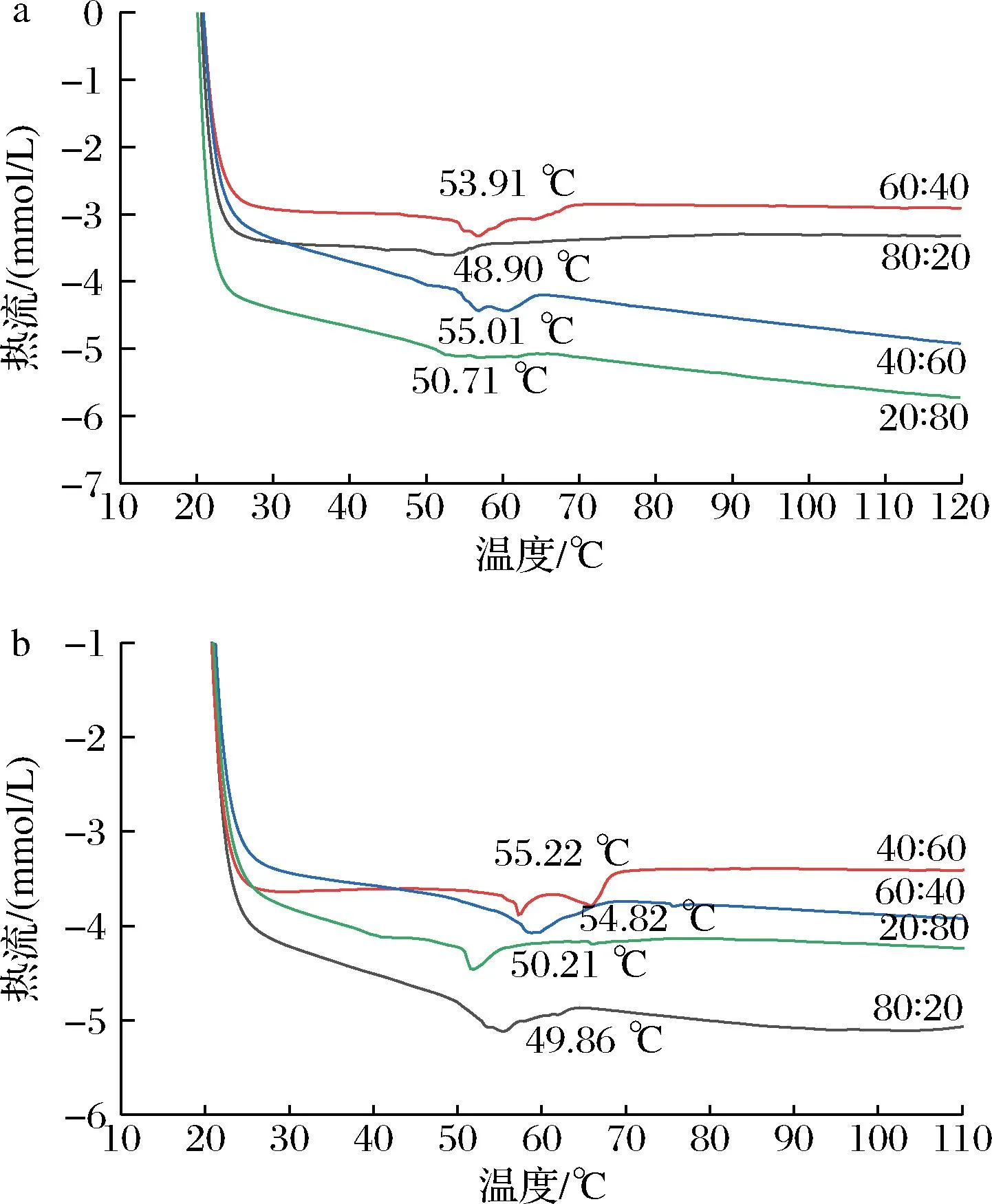
a-葵花籽油;b-牡丹籽油
2.5 油凝胶的微观结构
三维网络结构的形成是油凝胶黏弹性行为的基础。因此,为了详细了解凝胶的宏观性质不同的原因,本研究使用偏振光显微镜观察了结晶聚集体的形态和油凝胶的三维网络结构。在4 ℃下放置48 h后,不同植物甾醇与γ-谷维素质量比下葵花籽油和牡丹籽油凝胶的微观结构如图8~图11所示,亮白色部分是由凝胶剂形成的结晶体,而深色部分是被晶体网络束缚住的植物油。当葵花籽油和牡丹籽油中只添加8%(质量分数)的植物甾醇时,在10倍显微镜下可以观察到密集的晶体结构(图8-a、图10-a),在40倍显微镜下可以观察到大叶片状的晶体结构(图9-a、图11-a)。有研究制备了谷甾醇含量为5%和10%(质量分数)的葵花籽油样品,发现5%的样品没有凝胶,呈现出浑浊的晶体悬浮液状态,其晶体结构为针状晶体,而10%的样品则呈现为更加浑浊不透明的凝胶状态,其晶体结构为大叶片状[21],与本实验的晶体形状一致。但甾醇添加量过多时,会干扰凝胶三维网络结构的自主装,导致网格中甾醇晶体的增大和聚集,影响凝胶效果。当植物甾醇与γ-谷维素质量比为80∶20和60∶40时,均可以在偏振光显微镜下观察到2种晶体结构(图8-b、图8-c,图9-b、图9-c,图10-b、图10-c,图11-b、图11-c),一种是植物甾醇的叶片状结构,另一种为球晶状聚集体结构,这与DONG等[22]观察到的晶体类似。本研究中,随着γ-谷维素比例的增加,即植物甾醇与γ-谷维素质量比为40∶60时,在样品中仅观察到球晶状聚集体(图8-d、图9-d、图10-d、图11-d),这可能是在特定的摩尔分子数下,γ-谷维素和植物甾醇先自组装成一维小管,然后这些晶体以放射状方式生长,形成“球晶状”外观的三维网络结构,葵花籽油/牡丹籽油在晶格间有序堆积,形成固体凝胶[23]。植物甾醇与γ-谷维素质量比为20∶80时,在样品中观察到发蓝光的晶体结构和少量的球晶状聚集体(图8-e、图9-e、图10-e、图11-e)。当葵花籽油和牡丹籽油中仅添加8%的γ-谷维素时,可形成具有层状结构的大片状圆形晶体,这些晶体结构较大,且会从油中析出而沉积到容器底部,不会使液体油形成凝胶(图8-f,图9-f,图10-f,图11-f)。除此之外,谷甾醇和γ-谷维素可通过分子间氢键协同自组装,形成管状微结构[24],从而达到截留植物油的效果使其凝胶,但这种管状微结构的纤维细小,小于可见光的波长,无法在偏振光显微镜下观察到[21]。综上,在葵花籽/牡丹籽油中添加8%不同比例的植物甾醇和γ-谷维素时,体系中会形成不同形态的结晶和空间网络结构,由此形成的油凝胶的物理特性也有所差异。当植物甾醇与γ-谷维素的质量比例为40∶60时,二者可通过分子自组装形成以“球晶状”形态为主的三维网络空间,结构致密,且维系结构稳定的晶格间分子作用力也最强,形成的油凝胶具有较高的硬度、黏弹性和熔点。

a~f-植物甾醇与γ-谷维素的质量比分别为100∶0, 80∶20,60∶40,40∶60,20∶80,0∶100

a~f-植物甾醇与γ-谷维素的质量比分别为100∶0, 80∶20,60∶40,40∶60,20∶80,0∶100
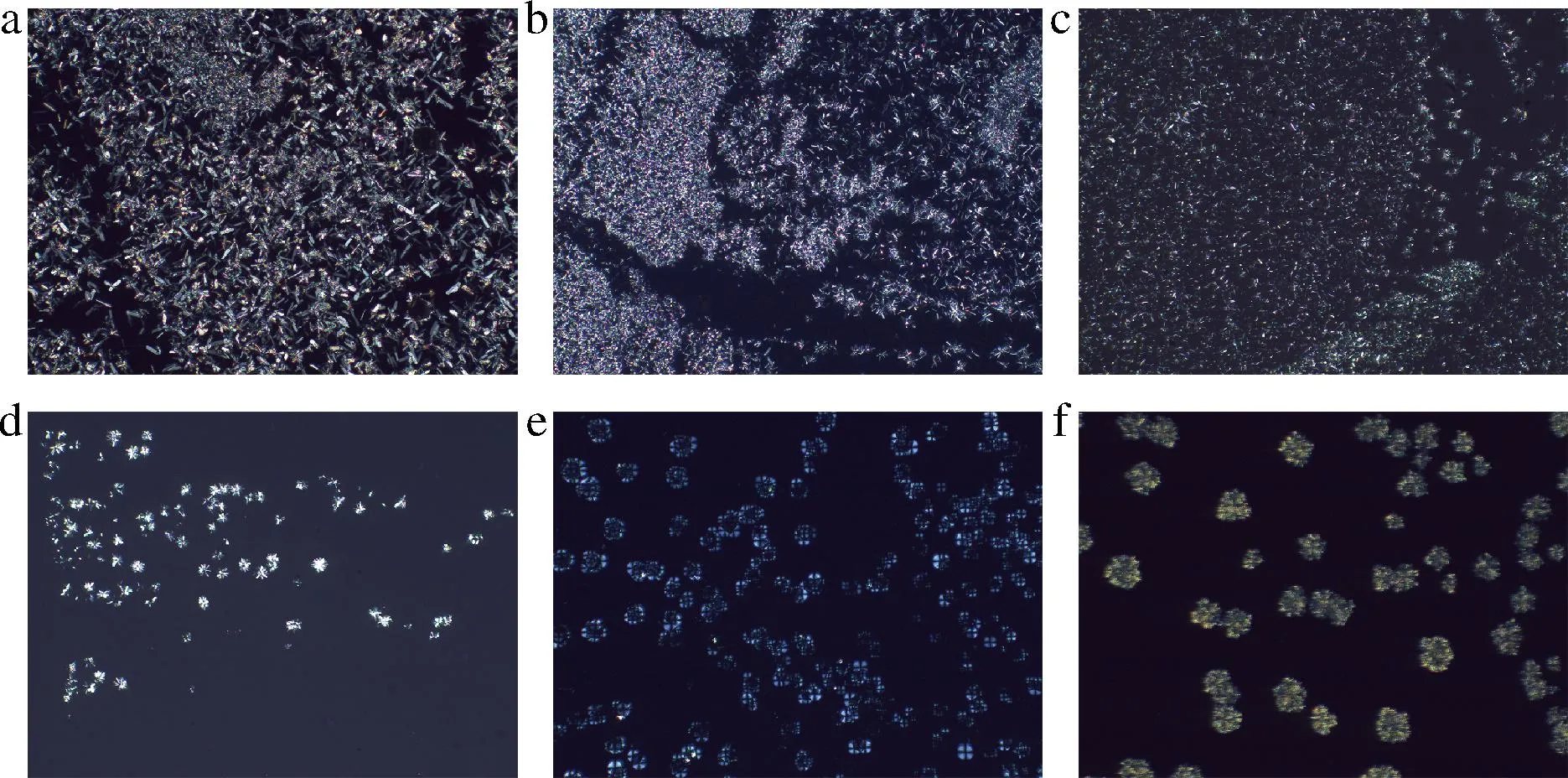
a~f-植物甾醇与γ-谷维素的质量比分别为100∶0, 80∶20,60∶40,40∶60,20∶80,0∶100

a~f-植物甾醇与γ-谷维素的质量比分别为100∶0, 80∶20,60∶40,40∶60,20∶80,0∶100
3 结论
以牡丹籽油和葵花籽油为基质油,植物甾醇和γ-谷维素为凝胶剂,通过其分子自主装行为,成功制备了高含量α-亚麻酸/亚油酸的植物油凝胶,探明了植物甾醇与γ-谷维素添加比例以及基质油的脂肪酸分布模式对油凝胶外观、硬度、黏度、微观结构、流变和热力学性质的影响规律。当植物甾醇与γ-谷维素质量比为40∶60、添加量为8%时,形成的油凝胶硬度和黏度最大,熔点最高,凝胶时间也最短,然后依次是二者添加比例为60∶40,80∶20和20∶80的凝胶样品;当植物甾醇与γ-谷维素添加比例相同时,牡丹籽油凝胶比葵花籽油凝胶的硬度更大,凝胶时间更短,熔点更高。油凝胶制备时,可通过调整植物甾醇与γ-谷维素的比例来获得所需的晶型和凝胶网络结构,并由此获得理想的硬度、黏度、熔点和透明度等,以适应特定食品加工的需求。此外,植物油中脂肪酸的分布模式也对油凝胶的硬度、熔点、黏度等特性产生一定的影响,高含量的α-亚麻酸酯在凝胶网络结构中倾向于以β型(三斜排列)的方式进行堆积,形成凝胶的硬度、黏度等相对更高。本研究为营养型(高α-亚麻酸/亚油酸、高植物甾醇/γ-谷维素)油凝胶制备时结晶和网络结构调控,硬度、黏度和透明度调控提供了技术支撑,也为后续进一步探讨该类凝胶在功能营养奶油和黄油的应用提供了理论基础。

