柴胡解表退热功效相关生物活性指标与柴胡皂苷a、柴胡皂苷d含量相关性分析△
刘壮壮,康媛,郭怡琳,郭欣慰,李西蒙,蔡润兰,高源,齐云
中国医学科学院 北京协和医学院 药用植物研究所,北京 100193
柴胡是临床常用中药,始载于《神农本草经》,列为上品,功效为解表退热、疏肝解郁、升举阳气。现代中医临床常将其用于感冒发热、寒热往来、胸胁胀痛、月经不调、子宫脱垂、脱肛等[1]。《中华人民共和国药典》(以下简称《中国药典》)2020 年版中收录了伞形科柴胡Bupleurum chinenseDC.(北柴胡)和狭叶柴胡B.scorzonerifoliumWilld.(南柴胡)2 个品种,依据南、北柴胡中柴胡皂苷a(SSa)和柴胡皂苷d(SSd)的含量,分别采用定性(南柴胡)或定量(北柴胡,SSa和SSd总质量分数不得少于0.30%)作为其化学质量控制标准[2]。
在柴胡的3 个功效中,解表退热的历史沿革最久,《神农本草经》中就记载了其“主治寒热邪气”[1],临床应用广泛(如经典名方小柴胡汤、大柴胡汤、柴胡桂枝汤、柴葛解肌汤)。因此,本研究聚焦于柴胡解表退热之功效,通过解析其可能存在的生物活性,从对应的相关体外模型中筛选出量效关系明显的指标,并根据各指标在实际病理过程的重要性赋予不同权重,以加权后的综合得分(生物活性量化值)量化柴胡解表退热作用的强弱。通过将各个柴胡样品的综合得分与其所含SSa 和SSd 的总量进行相关性分析,即可间接判断SSa 和SSd 是否是其解表退热功效的物质基础。
1 材料
1.1 细胞
小鼠单核巨噬细胞白血病细胞RAW264.7 购于美国模式培养物集存库(ATCC);人急性单核细胞白血病细胞THP-1 购于中国医学科学院基础医学研究所细胞资源中心。
1.2 药材
柴胡样品均由北京协和医学院药用植物研究所郭欣慰副研究员提供并鉴定为伞形科植物柴胡Bupleurum ChinenseDC.(北柴胡)或狭叶柴胡B.scorzonerifoliumWilld.(南柴胡)的干燥根,分别为四川北柴胡(用于活性指标筛选)、陕西宝鸡北柴胡(B-1#)、湖北十堰房县北柴胡(B-2#)、河南洛阳嵩县北柴胡(B-3#)、黑龙江齐齐哈尔碾子山区北柴胡(B-4#)、黑龙江大庆林甸县花园镇南柴胡(N-5#)、内蒙古呼伦贝尔市扎兰屯市卧牛河镇南柴胡(N-6#)、内蒙古兴安盟科尔沁右翼前旗大石寨镇南柴胡(N-7#)。
1.3 试药
DMEM 培养基干粉(批号:2445690)和RPMI 1640 培养基干粉(批号:2298430)均购自美国Gibco 公司;无噬菌体低内毒素优级胎牛血清(批号:22040703,浙江天杭生物科技股份有限公司);细胞培养用青链霉素(批号:090419210209,北京索莱宝科技有限公司);牛血清白蛋白(BSA,批号:WXBC8988V)、脂多糖(LPS,批号:0000130726)、Trolox(批号:BCBG5969V)和酵母多糖A(批号:BCBK3273V)均购自美国Sigma-Aldrich 公司;三吡啶三嗪(TPTZ,批号:1208864,美国Honeywell Fluka 公司);乙腈(批号:20230214,天津市永大化学试剂有限公司);Griess 试剂盒(批号:S0021M-2/S0021M-3,上海碧云天生物技术有限公司);正常人血清补体(批号:185488,美国Quidel公司);生物素化小鼠抗人C5b-9 抗体(批号:7397B-01,丹麦AntibodyShop公司);辣根过氧化物酶(HRP)标记亲和素(批号:B405103)、ELISA Coating Buffer(批号:B372207)、3,3′,5,5′-四甲基联苯胺(TMB)显色液(批号:B377080)和人肿瘤坏死因子-α(TNF-α)ELISA 试剂盒(批号:B352565)均购自美国Biolegend公司;CCK-8试剂盒(批号:40,美国GlpBio 公司);SSa(批号:PS011067,纯度≥98%)和SSd(批号:PS011481,纯度≥98%)均购自成都普思生物科技股份有限公司。
1.4 仪器
Quintix35 型十万分之一电子精密天平(德国Satorius 公司);YF-116B 型高速中药粉碎机(瑞安市永历制药机械有限公司);98-1B 型加热套(天津市泰斯特仪器有限公司);MB100-4P 型微孔板恒温振荡器(杭州奥盛仪器有限公司);Multiskan Ascent型酶标仪(美国Thermo Electron 公司);Napco 5410型二氧化碳孵箱(美国Napco 公司);Essentia LC-15C型高效液相色谱系统(配置LCsolution型色谱工作站、LC-15C 型泵、SIL-10AF 型自动进样器、SPC-15C型紫外检测器,日本岛津公司)。
2 方法
2.1 药物制备
按照临床柴胡煎药方式制备水煎剂:柴胡样品经粉碎机简单破碎后分别称取约80 g置于煎药器中,用10 倍量超纯水浸泡2 h 后煎煮15 min,收集药液;向药渣中加5 倍量超纯水煎煮15 min 后收集药液,此为第二煎;第三煎重复第二煎的操作;合并3 次药液。滤过并浓缩药液后加入乙醇至醇体积分数为70%,4 ℃静置过夜。滤过,除去多糖和蛋白质等沉淀物质,收集滤液浓缩至恒重,所得浸膏保存于-20 °C备用。
2.2 细胞培养
RAW264.7 细胞采用含10%胎牛血清和青霉素-链霉素的DMEM 培养基,THP-1 细胞采用含10%胎牛血清、0.05 mmol·L-1巯基乙醇和青霉素-链霉素的RPMI 1640培养基,于37 ℃、5% CO2培养箱中培养。
2.3 CCK-8法检测细胞活力
取对数生长期的RAW264.7细胞或THP-1细胞,分别按2×105个/孔或3×105个/孔(100 μL/孔)接种于96 孔板中,随后加入不同终质量浓度的柴胡提取物溶液(RAW264.7细胞为250、500、1000 μg·mL-1,THP-1细胞为125、250、500、1000 μg·mL-1,培养基溶解后过0.22 μm 滤膜除菌,100 μL/孔),于37 ℃、5% CO2培养箱中培养22 h 后,每孔加入CCK-8 溶液20 μL,在37 ℃继续孵育2 h 后,测定450 nm 处的吸光度(A),按照公式(1)计算细胞活力。
2.4 Griss 法检测细胞上清液中一氧化氮(NO)水平
取对数生长期的RAW264.7细胞,按2×105个/孔接种于96 孔板中,加入2.3 项下筛选得到的无毒质量浓度的柴胡提取物(B-1#、B-2#、B-3#和B-4#的终质量浓度为250、500 μg·mL-1;N-5#、N-6#和N-7#的终质量浓度为250、500、1000 μg·mL-1),预处理细胞1 h,加入终质量浓度为10 ng·mL-1的LPS,于细胞培养箱中继续孵育24 h 后取上清液,用Griess试剂盒测定NO含量。
2.5 ELISA法检测细胞上清液中TNF-α的含量
取对数生长期的THP-1 细胞,按3×105个/孔接种于96 孔细胞板中,加入2.3 项下筛选得到的无毒质量浓度的柴胡提取物(B-1#和B-3#终质量浓度为125、250、500 μg·mL-1;B-2#、B-4#、N-5#、N-6#、N-7#终质量浓度为125、250、500、1000 μg·mL-1),预孵育1 h 后加入终质量浓度为10 ng·mL-1的LPS,于37 ℃、5% CO2培养箱中培养24 h。次日收集细胞培养上清液,用ELISA试剂盒测定TNF-α的含量。
2.6 铁离子还原能力法(FRAP)测定总抗氧化能力
FRAP 工作液参照本课题组前期建立的方法配制[3],临用现配。向96 孔酶标板每孔加入Trolox 或柴胡提取物50 μL,再加入TPTZ工作液200 μL,于微孔板恒温振荡器中37 ℃反应20 min后,测定540 nm处的A。以Trolox当量代表柴胡样品总抗氧化能力。
2.7 酵母多糖介导的替代途径补体活化水平测定
实验方法在参考Jendza等[4]建立方法的基础上稍作修改。将酵母多糖包被至96 孔板(100 μL/孔,1 mg·mL-1),4 °C 孵育过夜。用PBST 洗去游离的酵母多糖后,每孔加入1% BSA 封闭液200 μL,在25 ℃避光孵育1 h 后洗板4 次,立即使用或储存于-20 ℃备用。于离心管中加入终质量浓度为125、250、500、1000 μg·mL-1的柴胡提取物50 μL,再加入稀释12.5 倍的正常人血清补体50 μL,25 ℃避光反应15 min。将反应物加至包被了酵母多糖的ELISA 板内(50 μL/孔),37 ℃避光孵育1 h。洗去未结合物,加入生物素化小鼠抗人C5b-9 抗体(100 μL/孔),37 ℃避光孵育1 h。用PBST 洗去未结合物,加入HRP 标记的亲和素(100 μL/孔),37 ℃避光孵育30 min。洗板5 次,加入TMB 底物(100 μL/孔),37 ℃避光显色15 min。加入2 mol·L-1H2SO4(100 μL/孔)终止显色反应,于450 nm 处检测A。
2.8 高效液相色谱法(HPLC)测定各柴胡样品中SSa和SSd的含量
2.8.1 样品制备 按照《中国药典》2020 年版柴胡【含量测定】项中的方法制备供试品溶液和对照品溶液[2]。
2.8.2 色谱条件 XBridge BEH C18反相色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-水(B),梯度洗脱(0~5 min,70%B;5~35 min,70%~30%B;35~40 min,30%B;40~45 min,30%~70%B;45~60 min,70%B),柱温为室温,检测波长为210 nm,流速为1 mL·min-1。
2.9 数据统计
3 结果
3.1 柴胡解表退热功效相关灵敏指标的筛选
灵敏指标的筛选研究以四川产北柴胡(提取物得率为18.45%)为研究对象,通过解析柴胡解表退热功效的临床应用、风寒/风热表证和外感发热的病理过程,从抗巨噬细胞活化 [包括3 个指标:LPS 刺激巨噬细胞分泌NO、白细胞介素-6(IL-6)、TNFα]、抗肥大细胞活化[包括3 个指标:免疫球蛋白E(IgE)/免疫球蛋白Fc 段受体(FcεRI)介导RBL-2H3 细胞脱颗粒、Mas 相关G 蛋白偶联受体-X2(MrgprX2)介导LAD2 细胞脱颗粒、钙离子载体A23187/佛波 酯(PMA)诱导RBL-2H3 细 胞分泌TNF-α]、抗氧化应激[包括3 个指标:1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力、羟自由基清除能力、总抗氧化能力]及解热(包括3 个指标:LPS 刺激单核细胞THP-1 分泌IL-6 和TNF-α,以及补体活化)这4 类与此功效相关的体外模型中寻找评价其质量的可靠灵敏指标,以综合评估柴胡解表退热作用的优劣与强弱。最终选定了量效关系明确、灵敏度高的4 项指标(图1):LPS 诱导RAW264.7巨噬细胞生成NO(抗炎)、LPS 刺激THP-1 细胞分泌TNF-α(解热)、总抗氧化能力及酵母多糖介导的替代途径补体活化(解热),并建立了基于柴胡解表退热功效的生物质控评价体系。
3.2 柴胡样品生物活性指标评价
7 个柴胡样品B-1#、B-2#、B-3#、B-4#、N-5#、N-6#、N-7#提取物得率分别为16.58%、11.53%、10.93%、14.56%、10.64%、13.34%、19.72%,用于后续生物活性指标评价。
3.2.1 柴胡提取物对RAW264.7和THP-1细胞活力的影响 分别考察7个柴胡样品提取物在RAW264.7细胞和THP-1 细胞上的无毒剂量。结果显示,4 个北柴胡的提取物在质量浓度为1000 μg·mL-1时对RAW264.7 细胞具有明显的细胞毒性;而3 个南柴胡的提取物在各质量浓度(250、500、1000 μg·mL-1)均对细胞活力无显著影响(图2)。在THP-1细胞上,B-1#和B-3#的提取物在质量浓度为1000 μg·mL-1时具有明显的细胞毒性;其余5 个样品的提取物在各质量浓度下均对细胞活力无显著影响(图3)。随后的细胞实验均在不影响细胞活力的剂量下展开。
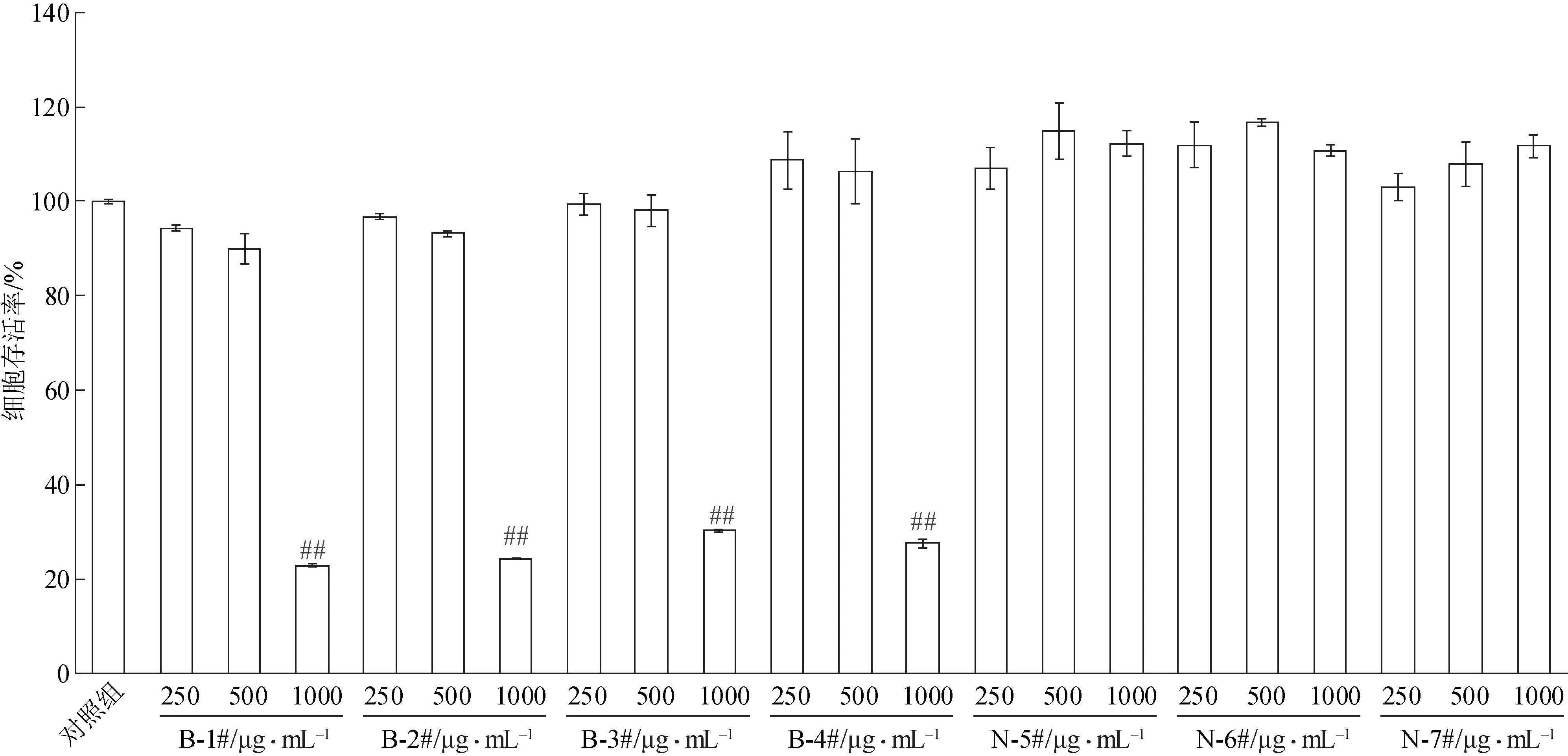
图2 不同质量浓度柴胡提取物对RAW264.7细胞活力的影响(±s,n=3)

图3 不同质量浓度柴胡提取物对THP-1细胞活力的影响(±s,n=3)
3.2.2 柴胡提取物对LPS诱导的RAW264.7细胞分泌NO 的作用 如图4 所示,7 个样品均能质量浓度依赖地抑制RAW264.7细胞分泌NO。将各样品提取物质量浓度换算为对应生药质量浓度,并绘制NO抑制率-生药质量浓度曲线(图5)。在相同抑制率下,曲线越靠右则表明该样品对NO 的抑制作用越弱,以此判断7个样品对NO 分泌的抑制作用强弱并排序:B-1#>N-5#≈N-6#≈N-7#>B-3#>B-2#>N-4#。

图4 不同质量浓度柴胡提取物对LPS刺激RAW264.7细胞分泌NO的作用(±s,n=3)

图5 柴胡提取物的NO抑制率-生药质量浓度曲线
3.2.3 柴胡提取物对LPS 刺激THP-1 细胞分泌TNF-α的作用 单核细胞被外生致热原刺激后生成致热因子如TNF-α、IL-6、IL-1β,致热因子是感染性发热的关键因素[5]。如图6 所示,样品B-1#、B-3#、N-5#、N-6#、N-7#均能质量浓度依赖地抑制LPS 诱导的THP-1 细胞分泌TNF-α;然而,B-2#和B-4#的提取物呈现出相反的作用。将除B-2#和B-4#外的5 个样品的提取物质量浓度换算为对应生药质量浓度,并绘制TNF-α抑制率-生药质量浓度曲线(图7),根据曲线右移情况判断5个样品对TNF-α的抑制作用强弱并排序:N-6#>N-7#>B-1#>N-5#>B-3#。

图6 不同质量浓度柴胡提取物对LPS刺激THP-1细胞生成TNF-α的作用(±s,n=3)
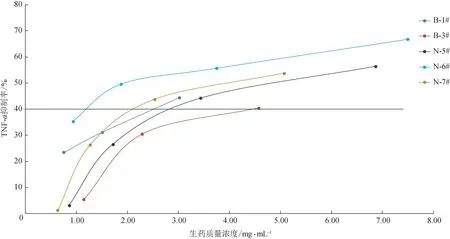
图7 柴胡提取物的TNF-α抑制率-生药质量浓度曲线
3.2.4 柴胡提取物的总抗氧化能力比较 如图8 所示,7 个柴胡样品的总抗氧化能力显著,且呈质量浓度依赖性。为了便于样品间作用比较,以Trolox当量表示柴胡样品的总抗氧化能力[2],将各提取物质量浓度换算成对应的生药质量浓度并绘制Trolox 当量-生药质量浓度曲线(图9),经计算,样品B-1#、B-2#、B-3#、B-4#、N-5#、N-6#和N-7#与10 μmol·L-1Trolox 的等效质量浓度分别为0.570 8、1.053 1、1.130 2、0.452 1、0.982 9、1.244 7、0.900 3 mg·mL-1。等效质量浓度越低表明总抗氧化能力越强,以此将7 个样品的总抗氧化能力强弱排序:B-4#>B-1#>N-7#>N-5#>B-2#>B-3#>N-6#。
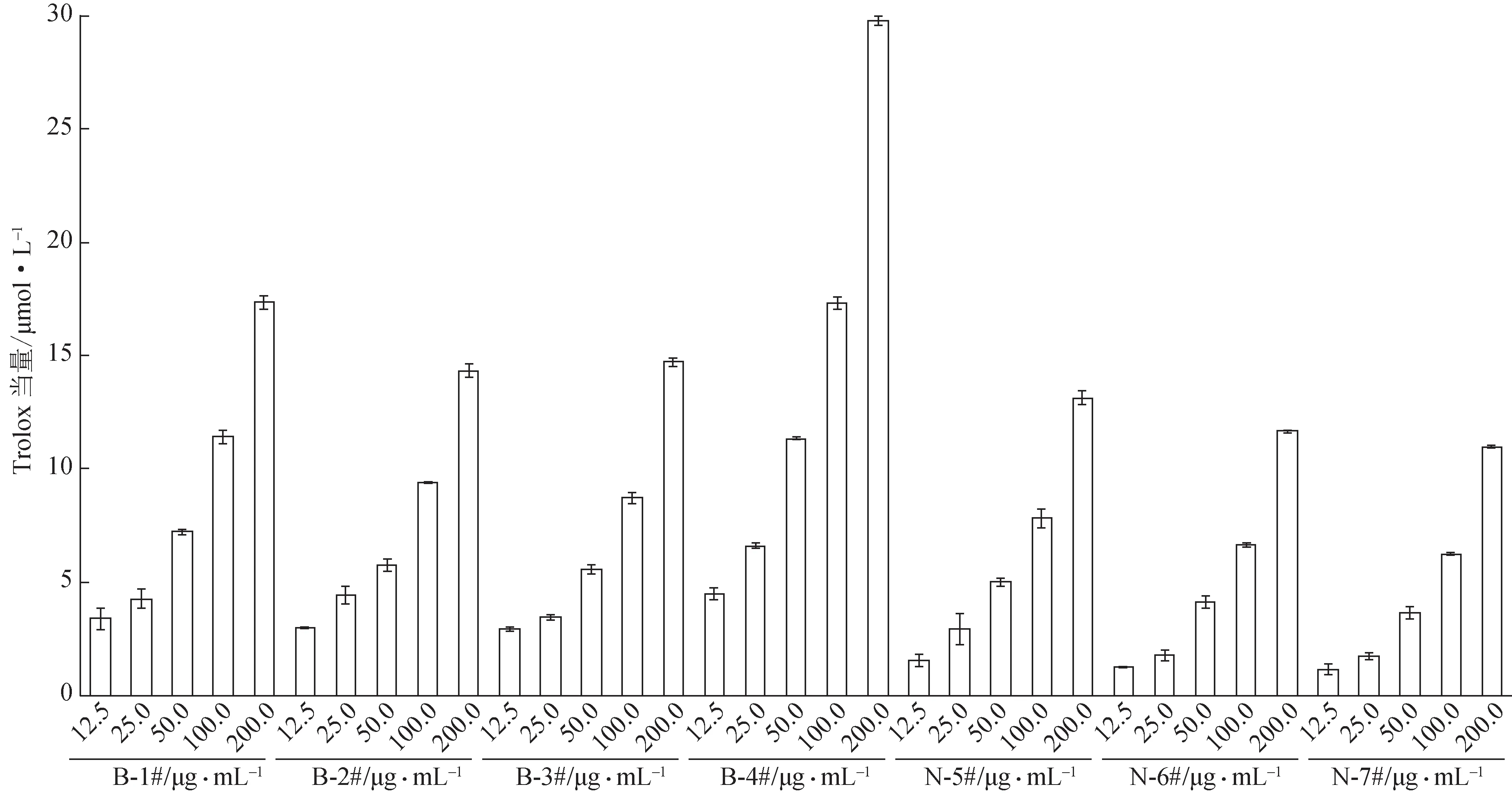
图8 不同质量浓度柴胡提取物的总抗氧化能力(±s,n=3)
3.2.5 柴胡提取物对酵母多糖介导的替代途径补体活化的作用 补体系统在接触到病原微生物或其产物时可以通过经典途径、凝集素途径和替代途径迅速激活,补体的活化与感染性发热密切相关[6-7],如细菌内毒素即可诱导替代途径的补体活化而引起或增强发热[8]。研究结果显示(图10),7 个样品均质量浓度依赖地抑制了该途径的补体活化。将提取物质量浓度换算为生药质量浓度并绘制补体活化抑制率-生药质量浓度曲线(图11),根据曲线右移情况判断7 个样品对替代途径补体活化的抑制作用强弱并排序:B-1#>B-2#>B-4#>N-6#>N-7#>B-3#>N-5#。

图10 不同质量浓度柴胡提取物对体外补体活化的作用(±s,n=3)
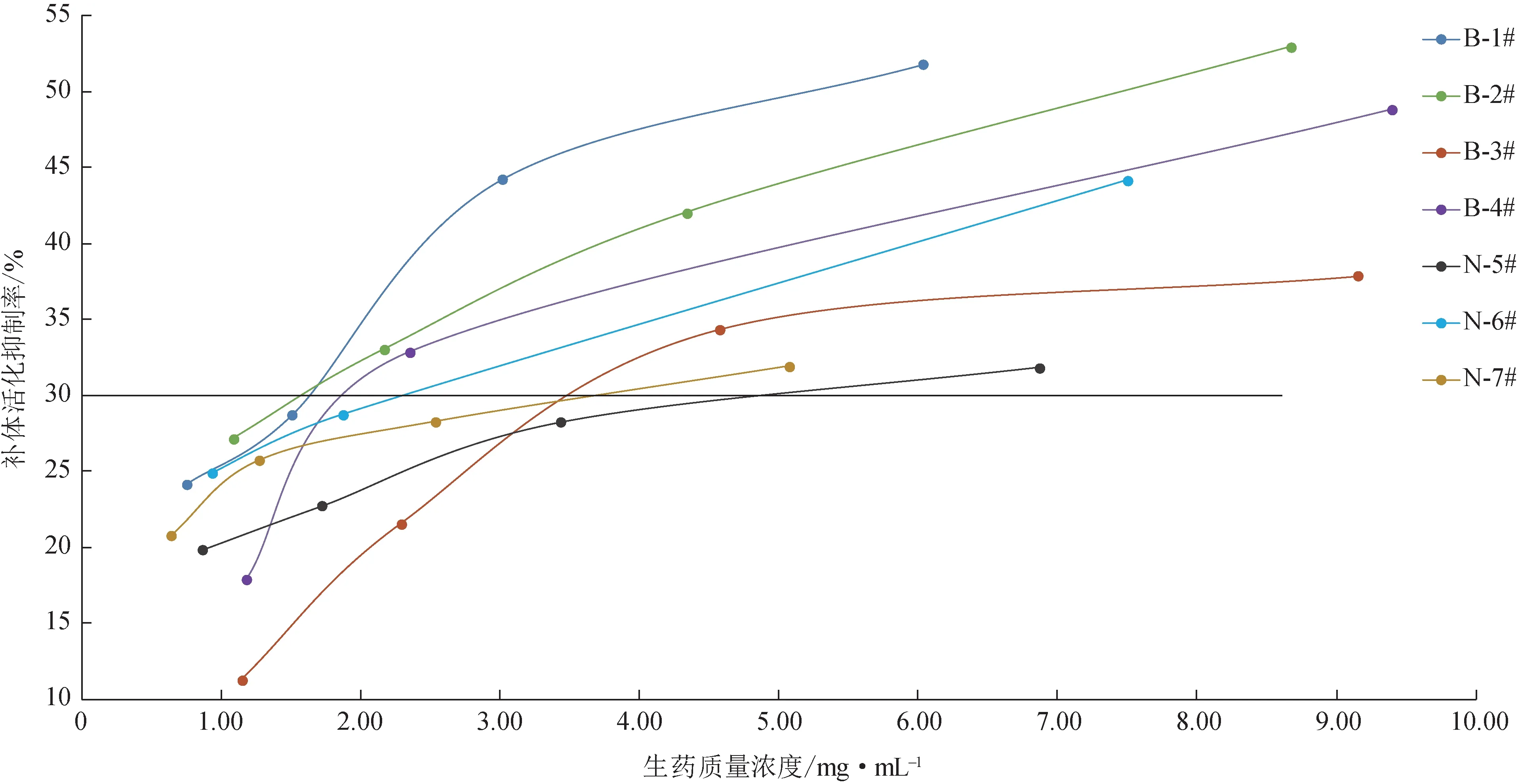
图11 柴胡提取物的补体活化抑制率-生药质量浓度曲线
3.2.6 生物评价得分 根据以上4 项指标在柴胡解表退热中的贡献度,并充分考虑临床用柴胡于表证,多因其擅长解散肌热(退热),故赋予了与发热直接相关的THP-1 细胞生成TNF-α(0.5)及补体活化(0.2)这2 项指标共占比0.7 的权重;而LPS 诱导RAW264.7 巨噬细胞生成NO 与总抗氧化能力这2 项指标的权重分别为0.2 和0.1。随后,将上述7 个样品在每项生物指标上的排名转换为分数,排名最高者计7分,排名第二者计6分,依次递减。以排名分数与相应的权重的积为该项得分,4 项得分的总和视为该柴胡解表退热生物活性的量化值。经计算,7个样品的总分由大到小排序为B-1#>N-6#>N-7#>N-5#>B-3#>B-2#>B-4#(表1)。

表1 柴胡样品生物评价得分
3.3 柴胡样品中SSa 和SSd 含量及其与生物评价总分的相关性分析
《中国药典》2020 年版将SSa 和SSd 的总含量作为北柴胡的质量控制标准(南柴胡由于SSa 和SSd含量低,仅以两者定性),并且普遍认为皂苷类成分是柴胡的主要活性成分之一[9]。按照《中国药典》2020 年版方法测定7 个柴胡样品中SSa 和SSd 含量。如 图12 所示,SSa 和SSd 的tR分别为21.057、26.987 min。SSa 和SSd 的峰面积-样品质量浓度标准曲线分别为Y=371 080X+11 733(r=0.998)和Y=338 550X+101 833(r=0.995 0),利用外标法计算得到7 个柴胡样品中SSa和SSd含量(表2)。其中,4个北柴胡样品(B-1#~B-4#)中SSa 和SSd 的总质量分数均远高于《中国药典》2020 年版规定的限度0.30%,质量分数最高的样品(B-3#)可达1.110 5%。而3 个南柴胡样品(N-5#~N-7#)中的SSa和SSd总质量分数均远低于北柴胡样品,这与文献报道南北柴胡皂苷含量差距是一致的[10]。随后,采用Spearman 相关分析法考察7 个样品的生物评价得分与其SSa 和SSd 总含量间的相关性(图13),两者间r=-0.500 0,P=0.266 7(>0.05),表明7 个柴胡样品中SSa 和SSd 的总质量分数与柴胡解表退热的生物活性量化值之间不具有相关性。
表2 柴胡样品中SSa和SSd的质量分数(±s,n=3) %
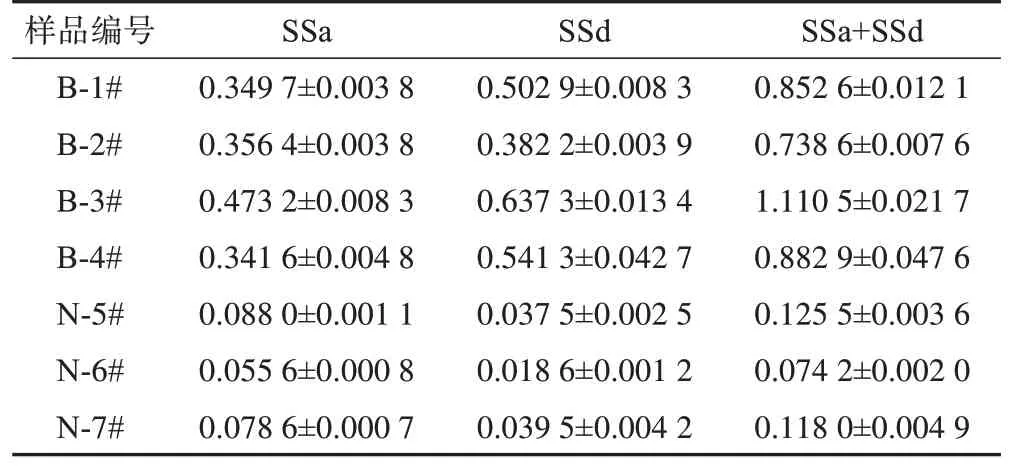
表2 柴胡样品中SSa和SSd的质量分数(±s,n=3) %

图12 对照品SSa和SSd及柴胡样品的HPLC图

图13 柴胡样品的生物活性量化值与SSa和SSd总质量分数的相关性
4 讨论
柴胡用于解表时,既能用于风寒表证也能用于风热表证[11]。表证即外感病邪(外界的各种致病因素)侵入机体浅表部位后出现的一组症候群,临床表现主要有恶寒、发热、鼻塞、喷嚏、流涕、咳嗽、咽喉痒痛、头痛、肌肉酸痛等。表证治疗的对症措施主要为抗炎(感染性炎症和过敏性炎症)和抗病原微生物。在感染性炎症方面,本研究从3 个指标(LPS诱导的RAW264.7细胞分泌NO、IL-6和TNF-α)中筛选出了灵敏指标,即柴胡对LPS 诱导的RAW264.7细胞生成NO的抑制作用。但在过敏性炎症上,选用MrgprX2 介导人肥大细胞LAD2 非免疫型脱颗粒模型、IgE/FcεRI介导RBL-2H3脱颗粒模型和A23187/PMA 联合刺激RBL-2H3 释放TNF-α模型筛选柴胡的抗过敏指标。然而,柴胡提取物对3 种过敏体外模型均无抑制作用。此外,由于氧化应激和炎症是高度关联且相互促进的病理生理过程,抗氧化也早已被纳入各种炎症性疾病的治疗策略中[12],故本研究将抗氧化应激也视作解表的对症措施之一,并从3个指标(总抗氧化能力、DPPH 自由基清除能力、羟自由基清除能力)中筛选出总抗氧化能力这一灵敏指标。考虑到包括柴胡在内的多数中药对感染性疾病的疗效并不依赖其抗病原微生物作用[13]而未将此项指标纳入。
柴胡的解表功效以退热为主要特征,柴胡从古至今也一直是临床治疗表证发热最常用的中药之一[11]。中医表证多属现代医学的上呼吸道感染,机体免疫细胞受外生致热原(细菌或病毒)刺激后产生的内生致热因子(如TNF-α、IL-6、IL-1β)随血液循环运输至血脑屏障附近,刺激脑内皮细胞产生中枢致热介质,后者作用于中枢神经系统而引发体温升高[5,14]。由此可见,抑制内生致热因子的分泌是解热的重要策略。本研究建立了LPS 诱导的THP-1细胞分泌致热因子(TNF-α和IL-6)细胞模型并发现柴胡能显著减少细胞TNF-α的生成。此外,补体系统在接触到病原微生物或其产物(如LPS 或酵母多糖触发的替代途径)时几乎立即被激活,激活过程产生的补体毒素C5a 是神经途径介导的快速发热过程的关键触发因素[6],且C5a还可协同LPS 刺激的单核/巨噬细胞分泌TNF-α等内生致热原从而放大感染性发热[15]。本研究结果显示,柴胡能剂量依赖地抑制酵母多糖介导的替代途径补体活化。本课题组前期研究在体内实验中也证实了柴胡水提物温和的退热作用与其抑制循环中TNF-α生成及补体活化有关[16]。
获得以上4 种灵敏指标数据后,本研究按照其在柴胡解表退热功效上的贡献度及在外感发热病理过程中的参与度赋予了不同权重。鉴于柴胡的解表功效以退热为最大特征,且单核细胞分泌内生致热原是导致外感发热的主要因素[6],本研究将与发热直接相关的2 项指标赋予了共计0.7 分权重(其中LPS诱导的THP-1 细胞分泌TNF-α的权重系数设为0.5,替代途径补体活化权重系数设为0.2);而代表抗炎的LPS 诱导RAW264.7 巨噬细胞生成NO 权重设为0.2,总抗氧化能力权重系数设为0.1。以此评价体系对7 个柴胡样品(4 个北柴胡,3 个南柴胡)解表退热作用优劣进行了对比与排序,结果发现,南、北柴胡在不同的生物活性指标上存在较大差异。值得注意的是,3 个南柴胡样品的SSa 和SSd 总含量均远低于北柴胡,但其生物活性量化值均仅次于排名第一的陕西北柴胡B-1#;而在3 个南柴胡样品中,SSa 和SSd 总含质量分数最低的N-6#(0.074 2%)在3 个南柴胡中得分最高。再结合本研究的相关性分析结果表明,《中国药典》2020 年版中北柴胡的指标性成分SSa 和SSd 总量与解表退热的生物活性量化值并无相关性,提示SSa 和SSd 可能并非是柴胡解表退热的物质基础。此发现也与前期学者的研究结果一致[17]。
中药成分组成复杂,成分之间还可能存在着交互作用,检测单个或几个化学成分难以与整体中药的临床功用真正相关。利用生物活性指标(群)来判断关联功用中药质量的方法可能是目前以指标性成分衡量其质量方式的一种有效修正与补充。本研究在筛选与柴胡解表退热功效相关的生物活性指标方面开展了有益的探索,为科学评价柴胡解表退热功效及物质基础的判断提供了研究的新路径。
[利益冲突]本文不存在任何利益冲突。

