AK-HER2与参照药治疗HER2阳性转移性乳腺癌患者的疗效、体内代谢特征、安全性和免疫原性比较:一项多中心、随机、双盲Ⅲ期等效性临床试验
罗 扬,孙 涛,邵志敏,崔久嵬,潘跃银,张清媛,程 颖,李惠平,杨 燕,叶长生0,于国华,王京芬,刘运江,刘新兰,周宇红,柏玉举,谷元廷 ,王晓稼,徐兵河,宋礼华
1.国家癌症中心/国家肿瘤临床医学中心/中国医学科学院北京协和医学院肿瘤医院内科,北京100021;
2.辽宁省肿瘤医院乳腺内科,辽宁 沈阳 110042;
3.复旦大学附属肿瘤医院乳腺外科,上海 200032;
4.吉林大学第一医院肿瘤科,吉林 长春 130021;
5.中国科学技术大学附属第一医院肿瘤内科,安徽 合肥 230001;
6.哈尔滨医科大学附属肿瘤医院乳腺内科,黑龙江 哈尔滨 150081;
7.吉林省肿瘤医院胸部肿瘤内科,吉林 长春 130021;
8.北京大学肿瘤医院乳腺肿瘤内科,肿瘤发生及转化研究教育部重点实验室,北京 100142;
9.蚌埠医科大学第一附属医院肿瘤内科,安徽 蚌埠 233004;
10.南方医科大学南方医院乳腺科,广东 广州 510515;
11.潍坊市人民医院肿瘤内科,山东 潍坊 261041;
12.临沂市肿瘤医院乳腺科,山东 临沂 276001;
13.河北医科大学第四医院乳腺外科,河北 石家庄 050010;
14.宁夏医科大学总医院肿瘤医院肿瘤内科,宁夏 银川 750003;
15.复旦大学附属中山医院肿瘤内科,上海 200032;
16.遵义医科大学第二附属医院肿瘤科,贵州 遵义 563006;
17.郑州大学第一附属医院乳腺外科,河南 郑州 450003;
18.中国科学院大学附属肿瘤医院(浙江省肿瘤医院)乳腺肿瘤内科,浙江 杭州 310022;
19.基因工程制药安徽省重点实验室,肿瘤精准治疗技术及产品国家地方联合工程研究中心,安徽 合肥 230088
世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的数据显示,2020年全球乳腺癌新发病例约230万和死亡病例68.5万[1]。2020年中国乳腺癌新发病例数高达41.6万,死亡病例数高达11.7万,乳腺癌已成为中国女性肿瘤相关死亡率最高的恶性肿瘤[2]。中国女性乳腺癌的发病率与死亡率特点[3]如下:① 发病年龄趋向年轻化。中国人群初诊时年龄为40~50岁[4-6];②不同地区乳腺癌生存率差异大。例如农村与城市比较,乳腺癌患者的5年生存率差异超过20%(55.9%vs77.8%)[7];③ 不同地区乳腺癌复发率不同。农村患者复发率高于城市患者(41.3%vs34.8%)[8],这些差异在一定程度上可归因于健康意识差距、社会经济差异、医疗资源不均以及不同地区诊疗水平参差不齐[9-10]。
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌在全部乳腺癌中占有较高比例,针对HER2阳性转移性乳腺癌患者,曲妥珠单抗治疗能够延长患者总生存期,显著改善患者预后,相比之下,没有接受曲妥珠单抗治疗的患者中,部分患者出现疾病快速进展,甚至死亡[11-15]。但是原研曲妥珠单抗价格较高。生物类似药理论上具有相当的疗效和安全性。本临床试验旨在评估曲妥珠单抗生物类似药AK-HER2与原研曲妥珠单抗在HER2阳性转移性乳腺癌患者中的疗效、药代动力学、安全性和免疫原性。
生物类似药与已批准的参照药相比,在临床安全性或有效性方面差异无统计学意义[15]。Ⅰ期临床试验表明,AK-HER2与原研曲妥珠单抗在健康志愿者中的药代动力学、安全性和免疫原性相当[16]。基于此,本研究旨在评估AK-HER2与原研曲妥珠单抗在HER2阳性转移性乳腺癌患者中的临床疗效、药代动力学、安全性和免疫原性的差异。
1 资料和方法
1.1 研究方案
本研究是多中心、随机、双盲的Ⅲ期临床试验,旨在评估AK-HER2在HER2阳性转移性乳腺癌患者中的疗效、安全性及体内代谢特征。该研究在中国43个分中心开展,时间为2017年9月—2021年3月,共550例乳腺癌患者纳入本研究。本研究遵从注册的研究方案、赫尔辛基宣言阐明的伦理学原则和药物临床试验质量管理规范,获得各医院医学伦理委员会批准,临床试验注册机构为国家药品监督管理局(临床试验批件号为2015L04224,临床试验登记号为CTR20170516)。在入组前获得了受试者的书面知情同意书。入组患者筛选流程见图1。

图1 患者筛选流程图Fig.1 Patient flow diagram
1.1.1 入组标准
① 患者年龄≥18岁;② 组织学或细胞学检查证实患有乳腺癌;③ 东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)表现状态评分为0~1;④ 其他关键入选标准包括HER2阳性及雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PgR)状态;⑤ 通过影像学检查评估的可测量病灶;⑥ 正常(在机构正常范围内)左心室射血分数(left ventricular ejection fraction,LVEF)及器官功能良好。
1.1.2 排除标准
① 既往或正在治疗(全身化疗,或靶向药物,或除内分泌治疗外的任何其他抗癌药物);② 转移性乳腺癌;③ 存在或疑似存在脑转移或任何其他中枢神经系统转移;④ 存在需要治疗的具有临床意义的活动性感染;⑤ 未得到控制的高血压或不稳定型心绞痛;⑥ 有蒽环类药物治疗史且达到某一累积剂量(图1)。筛选出550例HER2阳性转移性乳腺癌患者,按ER/PgR状态1∶1比例随机分配至AK-HER2组和对照组,应用临床电子化中央随机系统(DAS for IWRS)分配随机号。547例患者被纳入疗效分析(3例未接受研究药物治疗的患者未纳入分析),275例患者接受AK-HER2治疗,272例患者接受原研曲妥珠单抗(赫赛汀®)治疗。
1.1.3 随机研究方法
本研究采用动态随机方法,符合筛选入组条件的受试者,根据体内激素受体状态,将入组患者随机分配至2个治疗组(试验组和对照组)并产生随机号,随机号即作为试验盲法条件下该受试者的唯一编号。本研究对随机编码的权限进行严格控制。研究过程中每例受试者接受何种治疗不会向研究者、研究中心人员、受试者本人以及申办者公开。由于试验药与对照药的内包装不同,每个临床研究中心都设有非盲团队,他们为每例受试者复溶研究药物。药物复溶后,非盲人员将在输液袋/瓶上做相应标记,标记中不得透露任何有关药物组别的信息,因此研究团队及申办方均将无法获知输液袋/瓶内含有何种药物。受试者随机化结束,从中央随机系统(interactive web response system,IWRS)导出随机表(一级盲底),一式二份提交申办方,分别封存在申办方和临床研究负责单位。二级盲底在编盲时产生提交。入组患者的人口学和基线特征见表1。

表1 人口学资料及基线特征分析 (FAS)Tab.1 Patient demographics and baseline characteristics (FAS)
1.1.4 治疗方法
在第1个周期的第1天,患者接受 AK-HER2或原研曲妥珠单抗静脉滴注,起始量为8 mg/kg,90 min完成,每3周为1个周期,直至第16个周期结束。多西他赛初始剂量75 mg/m2,在第1个周期的第2天首次静脉滴注,滴注时间为60 min,后续治疗均与AK-HER2或原研曲妥珠单抗联合用药,持续至少9个周期,直至患者发生疾病进展或不可耐受的药物相关毒性反应。研究设计见图1。
1.1.5 治疗效果与不良事件评价标准
受试者最终疗效根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1 版[17]和独立盲态审核认定。这项研究的主要疗效终点是第9个周期治疗结束时,患者客观缓解率(objective response rate,ORR)即ORR9,包括完全缓解率(complete response rate,CR)和部分缓解率(partial response rate,PR)。次要疗效终点为16个周期治疗结束时,患者ORR16、疾病控制率(disease control rate,DCR)、临床获益率(clinical benefit rate,CBR)、无进展生存期(progression-free survival,PFS)和1年生存率。
1.2 影像学检查
本研究受试者在研究过程中接受全身增强电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)检查。患者治疗效果评估依据实体瘤疗效评价标准,结合盲态独立中心评估(blinded independent central review,BICR)标准。在首次给药后第6、12、18、27、36、45周及治疗结束时等7个不同时间点均进行一次疗效评估。在筛查期和研究期间,受试者通过CT或MRI增强扫描评估病情,影像学检查包括:① 胸部和腹部(包括肝、脾和肾上腺等)CT或MRI扫描;② 临床疑似出现中枢神经系统(central nervous system,CNS)转移时,增加头颅和(或)脊椎CT或MRI扫描;③ 如果骨病灶出现进展或出现新发骨病灶,则需要再次进行X线扫描;④ 如果受试者出现新发皮肤(或皮下)病灶,则通过CT/MRI等影像学检查进行监测。并通过超声心动图(echocardiogram,ECHO)或多门核素血管造影术(multigated radionuclide angiography,MUGA)对心脏功能进行评估。
1.3 不良事件评估
本研究评估治疗期间出现的不良事件(treatment emergent adverse event,TEAE)、严重不良事件(serious adverse event,SAE)和特殊关注的不良事件(adverse event of special interest,AESI)的发生率和严重程度,探讨AKHER2和原研曲妥珠单抗的安全性和耐受性。所有不良事件使用监管活动医学词典(medical dictionary for regulatory activities,MedDRA)编码,并依照国家癌症研究所不良事件通用术语标准第4.03版(National Cancer Institute Common Terminology Criteria for Adverse Events v4.03,NCI-CTCAE v4.03)进行分级。
1.4 药代动力学评估
本研究在第1、3、4、5、6、10、13、16个周期时,分别在药物输注前及末次访视(end of treatment,EOT)时,采集血样进行药代动力学(pharmacokinetics,PK)分析。本研究在第6个周期用药后,随机选择100例受试者(AKHER2组∶对照组=1∶1)进行血样采集,采集时间点分别为输注45 min时(即给药结束)、给药结束后第4、8、24、72、120、168、336、504 h。采集后血样进行PK参数(PK parameter set,PKPS)分析。PK参数分析采用PKPS分析方法,由非房室模型计算各受试者的药代动力学参数,包括:药物稳态峰浓度(steady-state maximum concentration,Cmax,ss)、分布容积(volume of distribution,Vz)、末端消除半衰期(elimination half life,T½)、静脉给药稳态清除率(steady-state clearance,CLss)和给药间隔内血药浓度-时间曲线下面积(area under the plasma concentration-time curve from time 0 to last time quantifiable concentration,AUC0-τ)等。采用线性模型进行不同药物变异模型的分析。血药浓度(c)-时间(t)数据分析采用药代动力学浓度集(pharmacokinetics concentration set,PKCS)。
采用配体结合式(ligand binding assays,LBA)的定量分析方法测定血清中曲妥珠单抗药物浓度。采集的血样基于抗药抗体(antidrug antibody,ADA)、中和抗体(neutralizing antibody,NAB)和桥式酶联免疫吸附法(bridging-ELISA)分析方法评估受试者血清免疫原性特征。
1.5 统计学处理
总样本量鉴于文献报道的ORR数据[18-21],假设两组治疗6个月的主要疗效指标ORR的保守估计值为60%,根据《曲妥珠单抗生物类似药临床试验指导原则(征求意见稿)》(CDE,2020),使用AK-HER2与原研曲妥珠单抗比率的等效性限度[0.8,1.25],采用双向单侧t检验,单侧α=0.05,β=0.20,AK-HER2组与对照组按1∶1比例分配病例,采用PASS 14.0计算,考虑13.0%的脱落率,本研究计划纳入540例受试者。
采用χ2检验比较组间ORR9(95% CI),均进行符合方案集(per protocol set,PPS)和全分析集(full analysis set,FAS)分析。采用χ2检验或Fisher精确概率法比较ORR16、CBR和DCR组间差别。采用Kaplan-Meier的方法分析PFS,分别列出四分位数、中位数和删失率,组间比较采用log-rank检验。在次要疗效指标敏感性分析中,PFS采用Cox比例风险回归模型估计组间风险比并计算其95% CI(Wald法)。在PFS与生存期(overall survival,OS)数据分析分别采用分层log-rank检验计算P值,分层COX回归计算HR,分层因素为来源于IWRS的激素受体水平;采用不分层log-rank检验计算P值,不分层Cox回归计算HR。
2 结 果
2.1 药物暴露
AK-HER2组和对照组的随访持续时间均为48周。AK-HER2和原研曲妥珠单抗平均暴露治疗天数分别为197.6和198.2 d,差异无统计学意义(P=0.950);药物平均暴露剂量分别为3 850.49和3 863.07 mg,差异无统计学意义(P=0.945)。AK-HER2组和对照组中,多西他赛平均暴露治疗天数分别为167.0和159.5 d,差异无统计学意义(P=0.369);药物平均暴露剂量分别为1 063.081和1 023.048 mg,差异无统计学意义(P=0.410)。
2.2 疗效分析
采用独立评审委员会(Independent Review Committee,IRC)标准评估数据,PPS分析研究结果提示,AK-HER2组(n=275)与对照组(n=241)的ORR9比为97.9%(54.4%vs55.6%,90% CI:85.4%~112.2%,P=0.784;表2);FAS分析AK-HER2组与对照组的ORR9比为95.4%(49.1%vs51.5%,90% CI:82.9%~109.7%,P=0.631;表2)。研究者评估,PPS分析研究结果表明,AK-HER2组与对照组的ORR9比为98.6%(54.4%vs55.2%,90%CI:86.0%~113.1%,P=0.843);FAS分析结果表明,AK-HER2组与对照组的ORR9比为96.1%(50.5%vs52.6%,90% CI:83.9%~110.2%,P=0.664;表2)。

表2 AK-HER2组和曲妥珠单抗组疗效评估Tab.2 Evaluation of efficacy in AK-HER2 group and trastuzumab group [n (%)]

续表2 AK-HER2组和曲妥珠单抗组疗效评估
次要疗效终点分析中,AK-HER2组受试者ORR16为51.6%(95% CI:45.6%~57.7%),对照组ORR16为52.2%(95% CI:46.1%~58.3%),两组间差异无统计学意义。AK-HER2组中,受试者达CR、PR或疾病稳定(stable disease,SD)有248例,受试者DCR为90.2%(95% CI:86.0%~93.4%)。对照组中,受试者达CR、PR或SD有241例,受试者DCR为88.6%(95% CI:84.2%~92.1%),两组间比较,组间差异无统计学意义(P=0.549)。AKHER2组达CR、PR或持续SD(SD≥24周)的受试者共159例,受试者CBR为57.8%(95% CI:51.7%~63.7%)。对照组164例受试者达CR、PR或持续SD(SD≥24周),受试者CBR为60.3%(95% CI:54.2%~66.2%),两组间比较,组间差异无统计学意义(P=0.556)。AK-HER2组中位PFS为10.3个月,对照组中位PFS为11.7个月。生存分析结果提示,AK-HER2组1年生存率为99.3%(95% CI:97.1%~99.8%),对照组生存率为98.9%(95% CI:96.6%~99.6%,图2,表2)。
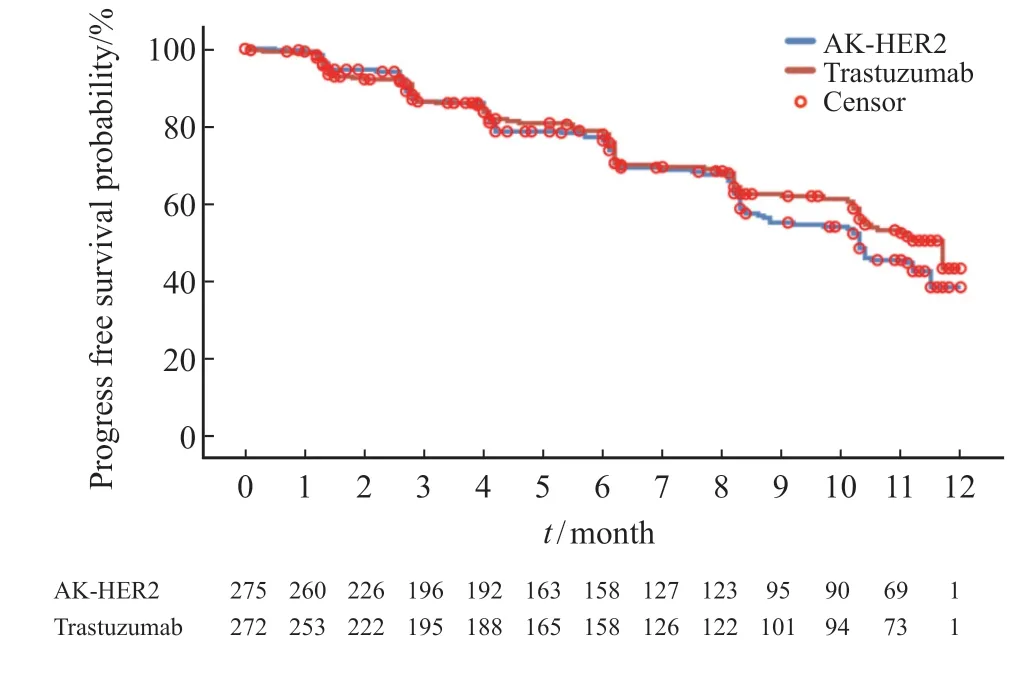
图2 Kaplan-Meier估计图(IRC评估,FAS)显示AK-HER2组及对照组治疗的HER2阳性转移性乳腺癌患者的PFSFig.2 Kaplan-Meier estimate plot (IRC assessment,FAS)showing PFS of patients with HER2-positive metastatic breast cancer treated in the AK-HER2 group and the trastuzumab group
2.3 药代动力学结果
采用PKCS分析AK-HER2组和对照组的AUC0-τ比率为97.87%(20 911.74vs21 366.27,90% CI:91.13%~105.12%),Cmax,ss比率为95.76%(90% CI:90.25%~101.59%),T½比率为98.75%(90% CI:91.05%~107.11%),CLss比率为102.21%(90% CI:94.80%~110.20%),Vz比率为100.94%(90%CI:93.27%~109.23%),结果表明,AK-HER2组和对照组PK参数的几何均值比率及90% CI均在等效区间80.00%~125.00%内,组间差异无统计学意义。研究结果提示两种药物的药代动力学特征相似(表3,图3)。

表3 药代动力学参数经对数转化后的(1-2α)置信区间检验 (PKPS)Tab.3 (1-2α) confidence interval test of pharmacokinetic parameters after logarithmic transformation (PKPS)
2.4 免疫原性结果
本研究中,AK-HER2组11例(4.1%)患者ADA阳性,对照组有7例(2.7%)患者ADA阳性。采用χ2检验分析两组患者ADA阳性率差异,结果显示,差异无统计学意义(P=0.385)。AK-HER2组有6例(2.2%)患者NAB阳性,对照组有4例(1.6%)患者NAB阳性。采用Fisher检验分析两组NAB阳性率差异,结果显示,差异无统计学意义(P=0.752,表4)。

表4 免疫原性数据汇总Tab.4 Summary of immunogenicity data
2.5 安全性结果
在AK-HER2组和对照组中,患者TEAE的发生率分别为96.4%和99.3%,两组患者TEAE发生率χ2检验,差异有统计学意义(P=0.021)。两组受试者SAE的发生率分别为15.6%和13.6%,而AESI的发生率分别为58.2%和59.2%。与对照组相比,AK-HER2组5级TEAE和SAE发生率较低,两组受试者均无一例发生5级AESI。AK-HER2组仅1例(0.4%)发生致死性TEAE(4级),而对照组有3例(1.1%)发生致死性TEAE(5级),其中1例(0.4%)与曲妥珠单抗药物治疗相关,1例(0.4%)与多西他赛药物治疗相关。曲妥珠单抗治疗导致药物减量或暂停的TEAE发生率,AK-HER2组为3.6%(10例),对照组为8.1%(22例),差异有统计学意义(P=0.027)。AK-HER2组发生率较对照组明显减少(表4)。
本研究分析了AK-HER2组与对照组最常见TEAE的发生率,包括白细胞减少、中性粒细胞减少、贫血、丙氨酸氨基转移酶升高和天冬氨酸氨基转移酶升高等。AK-HER2组与对照组不同TEAE发生情况分别为:白细胞计数减少(72.7%vs73.5%)、贫血(41.5%vs46.0%)、血小板减少(9.5%vs13.2%)、中性粒细胞减少(72.0%vs73.2%)、丙氨酸氨基转移酶升高(25.1%vs25.7%)和天冬氨酸氨基转移酶升高(24.0%vs26.5%)。研究结果提示,以上TEAE发生率AKHER2组均较对照组略低。其他药物不良反应观察结果显示,对照组出现1例输液部位过敏反应,AK-HER2组尚无输液不良反应(表5)。AK-HER2组与对照组比较,AK-HER2组发热(11.6%vs16.5%)、乏力(9.1%vs12.1%)和腹泻(10.9%vs14.3%)的发生率较对照组明显减少,但是上呼吸道感染的发生率AK-HER2组比对照组略高(13.1%vs8.1%)。

表5 安全性数据汇总Tab.5 Summary of safety data
本研究对药物的心脏毒性系统性评估结果显示,AK-HER2组与对照组的左心室射血分数(left ventricular ejection fractions,LVEF)基线以及C4D1均为64.0%,C16D1中位数分别为64.0%与62.0%。在EOT时间点,AK-HER2组与对照组的LVEF中位数分别为63.0%与62.7%。基线、C4D1、C7D1、C10D1、C13D1、C16D1和EOT等不同观察时间点,两组LVEF中位数差异无统计学意义(表6)。本研究结果显示,AKHER2组与对照组药物的心脏毒性差异无统计学意义。
3 讨 论
本研究是随机、多中心、双盲的Ⅲ期临床试验,结果显示,AK-HER2和原研曲妥珠单抗在HER2阳性转移性乳腺癌的疗效具有等效性。研究结果还表明,PFS与生存率无论是否采用分层分析,其组间风险比差异均无统计学意义。
AK-HER2的Ⅰ期临床试验[16]结果表明,在健康的中国成年人中,AK-HER2与原研曲妥珠单抗的药代动力学和安全性相当。目前曲妥珠单抗及其部分生物类似药Ⅰ期临床研究中,入组患者均为健康男性,缺少健康女性志愿者的数据作为参考[22-25]。为了提供更加全面的人体药物代谢信息,AK-HER2的Ⅰ期临床试验将患者性别因素纳入考虑范畴,入组患者由64例男性和32例女性健康志愿者组成,因此该研究结果也具有更好的代表性和参考价值[16]。在本研究中设计取血点不同,我们密集采集9个点的血样,分别在第6个周期给药结束后第0、4、8、24、72、120、168、336和504 h。研究结果也表明,AKHER2与原研曲妥珠单抗的药代动力学差异无统计学意义。综上所述,Ⅰ期健康男性与女性志愿者以及Ⅲ期HER2阳性乳腺癌患者的药代动力学参数AK-HER2组与对照组相比,生物等效性相当。
在药物不良反应方面,本研究结果显示,AK-HER2组比对照组TEAE发生率低,且AKHER2组无一例药物致死病例发生[27]。曲妥珠单抗治疗导致药物减量或暂停的TEAE发生率,AK-HER2组发生率较对照组明显减少且组间差异有统计学意义,可能是发生例数较少所致。药物安全性数据显示,AK-HER2组患者肝脏毒性和血液毒性较低。AK-HER2组发热、乏力等不良事件发生率也较低,但是上呼吸道感染发生率较对照组略高。在今后用药过程中,应更加严密观察上呼吸道感染相关疾病发生的可能性。本研究通过ECHO或MUGA扫描评估心脏功能,结果显示,AK-HER2用药前后LVEF差值变化与原研曲妥珠单抗差异无统计学意义,AK-HER2的心脏毒性在可接受范围内。
药物免疫原性常通过ADA评估,ADA可能会改变药物的药代动力学和药效学特性[27]。在更严重的情况下,ADA可以中和药物的治疗效果或发生严重的不良事件[28]。因此,本研究同样进行了两药的免疫原性分析与测定,AK-HER2与对照组ADA和NAB阳性率差异无统计学意义,证明AK-HER2与原研曲妥珠单抗的免疫原性相似。
随着分子生物学和基因组学的快速发展,乳腺癌新药治疗策略和方法不断涌现。尽管新的药物不断被研发和使用,但是由于国家与地区间发展不均衡性,加上每位患者经济条件不同,患者所能承受的经济负担的差异比较大[29],其标化死亡率差异明显[30]。与城市患者相比,农村患者经济条件较差,导致农村乳腺癌患者延迟就诊率较高,治疗依从性较低,这导致农村乳腺癌患者预后更差[8,30]。基于此,新研发的生物类似药价格低,可减轻患者的经济负担,目前已有曲妥珠单抗生物类似药被批准进入临床治疗[31]。
综上所述,AK-HER2组和曲妥珠单抗组的ORR9、ORR16、DCR、CBR、PFS和生存率差异无统计学意义。在药代动力学、免疫原性、药物不良反应、心脏毒性等其他方面,两组差异无统计学意义。本研究结果可为中国生物类似药的研发提供参考。
致谢:
感谢所有参与临床试验的研究者、管理组、监管者,感谢厦门大学附属第一医院叶峰医师、安徽医科大学第一附属医院顾康生医师、湘潭市中心医院封元清医师、第四军医大学唐都医院张贺龙医师、安徽医科大学第二附属医院陈振东医师、中国医科大学附属盛京医院吴荣医师、新疆医科大学附属肿瘤医院李迅医师与刘炜医师、江西省肿瘤医院吴毓东医师、烟台毓璜顶医院孙萍医师、北京大学人民医院王殊医师、四川大学华西医院邹立群医师、浙江大学医学院附属第一医院沈朋医师、郑州市第一人民医院邬德东医师、广州医科大学附属第一医院张还珠医师、云南省肿瘤医院刘德权医师、南昌市第三医院王红医师、济南市中心医院孙玉萍医师与孙美丽医师、四川省人民医院刘锦平医师、徐州市中心医院刘勇医师、新疆维吾尔自治区中医医院耿中利医师和柳州市人民医院朱州医师(排名按照患者入组例数)。感谢安徽安科生物工程(集团)股份有限公司为本研究提供研究药物与研究经费。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
罗扬:实施研究,采集数据,撰写与修改文章;孙涛、邵志敏、崔久嵬、潘跃银、张清媛、程颖、李惠平、杨燕、叶长生、于国华、王京芬、刘运江、刘新兰、周宇红、柏玉举、谷元廷、王晓稼:参与患者入组实施研究,采集数据;徐兵河:引导研究方向与课题设计;宋礼华提供研究药物与研究经费。

