KDM4A通过下调BMP9促进乳腺癌细胞MDAMB-231的迁移和侵袭
陈远香,余 涛,杨诗雨,曾 涛,魏 兰,张 彦
重庆医科大学检验医学院临床检验诊断学教育部重点实验室,重庆 400016
乳腺癌是一种严重威胁女性健康的常见恶性肿瘤,其发生、发展涉及遗传背景、激素紊乱和环境影响等多种因素,发病原因复杂[1-3]。因此,寻找新的有效治疗靶点对改善乳腺患者的生存至关重 要。
组蛋白甲基化修饰是一种重要的表观遗传修饰,不同组蛋白不同位点的甲基化修饰可导致其所在DNA区域的转录活性改变,从而激活或抑制其基因表达。赖氨酸特异性去甲基化酶4A(lysine specific demethylase 4A,KDM4A)在多种癌症中呈高表达,其在人乳腺癌组织中的表达显著高于癌旁组织,且癌变程度越深,其表达越高[4-5],提示KDM4A可作为潜在的乳腺癌治疗新靶标。有研究[6-7]显示,KDM4A可特异性识别组蛋白H3赖氨酸4号位三甲基化(H3K4me3)或组蛋白H3赖氨酸36号位三甲基化/二甲基化(H3K36me3/2),去除甲基基团引起甲基化水平下降,从而导致基因转录受到抑制。
骨形态发生蛋白9(bone morphogenetic protein 9,BMP9)是一种属于骨形态发生蛋白家族的信号分子,参与调控血管生成[8]、骨骼发育[9]、肝脏功能[10]和肿瘤生长[11-12]等生物学过程。研究[11,13-17]发现,BMP9在乳腺癌中常呈低表达甚至表达缺失,而外源性BMP9能抑制人乳腺癌细胞在体外的恶性生物学行为,调节乳腺癌细胞代谢,抑制乳腺癌的骨转移等。因此,本研究探索表观遗传修饰的组蛋白KDM4A在乳腺癌中的表达及作用,探究KDM4A与BMP9之间的关系及其可能的调节机制,并明确其对乳腺癌发生、发展的影响。
1 材料和方法
1.1 细胞系及主要试剂
实验所用乳腺癌细胞系由重庆医科大学检验医学院实验室保存。DMEM高糖培养基购自重庆赛米克生物科技有限公司,胎牛血清购自美国CLARK Bioscience公司,KDM4A小干扰RNA及GP-transfect-Mate转染试剂购自上海吉玛制药技术有限公司,RNA快速提取试剂盒购自上海奕杉生物科技有限公司,反转录试剂购自日本Takara公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)引物均由生工生物工程(上海)股份有限公司设计合成,染色质免疫沉淀(chromatin immunoprecipitation,ChIP)检测试剂盒、蛋白质印迹法(Western blot)相关试剂购自上海碧云天生物技术股份有限公司,兔抗人E-cadherin、vimentin、KDM4A、H3K36me3、H3K4me3、H3K36me抗体和鼠抗人β-actin抗体购自美国Proteintech公司,兔抗人BMP9抗体购自英国Abcam公司,放线菌素D及放线菌酮购自美国Selleck公司。
1.2 方法
1.2.1 细胞培养
细胞用含5%胎牛血清、1%青霉素-链霉素的DMEM高糖培养基于37 ℃、CO2体积分数为5%的培养箱中静置培养,待生长密度达90%时进行细胞传代。
1.2.2 细胞转染
细胞接种于培养皿,待生长密度达60%~80%时,依据GP-transfect-Mate转染试剂使用说明书进行转染,24 h后检测mRNA的表达情况,48 h后检测蛋白质表达情况。
1.2.3 RNA提取和RTFQ-PCR检测
使用RNA快速提取试剂盒进行细胞总RNA提取,再使用反转录试剂盒将RNA逆转录为cDNA用于RTFQ-PCR检测,实验所用引物序列见表1。
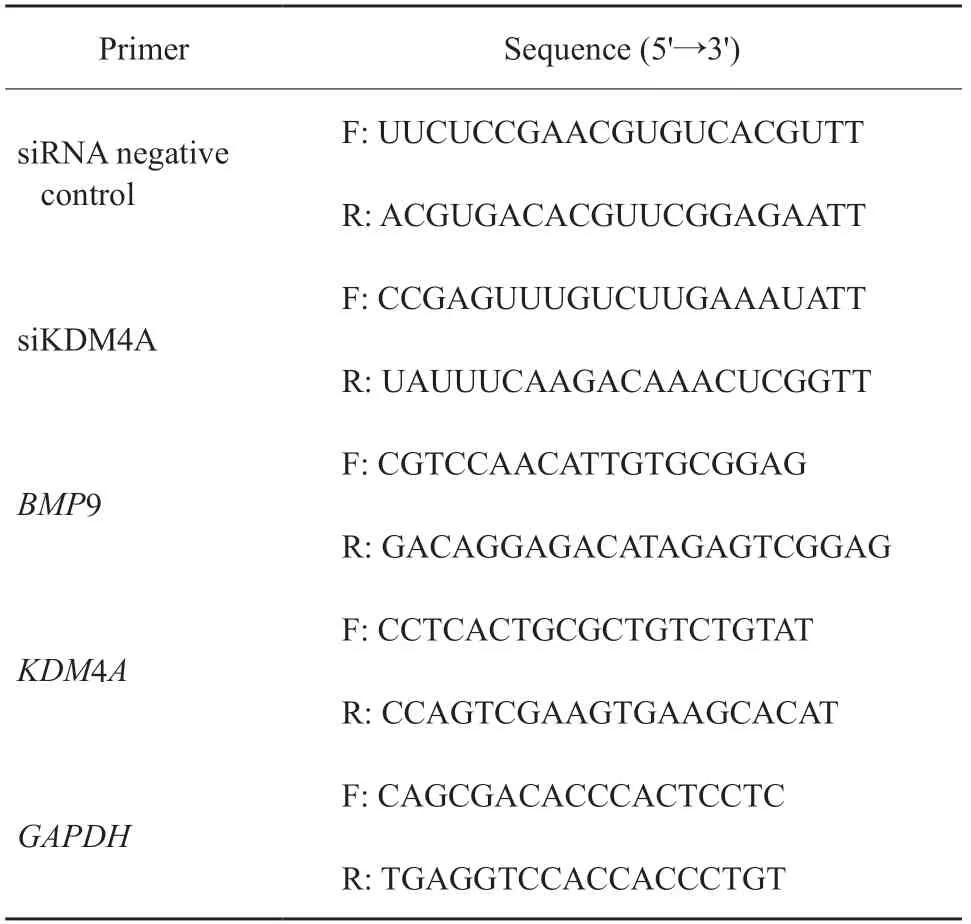
表1 siRNA及RTFQ-PCR引物序列Tab.1 Sequences of siRNA and RTFQ-PCR primer
1.2.4 Western blot
收集并裂解细胞获取总蛋白并定量,以30 μg蛋白上样量进行Western blot实验。蛋白样品在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)中分离后转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%脱脂奶粉37 ℃封闭2 h后加入相应一抗4 ℃静置过夜,第2天以HRP标记的山羊抗兔/鼠免疫球蛋白G(immunoglobulin G,IgG)抗体37 ℃温育1 h,洗膜后用显影仪显影。每组实验重复3次。
1.2.5 Transwell实验
细胞处理24 h后,消化细胞并计数,以双无培养基制备细胞混悬液,对于transwell侵袭实验,提前1 h在小室中加入35 μL基质胶稀释液(基质胶∶双无培养基=1∶9),transwell迁移实验则不需要。随后将细胞悬液加入小室上室,完全培养基加入小室下室,37 ℃温育24 h后固定并用结晶紫染色,于倒置显微镜下拍照。每组实验重复3次。
1.2.6 划痕愈合实验
细胞处理24 h后铺于6孔板内,待细胞长满,使用10 μL移液器吸嘴在6孔板中间划线,采用磷酸盐缓冲生理盐水(phosphate-buffered saline,PBS)清洗去除漂浮的细胞后加入双无培养基,此时于镜下拍照计作0 h,待24、48 h时在相同位置各拍1次照。使用CorelDRAW软件分析各个时间点划痕宽度,计算平均划痕愈合率,计算公式为:平均划痕愈合率=(0 h划痕宽度-24 h划痕宽度/48 h划痕宽度)/0 h划痕宽度×100%。每组实验重复3次。
1.2.7 ChIP
依据ChIP试剂盒进行实验。使用1%甲醛溶液室温固定对数生长期的细胞(约1×106个)10 min,使DNA和蛋白质交联,然后进行超声处理将DNA裂解,4 ℃温育过夜进行免疫沉淀。后续获得沉淀的染色质DNA后通过ChIP-PCR琼脂糖凝胶电泳进行分析。用于ChIP-PCR的正向引物序列为5’-AGTCAGGTCCATAGTCCTTCAT-3’,反向引物序列为5’-TGGATTGTCCTCCACTTGTGC-3’。每组实验重复3次。
1.2.8 RNA稳定性实验
细胞接种于培养皿中,以siKDM4A小干扰RNA转染细胞,并设置对照组。24 h后换液并加入放线菌素D,使终浓度为5 μg/mL,分别处理细胞0、30、60、90和120 min后,提取各时间点的RNA并进行定量检测。每组实验重复3次。
1.2.9 CHX蛋白稳定性实验
细胞接种于培养皿中,以siKDM4A小干扰RNA转染细胞,并设置对照组。48 h后换液并加入放线菌酮,使终浓度为100 μg/mL,分别处理细胞0、30、60、90和120 min后,提取各时间点的蛋白质并对蛋白水平进行检测。每组实验重复3次。
1.3 统计学处理
使用GraphPad Prism8.0软件对数据进行统计学分析。对实验数据进行正态性检验,符合正态分布的数据以±s表示,各组内两两比较采用Studentt检验,两组及两组以上组间数据比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 KDM4A在乳腺癌中异常高表达
通过检索GEPIA数据库(http://gepia.cancerpku.cn/)分析KDM4A在乳腺癌中的表达。结果显示,KDM4A在乳腺癌组织中的表达高于正常组织(图1A~1B),但KDM4A在乳腺癌各期表达差异无统计学意义(图1C),提示KDM4A参与了乳腺癌整个发生、发展过程。RTFQ-PCR及Western blot结果均显示,KDM4A在不同乳腺癌细胞系中的表达均显著高于乳腺正常永生化上皮细胞MCF-10A(图1D~1E)。

图1 KDM4A在乳腺癌中呈高表达Fig.1 KDM4A highly expressed in breast cancer
2.2 KDM4A与BMP9表达存在相关性
检索GEPIA数据库分析发现,KDM4A与BMP9在不同癌症中呈负相关关系,其在乳腺癌中也呈负相关关系(图2A~2C)。RTFQ-PCR及Western blot结果显示,在MDA-MB-231细胞中敲低KDM4A后,BMP9的mRNA表达及蛋白质水平均显著上调(图2D~2E)。以上结果提示KDM4A与BMP9呈负相关关系。

图2 KDM4A与BMP9表达呈负相关Fig.2 The expression of KDM4A is negatively correlated with BMP9
2.3 KDM4A可发挥去甲基化作用沉默BMP9表达
Western blot检测MDA-MB-231细胞中组蛋白甲基化水平,发现敲低KDM4A后,H3K36me3、H3K4me3水平均升高,H3K36me水平降低(图3A),说明KDM4A可以发挥去甲基化酶作用,降低组蛋白基因甲基化水平。以IgG抗体沉淀为阴性对照、Input为阳性对照,H3K36me3、H3K4me3抗体沉淀为实验组进行ChIP实验,结果显示,在乳腺癌细胞MDA-MB-231中敲低KDM4A后,H3K36me3在BMP9基因启动子区域显著富集,而H3K4me3则没有显著变化(图3B)。这说明KDM4A可以通过发挥其去甲基化作用下调BMP9基因启动子区的H3K36me3而不是H3K4me3组蛋白甲基化水平,从而沉默BMP9表达。

图3 KDM4A下调组蛋白甲基化水平Fig.3 KDM4A downregulatd histone methylation status
2.4 KDM4A可抑制BMP9基因的转录但不影响其mRNA的稳定性
鉴于敲低KDM4A可以上调BMP9的mRNA水平,本研究拟进一步探究KDM4A是否能发挥去甲基化酶以外的作用影响BMP9的表达。首先对KDM4A是否影响BMP9的mRNA稳定性进行探究,在分别使用放线菌素D处理MDA-MB-231细胞后检测BMP9的mRNA表达水平,结果显示,敲低KDM4A与否对BMP9的mRNA稳定性无明显影响(图4A)。
2.5 敲低KDM4A可增加BMP9蛋白的稳定性
前期发现敲低KDM4A可上调BMP9的蛋白表达水平,其可能对BMP9表达水平的调控存在一定的翻译后修饰作用。本研究又对KDM4A是否影响BMP9的蛋白稳定性进行探究。结果显示,在用蛋白合成酶抑制剂CHX处理MDA-MB-231细胞后,发现敲低KDM4A能明显延长BMP9蛋白的半衰期(图4B)。上述结果提示,KDM4A能够降低BMP9蛋白的稳定性,而敲低KDM4A可使BMP9蛋白的稳定性显著提高。
2.6 敲低KDM4A抑制乳腺癌细胞迁移及侵袭能力
划痕愈合及transwell实验结果显示,敲低KDM4A相较于对照组可以显著降低MDAMB-231细胞的划痕愈合率、减少穿膜细胞数,且这种作用可被敲低BMP9部分逆转(图5A~5B)。上述结果提示,KDM4A可以促进乳腺癌细胞迁移及侵袭,且这种作用可因BMP9的敲低而被部分逆转,说明KDM4A可通过下调BMP9促进乳腺癌的进展。
3 讨 论
在乳腺癌中,多种基因的表达与功能异常可促进乳腺癌的恶性生物学行为,而分子生物学技术的进步使得有助于识别乳腺癌诊断和治疗的更具体的生物标志物成为可能,从而改善个体化治疗[18]。因此,寻找高特异性的生物标志物帮助医师诊断及制订治疗计划对提高治疗成功率至关重要。
染色质的三维结构由核小体定位、组蛋白组成和组蛋白修饰等过程调节[19],带正电荷的组蛋白修饰直接影响复制、基因转录和DNA损伤修复等过程。KDM4A是一种组蛋白去甲基化酶,在多种癌症中呈高表达。有研究[20-21]显示,KDM4A可以去除甲基化组蛋白H3上激活转录的H3K4/36me3标记,直接引起癌症相关基因转录沉默或激活。例如,斑蝥素通过KDM4A依赖性组蛋白H3K36的去甲基化诱导DNA损伤,增强肝癌化疗敏感性[20];在非小细胞肺癌中KDM4A促进DLX5启动子H3K4me3的去甲基化引起DLX5转录激活,导致癌基因Myc的表达,从而促进癌症的发生、转移和生长等[21]。此外,KDM4A还能作用于转录抑制性标记H3K9me3,在骨肉瘤中通过控制SLC7A11启动子区域的H3K9me3去甲基化,调控SLC7A11的转录和癌细胞铁死亡[22];在宫颈癌中,KDM4A通过H3K9me3激活转铁蛋白受体1(transferrin receptor protein 1,TFR1)和二价金属转运蛋白1(divalent metal transporter 1,DMT1)启动子中的HRE序列,从而诱导宫颈癌细胞铁死亡[23]。除了以去甲基化组蛋白为底物,KDM4A还能以非组蛋白为底物,通过直接下调肿瘤抑制因子miR-491-5p促进宫颈癌细胞生长并抑制细胞凋亡[24]。KDM4A与肿瘤的发生、发展密切相关,而其在乳腺癌中的作用尚不明确。本研究首先发现了KDM4A与BMP9之间呈负相关关系,并明确了KDM4A在乳腺癌中对BMP9进行转录调节的作用,并且这种作用既可以依赖也可以独立于其酶活性,但其影响BMP9蛋白稳定性的具体机制还需进一步探索。
BMP9是骨形态发生蛋白家族的一员,在胚胎发育、组织再生和成年生理学过程中发挥重要作用。BMP9在乳腺癌中发挥着至关重要的作用,BMP9可通过cMyc/SNHG3/mTOR信号轴促进乳腺癌细胞自噬,抑制乳腺癌细胞迁移和侵袭[12];通过激活BMP/Smad信号转导通路,BMP9可以下调结缔组织生长因子(connective tissue growth factor,CTGF)抑制乳腺癌细胞骨转移[15];PI3K/AKT、ERK1/2、ALK1等信号转导通路也是BMP9靶向抑制乳腺癌的重要途径[16,25-26]。BMP9能够通过协调癌细胞与周围微环境之间的通讯来促进疾病的进展和转移。通过降低脂肪前细胞/脂肪细胞中瘦素的表达,下调磷酸化STAT3、ERK1/2和AKT,抑制瘦素信号转导通路来降低乳腺癌在脂肪微环境中的增殖和迁移[14];BMP9通过RANK/RANKL和SDF-1(CXCL12)/CXCR4-PI3K信号轴调节骨髓间充质干细胞与乳腺癌细胞之间的串扰,促进骨髓间充质干细胞的成骨分化和增殖[13]。外源性BMP9能显著抑制乳腺癌的发生、发展,但其在乳腺癌中的表达却极低甚至缺失,作为一种多功能的细胞因子,BMP9具有潜在的治疗应用前景,靶向BMP9在乳腺癌的诊断和治疗中可能是一个重要手段。
本研究结果表明,KDM4A可以通过去除BMP9基因启动子区域组蛋白H3上的甲基基团、降低BMP9蛋白的稳定性来下调BMP9的表达,促进乳腺癌细胞的迁移和侵袭能力。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
陈远香:设计及操作全部实验,撰写文章。
余 涛:生物信息学分析。
杨诗雨:数据分析。
曾 涛:数据分析。
魏 兰:设计实验。
张 彦:设计实验,修改文章。

