WAS基因c.1339-12T>A 新发变异及表达分析
何 蕊,高变变,裴利国,3,黄 蕾,许晓雪,赵君利,刘春莲,3
湿疹血小板减少伴免疫缺陷综合征(WAS)是一种罕见的X连锁隐性遗传病,女性携带基因,男性发病[1]。以湿疹、血小板减少和免疫缺陷为临床表现[2],易患自身免疫病和恶性肿瘤,人群中发病率约为1/10万至1/100万,多于六个月以内的婴儿期起病,目前研究认为,该疾病是由在造血细胞中表达的WAS基因变异引起的[3]。WAS位于Xp11.22-p11.23,编码一种WAS蛋白(WASp),WASp表达变化将影响淋巴细胞、血小板内信号转导和细胞骨架组合,从而影响血小板生成、聚集和淋巴细胞迁移等功能[4]。本研究筛选并验证该WAS家系的致病基因位点,为疾病临床诊断、遗传咨询及PGT治疗提供依据。
1 资料与方法
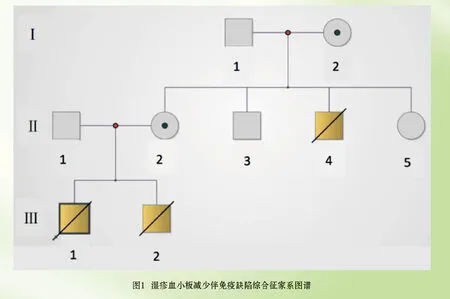
1.1 一般资料 选取2021年2月就诊于宁夏医科大学总医院生殖医学中心遗传门诊的一例WAS家系,见图1(封二)。咨询者(Ⅱ2)曾生育2个男孩,均在1岁左右不幸夭折,以反复面色苍白、皮肤黏膜出血为主要临床表现,多次血常规提示贫血、血小板减少,额部可见散在湿疹,临床确诊WAS综合征,无近亲结婚。咨询者哥哥(Ⅱ4)在四岁因流鼻血去世,其弟弟、妹妹均正常,咨询者父母表型均正常。
1.2 方法
1.2.1 外周血RNA提取及cDNA扩增 采集外周静脉血3~5mL,2%乙二胺四乙酸二钠(EDTA)抗凝,采用血液/组织/细胞总RNA提取试剂盒,提取咨询者及其父母三人样本RNA,进行反转录得到cDNA。
1.2.2 全外显子测序 采用靶向捕获技术+高通量测序技术检测人类基因组中约2万个基因的外显子区域以及上下游20bp信息(本检测由贝康医学检验实验室完成)。
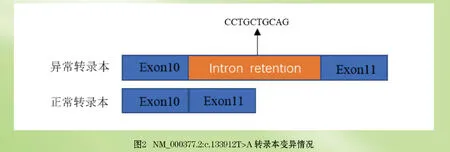
1.2.3 引物设计及RT-PCR 根据全外显子测序 结果发现一个变异位点,位于该转录本内含子10号上,属于非经典剪切变异,可能造成11号外显子跳跃性剪接异常,或形成内含子10号插入的异常转录本,见图2(封二)。通过RT-PCR、电泳和Sanger测序验证该剪切位点变异是否导致转录本剪接异常。上下游引物分别位于10号外显子和12号外显子,扩增产物长度568bp。
1.2.3.1 Exon10F GCCATCTCGAGGAGGGAACC。
1.2.3.2 Exon12R TAACTCAGCCACTCAGTCATCC。
1.2.3.3 对RT-PCR产物进行琼脂糖凝胶电泳 观察电泳条带,理论上变异样本RT-PCR产物产生2条电泳条带,分别为568bp及453bp。用正常样本作为对照,得到1条电泳条带,为568bp。
1.2.4 家系变异位点的Sanger测序 对RT-PCR产物切胶回收,利用ABI 3730一代测序仪对产物分别进行Sanger测序,并分析测序结果。
2 结果
2.1 全外显子测序结果 WAS在转录本NM_000377.2中包含12个外显子,编码502个氨基酸,检测出WAS c.1339-12T>A杂合变异,位于X染色体的内含子10,该变异在ClinVar数据和HGMD数据库中暂无记录,见表1。

表1 WAS c.1339-12T>A变异基本情况一览表
2.2 琼脂糖凝胶电泳图 对RT-PCR产物进行琼脂糖凝胶电泳,验证样本和对照样本均只有1条电泳条带,见图3(目次后)。
2.3 基因测序结果 家系中咨询者和其母亲均检测出WAS基因c.1339-12T>A杂合变异,经分析发现,Ⅱ2母亲样本(Ⅰ2)c.133912T>A的变异导致了内含子10号的10个碱基(CCTGCTGCAG)的保留。Ⅱ2的一条链也出现了10个碱基(CCTGCTGCAG)的保留,推测其遗传自母亲,见图4(目次后)。
2.4 NGS测序验证异常转录本情况 正常转录本和异常转录本reads,见表2。NM_000377.2:c.133912T>A的变异会导致10bp的内含子,产生异常转录本,转录水平NGS结果和Sanger测序结果一致。
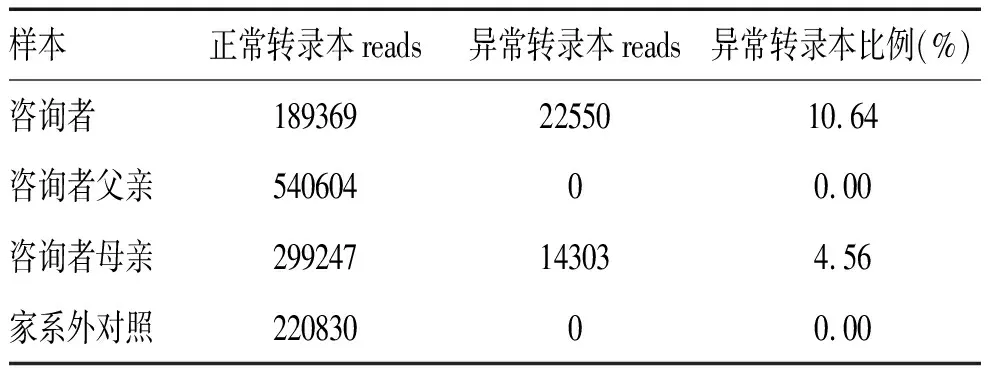
表2 正常转录本和异常转录本reads统计
2.5 WAS基因表达水平分析 荧光定量检测结果显示,与正常女性对照相比,待测样本的WAS基因表达水平差异无统计学意义,相对表达量均值分别为0.87、0.65及0.93。咨询者与其母亲的WAS基因整体表达水平正常,该结果提示异常转录本低水平可能不是样本mRNA降解所致。
3 讨论
WAS基因位于Xp11.22-p11.23,其编码一种含502个氨基酸的WAS蛋白(WASp)。WASp是细胞骨架肌动蛋白的关键调节因子,主要表达在造血细胞中,可调节T细胞、B细胞、NK细胞、树突状细胞及血小板等的功能[4]。WAS基因变异导致WASp表达减低甚至缺失是WAS的主要发病机制,且临床表现随年龄的增加而加重。本研究中2例患儿均于1岁左右发病,Jiang等人通过对中国5个散发WAS家系分析,患儿发病年龄在1天至17个月,这与其他文献报道发病年龄多在6个月内相一致[5]。
WAS基因变异类型不同会导致WASp结构域发生不同的构象改变[6],造成不同的临床表现,因此WAS基因变异类型与WASp表达情况与临床表现关系密切[7]。目前,国内外已报道400多种WAS基因变异,其中位于168C >T(T45M)、290C >N/291G >N(R86C/H/L)、IVS6+5G >A者,WASp表达减低,临床症状相对轻微,多表现为X-连锁血小板减少症;当变异位于665C >T(R211X)、IVS8+1G >N及IVS8+1-+6del GTGA时,临床症状较重,表现为典型WAS[8-9],出现血小板减少三联征、反复感染和湿疹,常伴有免疫疾病和恶性肿瘤的风险增加[5]。有研究显示,WAS基因变异最常见的是错义突变,其次是剪接突变、缺失和无义突变。错义突变主要位于外显子1-4,其余变异位于外显子7-11[10]。本研究中受检者和其母亲此次检测出WAS基因c.1339-12T>A杂合变异,位于内含子10,该变异属于非经典剪切变异,可能造成11号外显子跳跃性剪接异常,或形成内含子10插入的异常转录本,造成移码变异,且编码的蛋白形成多3个氨基酸的产物,导致蛋白结构出现异常,正常WASp表达减低,目前尚无该变异的相关报道。
由于WAS基因c.1339-12T>A经评估为临床意义未明变异,患儿的母亲及外婆均为WAS c.1339-12T>A携带者,并且都没有临床表现,由于X染色体非随机失活,携带者的WASp表达一般不受影响。Jiang等人发现4例患者的母亲是携带者,其中一位为部分WASp表达[5]。结合2例幼儿相似的发病情况和临床表现,本研究进行定量PCR检测WAS的表达水平,Ⅱ2的异常转录本变异占比约10.64%,其母亲为4.56%,经过转录水平相对定量排除了样本降解导致的转录水平低的可能性。转录水平检测到的异常转录本其比例较低,可能是女性X染色体存在失活现象,如果发生非随机性失活,可能导致变异所在的染色体失活。目前有多个研究中报道携带WAS基因变异的家系中,有部分女性携带者因为变异所在X染色体失活产生WAS表型,而同一个家系中女性表现出不同比例的X染色体失活[11-12]。本研究中Ⅱ2及其母亲的异常转录本变异占比较低,这可能是她们没有出现临床症状的原因,结合其曾生育2男孩均临床确诊WAS综合征,提升证据该变异位点为有害变异。考虑到咨询者目前尚无健康后代,建议其行PGT技术进行辅助生育助孕。

