脐带间充质干细胞治疗椎间盘退变研究进展
张学良,冉 兵,钟瑞丹,叶军明
(1. 赣南医科大学第一临床医学院;2. 赣南医科大学第一附属医院疼痛科;3. 赣南医科大学,江西 赣州 341000)
腰痛是世界范围内导致残疾的主要原因,给世界各国造成了沉重的社会经济负担,其预防和治疗成为全球公共卫生计划的重要挑战[1-2]。大约80%的人在一生中的某个阶段会受到椎间盘退变和随之而来的腰痛的影响[3]。目前,椎间盘(Intervertebral disc,IVD)退变机制尚不明确,吸烟、糖尿病、感染、遗传异常、非生理性机械应力及衰老等可导致髓核(Nucleus pulposus,NP)细胞中线粒体的结构和功能异常,引起IVD内合成代谢与分解代谢不平衡,微环境破坏,表现为IVD内Ⅱ型胶原、蛋白多糖等细胞外基质含量下降,NP细胞数量减少及基质金属蛋白酶含量增加,最终导致IVD退变[4]。
IVD 由中心凝胶样的NP、外围的纤维环(Annular fibrosus,AF)及上下软骨终板组成,是椎体间的连接部分,对脊柱力学传导和腰椎结构的维持至关重要。髓核内包含髓核细胞,Ⅱ型胶原蛋白和蛋白聚糖等细胞外基质,其作用主要为平衡椎体终板压力和应力。纤维环富含Ⅰ型胶原蛋白和AF 细胞,在脊柱负荷时抵抗来自髓核的横向张力。终板细胞是嵌入在透明软骨基质中的软骨细胞,是椎间盘与椎体的接合部,也是椎间盘营养、代谢的渠道。正常的椎间盘可传递和分散脊柱各方向的应力,维持椎间隙高度、减缓脊椎退变[5-8]。
近年来研究发现,间充质干细胞(Mesenchymal stem cells,MSCs)在特定条件下可以分化为软骨细胞样细胞和髓核细胞样细胞,移植MSCs 可增加NP细胞数量和细胞外基质(Extracellular matrix,ECM)含量,从而改善IVD 含水量和高度、延缓IVD 退变[9-10]。目前常用于研究治疗IVD 退变的MSC 包括骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)、脂肪间充质干细胞(Adipose mesenchymal stem cells,AMSCs)和脐带间充质干细胞(Umbilical cord mesenchymal stem cells,UCMSCs)。有证据表明BMSCs、AMSCs和UCMSCs均能够分化为髓核样细胞(Nucleus pulposus cells,NPCs),改善IVD含水量和高度,延缓IVD 退变[9,11-12],然而与BMSCs和AMSCs相比,UCMSCs具有更低免疫原性[13],更适合同种异体应用。此外,UCMSCs 还具有来源广泛、获取无痛、容易收集、存储和运输、伦理道德争议少等优点[14]。有研究[15-16]发现,UCMSCs 源性外泌体具有与UCMSCs 相似的功能,不受IVD 恶劣微环境影响,且具有免疫原性低、无致组织骨化或钙化、无致瘤作用等。本文就脐带间充质干细胞及其外泌体在椎间盘退化的修复及再生中的作用进行综述,以期更好地指导临床研究。
1 UCMSCs概况
1.1 UCMSCs 来源及分离培养 UCMSCs 是一类存在于脐带(Umbilical cord,UC)组织,具有自我更新和多向分化潜能的成体干细胞。UC 两端分别连着胎儿和胎盘,在妊娠期间连续不断为胎儿供应氧气和营养物质,由一条脐静脉、两条脐动脉、脐带血管周围透明黏液样结缔组织(即华尔通氏胶)和最外层羊膜组成[17]。UCMSCs 的分离培养方法较多,尚无统一的标准方法[18]。外植体法和酶消化法是常用于提取UCMSCs 的方法[19]。外植体法:新鲜脐带剥离脐带动静脉后,剪成1 mm3左右的碎块,平铺于培养皿上,加入含有10%胎牛血清和1%抗生素的低糖Dulbecco改良鹰培养基(L-DMEM),于37 ℃、5%CO2培养箱中培养2 周左右,收集P0 代细胞。酶消化法:使用胶原酶或胰酶消化去除脐带血管的组织,过滤收集UCMSCs,并于T75 培养瓶中培养[16]。研究表明,外植体法和酶消化法都能有效分离提取UCMSCs,酶消化法能在短时间内从人脐带组织中获得大量的UCMSCs,而外植体法有更高的细胞产量。外植体组织释放的旁分泌因子能够促进细胞增殖,使其细胞产量丰富[20-21]。
1.2 UCMSCs 生物学特性 UCMSCs 因具有自我更新能力、多向分化潜力、低免疫原性、免疫调节及归巢能力等特点,被广泛用于干细胞组织工程研究[22]。研究发现,从健康产妇分娩后华尔通氏胶中提取的UCMSCs 自我更新能力强,体外培养可传至20 代[23]。UCMSCs 在特定条件下可分化为NPCs。PEREZ-CRUET M 等[9]使用髓核分化培养基将UCMSCs 体外诱导分化为NPCs,然后用PKH26 染料标记分化后的NPCs,并将其移植到兔退变的椎间盘中,8 周后进行IVD 组织病理学、免疫细胞化学和q-PCR 分析,结果表明,UCMSCs 在分化培养基中能够分化为NPCs,移植后能在退化椎间盘中表达髓核细胞特异基因和蛋白质。DABROWSKI F A 等[24]通过混合淋巴细胞反应(Mixed lymphocyte response,MLR),发现UCMSCs在同种异体移植模型中具有很强地抑制淋巴细胞增殖的潜力。CORSELLO T 等[25]研究发现,UCMSCs 能够抑制MLR 中T 细胞增殖,但在MLR 中加入UCMSCs 表达的CD276/B7-H3 抗体后,其免疫调节能力消失,这一结果表明UCMSCs具有免疫调节和免疫耐受的特性。另有研究[26]发现,UCMSCs 具有归巢能力,能够迁移至效应位点,分泌趋化因子和细胞因子等有助于维持组织稳态和组织修复的蛋白分子,该过程受到信号分子、氧气和机械信号的严格梯度控制。UCMSCs较强的迁移和归巢特性是修复受损组织的重要机制之一,其迁移和归巢能力与其表达的整合素α4和巨噬细胞炎症蛋白1β有关[27]。
UCMSCs 表达多种特异性细胞表面标志物,除表达MSCs 标志物CD105、CD90 和CD73 外,还表达黏附分子标志物CD54、CD13、CD29和CD44,低表达或不表达CD31、CD14、CD34、CD45 和其他造血干细胞相关表面抗原。这符合国际细胞治疗学会的间充质和组织干细胞委员会提出的人类间充质干细胞的最低标准[28]。UCMSCs不表达参与T淋巴细胞活化的免疫应答相关抗原,如:CD80、CD86、CD40、CD40L和主要组织相容性复合物Ⅱ类抗原HLA-DR[13,19],这可能是其具有低免疫原性特点的原因。
1.3 UCMSCs治疗IVD退变的作用机制 UCMSCs治疗IVD 退变的机制尚不明确,通过多方面作用参与调节IVD 退变。体内外研究发现,MSCs可以通过以下几种方式发挥再生作用[29]:①分化成髓核样细胞;②激活椎间盘内源性细胞;③产生抗炎作用。另外,EKRAM S等[10]研究发现,UCMSCs及其分化后的软骨祖细胞移植入椎间盘后,能够迁移、归巢、分散和整合到退化椎间盘中,能在低氧、高渗及营养匮乏的椎间盘环境中存活并修复受损椎间盘。移植MSC 减缓IVD 退化的机制包括通过分化为髓核样细胞直接增加细胞数量和调控髓核微环境,改善髓核代谢,从而增加细胞外基质产生。QI L 等[30]使用UCMSCs条件培养基培养治疗经高糖损伤的髓核间充质干细胞(Nucleus pulposus mesenchymal stem cells,NPMSCs)后,通过流式细胞仪测细胞凋亡,qPCR、蛋白印迹和免疫组化等检测基因及蛋白表达情况,结果发现,UCMSCs 条件培养基能增加Bcl-2及减少Bax的表达,调节细胞凋亡和有丝分裂,从而保护NPMSCs 免受高糖的损伤。ZHANG B 等[31]研究发现,UCMSCs 外泌体通过激活ERK1/2 和p38 促进细胞增殖并防止氧化应激诱导的体外细胞凋亡。上述研究表明了UCMSCs及其外泌体通过多方面参与IVD退变的修复及再生。
2 UCMSCs治疗IVD退变
2.1 动物实验 近年来研究表明,移植UCMSCs可有效治疗IVD 退变。ZHANG Y 等[32]用转染绿色荧光蛋白基因的腺相关病毒载体(AAV2-EGFP)标记UCMSCs,并移植到犬退变的椎间盘中,分别在0、4、8、12 和24 周使用X 线和MRI 测量椎间盘高度和灰度值,并于24 周后行脊柱生物力学、组织学和基因表达分析;另外,在20周时取移植荧光标记UCMSCs的犬椎间盘,使用免疫组化检测和荧光显微镜观察UCMSCs移植后存活情况。结果表明,UCMSCs移植后能够维持退变IVD 屈伸和左右旋转的运动范围,改善退变IVD 椎间盘高度和T2 加权像信号强度。同时,UMSCs 移植后可促进聚集蛋白聚糖和Ⅱ型胶原的椎间盘基质形成,且首次证明了UCMSCs 移植可以在犬退行性IVD 中存活20 周。此外,王彦强等[33]将UCMSCs 移植到兔退变的椎间盘中,分别于术前、术后4、8和12周进行X线、MRI和蛋白多糖的检测,发现UCMSCs移植组椎间盘高度指数、MRI T2加权像信号强度及蛋白多糖含量均较退变组有所改善。综上所述,移植UCMSCs 对IVD 退变有一定的修复和再生作用,但IVD 内高渗、低氧、酸性增加及增加的炎症因子[34-35]使移植后的干细胞无法保质保量地在IVD 内存活。研究发现,髓核祖细胞或髓核细胞可以在较差的IVD 微环境中存活[36]。另外,PENG B G 等[37]认为,通过基因编辑,使其能够适应IVD 较差的微环境或许是一种令细胞在椎间盘内长期存活的有效方法。
因此,在单纯移植UCMSCs 治疗IVD 退变的基础上,有研究者对UCMSCs 进行基因改造或在体外条件下使用定向分化培养基将UCMSCs诱导分化为软骨样细胞或髓核样细胞后再移植到退变IVD 中,以探索UCMSCs分化后的细胞对退化椎间盘的再生修复作用。KHALID S 等[38]将3 种细胞分别移植至大鼠IVD 退变模型中,2 周后进行病理学和免疫组织学分析,比较SOX-9 和SIX-1 转录因子转染的UCMSCs、未转染UCMSCs 分化的软骨祖细胞和UCMSCs修复退变椎间盘的作用,结果表明,用Sox-9和Six-1 转染的UCMSCs 表现出更好的归巢、整合和分化成脊索细胞的能力,更佳的椎间盘修复作用。另外,PEREZ-CRUET M 等[9]使用分化培养基培养UCMSCs,使其分化为NPCs,然后用PKH26 染料分别标记UCMSCs、UCMSCs 分化后的NPCs,并将其移植到兔退化IVD 模型中,8 周后进行IVD 影像学、组织病理学、免疫细胞化学和qPCR 分析,结果发现,PKH26 标记的细胞定位于移植的宿主髓核区域,移植的UCMSCs 和NPCs 都在兔IVD 中存活,UCMSCs局限于移植部位,NPCs更加分散并整合到宿主髓核中;与UCMSC 移植组的IVD 相比,NPCs 组中的软骨基因SOX9、ACAN、COL2和NP 基因FOXF1、KRT19、PAX6、CA12和COMP表达显著上调,且移植NPCs组IVD 结构和细胞完整性均得到改善。另外,该研究首次证明了UCMSCs体外分化的髓核样细胞移植到兔退变IVD 中具有功能活性,并显示出修复和再生退变椎间盘的潜力。综上所述,无论移植UCMSCs或其分化后的细胞对退变的椎间盘都有一定的修复和再生潜力,移植UCMSCs 分化后的细胞治疗效果优于移植UCMSCs。然而,移植UCMSCs 分化后的细胞可能面临注射部位细胞泄露[39]及无法承受椎间盘较高的机械负荷等问题。
研究发现,单纯性移植干细胞后细胞在椎间盘内将承受较高的机械负荷,可能对细胞的生存能力或功能有害,将干细胞载入生物材料支架可能是一种提高干细胞植入后长期存活和有效分化的方法[40]。韩磊等[41]将胶原修饰改性聚乳酸-羟基乙酸/磷酸三钙[Poly(lactic-co-glycolic acid)/tricalcium phosphate, PLGA/TCP]人工支架复合UCMSCs 移植入兔椎间盘退变模型中,于术后2、4、8、12周进行兔椎间盘影像学评估,术后12周进行组织病理学评估,结果发现,PLGA/TCP 人工支架联合UCMSCs 组椎间盘高度指数及Ⅱ型胶原含量显著高于退变组,该结果表明PLGA/TCP 人工支架联合UCMSCs 能有效促进退变椎间盘修复。谭杰[42]使用Ⅱ型胶原/壳聚糖/β 甘油磷酸钠/透明质酸钠髓核组织工程水凝胶复合UCMSCs 移植入兔椎间盘退变模型中,术后12 周进行影像学检查、组织病理学和免疫组织化学评估,结果表明,UCMSCs 可以在Ⅱ型胶原/壳聚糖/甘油磷酸钠/透明质酸钠水凝胶中生长及分化,能够分泌聚集蛋白多糖、Ⅱ型胶原和SOX9 相关蛋白,并且干细胞凝胶复合物植入兔退变椎间盘中对椎间盘退变有一定的修复和再生作用。综上所述,生物材料支架或水凝胶支架复合UCMSCs移植可能是一种治疗椎间盘退变的有效方法。然而,上述研究未对支架/细胞复合体中细胞存活情况及支架机械力学进行测定,且水凝胶支架/脐带间充质干细胞复合体治疗椎间盘退变的研究较少。因此,还需要深入挖掘UCMSCs在治疗椎间盘退变上的优势。
2.2 临床研究 近年来脐带间充质干细胞已被广泛用于类风湿性关节炎[43]、肝衰竭[44]等多种疾病的治疗,且获得了显著临床效果。虽然UCMSCs 广泛应用于多种疾病的治疗,且在IVD退变动物模型研究中取得了令人兴奋的效果,但将其用于椎间盘源性腰背痛的临床研究仍相对较少。2014 年PANG X D等[14]首次将UCMSCs 移植到2 例慢性椎间盘源性腰痛患者的退变IVD 中,分别于术前、术后6 个月、12 个月和24 个月对2 例患者进行疼痛VAS 评分和Oswestry 残疾指数(ODI)评分,结果显示UCMSCs 移植治疗后患者VAS 评分和ODI 评分均显著下降,腰痛和腰椎功能明显改善。虽然,上述研究证明了脐带间充质干细胞移植能够明显缓解椎间盘源性腰痛,具有良好的临床应用前景,但该研究样本量只有2 例患者,且术后随访时间仅为1 年,未进行长期的跟踪随访,偏倚风险较大。因此,还需要大样本的研究和长期术后随访。
另外,关于干细胞移植治疗椎间盘源性腰背痛的有效性遭到质疑,PENG B G 等[37]认为,退变的椎间盘软骨终板可能钙化,营养物质的扩散受到限制,盲目追求椎间盘修复策略,促进细胞增殖和合成代谢活性,而不考虑退化椎间盘内的营养环境,未必是椎间盘再生的正确方向。另外,PENG B G等[37]对细胞疗法局限性如:患者的选择、IVD 内致痛神经纤维的生长、移植细胞的存活及无法恢复的IVD机械负荷等提出了可能的解决方法。MEISEL H J等[45]分析发现,目前使用同种异体或自体干细胞进行IVD 修复相关研究的证据等级非常低,缺乏大样本完全随机对照试验研究。尽管临床研究表明存在良好的风险-获益比,但仍需建立基于细胞治疗的临床证据。
3 UCMSCs来源外泌体在IVD退变中的研究
3.1 UCMSCs 来源外泌体的特点 越来越多的研究发现,不仅间充质干细胞本身可以分化为髓核样细胞、激活IVD 内源性细胞及具有抗炎作用,还能够分泌生长因子、趋化因子、微泡和外泌体等,这些分泌物参与细胞间的通讯、调节组织微环境、促进细胞增殖、抑制细胞凋亡,修复和再生受损组织[46]。外泌体是具有脂质双分子层的球形颗粒,被膜包含鞘磷脂、卵磷脂、脑磷脂、胆固醇和神经酰胺,直径大约40~100 nm,密度为1.13~1.19 g·mL-1。外泌体表面标志物为CD9、CD63、CD81 和CD83 等,含有DNA、RNA、细胞因子、其他脂质及蛋白质等与MSCs 相同的调控物质,这使外泌体与其来源的MSCs 具有类似的作用。MSCs 外泌体通过不同的途径积极参与细胞增殖、免疫调节、细胞凋亡以及ECM 合成代谢和分解代谢。此外,MSCs来源的外泌体具有低免疫原性、低细胞毒性、易获取、易存储及高可修复性等特点[47]。
3.2 UCMSCs 来源外泌体的分离提取 目前,关于外泌体的分离提取方法较多,常用方法有超速离心、免疫亲和、超滤和沉淀法等,其中超速离心法是分离外泌体的“金标准”,且被广泛使用。然而,这些方法并非完美无缺。使用这些方法提取外泌体需要昂贵的仪器和大量的样本,可能遇到污染及产出量少等问题。近年来,微流体技术被用于外泌体的提取,其具有灵敏度高、特异度高、产量高及纯度高等特点。然而,微流体技术复杂的系统及较高的成本使其广泛应用受到了阻碍,随着微流体技术的发展,有望成为外泌体提取有前途的技术。另外,各种原理的外泌体提取试剂盒的出现,方便了外泌体的提取,但缺点是价格较为昂贵[48]。总之,外泌体的分离提取方法种类繁多,传统分离方法、微流体技术及试剂盒各有优缺点。目前,尚无一种最完美的外泌体分离提取方法,需根据研究需求选择合适的方法(表1)。
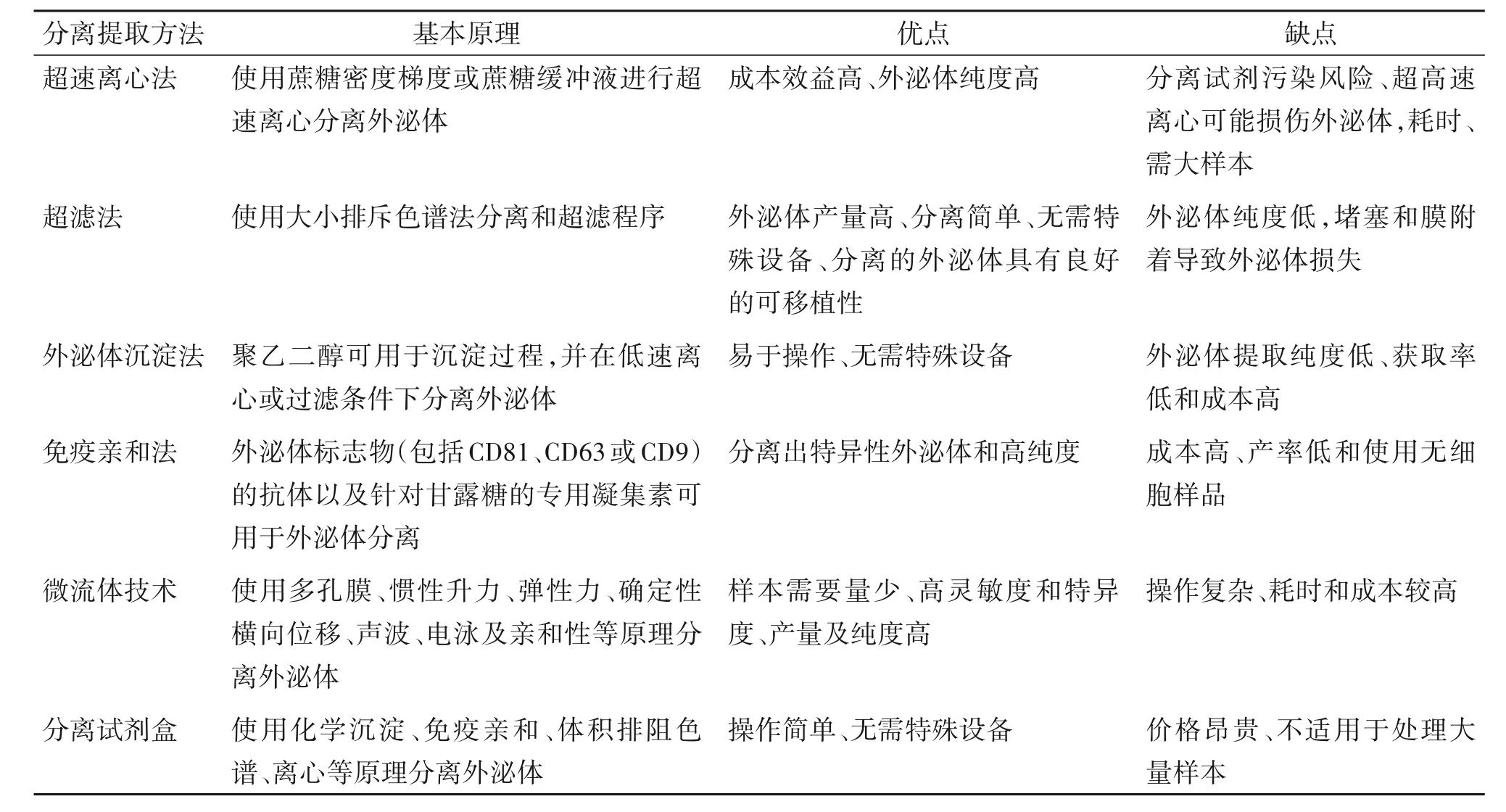
表1 外泌体分离提取方法的比较
3.3 UCMSCs 外泌体治疗椎间盘退变 UCMSCs来源外泌体具有低免疫原性、无肿瘤形成、易保存等优点,已在多种疾病治疗中表现出巨大的优势。UCMSCs 外泌体对退变的椎间盘具有一定的修复作用。YUAN X Q 等[49]体外研究发现,UCMSCs外泌体中miR-26a-5p 靶向作用于髓核细胞中mRNA 甲基转移酶L14(METTL14),下调METTL14 水平,降低了NLRP3 mRNA m6A 甲基化,减少了NLRP3 蛋白表达,使髓核细胞促炎因子和焦亡减少,从而延缓IVD 退变。ZENG X L 等[16]使用UCMSCs 条件培养基培养D-NPMSCs,通过三系分化诱导、流式鉴定及qRT-PCR 等技术分析后发现,使用条件培养基的D-NPMSCs 组在成脂、成骨和成软骨方面要优于未使用条件培养基的D-NPMSCs 组,且流式鉴定MSC特异性表明标志物CD29 和CD105 显著增加,qPCR结果显示Tie2基因表达显著上调。这些结果说明,UCMSCs条件培养基在体外条件下能够促进D-NPMSCs恢复到健康的MSCs 表型,且能改善D-NPMSCs的干性。余家悦[50]将UCMSCs 来源外泌体与D-NPMSCs共培养3 天后,通过qPCR 和蛋白印迹检测IL-1β 和IL-6等在基因和蛋白水平上的表达情况,结果发现,UCMSCs 来源外泌体能减少D-NPMSCs 炎症因子IL-1β 表达,增强IL-6 的表达,说明UCMSCs 来源外泌体具有抗炎作用。通过检测Tie2、NANOG、SOX2、OTC4的表达情况和髓核细胞标志物CD24发现,UCMSCs来源外泌体能够增强D-NPMSCs的多能性,改善DNPMSCs 去分化状态。因此,其对退变椎间盘的修复起到重要作用。然而,上述研究只在体外条件下证明了UCMSCs 外泌体具有促进IVD 内细胞增殖及改善其干性的作用,对于UCMSCs 外泌体在体内是否具有修复退变IVD 的能力尚未进行研究。UCMSCs 外泌体在治疗椎间盘退变的机制尚不完全清楚,且缺乏临床应用研究。因此,还需进一步研究探索。
4 小结与展望
UCMSCs 具有易获取、低免疫原性及伦理争议少等优点,且移植后可以延缓和修复椎间盘退化,是安全有效的。目前为止,移植细胞在椎间盘中存活时间和存活率,以及治疗功效尚未达到预期。虽然,移植UCMSCs来源外泌体不用考虑存活问题,且其在骨折、肾衰竭及脊髓损伤等疾病的治疗中已表现出巨大优势,但其治疗椎间盘退变的体内研究极少。总之,UCMSCs 及其外泌体治疗椎间盘退变在体外及动物研究方面取得了一定成果,但缺乏可靠的临床研究,完全修复和再生退化的椎间盘还需要深入地研究。

