Mn(acac)3诱导1-异腈基-2-[1-(三氟甲基)乙烯基]苯自由基环化合成4-三氟甲基喹啉衍生物
姚团利,汪 珂,朱 双,李 涛
(陕西科技大学化学与化工学院, 中国轻工业轻化工助剂重点实验室, 西安 710021)
含氟官能团在药物、 农药和有机功能材料中起着重要的作用[1~7]. 在各种含氟基团中,三氟烷基改善了重要分子的生物活性、 代谢稳定性、 亲油性和物理性质[8,9]. 因此,将三氟烷基引入到各种有机分子中备受关注[10~14]. 近年来,研究人员利用三氟甲基构建了大量含三氟甲基的杂环骨架[15~24].
喹啉是一类存在于天然产物、 生物活性物质和其它功能分子中的特殊骨架[25]. 在其中引入氟烷基,特别是三氟甲基(CF3),可以显著地改善药物分子的物理和化学性质,如抗疟药[26]、 抗结核药[27,28]和利什曼尼杀灭剂[29]. 迄今,已开发了多种制备三氟甲基化喹啉的合成方法[30,31]. CF3-喹啉主要由含CF3的原料制备,如氨基烯酮[32~35]、 3-氧代-3-CF3-丙酸苯胺[36,37]、 1-CF3-丙-2-炔盐[38]或由金属催化环化邻三氟乙酰苯胺[39,40]. 4-CF3-喹啉也可通过喹啉[41]或4-CF3-卤喹啉与转移试剂偶联来制备[42~44].
本课题组[45~47]探索了含三氟甲基的芳基异氰化物的环化反应,异氰化物是多种转化(包括自由基插入反应)的通用构建块. 根据Baldwin 规则,生成的酰基自由基中间体有两种可能的环化途径,即5-exo-trig 和6-exo-trig 环化. 5-exo-trig 环化在动力学和立体电子学上更有利,会生成吲哚类产物[48~50].Yu等[51]通过在乙烯基上引入稳定基取代基(如芳基和甲基),实现了6-endo-trig自由基的区域选择性环化. 根据Welin等[52]提出的极性匹配效应,本课题组假设苯乙烯α位置的吸电子三氟甲基可能会导致亲核酰基径向的6-endo-trig内环化. 基于此,本文发展了Mn诱导的1-异氰基-2-[1-(三氟甲基)乙基]苯与苯硼酸的6-endo-trig自由基环化反应,构建了多种4-三氟甲基喹啉衍生物.
1 实验部分
1.1 试剂与仪器
石油醚和乙酸乙酯,分析纯,西安凯诺科有限公司; 柱层析硅胶(200~300目),运城尔塞生物科技有限公司; 三乙酰丙酮锰[Mn(acac)3],分析纯,上海毕得医药科技股份有限公司; 二乙酰丙酮铜[Cu(acac)2]、 三乙酰丙酮铁[Fe(acac)3]、 醋酸铁[Fe(OAc)3]和四水合醋酸锰[Mn(OAc)2·4H2O],分析纯,上海麦克林生化科技有限公司; 苯硼酸(Phenylboronic acid)、 双(频哪醇合)二硼(B2pin2)和2-溴-3,3,3-三氟丙烯(2-Bromo-3,3,3-trifluoropropene),分析纯,上海皓鸿生物医药科技有限公司; 邻溴苯胺(2-Bromoaniline)和双二苯基膦二茂铁二氯化钯[PdCl2(dppf)],分析纯,安庆泽升科技有限公司; 乙酸钾(KOAc),分析纯,上海阿拉丁生化科技股份有限公司; 碳酸钾(K2CO3)、 乙腈(MeCN)、N,N-二甲基甲酰胺(DMF)和四氢呋喃(THF)、 分析纯,天津科茂化学试剂有限公司; 甲苯(Toluene)和乙酸酐(Ac2O),分析纯,国药集团化学试剂有限公司; 1,4-二噁烷(Dioxane)、 三氯氧磷(POCl3)和甲酸(HCOOH),分析纯,上海泰坦科技股份有限公司.
Bruker AVANCE Ⅲ 400 MHz 型核磁共振波谱仪(NMR),德国Bruker 公司; Bruker AVANCE NEO 600 MHz 型核磁共振波谱仪(NMR),德国Bruker 公司; BrukermicrOT 液质联用质谱仪,德国Bruker 公司; SGWX-4B 型显微熔点仪,上海仪电物理光学仪器有限公司; B S025型加热磁力搅拌器,德国IKA公司.
1.2 实验过程
1.2.1 1-异腈基-2-[1-(三氟甲基)乙烯基]苯衍生物的合成方法 向100 mL 耐压瓶中依次加入7.4 mmol 2-溴苯胺、 11.1 mmol联硼酸频那醇酯及30 mL 1,4-二噁烷,在氩气氛围下加入0.07 mmol 1,1-双(二苯基膦)二茂铁二氯化钯和14.8 mmol乙酸钾,通氩气2 min后密封反应瓶,于100 ℃加热搅拌3 h;利用薄层色谱法(TLC)监测反应; 待反应完全后,将溶液转移至分液漏斗中,加入20 mL 乙酸乙酯和20 mL水进行萃取,有机相再用60 mL饱和碳酸氢钠水溶液洗涤,用适量无水硫酸钠干燥,过滤,减压旋转蒸发除去溶剂,通过硅胶柱色谱(洗脱剂:V石油醚∶V乙酸乙酯=40∶1)分离纯化,以67%的产率得到1.3 g 2-氨基苯硼酸频哪醇酯白色固体.
向100 mL 耐压瓶中加入1.3 g 2-氨基苯硼酸频哪醇酯和23 mL 四氢呋喃,在氩气氛围下加入0.1 mmol双(三苯基膦)二氯化钯和11.5 mL 2 mol/L碳酸钾水溶液及14.4 mmol 2-溴-3,3,3-三氟丙基-1-烯,通氩气2 min后密封反应瓶,随后于60 ℃搅拌12 h; 通过TLC监测反应,待反应完全后,将溶液转移至分液漏斗中,加入20 mL水,然后用40 mL乙酸乙酯萃取; 有机相用20 mL饱和氯化钠水溶液洗涤,用适量无水硫酸钠干燥,过滤,减压旋蒸除去溶剂. 通过硅胶柱色谱(洗脱剂:V石油醚∶V乙酸乙酯=20∶1)分离纯化,以50%的产率得到538.1 mg 2-(3,3,3-三氟丙基-1-烯-2-基)苯胺黄色油状物.
向10 mL小瓶中加入17.3 mmol甲酸和17.3 mmol乙酸酐,并于室温下搅拌 30min,得到的甲酸乙酸酐直接用于下一步反应. 将2.9 mmol 2-(3,3,3-三氟丙基-1-烯-2-基)苯胺加入25 mL圆底烧瓶中,加入4 mL THF,用橡胶塞封口,于0 ℃下搅拌; 然后逐滴加入新制17.3 mmol甲酸乙酸酐; 滴加完毕后于0 ℃下搅拌1 h; 通过TLC监测反应,待反应完全后,将溶液转移至分液漏斗中,加入20 mL水,再用45 mL DCM 萃取; 有机相用60 mL 饱和碳酸氢钠溶液洗涤,用适量无水硫酸钠干燥,过滤,减压除去溶剂. 通过硅胶柱色谱(洗脱剂为:V石油醚∶V乙酸乙酯=5∶1)分离纯化,以90%的产率得到560 mgN-[2-(3,3,3-三氟丙-1-烯-2-基)苯基]甲酰胺黄色油状物.
将2.6 mmolN-[2-(3,3,3-三氟丙-1-烯-2-基)苯基]甲酰胺用13 mL THF转移至50 mL茄形瓶中,加入15.6 mmol 三乙胺,然后用橡胶塞密封后,将反应瓶置于0 ℃环境下搅拌预冷; 在0 ℃下,将7.8 mmol POCl3逐滴加入到反应体系中,每隔5 min 加一次; 滴加完毕后于室温搅拌3 h; 通过TLC 监测反应,待反应完全后,将溶液转移至分液漏斗中,加入20 mL 水,再用60 mL DCM 进行萃取; 合并有机相,用适量无水硫酸钠干燥,过滤,减压除去溶剂. 通过硅胶柱色谱(洗脱剂:V石油醚∶V乙酸乙酯=100∶1)分离纯化,以62%的产率得到318 mg 1-异腈基-2-[1-(三氟甲基)乙烯基]苯黄色油状物.
通过上述方法合成底物1a~1i(Scheme 1).

Scheme 1 Synthetic route of 1-isocyano-2-[1-(trifluoromethyl)ethenyl]benzenes derivatives
1.2.2 4-三氟甲基-2-芳基喹啉衍生物的合成方法 在25 mL烧瓶中,将0.2 mmol 异腈衍生物(1)溶于2 mL MeCN,随后加入0.4 mmol芳基硼酸(2)和0.4 mmol Mn(acac)3,将反应液置于60 ℃下搅拌1 h. 待反应完成后,降至室温,通过硅藻土过滤,随后用DCM洗涤硅藻土上的残留物后合并滤液,减压除去溶剂. 反应混合物通过石油醚/乙酸乙酯(V石油醚∶V乙酸乙酯=40∶1)洗脱,经硅胶柱层析法纯化,获得纯产物(Scheme 2).
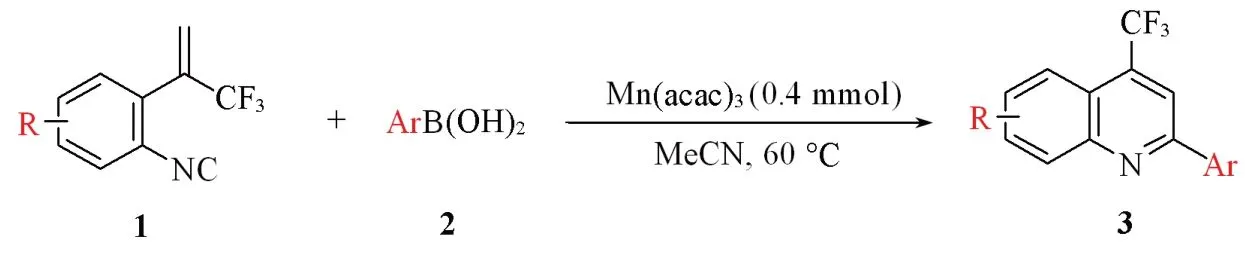
Scheme 2 Synthetic route of 4-CF3-quinoline derivatives
1.2.3 底物范围与数据表征 化合物3aa~3ia以及3ab~3ar的表征谱图见本文支持信息图S1~图S54,底物范围研究结果见表1.

Table 1 Study of substrate scope

Continued
化合物3aa[53],3ba[38],3ca[38],3da[39],3fa[32],3ga[54],3af[39]和3ag[55]为已知化合物. 本文采用新的方法制备了相同产物.
2-苯基-4-三氟甲基喹啉化合(3aa),白色固体,产率52%,m.p. 59.8~61.4 ℃.
6-三氟甲基-2-苯基-4-三氟甲基喹啉(3ba),白色固体,产率66%,m.p. 94.3~96.7 ℃.
6-氟-2-苯基-4-三氟甲基喹啉(3ca),白色固体,产率69%,m.p. 72.9~73.8 ℃.
6-氯-2-苯基-4-三氟甲基喹啉(3da),白色固体,产率65%,m.p. 115.7~117.0 ℃.
6-甲基-2-苯基-4-三氟甲基喹啉(3ea),白色固体,产率50%,m. p. 110~112 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.16(m,4H),7.89(s,1H),7.65(d,J=8.6 Hz,1H),7.57~7.53(m,2H),7.51~7.48(m,1H),2.60(s,3H);13C NMR(CDCl3,101 MHz),δ: 155.9,148.0,138.8,138.4,134.5(q,J=31.3 Hz),132.9,130.5,130.0,129.2,127.6,123.9(q,J=275.7 Hz),122.9,122.1,116.2(q,J=5.1 Hz),22.3; 高分辨质谱(HRMS,C17H12F3N计算值),m/z: 288.0993(288.0995)[M+H+].
7-氯-2-苯基-4-三氟甲基喹啉(3fa),白色固体,产率64%,m.p. 79.7~82 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.28(d,J=2.0 Hz,1H),8.21~8.15(m,3H),8.10~8.05(dq,J=1.8,9.1 Hz),7.63~7.59(dd,J=2.1,9.0 Hz),7.58~7.51(m,3H).
7-甲基-2-苯基-4-三氟甲基喹啉(3ga),白色固体,产率66%,m.p. 87.9~88.5 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.18(d,J=6.9 Hz,2H),8.10(s,1H),8.08~8.01(m,2H),7.58~7.48(m,4H),2.61(s,3H).
8-甲基-2-苯基-4-三氟甲基喹啉(3ha),白色固体,产率71%,m.p. 74~75 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.27(d,J=7.2 Hz,2H),8.20(s,1H),7.99(d,J=8.5 Hz,1H),7.66(d,J=7.0 Hz,1H),7.58~7.48(m,4H),2.93(s,3H);13C NMR(CDCl3,101 MHz),δ: 154.9,148.2,138.8,138.8,135.3(q,J=31.3 Hz),130.7,130.1,129.2,127.8,127.6,124.0(q,J=275.7 Hz),122.1,121.9,115.4(q,J=5.1 Hz),18.7; HRMS(C17H12F3N计算值),m/z: 288.0994(288.0995)[M+H+].
8-氟-2-苯基-4-三氟甲基喹啉(3ia),白色固体,产率68%,m. p. 93~95 ℃.1H NMR(CDCl3,600 MHZ),δ: 8.24~8.23(m,3H),7.92(d,J=8.5 Hz,1H),7.61~7.55(m,3H),7.53~7.49(m,2H);13C NMR(CDCl3,151 MHz),δ: 158.7(d,J=259.7 Hz),157.0,139.8(d,J=12.1 Hz),138.1,135.3(qd,J=31.7,3.0 Hz),130.6,129.3,128.0(d,J=7.6 Hz),127.8,123.6(q,J=274.8 Hz),123.6,119.8(d,J=3.0 Hz),117.0(q,J=4.5 Hz),114.9(d,J=18.1 Hz); HRMS(C16H9F4N 计算值),m/z:292.0744(292.0744)[M+H+].
4-(三氟甲基)-2[4-(三氟甲基)苯基]喹啉(3ab),白色固体,产率50%,m.p. 80~82 ℃.1H NMR(CDCl3,600 MHZ),δ: 8.32(d,J=8.2 Hz,2H),8.29(d,J=8.4 Hz,1H),8.18~8.16(m,2H),7.88~7.84(m,1H),7.81(d,J=8.2 Hz,2H),7.72~7.69(m,1H);13C NMR(CDCl3,151 MHz),δ: 155.2,149.3,141.9,135.7(q,J=31.7 Hz),132.0(q,J=33.2 Hz),131.0,130.9,128.7,128.0,126.2(q,J=3.4 Hz),124.3(q,J=271.8 Hz),124.1,123.7(q,J=276.3 Hz),122.4,116.0(q,J=4.5 Hz);HRMS(C17H9F6N计算值),m/z: 342.0711(342.0712)[M+H+].
4-(三氟甲基)-2-[4-(氰基)苯基]喹啉(3ac),白色固体,产率66%,m. p. 134~136 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.33(d,J=8.5 Hz,2H),8.28(d,J=8.5 Hz,1H),8.19~8.17(m,2H),7.89~7.82(m,3H),7.75~7.69(m,1H);13C NMR(CDCl3,101 MHz),δ: 154.5,149.3,142.5,135.8(q,J=32.3 Hz),133.0,131.1,129.0,128.2,124.2,124.1,123.6(q,J=275.7 Hz),122.5,118.7,115.8(q,J=5.1 Hz),113.8; HRMS(C17H9F3N2计算值),m/z: 299.0794(299.0791)[M+H+].
2-(4-氯苯基)-4-三氟甲基喹啉(3ad),白色固体,产率64%,m. p. 128~129 ℃.1H NMR(CDCl3,600 MHZ),δ: 8.25(d,J=8.5 Hz,1H),8.18~8.11(m,4H),7.82(t,J=7.7 Hz,1H),7.66(t,J=7.7 Hz,1H),7.52(d,J=7.9 Hz,2H);13C NMR(CDCl3,101 MHz),δ: 155.5,149.4,137.0,136.6,135.5(q,J=31.3 Hz),130.9,130.7,129.5,129.0,128.3,124.1,123.8(q,J=275.7 Hz),122.2,115.7(q,J=5.1 Hz); HRMS(C16H9ClF3N计算值),m/z: 308.0446(308.0448)[M+H+].
2-(4-溴苯基)-4-三氟甲基喹啉(3ae),白色固体,产率70%,m. p. 131~132 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.25(d,J=8.5 Hz,1H),8.15~8.12(m,2H),8.08(d,J=8.4 Hz,2H),7.82(t,J=7.7 Hz,1H),7.70~7.64(m,3H);13C NMR(CDCl3,101 MHz),δ: 155.5,149.4,137.5,135.5(q,J=31.3 Hz),132.4,130.9,130.8,129.2,128.3,125.0,124.1,123.8(q,J=275.7 Hz),122.2,115.6(q,J=5.1 Hz); HRMS(C17H12F3N计算值),m/z: 351.9942(351.9943)[M+H+].
2-(4-甲基苯基)-4-三氟甲基喹啉(3af),白色固体,产率68%,m.p. 99~101.3 ℃.
2-(4-甲氧基苯基)-4-三氟甲基喹啉(3ag),白色固体,产率63%,m.p. 97.5~98.8 ℃.
2-(3-硝基苯基)-4-三氟甲基喹啉(3ah),白色固体,产率57%,m.p. 155~156 ℃.1H NMR(CDCl3,400 MHZ),δ: 9.08(s,1H),8.55(d,J=7.7 Hz,1H),8.35(d,J=8.2 Hz,1H),8.30(d,J=8.5 Hz,1H),8.20~8.17(m,2H),7.87(t,J=7.7 Hz,1H),7.75~7.70(m,2H);13C NMR(CDCl3,101 MHz),δ: 154.0,149.3,149.3,140.3,136.0(q,J=32.3 Hz),133.3,131.1,131.1,130.2,129.0,124.7,124.2,123.7(q,J=275.7 Hz),122.6,122.5,115.5(q,J=5.1 Hz); HRMS(C16H9F3N2O2计算值),m/z:319.0687(319.0689)[M+H+].
2-(3-甲酯基苯基)-4-三氟甲基喹啉(3ai),白色固体,产率60%,m.p. 94~96 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.83(s,1H),8.44(d,J=7.8 Hz,1H),8.28(d,J=8.5 Hz,1H),8.20(s,1H),8.19~8.14(m,2H),7.83(t,J=7.7 Hz,1H),7.70~7.60(m,2H),4.00(s,3H);13C NMR(CDCl3,101 MHz),δ: 166.9,155.7,149.4,139.0,135.6(q,J=31.3 Hz),132.0,131.3,131.2,131.0,130.7,129.4,128.7,128.4,124.1,123.8(q,J=275.7 Hz),122.3,115.9(q,J=5.1 Hz),52.5; HRMS(C18H12F3NO2计算值),m/z: 332.0890(332.0893)[M+H+].
2-(3-氟苯基)-4-三氟甲基喹啉(3aj),白色固体,产率73%,m.p. 65~67 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.27(d,J=8.5 Hz,1H),8.18~8.13(m,2H),8.00~7.93(m,2H),7.86~7.80(m,1H),7.71~7.64(m,1H),7.55~7.48(m,1H),7.22~7.18(m,1H);13C NMR(CDCl3,101 MHz),δ: 164.9,162.5,155.4,149.3,140.9(d,J=7.1 Hz),135.5(q,J=32.3 Hz),130.8,130.7,129.7(d,J=255.5 Hz),124.1(d,J=2.0 Hz),123.8(q,J=275.7 Hz),123.2(d,J=3.0 Hz),122.3,117.2(d,J=22.2 Hz),115.9(q,J=5.1 Hz),114.7(d,J=23.2 Hz); HRMS(C16H9F4N计算值),m/z: 292.0745(292.0744)[M+H+].
2-(3-氯苯基)-4-三氟甲基喹啉(3ak),白色固体,产率70%,m.p. 64~65 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.30~8.21(m,2H),8.18~8.11(m,2H),8.07~8.02(m,1H),7.83(t,J=7.7 Hz,1H),7.70~7.64(m,1H),7.47(d,J=5.1 Hz,2H);13C NMR(CDCl3,101 MHz),δ: 155.2,149.3,140.4,135.5(q,J=32.3 Hz),135.5,131.0,130.8,130.4,130.2,128.5,127.8,125.7,124.1,123.8(q,J=275.7 Hz),122.3,115.8(q,J=5.1 Hz); HRMS(C16H9ClF3N 计算值),m/z: 308.0449(308.0448)[M+H+].
2-(2-甲酯基苯基)-4-三氟甲基喹啉(3al),黄色油状物,产率82%,1H NMR(CDCl3,400 MHZ),δ:8.22(d,J=8.5 Hz,1H),8.18(d,J=8.5 Hz,1H),7.94(d,J=7.7 Hz,1H),7.88(s,1H),7.85~7.79(m,1H),7.72~7.62(m,3H),7.56(td,J=7.6,1.3 Hz,1H),3.66(s,3H);13C NMR(CDCl3,101 MHz),δ: 168.8,158.4,148.9,140.4,134.5(q,J=32.3 Hz),131.9,131.6,130.7,130.6,130.4,130.3,129.4,128.4,124.1,123.8(q,J=275.7 Hz),122.0,118.7(q,J=5.1 Hz),52.3; HRMS(C18H12F3NO2计算值),m/z: 332.0891(332.0893)[M+H+].
2-(2-甲基苯基)-4-三氟甲基喹啉(3am),白色固体,产率78%,m. p. 58~59 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.27(d,J=8.5 Hz,1H),8.19(d,J=8.5 Hz,1H),7.87(s,1H),7.84(t,J=7.7 Hz,1H),7.70(t,J=7.7 Hz,1H),7.53(d,J=7.1 Hz,1H),7.42~7.33(m,3H),2.46(s,3H);13C NMR(CDCl3,101 MHz),δ: 159.8,148.9,139.6,136.4,135.6(q,J=31.3 Hz),131.4,130.7,130.6,129.9,129.3,128.3,126.5,124.1,123.7(q,J=273.7 Hz),121.6,119.5(q,J=5.1 Hz),20.6;HRMS(C17H12F3N计算值),m/z: 288.0997(288.0995)[M+H+].
2-(萘-1-基)-4-三氟甲基喹啉(3an),白色固体,产率80%,m.p. 134~135 ℃.1H NMR(CDCl3,600 MHZ),δ: 8.35(d,J=8.5 Hz,1H),8.25(d,J=8.5 Hz,1H),8.14(d,J=8.4 Hz,1H),8.05(s,1H),8.00(d,J=8.2 Hz,1H),7.97(d,J=8.2 Hz,1H),7.91~7.86(m,1H),7.77~7.72(m,2H),7.66~7.61(m,1H),7.58~7.51(m,2H);13C NMR(CDCl3,151 MHz),δ: 159.1,149.2,137.6,134.8(q,J=31.7 Hz),134.3,131.2,130.9,130.7,130.1,128.8,128.5,128.3,127.3,126.4,125.6,125.4,124.2,123.8(q,J=274.8 Hz),121.9,120.4(q,J=4.5 Hz); HRMS(C20H12F3N计算值),m/z: 324.0995(324.0995)[M+H+].
2-(萘-2-基)-4-三氟甲基喹啉(3ao),白色固体,产率63%,m.p. 144~146 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.63(s,1H),8.40(d,J=8.6 Hz,1H),8.34~8.30(m,2H),8.18(d,J=8.0 Hz,1H),8.01(d,2H),7.92~7.88(m,1H),7.83(t,J=7.6 Hz,1H),7.69~7.64(m,1H),7.57~7.55(m,2H);13C NMR(CDCl3,101 MHz),δ: 156.6,149.5,136.0,135.3(q,J=31.3 Hz),134.4,133.7,130.9,130.6,129.1,129.1,128.1,128.0,127.6,127.4,126.8,124.8,124.1,123.9(q,J=276.7 Hz),122.1,116.3(q,J=5.1 Hz); HRMS(C20H12F3N计算值),m/z: 324.0992(324.0995)[M+H+].
2-(噻吩-2-基)-4-三氟甲基喹啉(3ap),白色固体,产率64%,m.p. 94~96 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.21(d,J=8.5 Hz,1H),8.14~8.08(m,2H),8.05(s,1H),7.90(d,J=5.0 Hz,1H),7.79(t,J=7.7 Hz,1H),7.63(t,J=7.7 Hz,1H),7.47(dd,J=4.7,3.1 Hz,1H);13C NMR(CDCl3,101 MHz),δ: 152.8,149.4,141.9,135.2(q,J=31.3 Hz),130.6,130.6,127.9,127.0,126.9,125.8,124.1,123.8(q,J=275.7 Hz),122.0,116.3(q,J=5.1 Hz); HRMS(C14H8F3NS计算值),m/z: 280.0409(280.0402)[M+H+].
2-(呋喃-2-基)-4-三氟甲基喹啉(3aq),白色固体,产率46%,m.p. 74~76 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.20(d,J=8.5 Hz,1H),8.13~8.07(m,2H),7.83~7.76(m,1H),7.67~7.65(m,1H),7.65~7.59(m,1H),7.30(d,J=3.4 Hz,1H),6.63(dd,J=3.3,1.7 Hz,1H);13C NMR(CDCl3,101 MHz),δ: 153.0,149.1,148.5,145.0,135.1(q,J=31.3 Hz),130.8,130.4,127.9,124.2,123.6(q,J=275.7 Hz),121.9,115.0(q,J=5.1 Hz),112.8,111.4; HRMS(C14H8F3NO 计算值),m/z:264.0630.(264.0631)[M+H+].
2-(环戊-1-烯-1-基)-4-三氟甲基喹啉(3ar),白色固体,产率55%,m.p. 79~81 ℃.1H NMR(CDCl3,400 MHZ),δ: 8.14(d,J=8.4 Hz,1H),8.06(d,J=8.4 Hz,1H),7.90(s,1H),7.75(t,J=7.3 Hz,1H),7.59(t,J=8.1 Hz,1H),6.78(s,1H),3.02~2.95(m,2H),2.69~2.63(m,2H),2.15~2.06(m,2H);13C NMR(CDCl3,101 MHz),δ: 154.8,149.0,144.3,134.9,134.0(q,J=31.3 Hz),130.5,130.2,127.6,124.0,123.8(q,J=275.7 Hz),121.7,116.4(q,J=5.1 Hz),34.2,32.8,23.5; HRMS(C15H12F3N计算值),m/z: 264.0993(264.0995)[M+H+].
2 结果与讨论
2.1 反应条件的优化
以1-异腈基-2-[1-(三氟甲基)乙烯基]苯(1)和苯硼酸(2a)作为模型底物优化了反应条件. 首先,以乙腈为溶剂探索了不同种类氧化剂对该反应的影响(表2中Entries 1~5),其中乙酰丙酮铜、 乙酰丙酮铁、 乙酸铁(III)和四水合醋酸锰作氧化剂时,目标产物产率较低. 因此,在使用最佳催化剂乙酰丙酮锰的条件下,对反应溶剂进行了考察(表2中Entries 6~10). 实验结果表明,当使用甲苯作为溶剂时与使用乙腈作为的效果相同,均以52%的收率获得目标产物. 实验中将反应置于氩气环境下进行(表2中Entry 11),以相似的产率获得了目标产物,表明氧气的存在对于该反应并非必要. 对原料1a采用滴加的方式(表2中Entry 12),反应并未得到改善. 考察了苯硼酸(表2中Entry 13)和乙酰丙酮锰用量的影响(表2中Entries 16和17),发现将苯硼酸的用量提高至0.8 mmol以及将乙酰丙酮锰的用量降至0.2和0.1 mmol时,对反应均不利. 实验还对反应温度进行了筛选(表2中Entries 14和15),结果表明,降低温度对该反应有利,且当温度降低为60 ℃时效果最佳.
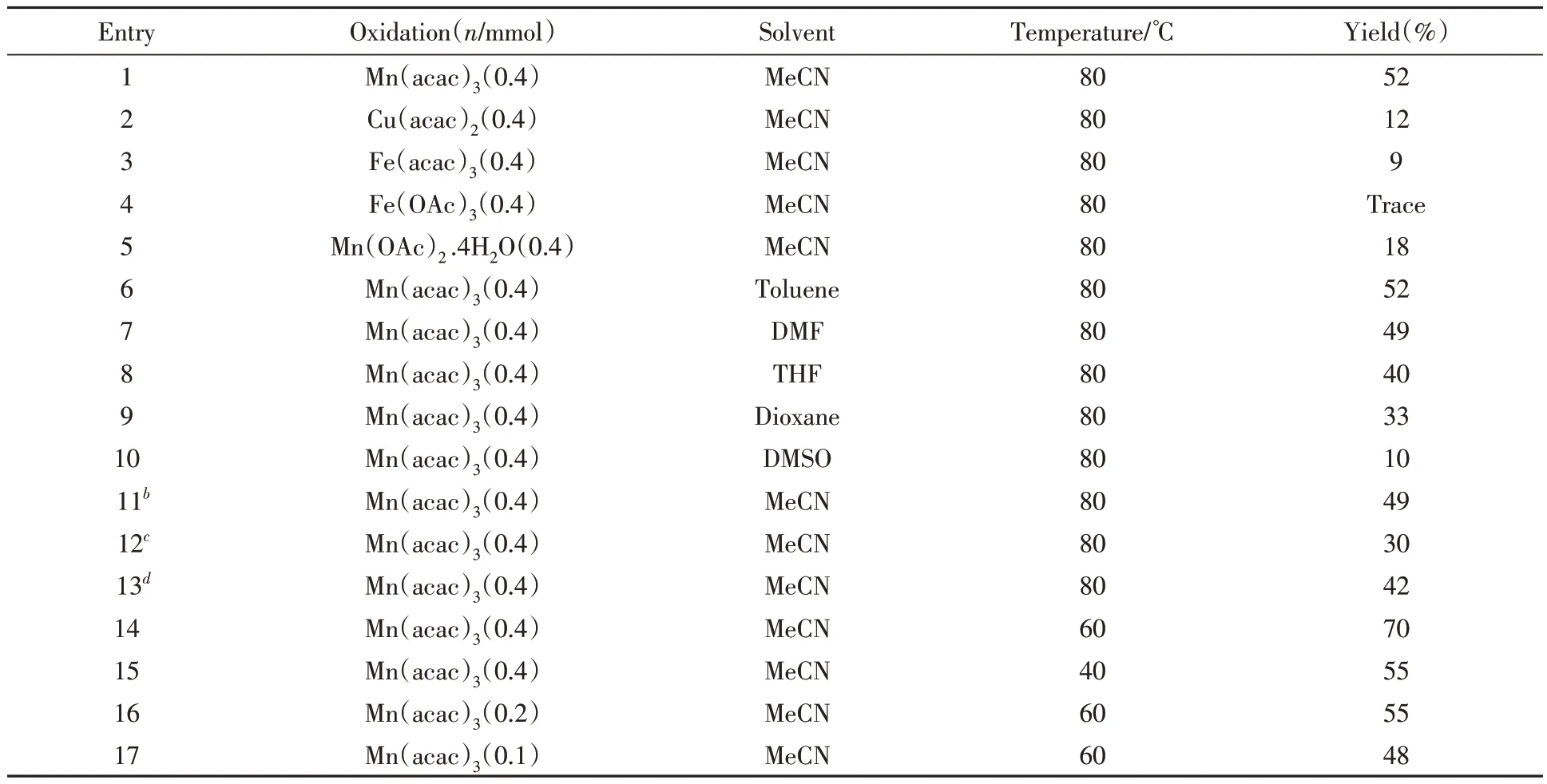
Table 2 Optimization of reaction conditionsa
根据以上结果确定了反应的最优条件: 原料为(0.2 mmol)1-异腈基-2-[1-(三氟甲基)乙烯基]苯和(0.4 mmol)苯硼酸,氧化剂为(0.4 mmol)乙酰丙酮锰,溶剂为(2.0 mL)乙腈,于60 ℃反应1 h.
2.2 底物的拓展
在确定最佳反应条件后,首先考察了不同取代基的1-异腈基-2-[1-(三氟甲基)乙烯基]苯(1)的适用范围. 当在邻烯基芳基异腈4号位引入吸电子基团如三氟甲基(1b)、 氟(1c)和氯(1d)时,以良好的产率(65%~69%)得到了2-苯基-4-三氟甲基喹啉产物3ba,3ca和3da. 即使在4号位和5号位均连接给电子基团如甲基(1e)以及5号位被氯(1f)取代时,以中等的产率(50%)和良好的产率(64%~68%)获得目标产物3ea,3fa和3ga. 当邻烯基芳基异腈6号位被甲基(1h)和氟(1i)取代时,以优异的产率获得目标产物3ha和3ia,表明空间位阻对该反应影响较小. 因此,该反应对含有各种取代基的芳基异腈均有良好的耐受性(Scheme 3).

Scheme 3 Scope of o-vinyl arylisocyanidesReaction conditions: 0.2 mmol compound 1, 0.4 mmol compound 2a, 0.4 mmol Mn(acac)3
进一步考察了不同的芳基硼酸对该反应的影响. 当Ar-4 号位引入吸电子(三氟甲基、 溴、 氯和氰基)和给电子基(甲基和甲氧基)时,均能以良好的收率(50%~70%)得到相应的喹啉产物3ab~3ag. 另外,Ar-3 号位引入吸电子基(硝基、 酯基、 氟和氯)时,能以57%~73%的产率得到相应喹啉产物3ah~3ak. 即使在R2-2号位引入明显具有空间位阻效应的酯基(3m)或甲基(3l)时,也能以82%和78%的优异产率获得对应目标产物3am和3al,该结果表明反应并不受电子效应和空间效应的显著影响. 值得注意的是,其它(杂)芳基硼酸同样对该反应表现出良好的耐受性,如1-萘基硼酸(3n)、 2-萘基硼酸(3o)、3-噻吩基硼酸(3p)、 2-呋喃基硼酸(3q)以及烯基硼酸(3r)均能顺利反应,以中等至良好的产率获得所需的喹啉衍生物3an~3ar. 当反应使用烷基硼酸时,未观察到期望的目标产物3as(Scheme 4).
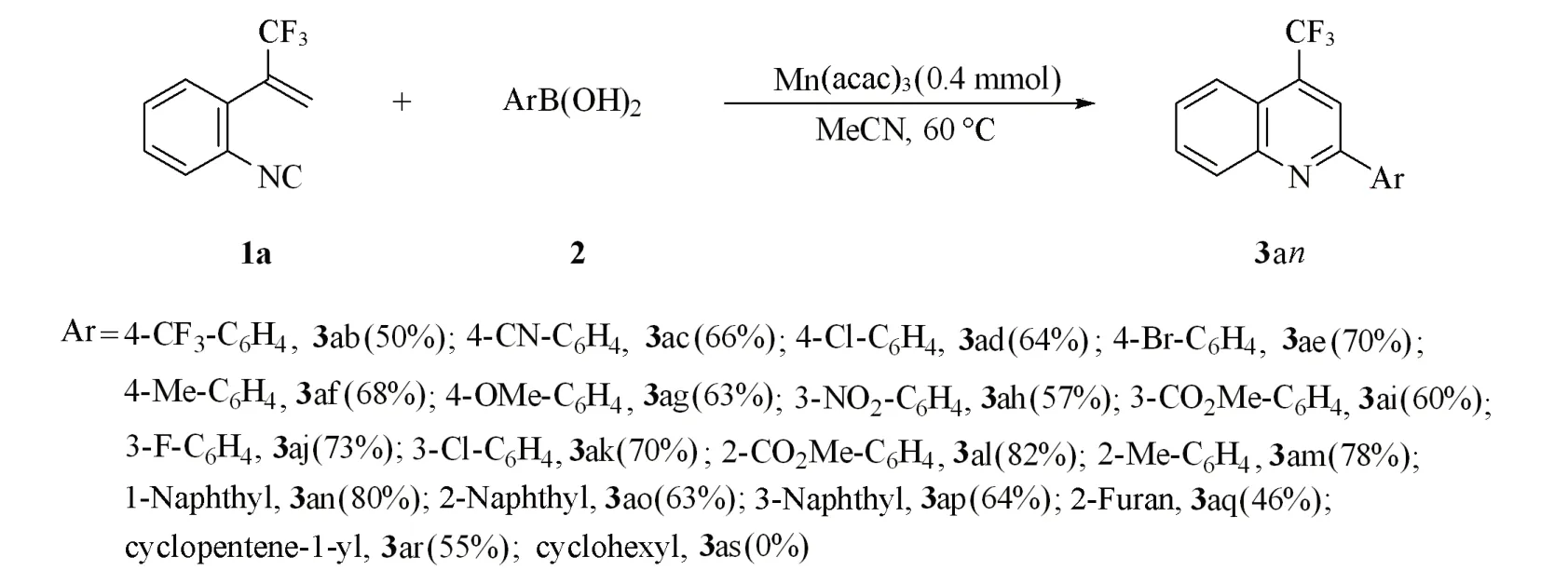
Scheme 4 Scope of arylboronic acidsReaction conditions: 0.2 mmol compound 1, 0.4 mmol compound 2a, 0.4 mmol Mn(acac)3.
2.3 反应机理的探究
为了深入了解反应机理,进行了Scheme 5(A)所示的实验. 当在标准条件下向反应体系中加入自由基清除剂2,2,6,6-四甲基哌啶氧化物(TEMPO)时,产率明显降低,表明该反应经历了自由基过程.由表2可见,该反应在氩气环境下进行与在空气环境下进行同样有效,表明氧气并不是反应的外部氧化剂. 基于前期的实验结果,提出了该反应可能的反应机理[Scheme 5(B)]. 首先,苯硼酸与Mn之间进行单电子转移(SET)过程生成苯基自由基中间体I,随后其选择性地插入到异腈中,形成亚胺基自由基中间体Ⅱ. 该中间体再进行6-endo-trig环化得到环状中间体Ⅲ. 中间体Ⅲ与Mn物种重组得到烷基Mn中间体Ⅳ,最后经历β-H消除得到喹啉产物.

Scheme 5 Mechanism experiments and speculations
3 结 论
开发了一种通用且实用的反应方法以获得具有潜在生物活性的4-CF3-喹啉衍生物. 该反应具有条件温和、 区域选择性和化学选择性高以及底物范围广等优点. 提出了一种新的Mn(III)/Mn(II)诱导的反应机理,为后续喹啉化合物的发展提供了新策略.
支持信息见http: //www.cjcu.jlu.edu.cn/CN/10.7503/20230448.