基于比较转录组测序分析雨生红球藻对克氏原螯虾肝胰腺基因表达的影响
周玥祺 黄春红 刘玉媛 易弋

摘 要:为明确饲料中添加雨生红球藻(Haematococcus pluvialis)对克氏原螯虾(Procambarus clarkii)肝胰腺基因表达的影响,以克氏原螯虾商业饲料作为基础饲料添加雨生红球藻,配置含有3‰雨生红球藻的试验饲料对克氏原螯虾进行为期45 d的喂养。基于RNA-seq技术对其肝胰腺的转录组数据进行分析,测序共获得44.61 Gb干净数据,Q30碱基百分比在92.46%以上。在FDR≤0.05且|log2FC|≥3的筛选条件下转录组测序分析共鉴定出895个差异表达基因。GO功能富集分析结果显示,差异表达基因主要在能量代谢过程上显著富集。KEGG通路富集分析结果显示,差异基因主要在能量代谢、免疫和神经传递相关通路中被显著富集。综上所述,饲料中添加3‰的雨生红球藻可能有助于克氏原螯虾提高抵抗病原体和外界环境变化的能力。
关键词:雨生红球藻(Haematococcus pluvialis);克氏原螯虾(Procambarus clarkii);转录组
克氏原螯虾(Procambarus clarkii)又称淡水小龙虾,是十足目鳌虾科原鳌虾属节肢动物[1]。因其适应能力强、肉质紧实、风味极佳且营养丰富,已成为我国重要的养殖水生生物[2]。2022年我国小龙虾产业综合产值为4 580亿元,产量为289.07万吨,占全国淡水养殖总产量的8.79%。是淡水虾类中养殖面积最广泛的品种[3]。
雨生红球藻(Haematococcus pluvialis)是一种淡水单细胞绿藻,因其富含蛋白质、矿物质和水溶性维生素等营养物质以及天然虾青素等生物活性物质而具有较高的营养价值和药用价值[4]。研究表明,饲料中添加15 mg/kg的雨生红球藻可以显著降低虹鳟体内的氧化程度,提高机体的抗氧化能力[5]。饲料中添加15%雨生红球藻粉可以促进中华绒螯蟹幼蟹生长,改善机体抗氧化功能[6]。饲料中添加0.1%~1.0%的雨生红球藻能提高尖吻鲈的抗氧化状态,降低鱼体的过氧化损伤[7]。饲料中添加大于0.30%的雨生红球藻能够显著提高黄颡鱼的生长性能,改善血液健康状况、氧化损伤及免疫应答能力[8]。
目前,雨生红球藻作为饲料添加剂在克氏原螯虾中进行的研究主要集中于探究其生长性能、抗氧化能力以及免疫状态等方面[9-10]。而雨生红球藻作为饲料添加剂影响克氏原螯虾基因表达的有关研究尚未见报道,其对克氏原螯虾肝胰腺作用的分子机制及作用通路尚未明确。本研究通过转录组测序技术探究饲料中添加雨生红球藻对克氏原螯虾肝胰腺差异表达基因转录表达的情况,为雨生红球藻作为克氏原螯虾饲料添加剂的研发提供参考,促进克氏原螯虾养殖业蓬勃发展。
1 材料与方法
1.1 试验动物
克氏原螯虾取自柳州市柳江区百朋镇光明水产养殖场。挑选42只初始平均体质量为(12.74±0.31)g体质健壮无病的克氏原螯虾在循环水养殖实验室中进行为期45 d的喂养。随机分为2组,每组3个重复,每个重复7尾。养殖过程中,每天分别于09:00和18:00按照虾体重的3%进行饱食投喂2次,养殖期间每天全量换水1次。
1.2 试验饲料
对照组饲喂基础饲料,HP处理组在基础飼料中添加3‰的雨生红球藻。基础饲料购自扬州市宏大饲料有限公司,基础饲料营养指标见表1。雨生红球藻购自云南维他源生物科技有限公司。饲料原料粉碎后与雨生红球藻混合均匀,用面条机加工成2.0和2.5 mm规格的饲料。饲料制作完成在通风处风干,用自封袋密封,-20 ℃保存备用。
1.3 样品采集
试验虾在养殖期结束后用75%酒精消毒后用无菌解剖剪剪开头部,然后用无菌眼科镊取出肝胰腺放入1.5 mL无酶离心管中。采样结束后将样品放液氮中速冻,随后保存在-80 ℃备用。
1.4 转录组学测序
使用RNA抽提(Trizol)法从肝胰腺组织中提取总RNA,采用Oligo dT富集mRNA。将mRNA随机断裂成300 bp左右的小片段并进行反转录。将反转录得到的cDNA加入End Repair Mix将其补成平末端,在3末端加上一个A碱基,用于连接Y字形的接头。对连接adapter(接头)后的产物进行纯化和片段分选,用分选产物进行PCR扩增,纯化得到最终的文库。采用Illumina NovaSeq 6000平台进行测序。采用fastp对测序得到的数据进行质控得到干净数据,再使用HiSat2与参考基因组(GCF_020424385.1)进行对比得到后续转录本组装、表达量计算等需要用到的mapped data(映射数据)。采用RSEM软件和DESeq2软件进行表达量分析和表达差异分析。显著差异表达基因的筛选标准为:FDR<0.05,|log2FC|≥3。使用美吉生物云系统对显著差异表达基因进行KEGG和GO的注释和富集分析。
1.5 荧光定量PCR验证
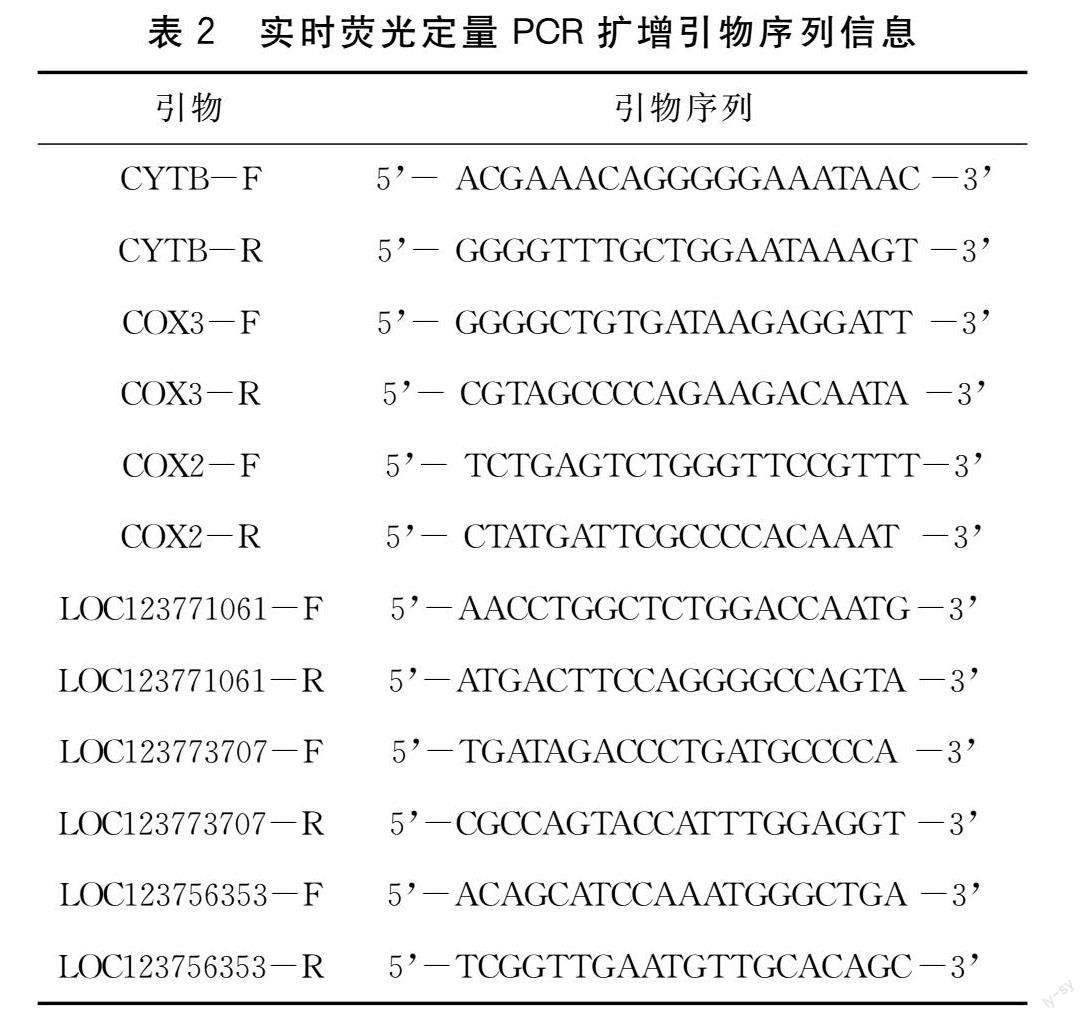
从转录组结果中随机选择6个差异表达基因采用primer 3软件设计定量引物。以β-actin为内参,进行荧光定量PCR反应,以Ct值计算每个基因的相对表达量。差异表达基因扩增引物序列如表2所示。
2 结果与分析
2.1 克氏原螯虾转录组测序数据质控及差异基因表达
6个样品的转录组分析共获得44.61 GB干净数据,各样品干净数据均达到6.08 GB以上,Q30>92.46%,Q20>97.34%,测序质量良好。分别将各样品的干净数据与指定的参考基因组进行序列比对,比对率从92.79%到94.99%不等,符合测序所要求范围。通过DESeq2软件对两组差异表达基因进行筛选,共得到895个差异表达基因,338个上调,557个下调(图1,见封三)。
2.2 GO功能分类及富集
2.2.1 GO注释分析结果 对差异表达基因进行GO功能注释分析(图2,见封三),结果显示,上调和下调差异基因在细胞组分中均主要集中在膜部分和细胞部分,在分子功能中均主要集中在结合和催化过程,在生物过程中均主要集中在代谢过程和细胞过程。
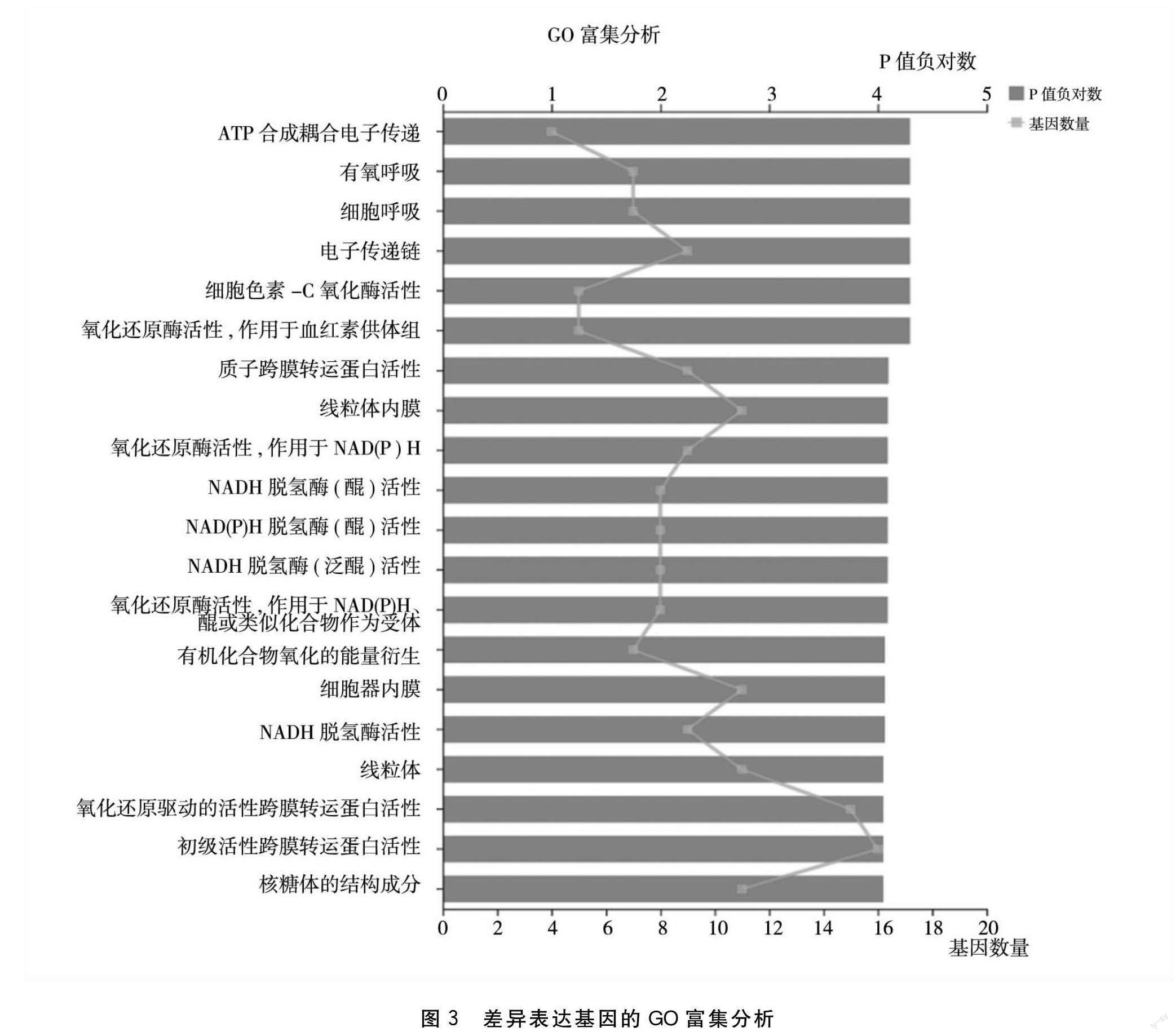
2.2.2 GO富集分析结果 对差异基因进行GO功能富集分析(图3),结果显示,在P≤0.05条件下,只有上调差异基因显著富集。差异上调基因主要注释在氧化还原相关过程、呼吸和能量传递中。
2.3 KEGG功能分类及富集
2.3.1 KEGG注释分析结果 对差异表达基因进行KEGG功能注释分析(图4,见封三),结果显示,差异基因主要集中在能量代谢、免疫、环境适应和信号转导等相关通路中。
2.3.2 KEGG富集结果 对差异表达基因进行KEGG功能富集分析(图5),结果显示,差异基因主要富集在能量代谢、免疫和神经传递相关通路中。能量代谢包括化学致癌作用-活性氧、氧化磷酸化和产热。免疫包括VEGF信号通路、趋化因子信号通路、白细胞跨内皮迁移、胃癌、子宫内膜癌和细菌对上皮细胞的侵袭、糖尿病性心肌病、亨廷顿病、帕金森病、朊病毒病、肌萎缩侧索硬化症、阿尔兹海默症、神经退行性疾病的途径 - 多种疾病和非酒精性脂肪肝病。神经传递包括逆行内源性大麻素信号传导、轴突导向和神经营养素信号通路。
2.4 荧光定量PCR验证结果
为了验证转录组测序的准确性,采用荧光定量PCR技术随机检测了6个基因的mRNA表达,结果见图 6。结果表明,荧光定量PCR与转录组测序的皮尔逊相关系数为0.840,说明转录组测序结果相对可靠。
3 讨论
目前,在水生生物的研究中,转录组经常被用作研究手段。Yu等[11]采用转录组学技术分析了饲料中添加硒可缓解低盐胁迫下南美白对虾的作用机制。Luo等[12]采用转录组学技术分析了高脂低蛋白饲料中添加左旋肉碱对鲤鱼脂肪和蛋白质代谢的调控作用及分子机制。Jiang等[13]基于转录组分析技术探究产梭菌蛋白代替鱼粉对南美白对虾肝胰腺转录组的影响。Li等[14]采用转录组学技术分析饲料中添加褪黑激素对南美白对虾肝胰腺转录组的影响,推测出褪黑激素对南美白对虾抗氧化和免疫功能影响的分子机制。 不同饲料喂养下皱纹盘鲍肝胰腺转录组分析结果表明在循环水工厂化养殖中,人工饲料比天然饲料更能促进皱纹盘鲍生长[15]。因此,本研究选择采用克氏原螯虾肝胰腺进行转录组学测序进行研究。肝脏主要参与水生动物的营养代谢和调节,并在免疫功能中起重要作用,肝胰腺是甲壳类动物重要的消化代谢和内分泌器官[16]。因此,本研究采用克氏原螯虾的肝胰腺进行转录组分析来探究饲料中添加3‰雨生红球藻对克氏原螯虾机体生理变化的调控机制。
在本研究中,差异表达上调基因显著富集在化学致癌作用-活性氧、氧化磷酸化和产热通路中。活性氧(ROS)是线粒体氧化磷酸化的副产物,对细胞存活、增殖、损伤和衰老至关重要,而产热是线粒体氧化磷酸化的必然结果[17-18]。研究表明,ROS水平超过细胞抗氧化防御系统的能力会诱发氧化应激,但氧化应激本身并不是坏事[19]。例如吞噬细胞中含有病原体的吞噬体中氧化应激的产生是抗菌免疫的重要组成部分。Sheu等[20]发现巨噬细胞通常是最先遇到入侵病原体的免疫细胞,它们通过吞噬作用吞噬病原体、死细胞和细胞碎片,随后降解吞噬溶酶体中的物质。巨噬细胞对细菌的识别会导致ROS大量产生并发挥不同的抗菌功能[21]。弓形虫是水生生物易感染的一种寄生虫, Park等[22]研究发现,巨噬细胞在针对这种病原体的免疫防御中起着核心作用,即ROS的大量产生有助于增强生物体对弓形虫的抵抗。线粒体来源的活性氧(mtROS)的杀菌活性直接有助于杀死吞噬细胞的细菌[23]。线粒体会诱导鼠伤寒沙门氏菌感染斑马鱼巨噬细胞产生基质mtROS促进鼠伤寒沙门氏菌的失活[24]。斑马鱼结核病模型中,过量的TNF诱导感染巨噬细胞中mtROS形成,有助于在吞噬过程中杀死细菌[25]。
线粒体氧化磷酸化提供了需氧生物90%以上的能量,线粒体的主要细胞功能是通过三羧酸循环和氧化磷酸化途径中代谢产物的氧化产生ATP[26]。在这个过程中,NADH和FADH2作为复合物 I(NADH:泛醌氧化还原酶)和复合物II(琥珀酸脱氢酶)的电子供体发挥作用,它们通过复合物III(泛醇细胞色素c还原酶)转运到复合物IV(细胞色素c氧化酶),其中分子氧充当线粒体呼吸链的最终電子受体。这种电子传递产生穿过线粒体内膜的质子梯度,与复合物V(ATP 合酶)偶联,将ADP转化为ATP[27]。水生生物面对胁迫条件时需要消耗大量的能量来缓解胁迫条件对机体产生的压力[28]。研究表明,产热和氧化磷酸化是冷胁迫下黄颡鱼产生能量的主要生物过程,产生的能量用以维持机体的代谢稳态[29]。胡成枫[30]发现斑马鱼细胞会通过促进机体适应性产热以适应低温环境造成的影响。南美白对虾和日本沼虾在面对冷应激时氧化磷酸化和产热通路也被显著激活,释放大量能量来抵御外界环境的变化[31-32]。这与我们的研究结果一致。综上所述,饲料中添加3‰的雨生红球藻可能有助于克氏原螯虾提高抵抗细菌、病原体和外界环境变化的能力。
本研究也富集到许多与疾病相关的通路,包括神经系统疾病和癌症等,说明添加雨生红球藻可以影响与疾病相关的免疫调节。
4 结论
通过对饲料中添加3‰的雨生红球藻对克氏原螯虾肝胰腺基因表达的影响进行分析,结果表明饲料中添加3‰的雨生红球藻可能有助于克氏原螯虾提高抵抗外界不良影响的能力。该研究将有助于为水产养殖饲料中添加雨生红球藻作为饲料添加剂的使用提供参考。
参考文献:
[1]
田贵云, 姜虎成, 孙梦玲,等. 噻虫嗪暴露对克氏原螯虾的病理损伤和生化反应的影响[J]. 水产养殖, 2023, 44 (10): 18-22+54.
[2] 吴乐, 李嘉尧, 周文宗,等. 氨氮短期胁迫与恢复对克氏原螯虾的影响 [J/OL]. 水产科学, 1-14[2024-03-01].https://doi.org/10.16378/j.cnki.1003-1111.23038.
[3] 于秀娟, 郝向举, 杨霖坤, 等. 中国小龙虾产业发展报告(2023)[J]. 中国水产, 2023(7): 26-31.
[4] 王裕玉, 宋庆辉, 贾晶,等. 雨生红球藻的营养价值及其在鱼类饲料中的应用[J]. 饲料研究, 2023, 46(17): 167-172.
[5] 陈果, 王磊, 吴旭干,等. 投喂雨生红球藻虾青素条件下的虹鳟血清代谢组学研究[J]. 基因组学与应用生物学, 2023, 42(11): 1189-1202.
[6] 李玥睿, 高金伟, 张文慧,等. 蛋白核小球藻粉和雨生红球藻粉对中华绒螯蟹幼蟹生长和生理生化指标的影响[J]. 饲料研究, 2022, 45(20): 49-54.
[7] 虞为, 陈雪晴, 杨育凯,等. 饲料中添加雨生红球藻对尖吻鲈生长性能、抗氧化能力及免疫状态的影响[J]. 南方水产科学, 2022, 18(5): 46-54.
[8] 樊玉文, 张木子, 黎明, 等. 饲料中添加雨生红球藻对黄颡鱼生长、抗氧化酶活性、免疫应答及氨氮耐受的影响[J]. 水产学报,2022, 46(11): 2168-2176.
[9] 惠文杰. 雨生红球藻对克氏原螯虾生长、体色、抗氧化及肝肠组织的影响[D]. 长沙:湖南农业大学, 2023.
[10] AN Z, ZHANG Y, SUN L. Effects of dietary astaxanthin supplementation on energy budget and bioaccumulation in Procambarus clarkii (Girard, 1852) crayfish under microcystin-LR stress[J].Toxins (Basel). 2018,10(7):277.
[11] YU Q, HAN F, ROMBENSO A, et al. Dietary selenium supplementation alleviates low salinity stress in the Pacific white shrimp Litopenaeus vannamei: growth, antioxidative capacity and hepatopancreas transcriptomic responses[J]. Br J Nutr, 2023, 130(6): 933-943.
[12] LUO W, CHEN P, ZHANG X, et al. Effect of adding L-carnitine to high-fat/low-protein diets of common carp (Cyprinus carpio) and the mechanism of regulation of fat and protein metabolism[J]. Aquac Nutr, 2022: 3768368.
[13] JIANG X, YAO W, YANG H, et al. Dietary effects of Clostridium autoethanogenum protein substituting fish meal on growth, intestinal histology and immunity of Pacific white shrimp (Litopenaeus vannamei) based on transcriptome analysis[J]. Fish Shellfish Immunol, 2021, 119: 635-644.
[14] LI Y, YANG Y, LI S, et al. Effects of dietary melatonin on antioxidant and immune function of the Pacific white shrimp (Litopenaeus vannamei), as determined by transcriptomic analysis[J]. Comp Biochem Physiol Part D Genomics Proteomics, 2023, 48: 101146.
[15] 梁爽, 梁健, 李永仁, 等. 不同飼料对皱纹盘鲍肝胰腺转录组的影响研究[J]. 饲料研究, 2023, 46(20): 52-56.
[16] 郑亮, 谢熙, 郑宏坤, 等. 三疣梭子蟹JHEH基因的克隆及表达分析[J]. 华北农学报, 2020, 35(6): 225-234.
[17] 张立秋, 李成华, 姜丽, 等. 衰老假说与活性氧研究[J].生理科学进展, 2020, 51(5): 327-331.
[18] 高芸, 徐美雪, 于太永,等. N-油酰(基)甘氨酸与油酸对线粒体UCP1非依赖产热的影响[J]. 中国生物化学与分子生物学报, 2021, 37(11): 1482-1488.
[19] DAN D J, ALVAREZ LA, ZHANG X. Reactive oxygen species and mitochondria: A nexus of cellular homeostasis[J]. Redox Biol. 2015, 6: 472-485.
[20] SHEU K M, HOFFMANN A. Functional hallmarks of healthy macrophage responses: Their regulatory basis and disease relevance[J]. Annu Rev Immunol. 2022, 40: 295-321.
[21] HERB M, SCHRAMM M. Functions of ROS in macrophages and antimicrobial immunity[J]. Antioxidants (Basel), 2021, 10(2): 313.
[22] PARK J, HUNTER C A. The role of macrophages in protective and pathological responses to Toxoplasma gondii[J]. Parasite Immunol, 2020, 42(7): e12712.
[23] FERNANDEZ-BOYANAPALLI R F, FRASCH S C, THOMAS S M, et al. Pioglitazone restores phagocyte mitochondrial oxidants and bactericidal capacity in chronic granulomatous disease[J]. J Allergy Clin Immunol, 2015, 135(2): 517-527.
[24] DO AMARALl M A, PAREDES L C, PADOVANI B N, et al. Mitochondrial connections with immune system in Zebrafish[J]. Fish Shellfish Immunol. Rep, 2021, 2: 100019.
[25] ROCA F J, RAMAKRISHNAN L. TNF dually mediates resistance and susceptibility to mycobacteria via mitochondrial reactive oxygen species[J]. Cell, 2013, 153(3): 521-534.
[26] BERMEJO-NOGALES A, CALDUCH-GINER J A, PEREZ-SANCHEZ J. Unraveling the molecular signatures of oxidative phosphorylation to cope with the nutritionally changing metabolic capabilities of liver and muscle tissues in farmed fish[J]. PLoS One. 2015, 10(4): e0122889.
[27] RICQUIER D. Fundamental mechanisms of thermogenesis[J]. C R Biol, 2006, 329(8): 578-586.
[28] 豐超杰, 刘霞飞, 张颖, 等. 高温胁迫下黑龙江茴鱼幼鱼肝脏组织结构变化及转录组表达特征[J]. 大连海洋大学学报, 2023, 38(4): 603-614.
[29] HU J, ZHAO H, WANG G, et al. Energy consumption and intestinal microbiome disorders of yellow catfish (Pelteobagrus fulvidraco) under cold stress[J]. Front Physiol, 2022, 13: 985046.
[30] 胡成枫. PGC-1α在斑马鱼细胞冷应激过程中的功能探究[D]. 上海: 上海海洋大学, 2017: 37.
[31] FAN L, WANG L, WANG Z. Proteomic characterization of the hepatopancreas in the Pacific white shrimp Litopenaeus vannamei under cold stress: Revealing the organism homeostasis mechanism[J]. Fish Shellfish Immunol, 2019, 92: 438-449.
[32] JIN S, HU Y, FU H, et al. Analysis of testis metabolome and transcriptome from the oriental river prawn (Macrobrachium nipponense) in response to different temperatures and illumination times [J]. Comp Biochem Physiol Part D Genomics Proteomics, 2020, 34: 100662.
The impact of Haematococcus pluvialis on hepatopancreas gene expression in Procambarus clarkii investigated through comparative transcriptome sequencing analysis
ZHOU Yueqi1, HUANG Chunhong2, LIU Yuyuan1, YI Yi1
(1. Guangxi University of Science and Technology, Liuzhou 545000, China; 2. Liujiang District Agricultural and Rural Comprehensive Development Service Center, Liuzhou 545000, China)
Abstract:To investigate the impact of Haematococcus pluvialis supplementation on hepatopancreas gene expression in Procambarus clarkii, commercial feed for Procambarus clarkii was used as the base diet and supplemented with Haematococcus pluvialis at a concentration of 3‰. The experimental group was fed with modified diet for 45 days, and RNA-seq technology was employed to analyze the transcriptome data from the hepatopancreas. A total of 44.61 Gb clean sequencing data were obtained, with over 92.46% Q30 bases. Through transcriptome sequencing analysis using screening criteria (FDR≤0.05 and |log2FC|≥3), we identified 895 differentially expressed genes. GO functional enrichment analysis revealed that these differentially expressed genes were primarily associated with energy metabolism pathways. KEGG pathway enrichment analysis demonstrated significant enrichment of differential genes in energy metabolism, immunity, and neurotransmission-related pathways. In conclusion, supplementing Procambarus clarkii's diet with 3‰ Haematococcus pluvialis may enhance its resistance against pathogens and environmental changes externally imposed upon it.
Key words:Haematococcus pluvialis; Procambarus clarkii; transcriptome
(收稿日期:2024-01-29)

