塔本文都苏提取物对糖尿病肾病小鼠肾功能的改善和保护作用
曹瑞珍,尹美珍,张国文,张树军,乔 伟
(内蒙古民族大学医学院,内蒙古 通辽 028043)
近年来,随着经济的发展,快节奏的生活、长期的熬夜和不合理饮食等诸多因素,使2 型糖尿病的发病率逐年升高,且趋于年轻化。2019 年公布的数据显示,全世界约有4.63 亿糖尿病患者,其中,中国约占1/4[1]。2型糖尿病患者,随着病情的进展,前期的胰岛素抵抗和后期胰岛素分泌不足,使细胞对血糖利用障碍,葡萄糖在血液堆积引起血糖升高,进而引起脂代谢紊乱,引起患者血脂升高[2]。高糖高脂和胰岛素抵抗还可引起组织细胞氧化应激反应加强,全身血管神经损害,导致各种并发症[3],如糖尿病肾病、眼底病变、心脑及下肢血管病变等,而糖尿病肾病在终末期肾病患者中的百分比例逐年升高,需要引起大家足够的重视。
中蒙药在治疗糖尿病方面有其独特的优势,对糖尿病患者肝肾损伤的预防和治疗也有丰富的经验[4-5]。现代研究表明,中蒙药大多是通过其有效成分如类胰岛素、黄酮类、多糖类、生物碱类等促进细胞对血糖的摄取、降低氧化应激损伤等途径而控制血糖和调节血脂等,同时利用这些活性物质清除自由基等达到抗氧化、保护肝肾等器官的目的[6-8]。
塔本文都苏方剂由黄精、玉竹、天冬、刺蒺藜和天花粉组成,每味药有相似活性成分,也有自己独特成分,这些活性成分或有抗氧化、调血脂功能,或有降糖功能等,组成方剂后功能互补,作用得到加强[7-8],通过这些作用最终使肝肾等组织器官得到保护。本实验目的是建立糖尿病肾病小鼠模型,考察塔本文都苏提取物对糖尿病肾病小鼠肾功能的保护作用。
1 材料与方法
1.1 实验动物
1.5~2 月龄C57BL/6J 雄性小鼠70 只,SPF 级,体重18~22 g,购于吉林省亿斯实验动物技术有限责任公司[SCXK-(吉)2018-0007][8]。环境温度24 ℃左右(空调),湿度50%左右。
1.2 主要试剂与仪器
塔本文都苏各组方由内蒙古民族大学蒙医药学院教师鉴定,从通辽市中医院购买[8]。转化生长因子β1(TGF-β1)多克隆抗体(上海谷研实业有限公司,批号:GOY-667);链脲佐菌素(Streptozotocin,STZ,sigma公司,批号:13071275422);基底膜六胺银染色液(北京雷根生物技术有限公司,批号:DZ0050);活性氧(ROS)试剂盒(批号:20190825)、肌酐(CRE)试剂盒(批号:20190920)、尿素氮(BUN)试剂盒(批号:20190821)、尿微量白蛋白(mAlb)试剂盒(批号:20190924)、超氧化物歧化酶(SOD)试剂盒(批号:20190815)、丙二醛(MDA)试剂盒(批号:20190809)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(批号:20190912)和考马斯亮兰蛋白测定试剂盒(批号:20190927)均购自南京建成生物工程研究所。
RE-52A型旋转蒸发器(上海亚索生化仪器厂);DY-89-1型电动玻璃匀浆机(宁波新芝生物技术公司);罗氏活力型血糖仪(德国罗氏公司);ZS-2型自动板式酶标仪(京航宇浪琴设备公司);奥林巴斯BX-41型显微镜(日本olimpus公司)。
1.3 实验方法
1.3.1 TBWDS提取液的制备
取TBWDS 方剂400 g,20目粗粉,用75%乙醇2.40 L,浸泡10余小时,回流提取,并重复2次,将提取液合在一起,乙醇充分回收,用蒸馏水溶解,最后定容至1.25 L,配成每毫升含生药0.32 g,按每星期的药量分装,4 ℃冰箱冷藏[8]。
1.3.2 动物模型的建立及分组
70只小鼠按体重随机分为正常对照组10只和糖尿病(DM)组60只,适应性饲养7 d后,DM组不进食24 h,然后以0.08 g/kg剂量连续腹腔注射STZ(溶解在柠檬酸缓冲液,酸碱度4.5)2 d,5 d后断尾取血,用血糖仪测定空腹血糖浓度,大于11.1 mmol/L的小鼠为DM小鼠(成功46只)。对正常对照组小鼠继续常规饲料饲养,DM小鼠改为高脂高糖饲料饲养,30 d后测定24 h尿蛋白≥30 mg者则认为糖尿病肾病造模成功(43只)[8-9]。
将DN 小鼠随机分为模型组、二甲双胍组和TBWDS 高剂量组、TBWDS 低剂量组,每组10只,每日按1 mL体积灌胃治疗,TBWDS高、低剂量组小鼠分别给与8 g/kg和4 g/kg TBWDS提取物,二甲双胍组小鼠给与30 mg/kg的二甲双胍,模型组和正常对照组小鼠均给与等量蒸馏水[8]。正常对照组依旧常规饲料饲养,其余组继续高脂高糖饲料饲养。
1.3.3 标本采集
12周后对小鼠进行实验标本的采集和制备。(1)处死前1 d,用尿液收集器收集小鼠24 h尿液,离心后上清液分装保存于4 ℃冰箱;(2)用断头取血法采集小鼠血液,制备血清,按组4 ℃保存以备用;(3)处死后,立即解剖取肾,将部分肾皮质置于4%多聚甲醛中固定;(4)其余肾组织快速用冰冷的生理盐水漂洗,并拭干水称重,用生理盐水于电动匀浆机中制成10%匀浆,离心后取上清液,-20 ℃保存备用。
1.3.4 标本生化指标检测
取出保存的血清、尿液和肾匀浆液,分别按照试剂盒说明书,检测各项指标。(1)采用全自动生化分析仪对血UA、BUN、Scr含量进行测定,用ELISA法测尿mAlb含量。(2)取-20 ℃保存的各组肾组织匀浆上清液,按照试剂盒操作说明,用ELISA法测ROS含量,比色法测定MDA、SOD和GSH-Px的水平。
1.3.5 观察肾组织病理学改变及TGF-β1表达量
(1)将各组固定24 h的肾组织取出,常规制作5 μm的石蜡切片,并分别行基底膜黏多糖六胺银染色和HE染色,光镜下观察肾组织的病理学改变。(2)将上述制备的各组肾组织石蜡切片,常规脱蜡至水,按照TGF-β1免疫组化检测试剂盒进行抗原修复,过氧化氢酶阻断,山羊血清封闭,兔抗TGF-β1多克隆抗体孵育,缓冲液洗涤,羊抗兔二抗孵育,链霉亲合素-生物素复合物(SABC)标记;二氨基联苯胺(DAB)显色,苏木素复染,常规脱水透明,中性树胶封片,光镜下观察并拍照。以磷酸盐缓冲液(PBS)代替一抗作为阴性对照,检测小鼠肾皮质TGF-β1的表达。
1.4 统计学方法
各组数据用xˉ±s表示。用SPSS20 软件单因素方差分析及t检验进行组间比较,P<0.05 和P<0.01分别表示有显著、极显著差异。
2 结果
2.1 塔本文都苏提取物对糖尿病肾病小鼠血清UA、BUN、Scr及尿mAlb的影响
模型组与正常对照组比较,小鼠血清Scr、BUN和UA浓度以及尿mAlb含量均显著升高(P<0.01);与模型组比较,TBWDS高、低剂量组的血清Scr、BUN和UA浓度以及尿mAlb含量均显著降低(P<0.01),且与二甲双胍组比较无明显差异。结果见表1。

表1 各组小鼠血清UA、BUN、Scr及尿mAlb的比较Tab. 1 Comparison of serum UA,BUN,Scr and urine mAlb of mice in each groupxˉ±s,n=10
2.2 塔本文都苏提取物对糖尿病肾病小鼠肾组织氧化及抗氧化指标的影响
模型组与正常对照组比较,小鼠肾组织GSHPx、SOD 活性下降,而ROS、MDA 水平升高,有明显差异(P<0.01);与模型组比较,TBWDS 高、低剂量组和二甲双胍组的小鼠肾组织GSH-Px、SOD 活性均显著上升(P<0.01),而ROS、MDA 水平均明显降低(P<0.01);TBWDS 高、低剂量组与二甲双胍组比较,GSH-Px、SOD 活性均无统计学差异,但TBWDS 低剂量组在降低ROS、MDA 水平方面不如二甲双胍组(P<0.05)。结果见表2。
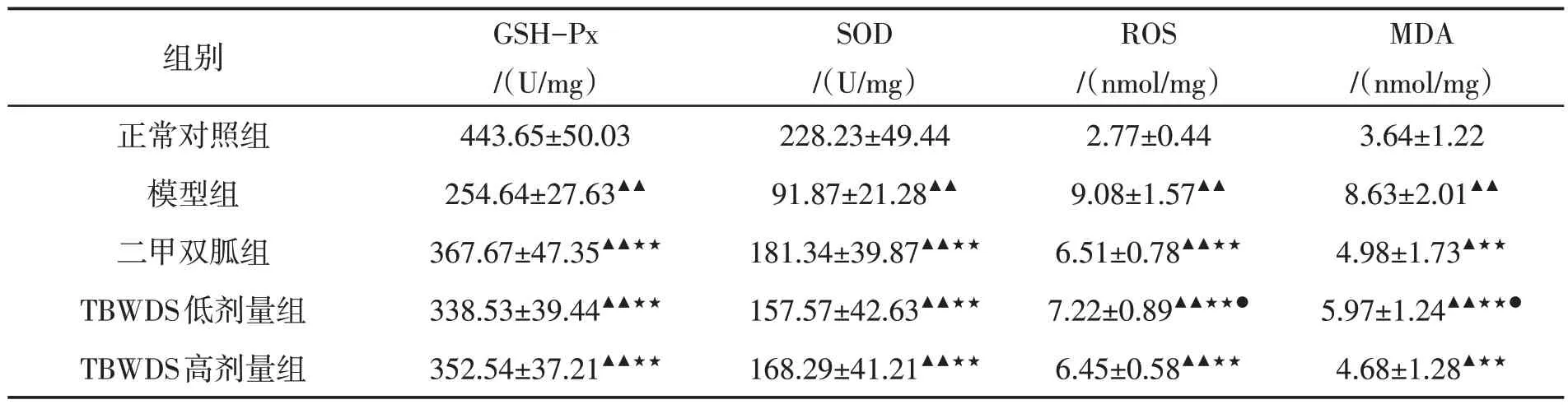
表2 各组小鼠肾组织GSH-Px、SOD、ROS及MDA的比较Tab. 2 Comparison of GSH-Px,SOD,ROS and MDA in kidney tissues of mice in each groupxˉ±s,n=10
2.3 塔本文都苏提取物对糖尿病肾病小鼠肾组织的影响
图1为各组小鼠肾组织HE染色结果,光镜下可见正常对照组肾组织中肾小体和肾小管结构清晰且较完整。模型组肾小管结构不规整,肾小管上皮细胞肿胀、有空泡,甚至细胞游离部的胞质和胞膜脱落;肾小球内毛细血管结构明显减少,系膜细胞增生,嗜酸性的基质明显增多,肾小囊扩张。与模型组比较,二甲双胍组和TBWDS提取液高剂量组的肾组织结构改善较为明显。
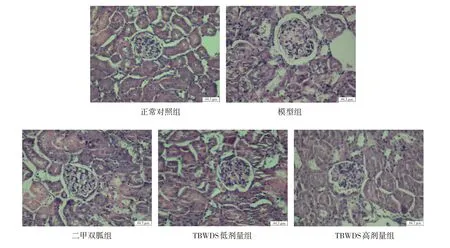
图1 各组小鼠肾组织HE染色的光镜照片Fig.1 Light microscope photos of HE staining in kidney tissue of mice in each group
各组小鼠肾组织六胺银染色呈棕黄至棕黑色,可显示肾小球系膜和基底膜以及肾小囊和肾小管的基底膜,见图2。光镜下明显可见,模型组较其余各组小鼠肾小球系膜和基底膜染色重。正常对照组小鼠的肾小球内血管、基底膜、系膜基质结构清晰,而模型组呈现弥漫性肾小球系膜基质区增宽,基质增多,基底膜明显增厚,球内血管管腔狭窄。二甲双胍组和TBWDS 提取物高、低剂量组的肾小球内结构明显改善,球内系膜和基底膜仅见局灶性改变,其中,二甲双胍组和TBWDS提取物高剂量组改善最为明显。
2.4 塔本文都苏提取物对糖尿病肾病小鼠肾组织中TGF-β1蛋白表达的影响
TGF-β1在机体的肾脏细胞中都有广范表达。TGF-β1免疫组化染色呈棕黄至棕黑色。图3显示,各组肾组织中肾小体、肾小管以及肾间质均呈阳性染色,但与正常对照组比较,模型组的肾小体、肾小管以及肾间质的染色均明显加深,而二甲双胍组和TBWDS提取物高、低剂量组的各部位染色则明显较模型组的染色浅,尤其是二甲双胍组和TBWDS提取物高剂量组染色更浅。这些结果表明,模型组肾组织细胞中TGF-β1表达明显增强,而二甲双胍组和TBWDS提取物可降低肾组织细胞中TGF-β1的表达。
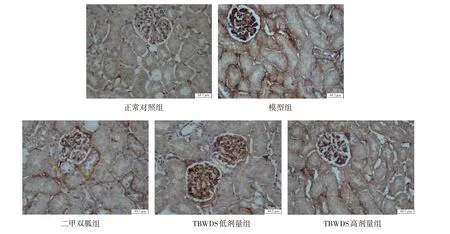
图3 各组小鼠肾组织TGF-β1免疫组化染色的光镜照片Fig.3 Light microscope photos of immunohistochemical staining of TGF-β1 in kidney tissue of mice in each group
3 讨论
糖尿病肾病(DN)从早期病变逐渐发展到肾衰竭,以往大家认为,DN的早期病变发生在肾小球,但现在越来越多的研究发现,肾小管病变不仅具有独立性且病变的程度与肾功能的相关性更为密切,无论从发病时间上还是发病机制上均具有独立性[10]。本实验的病理学观察结果显示,DN模型组小鼠的肾小球结构以及肾小管上皮细胞的损伤较为严重,而TBWDS提取物能明显改善肾组织的损伤。
活性氧(reactiveoxygenspecies,ROS)是多种氧自由基统称,少量的ROS具有免疫和信号转导作用[11],但过多的ROS 会破坏人体的组织细胞,而高血糖、高血脂、缺血等会刺激ROS 的产生,引起组织细胞损害[12-13];ROS还可作为类似于第二信使,激活多种信号转导通路,TGF-β1通路就是其中最重要的一个[14]。ROS使TGF-β1表达增加,而TGF-β1促进肾间质纤维化[15]。本实验通过分子生物学和形态学结合的手段,观察到糖尿病肾病模型组小鼠的肾小球、肾小管以及肾间质部位的TGF-β1表达明显增强,这就意味着随病情的发展,不仅出现肾小球纤维化,肾间质也发生了纤维化。TGF-β1反过来又可刺激ROS的产生,从而加剧肾脏的损伤[16]。TBWDS提取物能明显降低肾组织ROS含量并降低TGF-β1的表达,表明其具有抗氧化、保护肾组织纤维化的作用。
高糖高脂环境刺激下,机体产生的大量氧自由基使脂质过氧化产生MDA,同时降低SOD、GSH-PX的活性,使后两者清除氧自由基和过氧化物的能力不足,MDA堆积,进一步引起肾组织损伤[17]。本研究结果显示,TBWDS 提取物高、低剂量组的SOD、GSH-PX 活性较模型组升高明显,MDA 明显降低,说明TBWDS提取物可提高机体抗氧化能力,减少MDA产生,加速其清除,保护肾组织免受氧化应激的损伤,从而改善肾功能。
由于肾小球基底膜的分子屏障和电荷屏障,在健康人和小鼠尿液中仅含有微量的白蛋白,尿微量白蛋白是反映肾早期损害的指标[18]。肾小球基底膜受损,屏障破坏,致使通透性增加,引起大量白蛋白尿。血尿素氮和肌酐是反映肾损害的晚期指标,反映肾小球滤过功能随着肾纤维化的发生发展,肾小球滤过功能逐渐下降,导致血尿素氮和肌酐水平升高[19]。TBWDS提取物可以显著降低糖尿病肾病小鼠尿mAlb含量和血肌酐、尿素氮的水平,能够修复肾小球的损伤,改善肾功能。
糖尿病患者其不良饮食习惯,摄入高嘌呤食物,再加上高糖引起的氧化应激反应,使组织细胞损伤,细胞中的嘌呤化合物分解代谢增强,产生尿酸增多,而由于其溶解度低,一旦含量升高就会沉积在肾脏,引起肾损伤;肾损伤后又引起尿酸的排泄障碍,进一步使血尿酸升高[18]。近来发现,在2型糖尿病和糖代谢异常人群中高尿酸血症者明显高于正常人群,并且血尿酸在肾脏疾病进展中发挥着重要作用,可能是慢性肾脏病(CKD)进展的独立危险因素[20]。因此,越早控制高尿酸血症越有利于延缓DN的进展,达到防止终末期肾衰竭。TBWDS 提取液具有明显降低糖尿病肾病小鼠血尿酸水平的作用,进而可以改善肾功能。
综上所述,TBWDS提取物能够提高DN小鼠肾组织细胞的抗氧化能力,改善和保护肾小球和肾小管的损伤,降低肾组织细胞对促纤维化因子TGF-β1的表达,从而保护肾功能。TBWDS提取物具体药效成分及改善DN小鼠肾功能的作用机制仍有待进一步开发和研究。

