超声血管指数定量、弹性模量与乳腺癌生物学特征关系及其变化的临床意义
孙莉漪,何小芳,蒋媛慧,华骁帆,周 敏
(苏州大学附属苏州九院/苏州市第九人民医院,1.超声科,2.普外科,江苏 苏州,215200)
乳腺癌属高度异质性肿瘤,其生物学行为与预后密切相关。目前病理学检查尚不能完全明确乳腺癌的生物学行为。研究[1]表明,乳腺癌病灶内部存在增生胶原纤维构成的细胞外基质,与病灶周围组织粘连起来,可增大组织硬度。超声剪切波弹性成像(SWE)通过脉冲波在组织内的弹性模量可反映组织硬度[2]。SWE的弹性模量值是否与乳腺癌生物学特征有关的相关研究甚少。超微血管成像(SMI)作为一种新型多普勒超声技术,可在不使用超声造影剂条件下定量评估感兴趣区的血管数量[3],对肿瘤预后判断、靶向化疗药物的个体化选择均有指导作用[4]。新辅助化疗(NAC)作为局部进展期乳腺癌的规范化治疗方案,能缩小肿瘤体积、降低肿瘤负荷,改善患者预后[5]。但以往SMI技术评估乳腺癌的研究主要集中于血管形态学方面,缺少对病变区域血管指数(VI)的定量分析。为了探索无创检测方法和有效预测乳腺癌NAC病理反应的敏感指标,本研究分析SMI的VI、SWE的弹性模量与乳腺癌生物学特征的关系,并探讨其变化率预测乳腺癌NAC病理反应的效能,以期为临床提供参考。
1 对象与方法
1.1 研究对象
选取2021年6月—2023年3月接受NAC治疗的 103例乳腺癌患者作为研究对象。纳入标准:① 经超声引导穿刺活检确诊符合《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》[6]中的原发性浸润性乳腺癌诊断标准者; ② 首诊病例,NAC前未进行过任何抗癌治疗者; ③ 女性,且肿瘤为单侧单发,无远处转移者; ④ 自愿参与本研究,并签署知情同意书者。排除标准:① 合并严重心、肺等器质性病变者; ② 因原位癌成分过多,导致无法确认浸润性癌大小或无法评估临床疗效者; ③ 除乳腺癌外,合并其他恶性肿瘤者; ④ 既往接受过乳腺相关手术者,如隆胸、乳腺肿块切除等; ⑤ 乳腺癌灶紧邻部位有明显瘢痕,潜在影响SWE弹性模量值者; ⑥ 妊娠期女性; ⑦ 中途退出本研究者。本研究已获得医院医学伦理委员会批准同意。
1.2 方法
1.2.1 超声检查:采用彩色多普勒超声诊断仪对患者进行检查。患者取仰卧位,暴露乳房检测区域,观察肿瘤位置、直径等特征。常规超声检查完成后切换至SMI模式,将探头置于皮肤上,方向尽量与腺体保持垂直,嘱咐患者尽量保持呼吸平稳。观察病变内部血流,在血流最丰富的切面冻结图像,围绕病变边缘勾画感兴趣区,通过SMI定量分析软件测量VI,同一切面重复测量3次,取均值作为结果。SMI完成后切换至SWE模式,选择L4~15高频线阵探头,频率4~15 MHz。按照病灶体积的2~3倍勾画感兴趣区,手持探头检测部位,不施加压力进行扫查,嘱咐患者屏气,待图像稳定后存储图像信息。使用Q-Box软件测量病灶最大弹性模量值(Emax),同一切面重复测量3次,取均值作为结果。进一步计算患者NAC第1、2、4周期末VI变化率、Emax变化率,公式为:VI变化率=(化疗前VI-n周期末VI)/化疗前VI×100%;Emax变化率=(化疗前Emax-n周期末Emax)/化疗前Emax×100%;n代表第1、2、4周期末。所有超声检查均由2位分别具有6、11年超声检查工作经验的超声医师执行,当评估出现分歧时,请主任医师参与评估,共同商量后达成一致意见。
1.2.2 病理检查:NAC前行超声引导下穿刺活检获得乳腺肿瘤组织,将组织常规石蜡包埋处理获得切片进行相关免疫组化。检测肿瘤增殖抗原(Ki-67)和人表皮生长因子受体2(HER-2)、雌激素受体(ER)、孕激素受体(PR)的表达情况。Ki-67表达≥14%为阳性、ER表达≥1%为阳性、PR表达≥1%为阳性,HER-2阳性细胞数()为阳性、0~+为阴性,以荧光原位杂交分析有无基因扩增分为阳性和阴性,同时经病理学检查确定组织学类型[7-8]。
1.2.3 NAC治疗:NAC方案均根据穿刺组织的免疫组化法结果进行选择,主要以蒽环类和(或)紫杉类治疗方案为主。NAC以21 d为1个周期,至少完成4个周期,总体化疗4~8个周期。化疗药剂量参照《中国乳腺癌新辅助治疗专家共识(2022年版)》[9]进行设定。化疗结束后根据患者肿瘤部位、分期及患者意愿等决定外科手术方式。参照Miller-Panye病理反应分级法将手术切除标本病理组织与NAC前穿刺的病理组织进行比较,将其分为5个级(G1~G5级),级别越高表明NAC效果越显著。将G1~G2级纳入非显著反应组、G3~G5级纳入显著反应组。
1.3 统计学分析
2 结 果
2.1 NAC前VI、Emax与乳腺癌生物学特征的关系
NAC前VI、Emax与乳腺癌组织分化程度、病理分期及癌组织HER-2表达有关(P<0.05),与肿瘤直径及癌组织的Ki-67表达、ER表达、PR表达无关(P>0.05),见表1。
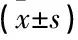
表1 NAC前VI、Emax与乳腺癌生物学特征的关系
2.2 乳腺癌NAC不同周期末VI变化率、Emax变化率比较
103例乳腺癌患者NAC后经Miller-Panye分级法评估为G1级的患者9例,G2级21例,G3级46例,G4级17例,G5级10例。显著反应组73例、非显著反应组30例。显著反应组NAC第1、2、4周期末的VI变化率、Emax变化率均高于非显著反应组,差异有统计学意义(P<0.01),见表2、表3。
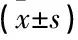
表2 2组NAC不同周期末VI变化率比较 %
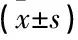
表3 2组NAC后不同周期的Emax变化率比较 %
2.3 不同周期末VI变化率和Emax变化率预测乳腺癌NAC病理反应效能
ROC曲线分析表明,NAC第1、2、4周期末VI变化率的AUC分别为0.786、0.863、0.815,灵敏度分别为0.745、0.832、0.771,特异度分别为0.773、0.814、0.817,见图1A。NAC第1、2、4周期末Emax变化率的AUC分别为0.793、0.883、0.839,灵敏度分别为0.782、0.868、0.823,特异度分别为0.756、0.841、0.775,见图1B。第2周期末,VI变化率联合Emax变化率预测乳腺癌NAC病理反应的AUC为0.918,灵敏度为0.874,特异度为0.905,均高于第1周期末VI变化率联合Emax变化率的AUC(0.832)、灵敏度(0.788)和特异度(0.827)和第4周期末VI变化率联合Emax变化率的AUC(0.853)、灵敏度(0.827)、特异度(0.849),见图1C。
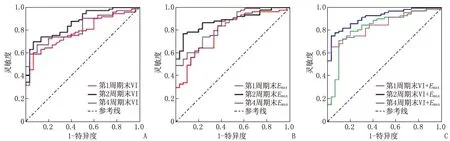
A:VI变化率; B:Emax变化率; C:VI变化率联合Emax变化率。
3 讨 论
恶性肿瘤的不同生物学行为有着不同临床表现和预后差异[10]。研究[11]表明,乳腺癌细胞增殖与转移均对血管依赖性较高。因此,探讨血管特征与乳腺癌生物学行为的关系有助于临床分析乳腺癌的生物学特性,并在预后评估方面提供指导。
吕景等[12]研究发现,乳腺恶性病灶的超声SMI分级显著高于良性病灶,可能是因为乳腺恶性病变发展过程会介导病灶内部再生毛细血管。本研究围绕乳腺癌病变边缘勾画感兴趣区并计算VI,经分析发现,VI与分化程度、病理分期有关。分化程度低、病理分期高的肿瘤往往生长活跃、侵袭能力强。肿瘤发展过程会受各种细胞因子刺激,增强血管内皮生长因子表达,促进新生血管生成,增加病变边缘的微血管数量,即VI增高。新生血管增多则增强和扩大肿瘤内微血管网状结构,为癌细胞增殖和转移带来便利,使癌细胞迅速向外生长。CAI S M等[13]研究发现,乳腺癌迅速生长会导致病灶中心区域出现坏死、变性、钙化,使病变中心区域充满结缔组织、纤维组织,增加质地硬度。因此,乳腺癌恶性发展过程所致的中心区域的质地硬度增加不利于病变中心区域的血管生成,易造成该区域出现乏血供状态,但病变边缘血供可能仍较丰富,这恰好也是乳腺癌恶性发展与转移的特性。本研究围绕病灶体积的2~3倍勾画感兴趣区,计算出Emax,经分析发现Emax与分化程度、病理分期表达有关,推测原因为乳腺癌恶性发展过程使中心区域癌细胞坏死,介导周边组织分裂增殖成大量纤维细胞,并以趋化作用积聚于坏死区域进行组织修复。因此,乳腺癌病灶区域纤维组织增多会导致硬度增加、弹性降低,使Emax增高。研究[14]表明,不同乳腺癌内部腺管走行、细胞核分化及核分裂情况存在差异,而HER-2阳性乳腺癌具有高度侵袭性特征。孔汉卿等[15]研究发现,HER2阳性乳腺癌在超声下多呈现低回声、边缘不规则等表现。本研究发现,HER-2阳性乳腺癌患者VI、Emax高于HER-2阴性者,原因可能是肿瘤边缘血管网发达、恶性程度高,导致肿瘤边缘不规则、低回声等现象。因此,可推测Emax、VI会因HER2阳性乳腺癌恶性程度、血管网发达等影响而发生变化。
NAC可杀灭肿瘤细胞、缩小肿瘤体积,利于患者后期手术切除病灶,但不可忽视化疗副作用,且乳腺癌NAC通常需要行4~8个周期。因此,对于NAC无显著反应的患者,可及时调整治疗方案,减轻或避免化疗副作用。研究[16]发现,Emax变化率可预测乳腺癌NAC病理反应,但这些研究尚未结合肿瘤血管变化情况进行探讨。本研究发现,NAC显著反应组NAC第1周期末、第2周期末、第4周期末的VI变化率、Emax变化率均高于非显著反应组,其中第1、第4周期末的VI变化率和Emax变化率在预测乳腺癌NAC病理反应效能较低(AUC<0.85); 第2周期末VI变化率和Emax变化率在预测乳腺癌NAC病理反应效能较高(AUC>0.85),提示该阶段的VI变化率和Emax变化率在预测乳腺癌NAC病理反应时机最佳。本研究进一步分析发现,第2周期末VI变化率联合Emax变化率预测乳腺癌NAC病理反应的AUC为0.918,均高于第1周期末联合应用的AUC(0.832)和第4周期末AUC(0.853),说明第2周期末VI变化率联合Emax变化率在预测乳腺癌NAC病理反应较敏感,可能是因为联合应用能够反映肿瘤细胞密度和胶原纤维含量,也反映了肿瘤微血管变化状况,因此预测效能高。
综上所述,VI、Emax与乳腺癌分化程度、病理分期、HER-2表达具有关联性,其中化疗第2周期末的VI变化率、Emax变化率是预测乳腺癌NAC病理反应的最佳时机。VI值和Emax是通过超声检查获得,具有无创、简便、可重复检测及定量评估的优势,在乳腺癌NAC病理反应评估中具有重要的临床应用价值。但本研究为单中心数据,样本量少,结果可能存在偏倚,还需开展多中心的大样本研究进一步佐证。

